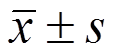 表示,满足正态性且方差齐时采用单因素方差分析,两两比较采用SNK法检验,方差不齐性则采用Tamhane’s T2法进行方差检验,若不满足正态时采用秩和检验。以P<0.05作为差异具有统计学意义。
表示,满足正态性且方差齐时采用单因素方差分析,两两比较采用SNK法检验,方差不齐性则采用Tamhane’s T2法进行方差检验,若不满足正态时采用秩和检验。以P<0.05作为差异具有统计学意义。何飞1,汝触会1,徐俭朴1*,王辉2,蔡宛如3
(1.浙江省中西医结合医院,杭州 310003;2.浙江中医药大学,杭州 310053;3.浙江中医药大学附属第二医院,杭州 310005)
摘要:目的观察益气活血通络法对慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)大鼠肺血管重构IL-6/JAK/STAT信号转导通路的影响。方法SD大鼠50只,随机均分为正常对照组、模型组、中药组、西药组和中西医结合组。采用气道滴注脂多糖联合香烟烟雾暴露的方法制备大鼠COPD肺血管重构模型。药物干预后各组大鼠右下肺叶行HE染色观察肺血管病理形态学变化,并采用ELISA法检测血清IL-6含量变化;Western blot测定肺组织p-JAK2和p-STAT3蛋白表达水平;免疫组化技术检测肺动脉增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)蛋白表达。结果与模型组比较,各药物组大鼠血清IL-6含量及肺动脉PCNA表达显著减少(P<0.05或<0.01),p-JAK2和p-STAT3表达显著降低(P均<0.01);中西医结合组较中药组及西药组p-JAK2表达均显著下降(P均<0.01)。结论中医益气活血通络法能有效减轻COPD大鼠肺血管重构,其机制可能与抑制IL-6/JAK/STAT信号转导通路进而调节肺小动脉PCNA表达有关。
关键词:益气活血通法;肺血管重构;IL-6/JAK/STAT信号转导通路;增殖细胞核抗原;慢性阻塞性肺疾病
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)主要的病理改变包括气道重塑和肺动脉血管重构。气道重塑是COPD患者肺功能持续气流受限的重要病理基础,而肺血管重构是COPD产生肺动脉高压、肺心病并持续进展的重要原因[1]。多种细胞因子引起肺血管细胞内信号转导通路发生变化是诱导肺血管重构的重要分子机制,IL-6/JAK/STAT信号转导通路与血管细胞生长、增殖和分化间的关系十分密切,并在血管平滑肌细胞增殖和迁移中发挥着重要作用[2],可能是参与肺血管重构的分子机制之一。现代西医治疗COPD肺血管重构的药物较少、价格昂贵,同时疗效不理想,中医药在治疗COPD肺血管重构方面具有一定优势[3]。本研究通过建立COPD大鼠模型,基于IL-6/JAK/STAT信号转导通路探讨益气活血通络法(采用国家级名老中医王会仍经验方保肺定喘汤)对COPD大鼠肺血管重构的干预机制,为治疗COPD及其并发症提供参考。
清洁级健康SD大鼠50只,♂,5周龄,体质量(150±20)g,由浙江中医药大学动物实验中心提供,动物许可证号:SYXK(浙)2013-0184,所有动物均饲养于清洁级动物房。
保肺定喘汤,组成:党参15 g、黄芪15 g、丹参15 g、当归10 g、熟地15 g、麦冬9 g、广地龙15 g、仙灵脾10 g、桔梗9 g、甘草6 g,上述药物由浙江中医药大学附属中西医结合医院中药制剂室制成流浸膏,生药含量3.1 g·mL-1,4 ℃储备;布地奈德混悬液(阿斯利康制药有限公司,批号:317538;规格:每支1 mg)。
脂多糖(lipopolysaccharides,LPS)试剂盒(美国Sigma公司,货号:L2630);香烟(大前门牌,上海卷烟厂,每支含烟碱量为13 mg,尼古丁为1.0 mg);大鼠IL-6 ELISA检测试剂盒(杭州联科生物有限公司,货号:70-EK3062/2;规格96T);phospho-JAK2(phospho Y1007+Y1008)抗体(货号:ab32101)、Anti-JAK2抗体(货号:ab39636)均购自美国Abcam公司;Phospho-Stat3(Tyr705)抗体(美国Cell Signaling Technology公司,货号:9145S);Stat3 (D3Z2G) Rabbit mAb(货号:12640)、PCNA抗体(货号:13110S)均购自美国Cell Signaling Technology公司。
酶标仪(美国伯腾仪器有限公司);低温高速离心机(德国Eppendorf公司);BX43型光学显微镜(OLYMPUS公司);Prisma型全自动生物组织染色机(Tissue-Tek公司)。
SD大鼠50只,♂,按随机数字表法随机分成5组:正常对照组、模型组、中药组、西药组及中西医结合组,每组10只。采用气道滴注LPS联合烟熏方法建立COPD模型,参照相关文献[4],大鼠在自制吸烟染毒箱内被动吸烟20支,每天2次,每次30 min,间隔8 h,共70 d;造模第1,28天,每只大鼠气道内滴入LPS 0.2 mL(200 μg),该日内不予以吸烟。正常对照组大鼠每天在自制吸烟染毒箱内以相同时间呼吸正常空气并于造模第1,28天气道内滴入0.2 mL生理盐水。造模后第29~70天给药,用药量按照体质量60 kg的成年人每日常规服用药量换算,通用公式:(动物体质量/人的体质量)×人用药量×6.25[5]。正常对照组、模型组生理盐水灌胃,西药组雾化吸入布地奈德混悬液(50 μg·kg-1),中药组给予保肺定喘汤灌胃(12.4 g·kg-1·d-1),中西医结合组同时予保肺定喘汤灌胃及雾化吸入布地奈德。
1.5.1 各组大鼠肺小动脉病理形态学改变 取右下叶肺组织,右肺门横断取材,常规石蜡制片,HE染色,光学显微镜下观察肺小动脉形态学改变。
1.5.2 各组大鼠血清白细胞介素-6(IL-6)测定 采用ELISA法检测血清IL-6,操作方法严格按照试剂盒说明书进行。
1.5.3 肺小动脉PCNA测定 使用免疫组化染色法检测大鼠肺小动脉PCNA含量。采用Imgae-pro plus 6.0软件进行图像分析,在200倍光镜下观察PCNA免疫组化染色切片,以固定颜色模式界定色调、饱和度、颜色强度等条件下测得的大鼠肺小动脉壁内PCNA平均吸光度值作为其相对含量,每张切片均选取3~5个小动脉进行测量,并取其平均值进行统计学分析。
1.5.4 各组大鼠肺组织中磷酸化JAK2(p-JAK2)和STAT3蛋白表达的测定 采用Western blot法分析大鼠肺组织中p-JAK2及p-STAT3蛋白表达。取1 mm3肺组织,液氮研磨制作肺组织匀浆,每个标本中加入裂解液混合物(含增强型RIPA、蛋白酶抑制剂PMSF)100 μL,冰上裂解30 min,每10 min震荡器上震荡1次,共3次。离心机预冷4 ℃,13 000 r·min-1离心12 min,取上清150 μL,加入新的已预冷EP管。采用BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移到PVDF膜上,室温下用5%脱脂奶粉封闭2 h,TBST洗一遍,孵相应Ⅰ抗过夜,然后用TBST洗10 min 3次,室温孵相应Ⅱ抗2 h,再用TBST 洗10 min 3次。ECL发光液将PVDF膜显色,凝胶成像系统扫描分析结果。
采用SPSS 22.0统计软件包进行处理。所得数据以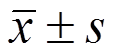 表示,满足正态性且方差齐时采用单因素方差分析,两两比较采用SNK法检验,方差不齐性则采用Tamhane’s T2法进行方差检验,若不满足正态时采用秩和检验。以P<0.05作为差异具有统计学意义。
表示,满足正态性且方差齐时采用单因素方差分析,两两比较采用SNK法检验,方差不齐性则采用Tamhane’s T2法进行方差检验,若不满足正态时采用秩和检验。以P<0.05作为差异具有统计学意义。
HE染色可见正常对照组大鼠肺小动脉内皮细胞扁平连续,管壁薄;模型组肺小动脉内皮细胞变性肿胀,平滑肌细胞增生肥厚明显,厚薄不一致,管腔变小、不规则;各药物组大鼠肺小动脉血管壁不同程度增厚、管腔略有变窄,较模型组均有不同程度减轻。见图1。
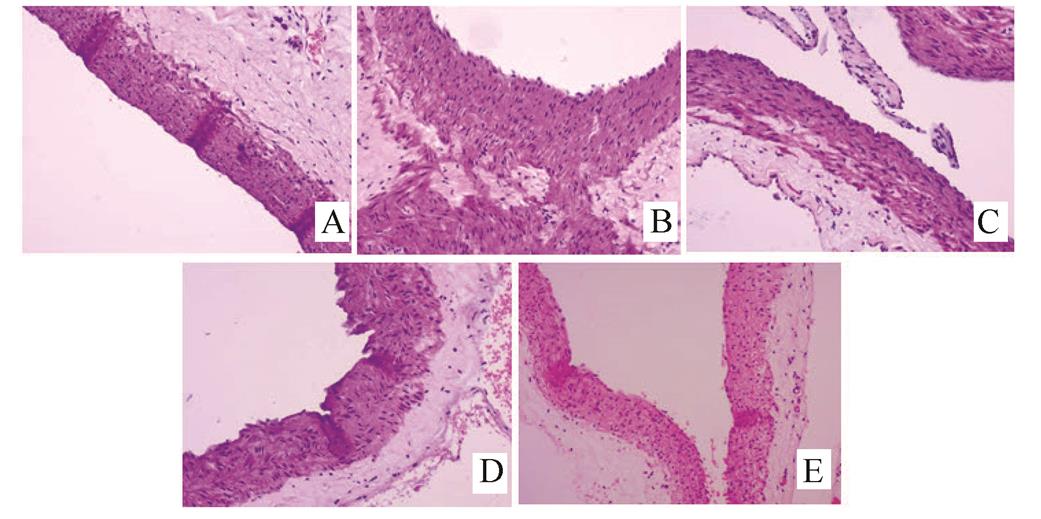
图1 大鼠小肺动脉病理形态(HE染色,×200)
A-正常对照组;B-模型组;C-中药组;D-西药组;E-中西医结合组。
Fig. 1 The pathological features of pulmonary arteries in rats(HE staining, ×200)
A-normal control group; B-model group; C-Chinese medicine group; D-western medicine group; E-integrated Chinese and western medicine group.
与正常对照组比较,模型组与各药物组大鼠血清IL-6含量均显著升高,差异具有统计学意义(P<0.01)。与模型组比较,各药物治疗组血清IL-6均有不同程度显著降低(P均<0.01),各药物治疗组之间比较差异无统计学意义。结果见图2。
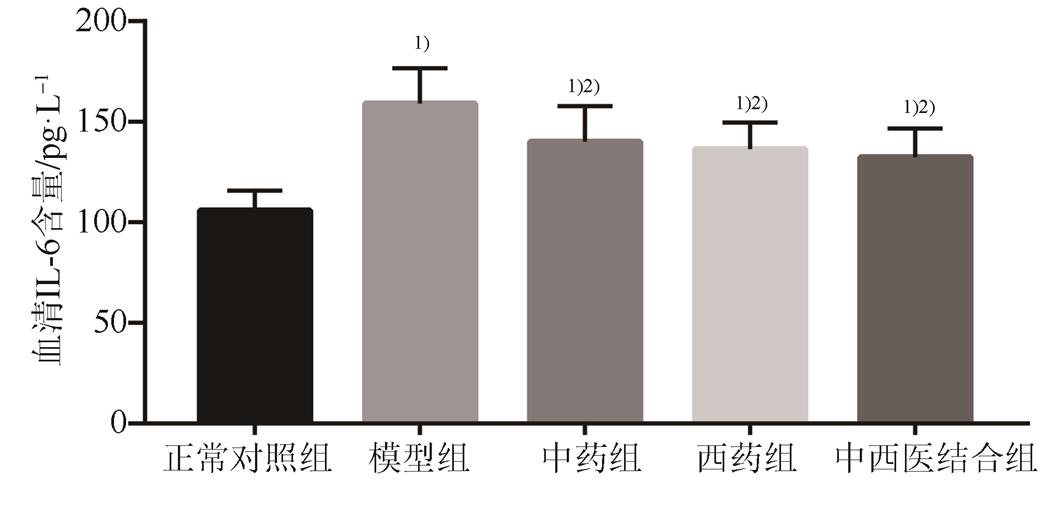
图2 各组大鼠血清IL-6含量比较(n=10)
与正常对照组比较,1)P<0.01;与模型组比较,2)P<0.01。
Fig. 2 Comparison of IL-6 in the blood serum among different groups of rats(n=10)
Note: Compared with the normal control group,1)P<0.01; compared with the model group,2)P<0.01.
与正常对照组PCNA表达(0.002 5±0.000 8)比较,模型组PCNA表达(0.014 1±0.008 3)显著增加(P<0.01);与模型组比较,中药组(0.009 7± 0.002 4)、西药组(0.008 5±0.002 7)与中西医结合组(0.007 0±0.002 2)PCNA表达显著降低(P<0.05或P<0.01);各药物治疗组之间差异无统计学意义。
Western blot检测结果显示,与正常对照组比较,模型组及各药物治疗组p-JAK2表达显著增加(P均<0.01);与模型组比较,各药物治疗组p-JAK2表达均显著降低(P均<0.01);中西医结合组较中药组及西药组p-JAK2 表达均显著下降(P均<0.01),中药组和西药组比较无统计学差异。
与正常对照组比较,模型组及各药物治疗组p-STAT3表达均显著增加(P均<0.01);与模型组比较,各药物治疗组p-STAT3表达均显著降低(P均<0.01)。各药物治疗组之间差异无统计学意义。见表1,图3。
表1 大鼠肺组织p-JAK2和p-STAT3蛋白表达(n=10,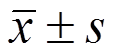 )
)
Tab. 1 Comparison of the protein expression levels of p-JAK2 and p-STAT3 in lung tissue of rats(n=10,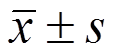 )
)

注:与正常对照组比较,1)P<0.01;与模型组比较,2)P<0.01;与中西医结合组比较,3)P<0.01.
Note: Compared with normal control group,1)P<0.01; compared with model group,2)P<0.01; compared with integrated Chinese and western medicine group,3)P<0.01.
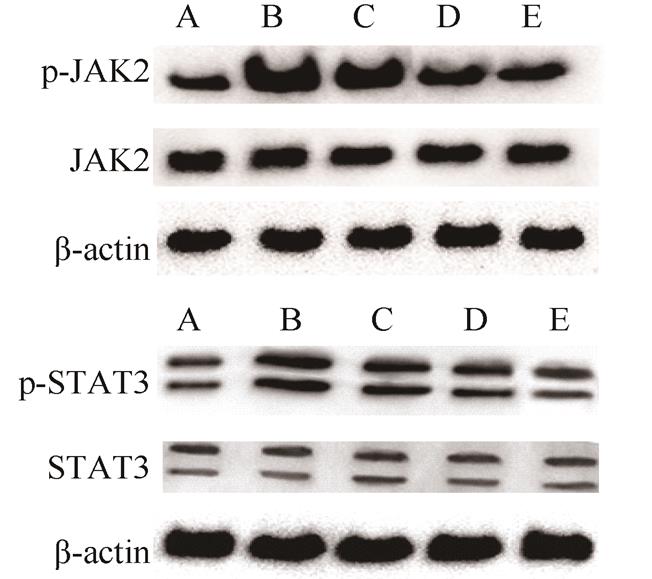
图3 各组大鼠肺组织p-JAK2和p-STAT3蛋白表达情况
A-正常对照组;B-模型组;C-中药组;D-西药组;E-中西医结合组。
Fig. 3 Comparison of the protein expression levels of p-JAK2 and p-STAT3 in lung tissue of rats
A-normal control group; B-model group; C-Chinese medicine group; D-western medicine group; E-integrated Chinese and western medicine group.
COPD是一种持续气流受限疾病,在疾病早期即可发生肺血管重构[6]。肺血管重构在COPD肺动脉高压、肺心病形成过程中具有关键作用,主要表现为内皮损伤、增殖,肺动脉平滑肌细胞增殖导致血管中层增厚,胶原蛋白过度沉积,小血管管腔闭塞等。炎症在慢性阻塞性肺疾病肺血管重构过程中具有一定作用[7],IL-6作为急性炎症反应的诱导因子,与血管性疾病进展密切相关,其作用的重要机制是IL-6能促进血管平滑肌的增殖以及单核细胞趋化因子-1的释放,有研究证明这种促进作用是通过JAK/STAT信号通路来实现的[2],说明在血管性疾病平滑肌细胞增殖的病理过程中,IL-6/JAK/STAT扮演着重要角色。而平滑肌细胞增殖在肺血管重构中起到重要作用,PCNA是反映细胞增殖状态的良好指标[8]。深入研究COPD肺血管重构的发病机制,并进一步阐明中医临床治法对COPD肺血管重构干预作用的相关作用机制,是防治COPD及其并发症的重点所在。
中医目前认为COPD肺血管重构属肺络病范畴[9],两者在病因病机、病位、病程及转归方面具有一定相关性[10],发病中心环节均具有“气虚”和“痰瘀”2个病理因素,所以益气活血通络法在各分型治疗中,都应适当运用。国内临床研究发现采用中医益气活血通络理论指导治疗COPD取得了良好的临床效果[11-12]。但这些研究均没有进一步深入研究益气活血通络法干预COPD肺血管重构的机制。
本研究结果显示,模型组大鼠血清IL-6含量显著升高,同时肺组织p-JAK2和p-STAT3蛋白表达显著增加(P<0.01)。采用中医益气活血通络法(保肺定喘汤)干预后大鼠肺动脉病理形态学有不同程度改善,血清IL-6、肺小动脉PCNA表达、肺组织p-JAK2和p-STAT3蛋白表达均显著减少(P<0.01),说明中医益气活血通络法可以显著减轻肺血管重构,其机制可能与抑制IL-6/JAK/STAT信号转导通路进而调节肺小动脉PCNA表达有关,在今后的研究中可进一步在分子细胞水平阐述该信号系统对肺动脉平滑肌细胞增殖的作用。另一方面,本研究发现中西医结合组p-JAK2蛋白表达较中药组及西药组均显著下降(P<0.01),说明中西医结合组在防治肺血管重构方面较单一疗法更具优势。本研究中的其他指标在3个药物组之间比较均无显著差异,可能与实验纳入样本量不够有关。
REFERENCES
[1] SAKAO S, VOELKEL N F, TATSUMI K. The vascular bed in COPD: pulmonary hypertension and pulmonary vascular alterations [J]. Eur Respir Rev, 2014, 23(133): 350-355.
[2] WATANABE S, MU W, KAHN A, et al. Role of JAK/STAT pathway in IL-6-induced activation of vascular smooth muscle cells [J]. Am J Nephrol, 2004, 24(4): 387-392.
[3] HE F, XU J P. Progress of traditional Chinese medicine preventing and treating pulmonary vascular remodeling of COPD [J]. Chin Arch Tradit Chin Med(中华中医药学刊), 2015, 33(4): 823-825.
[4] 方苏榕, 谷伟, 谭焰, 等. 烟熏联合内毒素构建COPD大鼠模型[J]. 南京医科大学学报(自然科学版), 2013, 33(9): 1226-1230.
[5] 章元沛. 药理实验方法学[M]. 第2版. 北京: 人民卫生出版社. 1996: 238.
[6] DING Y. Clinical efficacy of simvastatin in treatment of COPD complicated with pulmonary hypertension [J]. Pharm Today(今日药学), 2016, 26(8): 606-608.
[7] 赵霞, 杨朝, 葛利军. 炎症在慢性阻塞性肺疾病相关肺动脉高压发病机制中的作用的研究进展[J]. 国际呼吸杂志, 2013, 33(3): 218-221.
[8] LU Z, LI S, ZHAO S, FA X. Upregulated miR-17 regulates hypoxia-mediated human pulmonary artery smooth muscle cell proliferation and apoptosis by targeting mitofusin 2 [J]. Med Sci Monit, 2016, 22(9): 3301-3308.
[9] 何飞. 运用肺络理论治疗肺系疾病刍议[J]. 浙江中医杂志, 2011, 46(8): 549-550.
[10] 郑莉莉, 王婕琼, 李泽庚. “肺络微型癥瘕”与慢性阻塞性肺疾病肺血管重构的相关性[J]. 长春中医药大学学报, 2017, 33(1): 7-9.
[11] 何飞, 汝触会, 陈爱凤, 等. 益气活血通络法治疗慢性阻塞性肺疾病D组稳定期的临床观察[J]. 中华中医药学刊, 2017, 35(6): 1466-1468.
[12] 王胜, 陈悦, 任薇, 等. 益气活血法对慢性阻塞性肺疾病急性加重患者血浆纤维蛋白原及D-二聚体的影响[J]. 中国中西医结合杂志, 2015, 35(5): 537-540.
Effect of Tonifying Qi, Promoting Blood Flow and Dredging Collaterals Treatment on Pulmonary Vascular Remodeling of COPD Rats
HE Fei1, RU Chuhui1, XU Jianpu1*, WANG Hui2, CAI Wanru3
(1.Zhejiang Chinese and Western Medicine Integrated Hospital, Hangzhou 310003, China; 2.Zhejiang Chinese Medical University, Hangzhou 310053, China; 3.The Second Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou 310005, China)
ABSTRACT:OBJECTIVETo observe the effects of tonifying Qi, promoting blood flow and dredging collaterals treatment on IL-6/JAK/STAT signaling pathway of pulmonary vascular remodeling of COPD rats.METHODSFifty SD rats were randomly divided into normal control group, model group, Chinese medicine group, western medicine group, and integrated Chinese and western medicine group. The rat model of COPD was established by intratracheal instillation of LPS and daily exposure to cigarette-smoking. The pathological features of pulmonary arteries were observed by microscope after intervention of drugs. The serum contents of IL-6 was detected by ELISA. The expressions of p-JAK2 and p-STAT3 were detected by Western blot. The content of the protein expression levels of PCNA in pulmonary artery were detected by immunohistochemistry.RESULTSThe serum content of IL-6 and protein expression levels of PCNA in each drug group was significantly lower than in model group(P<0.05 or <0.01). P-JAK2 and p-STAT3 expression level in each drug group was significantly lower than in model group(P<0.01). P-JAK2 expression level in integrated Chinese and western medicine group was lower than in Chinese medicine group and western medicine group significantly(P<0.01).CONCLUSIONTonifying Qi, promoting blood flow and dredging collaterals treatment may reduce the remodeling of pulmonary vascular by the way of inhibiting the activation of IL-6/JAK/STAT signal pathway, which can lead to regulate the protein expression levels of PCNA.
KEY WORDS:tonifying Qi, promoting blood flow and dredging collaterals treatment; pulmonary vascular remodeling; IL-6/JAK/STAT signaling pathway; PCNA; COPD
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2018)10-1439-04
DOI:10.13748/j.cnki.issn1007-7693.2018.10.001
引用本文:何飞, 汝触会, 徐俭朴, 等. 益气活血通络法对COPD大鼠肺血管重构的影响[J]. 中国现代应用药学, 2018, 35(10): 1439-1442.
收稿日期:2017-11-24
基金项目:国家自然科学基金项目(81403336)
作者简介:何飞,男,副主任医师 Tel: (0571)56109765 E-mail: lung1024@163.com
*通信作者:徐俭朴,女,主任医师 Tel: (0571)56109765 E-mail: xujianpu1@163.com
(本文责编:李艳芳)