血根碱对脂多糖致H9c2细胞氧化损伤的改善作用
王玲1,干学东2*
(1.武汉大学医院内科,武汉 430072;2.武汉大学中南医院,武汉430071)
摘要:目的观察血根碱(sanguinarine,SAN)对脂多糖(lipopolysaccharide,LPS)诱导的H9c2细胞氧化应激的影响,并对其与HO-1/NOX2途径之间的关系进行探讨。方法不同因素干预H9c2细胞后,采用细胞活性试剂盒检测不同浓度SAN和/或LPS对H9c2细胞生存的影响;酶标仪及荧光显微镜检测SAN对LPS诱导细胞产生活性氧(reactive oxygen species,ROS)的影响;Real time RT-PCR检测SAN对LPS诱导的NOX2、P47PHOX、HO-1、SOD1、SOD2基因表达的影响;MDA检测试剂盒检测MDA的变化。结果单用SAN对H9c2细胞活性无影响,LPS可显著降低细胞活性,而SAN与LPS共同干预则可呈浓度依赖性地提高细胞活性,降低ROS产生。LPS处理12 h上调H9c2细胞NOX2、p47phox mRNA表达、下调HO-1 mRNA表达;SAN预处理后,细胞内NOX2、p47phox mRNA下调、HO-1 mRNA上调,而SAN与锌原卟啉IX预处理则可逆转这种现象。SAN 上调SOD1及SOD2 mRNA表达,降低MDA产生。结论SAN可通过活化HO-1/NOX2途径,抑制ROS的产生,从而使H9c2细胞免受LPS介导的损伤,提高细胞活力。
关键词:血根碱;脂多糖;氧化应激;活性氧;H9c2细胞
败血症是指致病菌侵入血循环引起全身系统性的炎症反应,继而引发进展性的多器官功能障碍,在世界范围内的发病率和死亡率均较高[1],属于临床危急重症。革兰阴性杆菌细胞壁的脂多糖(lipopolysaccharide,LPS)是内毒素的主要成分,是革兰阴性杆菌造成败血症或脓毒性休克最重要的致病因素。LPS引发的感染性心功能不全在感染性休克中较为常见,同时也是导致死亡率增加的主要原因[2]。既往大量研究证实,改善败血症患者的心功能可大大提高患者生活质量,降低死亡率[3],而活性氧(reactive oxygen species,ROS)则在败血症相关的心肌功能障碍中起着举足轻重的作用[4-5]。
LPS可增加心肌细胞NADPH氧化酶的表达,产生大量的ROS,继而破坏线粒体,而线粒体也是ROS产生的主要细胞器,线粒体受损后产生的ROS对线粒体产生二次损伤,因此LPS导致的心肌细胞氧化损伤是心肌损伤的重要机制[5-6]。血红素加氧酶-1(HO-1)具有抗氧化作用,其过表达可使各种体内外模型免受氧化应激损伤。
血根碱(sanguinarine,SAN,[C20H14NO4]+)来源于罂粟科植物博落回的果实,具有杀菌、抗增殖、抗炎、抗氧化应激和增加免疫力的功效[7]。近年来研究显示,SAN可以通过增加细胞凋亡、抑制细胞增殖从而发挥抗肿瘤作用[8-9]。研究发现,SAN通过调节COX-2能够保护LPS诱导的内毒素性休克[7];研究还发现,SAN能够保护血管紧张素II刺激引起的心肌细胞凋亡[3];研究人员还证实,SAN在多种模型中具有广泛抗氧化应激的作用[7-9]。但是,SAN是否能在心肌细胞中抑制LPS诱导的氧化应激,目前还没有研究报道。本研究采用LPS诱导H9c2细胞造成感染性心功能不全的模型,研究SAN是否可通过HO-1/NOX2途径改善LPS诱导的H9c2细胞氧化损伤,从而改善心功能不全。
1 材料与方法
1.1 材料
SAN(上海融禾医药科技发展有限公司,批号:5578-73-4;纯度≥98%);DMEM basic培养基、新生小牛血清(NBS)、双抗(Penicillin Streptomycin,PS)、胰酶均购自Gibco;2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorofluorescin diacetate,DCFH-DA)、LPS购自Sigma;细胞毒性检测试剂盒(Cell Counting Kit assay,CCK-8)购自日本同仁化学研究所;RT-PCR试剂盒购自Roche;细胞MDA检测试剂盒购自南京建成;4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)购自Thermo Scientific;锌原卟啉IX(SnPPIX)购自美国Tocris Bioscience公司。
1.2 仪器
Synergy HT多功能微孔板检测系统(美国BioTek公司);恒温培养箱(日本Sanyo公司);NANODROP 2000c紫外分光光度计(Thermo scientific);Veriti 96 well Thermal CyclerRT反转录仪器(Applied Biosystems公司);Light Cycler 480实时定量PCR仪(Roche公司);DP72倒置相差显微镜(日本Olympus)。
1.3 细胞
大鼠H9c2细胞系(中科院上海细胞库),细胞培养在37 ℃恒温、5%的CO2培养箱中;培养细胞所用的培养基成分为DMEM basic+10% FBS+ 1% PS,当细胞密度铺满80%的培养皿底(2× 105·ml-1时,采用0.25%胰酶消化后进行传代。在对细胞采取刺激因素之前,将培养细胞所用的基础培养基更换为无血清培养基(DMEM basic+0.5% PS)行饥饿处理18 h,以减少血清对刺激因素的影响,同时饥饿处理也可使所有细胞处于同步化。
1.4 分组
实验分空白对照组、LPS 10 μg·ml-1组、LPS 10 μg·ml-1+SAN 0.25 μmol·l-1组、LPS 10 μg·ml-1+ SAN 0.5 μmol·l-1组、LPS 10 μg·ml-1+SAN 1 μmol·l-1组、LPS 10 μg·ml-1+SAN 0.25 μmol·l-1+ SnPPIX 10 μmol·l-1组和SAN 1 μmol·l-1组。
1.5 细胞毒性实验
采用CCK-8毒性检测试剂盒对不同刺激条件下细胞的活力进行检测。细胞被接种至96孔板中,每孔100 μl,密度大约为2×105·ml-1,置于恒温箱继续培养24 h。将培养基更换为无血清的培养基饥饿18 h。采用不同处理因素干预12 h后,将96孔板中的培养基换为含有10 μL CCK-8的无血清培养基100 μL,继续在恒温箱中孵育2~2.5 h后置酶标仪下(波长450 nm)检测。
1.6 ROS检测
将细胞等密度的接种至96孔板中,每孔100 μL,密度大约为2×105·ml-1,置于恒温箱继续培养24 h后将培养基更换为无血清的培养基饥饿18 h,采用不同处理因素干预6 h,将96孔板中的培养基换为含有10 μmol·l-1DCFH-DA的培养基继续孵育20 min,之后将培养基吸出,使用PBS清洗96孔板3次,以排除未进入细胞内部的DCFH-DA的干扰,最后再次加入PBS 100 μL,置于酶标仪下检测,激发光波长为485 nm,发射光波长为525 nm。ROS水平(倍数)=干预组荧光值/对照组荧光值。
采用不同的干预因素刺激6 h后,将24孔板中的培养基换为含有10 μmol·l-1DCFH-DA的培养基继续孵育20 min,用PBS清洗3遍后将爬片捞出,DAPI封片后使用荧光显微镜进行观察。
1.7 Real-time RT-PCR
细胞以不同因素处理后,弃去培养基,以TRIzol法提取细胞总的RNA,采用UV测定其含量与纯度。取大约5 μg总RNA逆转录为cDNA。以GAPDH为内参照,采用20 μg体系进行PCR扩增。反应条件为:Cycle 94 ℃ 2 min;25~ 35 Cycles 94 ℃ 40 s,50~65 ℃ 40 s,72 ℃ 1 min;Cycle 72 ℃ 5 min。所用的引物序列见表1。
表1 引物序列
Tab. 1 Primer sequence

基因引物序列5’-3’ SOD1SOD1-FGCGTCATTCACTTCGAGCAGA SOD1-RGGACCGCCATGTTTCTTAGAGT SOD2SOD2-FAGCCTCCCTGACCTGCCTTA SOD2-RCGCCTCGTGGTACTTCTCCTC NOX2NOX2-FTGAATCTCAGGCCAATCACTTT NOX2-RAATGGTCTTGAACTCGTTATCCC P47PHOXP47phox-FCCTTCATTCGCCACATCA P47phox-RCATCATACCACCTGGGAGC HO-1HO-1-FCGCATGAACACTCTGGAGATG HO-1-RTGTGAGGGACTCTGGTCTTTGT GAPDHGAPDH-FGACATGCCGCCTGGAGAAAC GAPDH-RAGCCCAGGATGCCCTTTAGT
1.8 细胞内MDA含量测定
细胞经过不同因素处理后,弃去上清,用细胞刮将细胞刮下,将其转移至1.5 ml离心管中,按照试剂盒说明对样本进行处理后采用酶标仪进行读数(波长530 nm),计算公式为:MDA(倍数)= OD(干预组)/OD(对照组)。
1.9 统计学方法
应用SPSS 17.0统计软件包进行统计分析,计量资料以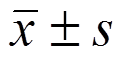 表示,多组间均数比较采用单因素方差分析,组间两两均数比较采用S-N-K法(方差齐)或Dunnett′s T3(方差不齐)检验,P<0.05为差异具有显著性。
表示,多组间均数比较采用单因素方差分析,组间两两均数比较采用S-N-K法(方差齐)或Dunnett′s T3(方差不齐)检验,P<0.05为差异具有显著性。
2 结果
2.1 SAN可增加细胞活性
不同处理因素干预12 h,CCK8结果显示,与空白对照组相比,不同浓度SAN单独干预H9c2细胞对其活力无影响;LPS干预H9c2细胞后引起细胞活性显著下降(P<0.01),SAN与LPS同时干预H9c2细胞则可呈现浓度依赖性地提高细胞活性(P<0.01)。见图1。
2.2 SAN可降低LPS诱导的ROS
与空白对照组相比,LPS处理6 h后可显著增加H9c2中ROS水平(P<0.01),而SAN与LPS同时作用细胞则可显著抑制ROS的产生(P<0.01),且SAN的这种抑制作用具有浓度依赖性,SAN单独干预H9c2细胞则对ROS的表达无影响。见图2。与空白对照组相比,LPS干预30,60,120 min可逐级增加细胞内ROS水平;而SAN 1 μmol·l-1与LPS同时作用于细胞60,120 min所产生的ROS水平则显著低于同期单LPS干预组。见图2。
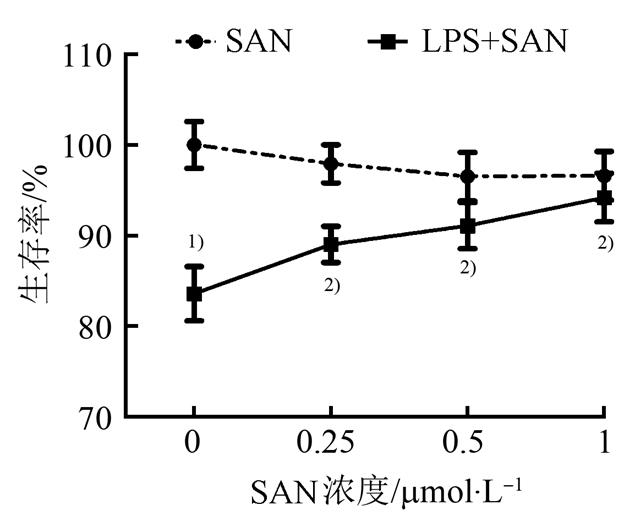
图1 SAN可增加细胞活性
与空白对照组相比,1)P<0.01,与LPS组相比,2)P<0.01。
Fig. 1 Effectsof SAN on cell activity
Compared with normal control group,1)P<0.01; compared with LPS group,2)P<0.01.
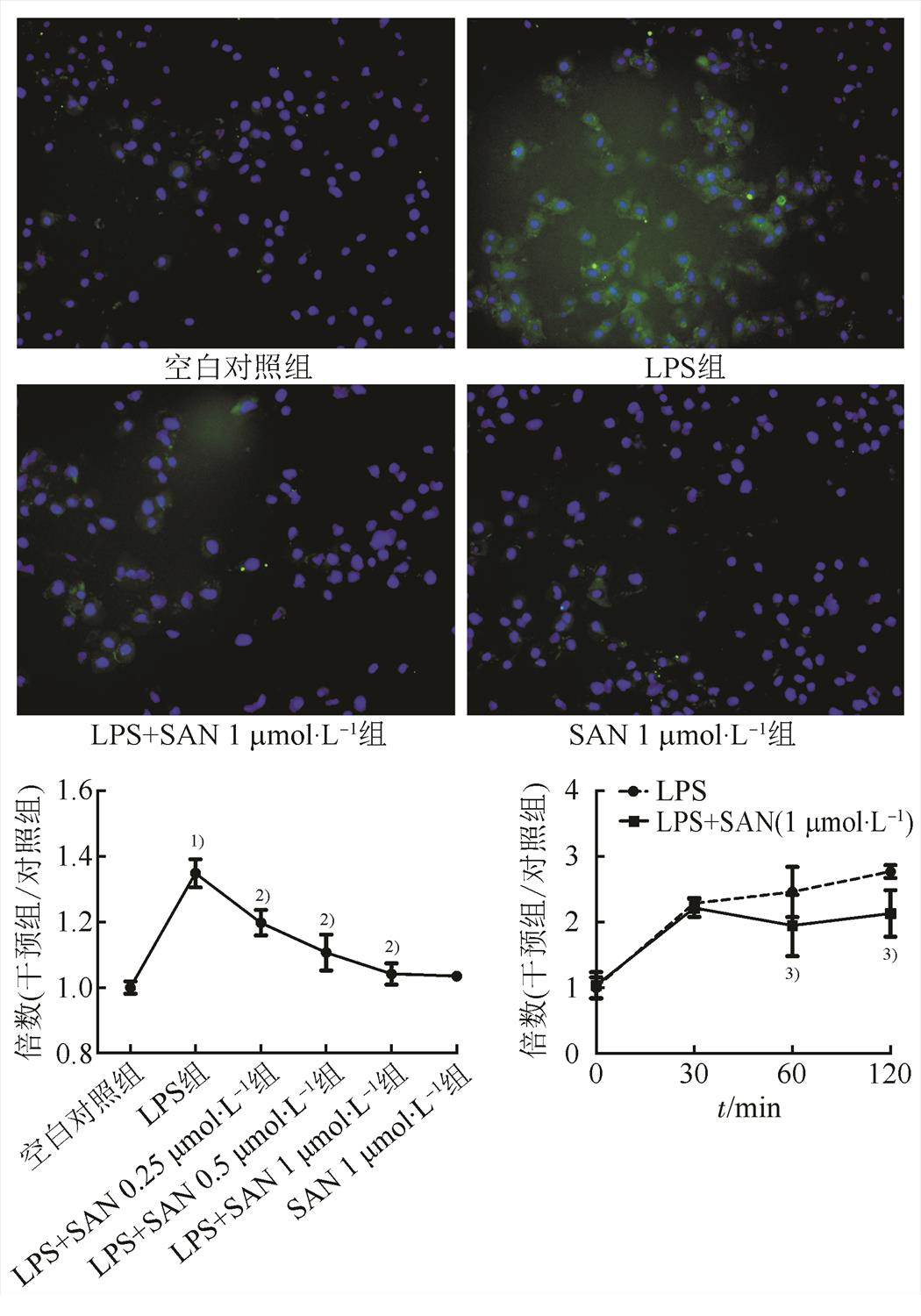
图2 SAN可抑制ROS的产生
与空白对照组相比,1)P<0.01,与LPS组相比,2)P<0.01;与同时间点LPS组相比,3)P<0.01。
Fig. 2 Effects of SAN on ROS generation
Compared with normal control group,1)P<0.01; compared with LPS group,2)P<0.01; compared with the LPS group at the same time point,3)P<0.01.
2.3 SAN对NOX2、p47phox和HO-1 mRAN水平的影响
Real time RT-PCR结果显示,LPS作用12 h后,H9c2细胞中NOX2及其亚单位p47phox的mRNA水平均显著增高(P<0.01),HO-1的mRNA水平显著下降(P<0.01);SAN 1 μmol·l-1与LPS同时作用则可显著抑制NOX2及p47phox的表达(P<0.01),上调HO-1 mRNA表达(P<0.01),联合SAN和SnPPIX预处理组与LPS+SAN组相比,NOX2与 p47phox mRNA 表达上调(P<0.01),而HO-1的mRNA表达水平则下调(P<0.01)。见图3。

图3 SAN对NOX2、p47phox和HO-1 mRNA水平的影响
与空白对照组相比,1)P<0.01,与LPS组相比,2)P<0.01,与LPS+SAN组相比,3)P<0.01。
Fig. 3 Effects of SAN on mRNA levels of NOX2, p47phox and HO-1
Compared with normal control group,1)P<0.01; compared with LPS group,2)P<0.01; compared with LPS+SAN group,3)P<0.01.
2.4 SAN增加H9c2细胞的抗氧化能力
LPS干预细胞12 h后,细胞内SOD1、SOD2 mRNA水平显著下降(P<0.01);SAN 1 μmol·l-1与LPS同时干预H9c2细胞后,SOD1、SOD2的mRNA水平则呈显著上调(P<0.01)。见图4。
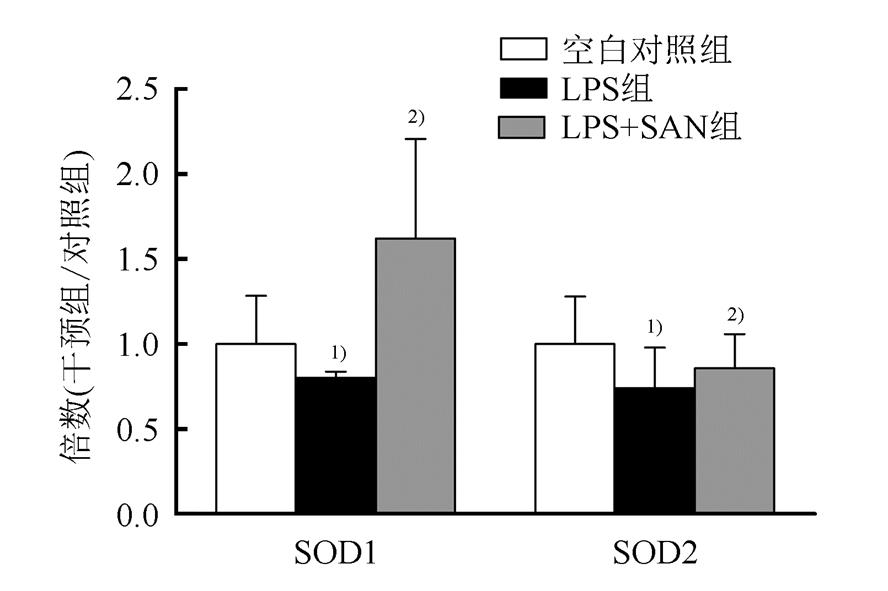
图4 SAN对细胞抗氧化应激能力的影响
与空白对照组相比,1)P<0.01,与LPS组相比,2)P<0.01。
Fig. 4 Effects of SAN on antioxygenic ability
Compared with normal control group,1)P<0.01; compared with LPS group,2)P<0.01.
2.5 SAN可降低细胞损害
LPS干预细胞12 h后,细胞内MDA含量显著增加(P<0.01);而SAN与LPS同时作用则可降低MDA的含量(P<0.01)。见图5。
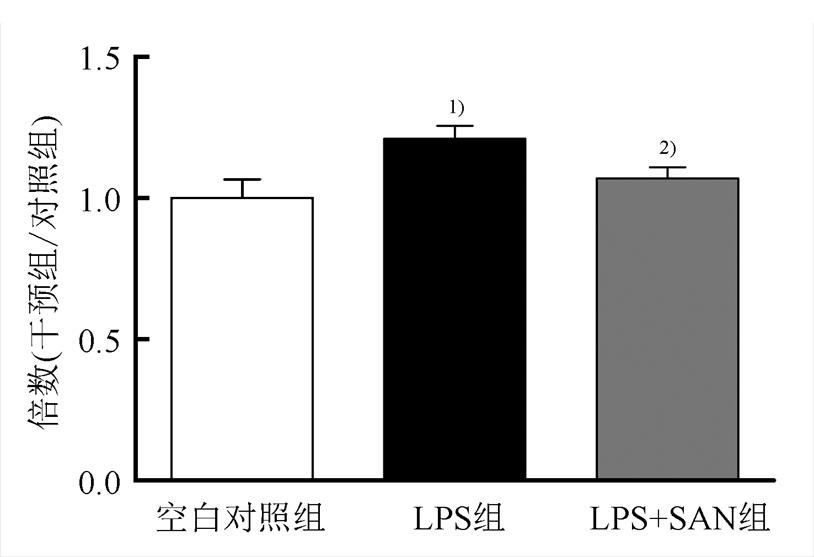
图5 SAN对细胞损伤的影响
与空白对照组相比,1)P<0.01,与LPS组相比,2)P<0.01。
Fig. 5 Effects of SAN on cell damage
Compared with normal control group,1)P<0.01; compared with LPS group,2)P<0.01.
3 讨论
本研究结果显示,LPS可引起细胞内ROS及细胞脂质过氧化物MDA水平显著上升,心肌细胞膜的NADPH氧化酶NOX2及其亚单位p47phox的基因表达也显著上调,而SOD1、SOD2及HO-1的下调则说明H9c2细胞的抗氧化能力下降;SAN干预可抑制细胞ROS的产生、降低MDA水平,NOX2与p47phox的基因表达及细胞的抗氧化指标SOD1、SOD2及HO-1均显著上调。这些结果均提示,SAN可抑制LPS诱导的H9c2细胞氧化应激损伤反应。
3.1 ROS与心肌细胞炎症及凋亡的关系
ROS在体内少量存在,对维持机体的正常生理功能发挥着重要作用。败血症发生时,细菌在血液中产生大量的内毒素,通过调节心脏中NADPH氧化酶、黄嘌呤氧化酶和对线粒体的直接损伤以及二次损伤作用产生大量的ROS,进而对心肌的其他细胞器、蛋白、细胞核以及细胞膜造成损伤,继而引起细胞炎症或凋亡[10]。本研究结果显示,LPS可以引起细胞内ROS的产生,抑制细胞活性。国内外的一些研究证实,给予LPS诱导的H9c2细胞抗氧化应激药物处理后,可抑制NF-κB的核转位,改善炎症反应,减少细胞的凋亡,降低LPS诱导的小鼠心肌组织氧化损伤[4-5,11]。
3.2 SAN的药理作用
SAN属苄基异喹啉类生物碱,其药效作用主要包括抗菌、杀虫、抗氧化、增强免疫力、改善肝脏功能等作用[12]。近些年的研究发现,SAN作用于肿瘤细胞如卵巢癌、结肠癌、前列腺癌等,可发挥强有力的促肿瘤细胞氧化应激及凋亡的作用,从而抑制肿瘤细胞生长、转移和浸润,促进其凋亡[8,13]。在心血管系统中,吴茂旺等[14]研究发现SAN能影响心肌细胞中Ca2+的流动,诱导心肌细胞凋亡,此外,SAN还可以加强心脏活动,发挥外周抗肾上腺素交感神经的作用,但笔者所在课题组之前的研究发现[15],SAN可通过抑制NF-κB信号通路从而显著改善压力负荷诱导的心室重构,这与吴茂旺的研究相悖,需要再次实验证实。
3.3 SAN通过抑制HO-1/NOX2进而抑制ROS的产生
LPS或内毒素诱导的心肌细胞炎症反应主要通过位于心肌细胞膜上的TLR4受体以及下游的NF-κB信号通路来传导,而心肌细胞中NADPH氧化酶的激活以及产生的大量ROS是TLR4受体活化的前提和必要条件[16]。NADPH氧化酶的NOX家族是许多非吞噬细胞中ROS的主要来源,生理情况下,机体通过此种途径产生的ROS主要参与维持机体正常的生理功能以及细胞内信号传导[17]。当细胞受到刺激时,NOX家族表达上调,ROS大量产生,从而诱导机体发生病变。在心肌细胞中主要有NOX2及NOX4,两者任一表达上调均引起的心肌细胞内ROS水平上调,从而发挥调控心肌细胞肥大、凋亡、纤维化以及线粒体功能障碍的作用[18]。此外,HO-1在各种氧化应激情况下均可被诱导激活,催化血红素降解,产物都有抗氧化损伤功能,在许多疾病如败血症和动脉粥样硬化中发挥着重要的保护作用,在血管平滑肌中,HO-1过表达可抑制NADPH氧化酶的活性,减轻心血管疾病的氧化应激,本研究证明HO-1可调节NOX2的基因表达水平,SAN对细胞损伤的保护作用可被HO-1抑制剂SnPPIX抑制,HO-1表达水平的上调可有效减轻LPS诱导的H9c2细胞氧化应激损伤,显著引起NOX2及位于细胞质内的调节亚基p47phox mRNA的表达下调。因此,笔者推断,SAN可通过抑制心肌细胞中HO-1/NOX2继而发挥抗ROS的作用,从而提高细胞活性。
3.4 SAN通过增加细胞抗氧化应激能力清除过多的ROS
正常机体存在各种抗氧化酶和小分子抗氧化剂,具有直接对抗ROS的作用。SOD在体内广泛分布,是人体防御内外环境中超氧离子损伤的重要酶。哺乳动物细胞有3种SOD同工酶,在细胞外、细胞质中的SOD,其活性中心含Cu/Zn离子,称SOD1(Cu/Zn-SOD),线粒体中的SOD活性中心含Mn2+,成为SOD2(Mn-SOD)。本研究结果显示,LPS可大大降低H9c2细胞中抗氧化指标SOD1、SOD2的水平,而SAN与LPS同时作用则可逆转这种现象。说明SAN可显著增加H9c2细胞的总体抗氧化能力,胞浆和线粒体中清除ROS的能力显著增强,也进一步降低了ROS对线粒体的损伤,进一步减少ROS对细胞的损伤,从而提高细胞活力。
本研究结果显示,SAN可减少LPS诱导产生的ROS,同时又可增强H9c2细胞清除ROS的能力,降低ROS对细胞的损伤,为进一步探讨SAN的临床治疗提供基础实验研究证据。但本研究未能进一步明确线粒体的电位变化,未能阐明SAN改善细胞活力,降低ROS下游信号通路的机制,也未能阐明SAN对其他抗氧化分子的作用。接下来的实验需要继续深入探讨SAN对H9c2细胞作用的具体信号传导通路,以及与凋亡、炎症的具体关系。
REFERENCES
[1] Angus D C, Pereira C A, Silva E. Epidemiology of severe sepsis around the world [J]. Endocr Metab Immune Disord Drug Targets, 2006, 6(2): 207-212.
[2] Merx M W, Weber C. Sepsis and the heart [J]. Circulation, 2007(116): 793-802.
[3] Zhou H, Qian J, Li C, et al. Attenuation of cardiac dysfunction by HSPA12B in endotoxin-induced sepsis in mice through a PI3K-dependent mechanism [J]. Cardiovasc Res, 2011, 89(1): 109-118.
[4] 刘丹, 尹东, 曾姝, 等. 川芎嗪对LPS致心肌细胞损伤的影响及机制研究[J]. 中国药理学通报, 2012, 28(11): 1531-1535.
[5] 刘玲, 刘新伟, 梁灿鑫, 等. 白藜芦醇对脂多糖诱导的H9c2心肌细胞损伤的影响[J]. 中国医科大学学报, 2013, 42(4): 339-343.
[6] ZHANG Z H, YU Y, WEI S G, et al. Centrally administered lipopolysaccharide elicits sympathetic excitation via NAD(P)H oxidase-dependent mitogen-activated protein kinase signaling [J]. J Hypertens, 2010, 28(4): 806-816.
[7] Chaturvedi M M, Kumar A, Darnay B G, et al. Sanguinarine (pseudochelerythrine) is a potent inhibitor of NF-kappaB activation, IkappaBalpha phosphorylation, and degradation [J]. J Biol Chem, 1997, 272(48): 30129-30134.
[8] Ahmad N, Gupta S, Husain M M, et al. Differential antiproliferative and apoptotic response of sanguinarine for cancer cells versus normal cells [J]. Clin Cancer Res, 2000, 6(4): 1524-1528.
[9] Burgeiro A, Bento A C, Gajate C, et al. Rapid human melanoma cell death induced by sanguinarine through oxidative stress [J]. Eur J Pharmacol, 2013, 705(13): 109-118.
[10] Fernandes C J J r, de Assuncao M S. Myocardial dysfunction in sepsis: a large, unsolved puzzle [J]. Crit Care Res Pract, 2012(2012): 896430.
[11] Sebai H, Sani M, Aouani E, et al. Cardioprotective effect of resveratrol on lipopolysaccharide-induced oxidative stress in rat [J]. Drug Chem Toxicol, 2011, 34(2): 146-150.
[12] Chaturvedi M M, Kumar A, Darnay B G, et al. Sanguinarine (pseudochelerythrine) is a potent inhibitor of NF-kappaB activation, IkappaBalpha phosphorylation, and degradation [J]. J Biol Chem, 1997, 272(48): 30129-30134.
[13] Burgeiro A, Bento A C, Gajate C, et al. Rapid human melanoma cell death induced by sanguinarine through oxidative stress [J]. Eur J Pharmacol, 2013, 705(1-3): 109-118.
[14] WU M W, ZHU J H, ZHANG D Y, et al. Activity of Ca2+.Mg2+-ATPase and SDH in myocardium of rat induced by macleaya cordata and ultrastructures [J]. Chin J Forein Med(中国法医学杂志), 2008, 23(3): 154-156.
[15] Deng W, Fang Y, Liu Y, et al. Sanguinarine protects against pressure overloadinduced cardiac remodeling via inhibition of nuclear factor-kappaB activation [J]. Mol Med Rep, 2014, 10(1): 211-216.
[16] Pawate S, Shen Q, Fan F, et al. Redox regulation of glial inflammatory response to lipopolysaccharide and interferongamma [J]. J Neurosci Res, 2004, 77(4): 540-551.
[17] HAN X Y. NOX family of NADPH oxidase and diseases [J]. J Inter Pathol Clin Med(国际病理科学与临床杂志), 2010, 33(6): 513-517.
[18] Nabeebaccus A, Zhang M, Shah A M. NADPH oxidases and cardiac remodelling [J]. Heart Fail Rev, 2011, 16(1): 5-12.
Sanguinarine attenuates H9c2 Cardiomyocytes Oxidative Stressin vitroinduced by Lipopolysaccharide
WANG Ling1, GAN Xuedong2*
(1.Department of Internal medicine, Hospital of Wuhan University, Wuhan 430072, China; 2.Zhongnan Hospital of Wuhan University, Wuhan 430071, China)
ABSTRACT:OBJECTIVETo observe the efficiency of sanguinarine(SAN) acting on oxidative stress of H9c2 cellin vitroinduced by lipopolysaccharide(LPS), and investigate its relationship with HO-1/NOX2 pathway.METHODSAfter H9c2 cells received intervention by different factors, cell growth was determined by CCK8 assay, reactive oxygen species(ROS) generation was detected by a Micro plate reader and Fluorescence microscopy, the mRNA expression ofNOX2,P47PHOX,SOD1,SOD2andHO-1were determined by real time RT-PCR, MDA detection kit was determined to test the change of MDA.RESULTSSAN alone had no effect on cell activity; LPS reduced cell viability significantly, while co-treated the H9c2 cells with SAN and LPS could reverse this condition, improve cell activity and reduce ROS; the mRNA expression of NOX2, p47phox were increased and HO-1 decreased after LPS treated for 12 h, pre-treated with SAN, the mRNA expression of NOX2, p47phox were decreased and HO-1 was increased, while, pre-treated with SnPPIX and SAN could reverse this condition. SAN could increase the mRNA expression of SOD1 and SOD2, decrease the MDA level.CONCLUSIONSAN inhibits the ROS generation induced by LPS via activate the HO-1/NOX2 pathway and also enhance ROS scavenging ability of H9c2 cell, and enhance the cell activity in the end.
KEY WORDS:sanguinarine; lipopolysaccharide; oxidative stress; SOD; H9c2 cell
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2018)10-1451-06
DOI:10.13748/j.cnki.issn1007-7693.2018.10.004
引用本文:王玲,干学东. 血根碱对脂多糖致H9c2细胞氧化损伤的改善作用[J]. 中国现代应用药学, 2018, 35(10): 1451-1456.
收稿日期:2017-11-13
作者简介:王玲,女,硕士 Tel: 18995607183 E-mail:wangling012345678@126.com
*通信作者:干学东,男,博士,副主任医师 Tel: 13971487929 E-mail:dhgxd319@163.com
(本文责编:曹粤锋)

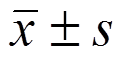 表示,多组间均数比较采用单因素方差分析,组间两两均数比较采用S-N-K法(方差齐)或Dunnett′s T3(方差不齐)检验,P<0.05为差异具有显著性。
表示,多组间均数比较采用单因素方差分析,组间两两均数比较采用S-N-K法(方差齐)或Dunnett′s T3(方差不齐)检验,P<0.05为差异具有显著性。



