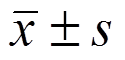 表示,组间比较采用独立样本t检验,组内比较采用配对t检验,计数资料计算构成比,采用χ2检验。P<0.05为差异有统计学意义。
表示,组间比较采用独立样本t检验,组内比较采用配对t检验,计数资料计算构成比,采用χ2检验。P<0.05为差异有统计学意义。曹国军,张行丰,郑科达
(宁波市奉化区人民医院全科医疗科,浙江 宁波 315500)
摘要:目的探讨普拉克索对老年血管性帕金森综合征(vascular parkinsonism,VP)患者非运动症状及氧化应激的影响。方法纳入2015年1月—2016年6月于宁波市奉化区人民医院接受治疗的96例老年VP患者,按照随机化原则分为2组,各48例。2组均接受抗凝、改善循环、神经营养治疗,观察组在此基础上应用普拉克索,对照组应用美多芭片。分别于治疗前、治疗12月时测评患者统一帕金森病评定量表(UPDRS)、汉密尔顿抑郁量表(HAMD)、社会功能活动问卷(FAQ)、匹兹堡睡眠质量指数量表(PSQI)评分变化情况,并统计肢体感觉异常、自主神经症状发生情况,同时采集患者空腹静脉血,检测血清丙二醛、同型半胱氨酸、血钙、对氧磷酶-1水平。结果2组治疗前UPDRS、HAMD、FAQ、PSQI量表评分,血清丙二醛、同型半胱氨酸、血钙、对氧磷酶-1水平均接近,组间差异无统计学意义。治疗后上述指标均有所改善,且观察组UPDRS各部分得分、HAMD和FAQ得分、PSQI各维度得分均显著低于对照组(P<0.05),丙二醛、同型半胱氨酸水平显著低于对照组(P<0.05),对氧磷酶-1水平显著高于对照组(P<0.05)。观察组治疗期间肢体感觉异常、自主神经症状发生率显著低于对照组(P<0.05)。结论普拉克索能够有效改善老年VP患者非运动症状,抑制氧化应激损伤,对老年VP患者疗效更优。
关键词:普拉克索;老年;血管性帕金森综合征;非运动症状;氧化应激
血管性帕金森综合征(vascular parkinsonism,VP)是常见于老年人群的神经系统退行性疾病,属于继发性帕金森综合征类型之一,约占所有帕金森病的2%~12%。目前认为VP患者群年龄更大,较帕金森病患者大4~10岁[1]。VP病因尚未完全阐明,但临床多认为其与脑组织退行性病变、氧化应激损伤、神经元损害等有关[2]。目前临床主要采用美多芭治疗该疾病,但其疗效及稳定性相对较差,且长期应用可能导致多巴胺神经元不良反应[3],同时老年患者往往伴随精神类症状、自主神经紊乱、肢体感觉异常等非运动性症状,美多芭对此类症状改善效果不佳[4]。针对非VP的研究指出,普拉克索能够同时改善患者运动及非运动症状[5],但针对性探讨普拉克索对VP患者非运动症状改善效果的报道尚少。本研究拟对比分析普拉克索对老年VP患者的疗效、非运动症状及氧化应激等方面影响,并初步分析其可能机制。
根据既往宁波市奉化区人民医院每年收治VP老年患者例数,结合样本量估计计算公式为:n=[P1(100-P1)+P2(100-P2)]/(P1-P2)2×f(α,β)(其中,n表示样本量,P1和P2分别表示两总体率的估计值,a和b表示检验水准第2类错误概率),拟定患者入组时间为2015年1月—2016年6月,并初步确定样本量为98例,最终入组96例老年VP患者,根据入院先后顺序将患者随机均分为2组。观察组:48例,男22例、女26例;年龄60~86岁,平均(71.40±8.83)岁;病程3~36月,平均(16.81±3.63)月。对照组:48例,男21例、女27例;年龄60~87岁,平均(72.17±9.04)岁;病程4~36月,平均(17.08±4.23)月。2组性别、年龄、病程等一般资料比较,差异无统计学意义。
纳入标准:①符合国际运动障碍学会2015年提出的诊断标准[6];②年龄≥60岁,未长期使用帕金森治疗药物且病程3年以内;③Hoehn-Yahr分级Ⅱ~Ⅳ级;④病情稳定,语言功能正常,能够理解并填写问卷调查表格,治疗及随访依从性高;⑤患者及家属对本研究知情同意,并获得医院伦理主管部门批准。
排除标准:①服用可导致帕金森综合征的药物;②纳入研究前1月内应用可能影响锥体外系的药物;③严重的肝、肾等脏器功能障碍;④对本研究的应用药物过敏;⑤存在其他可能导致非运动症状的因素,如严重心理创伤、脑积水患者、肿瘤等。
脱落标准:自主要求脱落;随访期间失访患者;未严格按医嘱用药患者;并发脑血管病影响治疗及观察者。
2组患者均接受常规抗凝、改善循环、营养神经等治疗方案。在此基础上,对照组应用美多芭片(上海罗氏制药有限公司生产,国药准字H10930198,每片含左旋多巴200 mg、苄丝肼50 mg)口服,0.25~0.75 g·d-1,采用个体化治疗方案,以不超过最大可耐受剂量为准。观察组应用普拉克索(德国Booehringer Ingelheim International GmbH,国药准字号H20110355,每片0.25 mg)口服,起始每次0.25 mg,每日3次,根据患者临床症状和安全性逐步加量,患者症状的改善达到稳定后维持剂量,如出现明显药物不良反应,予以暂时性减量或对症支持处理。2组均持续治疗12月后统计相关指标。
1.4.1 帕金森综合征症状改善效果 采用统一帕金森病评定量表(unified Parkinson’s disease rating scale,UPDRS)测评患者VP病情的总体变化情况,本量表共4个部分、42项,前3个部分分别测评精神、行为和情绪,日常生活能力,运动功能,各项分5个等级,0分为正常,4分最严重,后1个部分为并发症积分,共23分,得分越高提示患者相关症状越严重,国内测评显示该量表内部一致性Cronbach’s α系数0.94,内容效度相关系数0.43~0.81[7]。
1.4.2 抑郁症状改善效果 采用汉密尔顿抑郁量表(Hamilton depression scale,HAMD)17项版本测评患者抑郁症状,得分越高提示抑郁症状越严重,总分<7分为正常,7~17分为轻度抑郁,18~24分为中度抑郁;>24分为重度抑郁[8]。
1.4.3 生活质量改善效果 采用社会功能活动问卷(functional activities questionnaire,FAQ)测评患者生活质量改善情况,量表共10项,各项按0~3分赋分,0分指正常或从未做过,但能做;1分指困难,但可独立完成或从未做过;2分指需要帮助;3分指完全依赖他人[9]。
1.4.4 睡眠质量改善情况 采用匹兹堡睡眠质量指数量表(Pittsburgh sleep quality index,PSQI)测评患者睡眠质量,本量表共19个自评和5个他评条目,其中第19个自评项目和5个他评项目不参与计分,所有条目可划分为睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物和日间功能7个维度,每个维度按0~3计分,得分越高提示睡眠质量越差,国内测评提示其内部一致性Cronbach’s α系数0.845[10]。
1.4.5 自主神经功能症状及肢体感觉异常发生情况 统计患者治疗期间自主神经症状及肢体感觉异常发生情况,自主神经功能症状包括:出汗、口干、流涎、便秘、尿频尿急、四肢寒冷、低位性低血压、性功能障碍,感觉异常包括:嗅觉异常、肢体疼痛、肢体痉挛、不宁腿综合征。
1.4.6 氧化应激指标变化情况 采集患者空腹外周血送奉化市人民医院检验中心进行检验,采用化学发光免疫法检测同型半胱氨酸(homocysteine,Hcy)浓度,采用离子选择电极法检测血钙浓度,采用乙酸苯酯法检测对氧磷酶-1(paraoxonase-1,PON-1)水平。采用硫代巴比妥酸法检测丙二醛(malondialdehyde,MDA)水平,检测试剂盒由南京建成生物科技公司提供。上述6个观察项目分别于治疗前、治疗12月后择上午测评。
采用SPSS19.0处理数据,计量资料符合正态分布以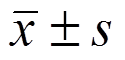 表示,组间比较采用独立样本t检验,组内比较采用配对t检验,计数资料计算构成比,采用χ2检验。P<0.05为差异有统计学意义。
表示,组间比较采用独立样本t检验,组内比较采用配对t检验,计数资料计算构成比,采用χ2检验。P<0.05为差异有统计学意义。
观察组治疗期间,1例患者未严格按医嘱用药、1例脑血管病复发,对照组失访2例,此4例均纳为脱落患者,其余患者均得到完整随访。2组患者治疗前精神、行为和情绪,日常生活能力,运动功能,并发症积分比较,组间差异无统计学意义;经治疗后,2组上述部分得分均明显下降,组内差异有统计学意义(P<0.05);治疗后观察组上述部分得分均明显低于对照组,组间差异有统计学意义(P<0.05)。见表1。
表1 2组UPDRS评分变化情况比较(n=46,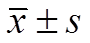 )
)
Tab. 1 Comparison of changes of UPDRS score in two groups(n=46,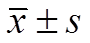 ) 分
) 分

注:与同组治疗前比较,1)P<0.05;与观察组治疗后比较,2)P<0.05。
Note: Compared with the same group before treatment,1)P<0.05; compared with the observation group after treatment,2)P<0.05.
2组患者治疗前HAMD、FAQ得分比较,组间差异无统计学意义;经治疗后上述得分均明显下降,组内差异有统计学意义(P<0.05);治疗后观察组上述得分低于对照组,组间差异有统计学意义(P<0.05)。见表2。
表2 2组患者HAMD、FAQ得分变化情况比较(n=46,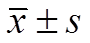 )
)
Tab. 2 Comparison of changes of HAMD, FAQ scores in two groups(n=46,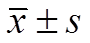 ) 分
) 分

注:与同组治疗前比较,1)P<0.05;与观察组治疗后比较,2)P<0.05。
Note: Compared with the same group before treatment,1)P<0.05; compared with the observation group after treatment,2)P<0.05.
2组治疗前PSQI评分各维度得分比较,组间差异无统计学意义;经治疗后2组PSQI评分各维度得分均明显下降,组内差异有统计学意义(P<0.05);治疗后观察组PSQI评分各维度得分均明显低于对照组,组间差异有统计学意义(P<0.05)。见表3。
观察组治疗期间,出汗、口干、流涎、便秘、尿频尿急、四肢寒冷、低位性低血压、性功能障碍、嗅觉异常、肢体疼痛、肢体痉挛、不宁腿综合征发生率均明显低于对照组,差异有统计学意义(P<0.05)。见表4。
2组患者治疗前血清MDA、Hcy、血钙、PON-1水平比较,组间差异无统计学意义;治疗后MDA、Hcy均明显下降,PON-1均明显增加,组内差异有统计学意义(P<0.05);治疗后观察组MDA、Hcy水平明显低于对照组,PON-1水平明显高于对照组,组间差异有统计学意义(P<0.05)。见表5。
表3 2组患者PSQI评分变化情况比较(n=46,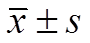 )
)
Tab. 3 Comparison of changes of PSQI scores in two groups(n=46,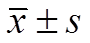 ) 分
) 分

注:与同组治疗前比较,1)P<0.05;与观察组治疗后比较,2)P<0.05。
Note: Compared with the same group before treatment,1)P<0.05; compared with the observation group after treatment,2)P<0.05.
表4 2组患者自主神经功能症状及肢体感觉异常发生情况比较(n=46)
Tab. 4 Comparison of occurrence of autonomic nerve symptoms and abnormal body feeling(n=46) 例(%)
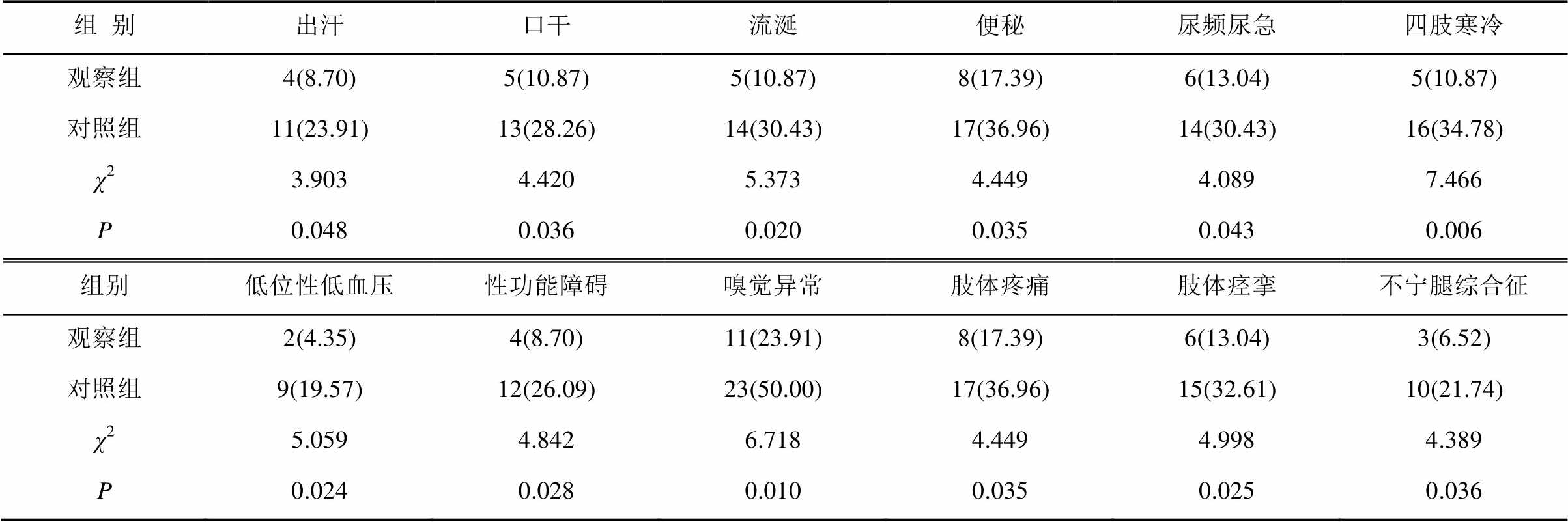
表5 2组氧化应激指标变化情况(n=46, )
)
Tab. 5 Changes of oxidative stress indicators in two groups(n=46,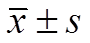 )
)
注:与同组治疗前比较,1)P<0.05;与观察组治疗后比较,2)P<0.05。
Note: Compared with the same group before treatment,1)P<0.05; compared with the observation group after treatment,2)P<0.05.
VP是一种多发于老年群体的神经变性疾病,男性多于女性,随着我国老年人口的增加,VP发病率呈上升趋势[11]。目前,VP的形成机制尚未完全阐明,但已发现其主要病理改变是壳核、基底节区、基白球及脑干多发性病灶直接破坏纹状体系统的多巴胺突触后结构,导致多巴胺受体减少,而体内多巴胺和乙酰胆碱未被破坏,故多巴胺利用度减少,导致出现类帕金森症状[12]。美多芭片是治疗该疾病的常见药物,其能够补充脑内多巴胺神经递质,有一定早期治疗效果。本研究对照组在常规治疗的基础上应用该药物,UPDRS评分各部分均有明显改善,提示其能够有效控制类帕金森症状,与王雅娟等[13]报道中对照组结果相似。但长期应用该药物可能影响黑质神经细胞对多巴胺功能的调节,导致总远期疗效下降,且可能引发运动障碍、开关现象等,同时该药物对患者非运动症状改善效果欠佳,因此长期应用价值受限[14]。
普拉克索为多巴胺受体激动剂,能够通过减少细胞内多巴胺的含量来阻止谷氨酸对多巴胺神经元的毒性,从而保护神经功能,目前研究认为其药理作用可能与抑制神经毒性、减少活化羟自由基水平、下调多巴胺转运蛋白等因素有关[15]。本研究观察组应用该药物,UPDRS各部分得分下降效果更明显,提示其能够更有效地抑制类帕金森症状。但老年VP患者往往表现出严重的非运动症状,例如抑郁、流涎、认知和睡眠障碍等,同时本研究发现患者治疗前HAMD、FAQ、PSQI评分均较高,提示其抑郁症状、日常生活能力、睡眠质量等均较差。鉴于此,《中国血管性帕金森综合征诊断与治疗专家共识》[1]建议重点关注并治疗非运动症状。本研究进一步发现该药物对老年患者非运动症状也有更好的改善作用:①目前多认为普拉克索较美多芭能够更有效地控制抑郁[5],本研究中观察组患者经治疗12月后HAMD评分改善效果明显优于对照组,但有部分患者接受多巴胺治疗可能出现抑郁加重,临床上需要及时减量或给予对症支持处理。Berghauzen-maciejewska等[16]研究也认为普拉克索能够有效控制抑郁症状,可能与选择性活化前额叶皮质多巴胺系统有关。②普拉克索能够有效改善老年VP患者日常生活能力,观察组患者经治疗12月后FAQ评分改善效果明显优于对照组。这与司霞等[17]报道结果相符,这可能与患者精神类、自主神经紊乱等症状改善效果更可靠有关。③普拉克索能够有效改善患者睡眠质量,观察组治疗12月后PSQI评分改善效果明显优于对照组。VP对老年患者睡眠的影响,可能与患者脑中红核及黑质内多巴胺增多、神经元脱失有关[18],而普拉克索能够活化多巴胺受体,故能够抑制上述病理变化,改善患者睡眠质量。④普拉克索能够降低老年患者治疗期间的自主神经功能症状及肢体感觉异常发生率,这与马义鹏等[19]报道的普拉克索与左旋多巴在改善患者自主神经症状、感觉障碍等方面无明显差异的研究结果不同,考虑可能与在使用左旋多巴药物的基础上加用普拉克索对治疗老年VP具有较好的临床疗效,或本研究样本量较小有关。但与焦琳娜等[20]报道结果相符,而既往也有应用该药物治疗不安腿综合征的报道[21]。可见,对于普拉克索能否有效减轻患者自主神经功能症状及肢体感觉异常还需进一步验证。
氧化应激损伤是VP病理损伤的主要机制之一[11],本研究发现2组患者经治疗12月后,MDA、Hcy均明显下降,PON-1均明显升高,提示2种方案均能够有效改善患者氧化应激损伤。其中MDA是脂质代谢产物,直接反映脂质过氧化速度和强度,间接反映组织受自由基损伤程度,既往报道[22]证实其在患有帕金森综合征的机体内高表达;Hcy在机体内生成同型半胱氨酸硫内酯,增强氧化应激,同时还可抑制PON-1的表达,这是动脉硬化与血管内皮损伤的主要机制之一,Hcy可能参与了VP的发生与发展过程;PON-1能够通过多种途径降低氧化应激和脂质过氧化损伤,研究表明[23]其低表达与多种神经系统疾病有关。本研究发现观察组治疗后MDA、Hcy水平低于对照组,PON-1水平高于对照组,提示普拉克索能够更有效地抑制氧化应激损伤,这可能也是其对老年VP的治疗机制之一,但目前尚不清楚其具体作用机制。
总之,本研究发现普拉克索能够有效抑制老年VP患者非运动症状及氧化应激水平。与美多芭相比,普拉克索对老年VP患者疗效更优,但其具体机制有待进一步研究。
REFERENCES
[1] 中华医学会神经病学分会帕金森病及运动障碍学组, 中国医师协会神经内科医师分会帕金森病及运动障碍专业委员会. 中国血管性帕金森综合征诊断与治疗专家共识[J]. 中华神经科杂志, 2017, 50(5): 326-331.
[2] GUAN J, PAVLOVIC D, DALKIE N, et al. Vascular degeneration in Parkinson’s disease [J]. Brain Pathol, 2013, 23(2): 154-164.
[3] JIA Z G, DANG L L, LI J J, et al. Efficacy observation of levodopa and benserazide hydrochloride tablets combined with edaravone in treatment of vascular parkinsonism [J]. Drug Eval Res(药物评价研究), 2016, 39(6): 1050-1053.
[4] 吴东川, 吴晓霞, 王广君, 等. 多巴丝肼片口服联合经颅直流电刺激对帕金森病患者非运动症状的改善作用[J]. 山东医药, 2016, 56(31): 88-90.
[5] YOU H S, MAO X Q, SHI J, et al. Impact of non-motor symptoms in old patients with Parkinson’s disease treated with madopar combined pramipexole [J]. J Int Psychl(国际精神病学杂志), 2017, 44(4): 649-651.
[6] POSTUMA R B, BERG D, STERM M, et al. MDS clinical diagnostic criteria for Parkinson’s disease [J]. Mov Disord, 2015, 30(12): 1591-1601.
[7] ZHANG W, YUAN W, XIE H, et al. Meta-analysis of piribedil combined with levodopa for the treatment of Parkinson’s disease [J]. Chin J Mod Appl Pharm (中国现代应用药学), 2016, 33(10): 1323-1328.
[8] SONG Y P, DAI J T, WANG X W, et al. Investigation and study on the depression status and quality of 134 patients with Parkinson disease [J]. Sichuan Med J(四川医学), 2013, 34(6): 852-853.
[9] 管细红, 李博. 太极拳训练对帕金森患者认知功能及社会功能的影响[J]. 护士进修杂志, 2016, 31(18): 1684-1686.
[10] LU T Y, LI Y, XIA P, et al. Analysis on reliability and validity of the Pittsburgh sleep quality index [J]. Chongqing Med(重庆医学), 2014, 43(3): 260-263.
[11] LIU J, DUAN C L, YANG H, et al. Research progress of pathogenesis and treatment of Parkinson’s disease [J]. Prog Physiol Sci(生理科学进展), 2015, 46(3): 163-169.
[12] CHEN Y F, TSENG Y L, LAN M Y, et al. The relationship of leukoaraiosis and the clinical severity of vascular Parkinsonism [J]. J Neurol Sci, 2014, 346(1-2): 255-259.
[13] 王雅娟, 张秀敏, 周华. 补气破瘀息风法联合多巴丝肼治疗血管性帕金森综合征疗效观察[J]. 现代中西医结合杂志, 2016, 25(21): 2316-2318.
[14] CHANG J. Clinical study on the application of madopar regimen in treatment of patients with Parkinson’s disease [J]. J Clin Exp Med(临床和实验医学杂志), 2013, 12(22): 1832-1834.
[15] GUO S J, WANG C M. Protective effects of R(+) pramipexole on acute cerebral ischemia injury in rats [J]. J Dalian Med Univ(大连医科大学学报), 2015, 37(4): 320-323.
[16] BERGHAUZEN-MACIEJEWSKA K, KUTER K, KOLASIEWICZ W, et al. Pramipexole but not imipramine or fluoxetine reverses the "depressive-like" behaviour in a rat model of preclinical stages of Parkinson’s disease [J]. Behav Brain Res, 2014, 271(1): 343-353.
[17] SI X, CHEN Y, LI Y, et al. A systematic review of therapuetic efficacy and safety of pramipexole as adjunctive therapy for Parkinson’s disease [J]. China Pharm(中国药房), 2013, 24(44): 4163-4167.
[18] RAGGI A, BELLA R, PENNISI G, et al. Sleep disorders in Parkinson’s disease: a narrative review of the literature [J]. Rev Neurosci, 2013, 24(3): 279-291.
[19] 马义鹏, 胡为民, 梁蔚骏, 等. 普拉克索缓释片治疗原发性帕金森病非运动症状的临床观察[J]. 中国药物与临床, 2017, 17(8): 1191-1194.
[20] JIAO L N, ZHANG X B, CAO X, et al. The influence of pramipexole dihydrochloride on non-motor symptoms and sleep quality of patients with Parkinson disease combined with depression [J]. Chin Med Herald(中国医药导报), 2016, 13(18): 153-156.
[21] JUNG KY, KIM S M, SONG J Y, et al. Sternberg working memory performance following treatment with pramipexole in patients with moderate-to-severe restless legs syndrome [J]. Sleep Med, 2015, 16(6): 703-708.
[22] YANG Y, ZHANG X L, WANG Y P, et al. Antioxidation and anti-inflammatory effects of antrodia camphorata polysaccharide on Parkinsonian mice induced by 6-OHDA [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(7): 969-972.
[23] MENINI T, GUGLIUCCI A. Paraoxonase 1 in neurological disorders [J]. Redox Rep, 2014, 19(2): 49-58.
Effect of Pramipexole on Non-motor Symptoms and Oxidative Stress in Elderly Patients with Vascular Parkinsonism
CAO Guojun, ZHANG Xingfeng, ZHENG Keda
(Department of General Medicine, Fenghua People’s Hospital of Ningbo, Ningbo 315500, China)
ABSTRACT:OBJECTIVETo investigate the effect of pramipexole on non-motor symptoms and oxidative stress in elderly patients with vascular parkinsonism(VP).METHODSA total number of 96 elderly patients with VP who were treated in Fenghua People’s Hospital of Ningbo from January 2015 to June 2016 were randomly divided into 2 groups, each of 48 cases. Two groups were treated with anticoagulation, circulation improvement and nerve nutrition therapy, and on this basis, the observation group was treated with pramipexole, while the control group was treated with madopar. Before treatment and at 12 months after treatment, the changes of unified Parkinson’s disease rating scale(UPDRS), Hamilton depression scale(HAMD), functional activities questionnaire(FAQ) and pittsburgh sleep quality index(PSQI) were tested and evaluated; the conditions of abnormal body feeling and autonomic nerve symptoms were counted, at the same time, fasting blood in patients were collected to detect the changes of serum malondialdehyde(MDA), homocysteine(Hcy), serum calcium and paraoxonase-1(PON-1) in 2 groups.RESULTSBefore treatment, the scores of UPDRS, HAMD, FAQ and PSQI, and the expression of MDA, Hcy, calcium and PON-1 in serum of 2 groups showed no significant differences. After treatment, the above indexes were significantly better than those before treatment in two groups, and the scores of UPDRS, HAMD, FAQ, PSQI in the observation group were significantly lower than those in the control group(P<0.05), the levels of MDA and Hcy were significantly lower than those in the control group(P<0.05), PON-1 was significantly higher than that in the control group(P<0.05). The incidences of abnormal body feeling and autonomic nerve symptoms in the observation group were significantly lower than those in the control group(P<0.05).CONCLUSIONPramipexole can effectively improve non-motor symptoms and inhibit oxidative stress injury in elderly patients with VP, which may contribute to the better clinical outcomes.
KEY WORDS:pramipexole; elderly; vascular parkinsonism; non-motor symptoms; oxidative stress
中图分类号:R969.4
文献标志码:B
文章编号:1007-7693(2018)10-1554-06
DOI:10.13748/j.cnki.issn1007-7693.2018.10.027
引用本文:曹国军, 张行丰, 郑科达. 普拉克索对老年血管性帕金森患者非运动症状及氧化应激的影响[J]. 中国现代应用药学, 2018, 35(10): 1554-1559.
收稿日期:2018-01-02
作者简介:曹国军,男,副主任医师 Tel: (0574)88589030 E-mail: yuefu40080@163.com
(本文责编:李艳芳)