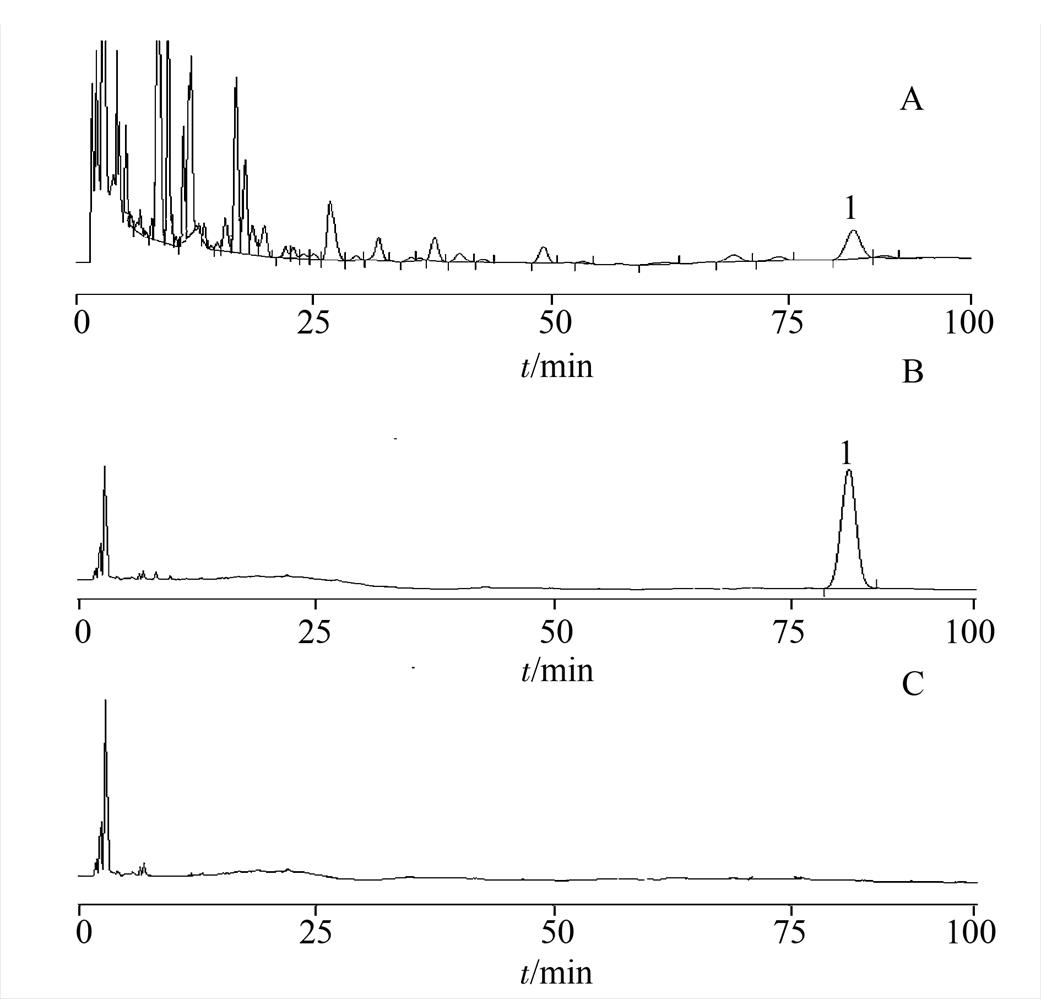
图1 高效液相色谱图
任佳伟1,马月梅2,陈新晶3,李梦薇3,王豪3,刘洋3*
(1.华北电力大学医院,北京 02206;2.亚宝药业集团股份有限公司北京药物研究院,北京 101111;3.北京中医药大学,北京 102488)
摘要:目的建立阿里红中齿孔酸及其总三萜酸的含量测定方法。方法采用紫外-可见分光光度法测定总三萜酸含量;采用HPLC测定齿孔酸含量。色谱柱为RP-C18柱(4.6 mm×250 mm,5mm);流动相为乙腈-0.4%磷酸(68∶32),检测波长210 nm,流速1.0 mL·min-1,柱温30 ℃。结果3批阿里红药材中齿孔酸含量分别为2.3%,2.6%,3.1%;总三萜酸含量分别为27.2%,32.1%,35.9%。结论所建立的分析方法准确、简便,可为定量评价阿里红药材的质量提供依据。
关键词:阿里红;总三萜酸;含量测定;齿孔酸
阿里红为多孔菌科真菌药用层孔菌Fomes officinalis(Vill.ex Fr.) Ames.的干燥菌体,是新疆维吾尔医常用的民族药,分布于河北、山西、四川、吉林、黑龙江、内蒙古、甘肃、新疆、福建等地。药理实验表明其具有温肺化痰、降气、活血消肿和利尿作用[1-2]。新疆维吾尔医常用其于治疗慢性支气管炎、腹痛、感冒、肺结核和各种癌症[2]。阿里红含有三萜类、甾醇类、多糖类及脂肪酸等化学成分,其主要成分为羊毛甾烷型三萜酸类成分[3-8],齿孔酸是其主要的三萜类成分[8],三萜酸类成分往往是药用真菌的有效成分之一,具有提高人体免疫功能、抗衰老等多种保健功效[9-11]。已有研究表明阿里红中三萜酸类成分具有多种活性,如对凝血酶具有一定的抑制活性;可显著抑制LPS诱导的RAW 264.7细胞产生NO作用[8,12]。为了更好地控制阿里红的质量,本实验采用紫外-可见分光光度法和HPLC分别对阿里红中总三萜酸和齿孔酸含量进行测定,并对药材提取与显色过程中的影响因素进行考察。
LC-10AT高效液相色谱仪、SPD-10AT紫外检测器、UV-2501PC型紫外分光光度计(日本岛津公司);BP211D型电子分析天平(德国Sartourius公司);KQ-250DB型数控超声清洗器(昆山市超声仪器有限公司)。
甲醇(色谱纯,康科德有限公司,批号:143660);乙腈(色谱纯,Dikma公司,批号:154450);水为重蒸水;其他试剂均为分析纯;齿孔酸对照品(自制,批号:FFO-02-0301;纯度:98.19%);阿里红(新疆,批号:061001,061002和061003),所有批次样品经中国中医科学院中药研究所郝近大教授鉴定均为菌科真菌药用层孔菌Fomes officinalis(Vill.ex Fr.) Ames.的干燥菌体。
2.1.1 色谱条件 色谱柱为RP-C18柱(4.6 mm× 250 mm,5 μm);流动相为乙腈-0.4%磷酸(68∶32),检测波长210 nm,流速1.0 mL·min-1,柱温30 ℃。
2.1.2 溶液制备 ①齿孔酸对照品溶液制备:精密称取齿孔酸对照品25.68 mg,加入甲醇溶解并定容于25 mL量瓶中,摇匀,即得浓度为1.008 6 mg·mL-1的对照品溶液,备用。②供试品溶液制备:称取阿里红药材粗粉(过40目筛)约0.5 g,精密称定,用甲醇加热回流提取2次,每次20 mL,提取1 h,过滤,合并滤液至50 mL量瓶中,使用甲醇定容,用0.22mm滤膜过滤,取续滤液作为供试品溶液。③空白样品溶液:甲醇用0.22mm滤膜过滤,续滤液作为空白样品溶液。
2.1.3 线性关系考察 精密量取对照品溶液0.50,1.00,1.50,2.00,2.50,5.00 mL分别置于10 mL量瓶中,加甲醇定容,摇匀。分别吸取上述各浓度对照品线性溶液各10 μL依次注入液相色谱仪,按“2.1.1”项下色谱条件测定,以对照品浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得回归方程为Y=5 195 734.157 5X-4 885.01,r=0.999 9,结果表明在0.050~0.504 mg·mL-1内,浓度和峰面积的线性关系良好。高效液相色谱图见图1。
2.1.4 仪器精密度试验 制备同一份阿里红药材对照品溶液,分别精密吸收10 μL,连续进样6次,RSD为1.2%,表明仪器精密度良好。
2.1.5 稳定性试验 精密吸取同一供试品溶液10 μL,分别于0,1,2,4,8,24 h测定峰面积,结果显示RSD为1.4%,表明本品在室温条件下24 h内稳定性良好。
2.1.6 重复性试验 取同一批(批号:061001)阿里红药材6份,按供试品溶液制备方法制成样品溶液,按“2.1.1”项下色谱条件测定,测定的平均含量为2.3%,RSD为1.3%,表明本法重复性良好。
2.1.7 回收率试验 称取6份同一样品粉末约0.25 g,精密称定,并加入一定量的对照品,按供试溶液制备方法制成样品溶液,精密吸取10 μL,按“2.1.1”项下色谱条件测定,计算回收率。结果显示,平均回收率为100.85%,RSD为1.5% (n=6),表明回收率良好。结果见表1。

图1 高效液相色谱图
A-供试品溶液;B-齿孔酸对照品溶液;C-空白样品溶液;1-齿孔酸。
Fig. 1 HPLC chromatograms
A-sample solution; B-standard solution; C-blank; 1-eburicoic acid.
表1 齿孔酸加样回收率试验结果(n=6)
Tab. 1 Result of sample recovery of eburicoic acid(n=6)

2.1.8 阿里红中齿孔酸含量测定 取3批阿里红药材,每一批样品平行制备3份,按“2.1.1”项下色谱条件测定,计算样品中齿孔酸的含量。3批样品中齿孔酸含量分别为2.3%,2.6%,3.1%。
2.2.1 溶液制备 ①齿孔酸对照品溶液制备:按“2.1.2”项下方法制备。②供试品溶液制备:称取阿里红药材约0.5 g,精密称定,加入20 mL甲醇回流提取2次,每次1 h,提取液过滤,合并滤液至50 mL量瓶中,甲醇定容,摇匀后使用0.22 μm滤膜过滤,精密量取续滤液1.0 mL置10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得。
2.2.2 线性关系考察 分别精密吸取齿孔酸对照品溶液(浓度:0.491 9 mg·mL-1)0.10,0.30,0.50,0.60,0.70,1.00 mL置10 mL具塞试管中,水浴蒸干,依次分别加入5%香草醛-冰醋酸0.40 mL,高氯酸0.80 mL,摇匀,于60 ℃水浴中加热20 min,取出置冰水浴中冷却5 min,加冰醋酸10 mL,摇匀,放至室温后,在400~800 nm内扫描,根据扫描结果,确定在553 nm处测定吸收度值。
以对照品质量(mg)为横坐标,吸光度为纵坐标,绘制标准曲线。得到的曲线回归方程为Y=2.537 3X-0.040 5,r=0.997 8,表明在0.049~ 0.492 mg内,齿孔酸质量与其吸光度之间线性关系良好。
2.2.3 仪器精密度试验 取同一份阿里红药材供试品溶液,在553 nm处直接紫外测其吸光度。RSD为0.30%,表明仪器精密度良好。
2.2.4 稳定性试验 取同一份供试品溶液,分别在0,0.5,1.0,1.5,2.0,3.0,4.0 h,于553 nm处测定其吸光度,RSD为0.80%,表明本品4 h内稳定性良好。
2.2.5 重复性试验 取同一批次(批号:061001)的阿里红药材6份,按供试品溶液制备方法操作,得到6份药材供试品溶液,在553 nm处测定供试品溶液的吸光度,计算其含量。测得的平均含量为25.3%,RSD为2.8 %,表明本法重复性良好。
2.2.6 回收率试验 称取6份阿里红药材粗粉,每份约0.25 g,精密称定,再精密加入对照品,按供试品溶液制备方法操作,得到药材供试品溶液。在553 nm处测定齿孔酸对照品溶液和供试品溶液的吸光度,计算方法的回收率,测得的平均加样回收率为100.64%,RSD为2.4%,表明总三萜酸回收率良好,见表2。
表2 总三萜酸加样回收率试验结果(n=6)
Tab. 2 Results of sample recovery of total tritepenoidic (n=6)

2.2.7 阿里红中总三萜酸含量测定 取3批阿里红药材,每一批样品平行制备3份测定,计算样品中总三萜酸的含量。结果3批样品中总三萜酸含量分别为32.1%,27.2%,35.9%。
阿里红属于极少见含有高含量三萜酸类成分的药材,对阿里红药材深入研究可以分离得到20多个三萜酸类成分,其中5个单体三萜酸类化合物(硫色多孔菌酸、齿孔酸、阿里红酸A、3-酮基-去氢硫色多孔菌酸和Versisponic acid D)百分含量总和达到12.6%,因此阿里红药材中总三萜酸的含量在30%左右是极有可能的。本研究选择阿里红中含量较高的齿孔酸作为其三萜酸类成分的指标成分,建立了测其单体含量的HPLC方法,并以其作为对照,通过紫外-可见光分光光度法测定总三萜酸的含量,所建立的含量测定方法通过方法学验证,均证明可靠可行,说明可以用来有效控制控制阿里红药材的质量。
3.1.1 提取方法的选择 本实验采用甲醇加热回流提取,通过对齿孔酸提取中各个影响因素(提取溶剂种类、提取方式、提取次数)进行了系统的研究。结果显示,提取溶剂采用水、50%乙醇、乙醇、50%甲醇、甲醇、乙酸乙酯时齿孔酸的含量分别为0,0.33%,1.61%,0.16%,1.87%,1.49%;采用超声、回流、索氏提取时齿孔酸的含量分别为1.73%,2.19%,1.81%;提取1,2,3次时齿孔酸的含量分别为1.86%,2.33%,2.32%。最终确定了可将齿孔酸提取完全的供试品制备方法为甲醇加热回流提取2次,每次20 mL,每次提取1 h。
3.1.2 色谱条件选择 本实验采用HPLC测定阿里红中齿孔酸的含量。实验过程中对流动相中添加剂种类和用量进行了考察,通过比较发现:当流动相添加剂为0.4%磷酸时,基线噪音较小,且指标成分齿孔酸和其他三萜酸类成分的峰形较理想;齿孔酸在紫外光区的末端吸收较强,但为了避免末端波长处的基线噪音对目标峰测定的干扰,特选择210 nm作为HPLC的测定波长,既保证了该检测方法的准确性和灵敏度,又有效避免了基线噪音对结果的影响。
3.2.1 显色条件选择 本实验采用紫外-可见分光光度法测定总三萜酸的含量。5%香草醛-冰乙醋、高氯酸比色法是测定三萜类化合物最常用的显色方法,但其影响因素较多,因此首先对显色的影响因素进行筛选。结果表明,5%香草醛和高氯酸的加入量分别为0.4 mL与0.8 mL时,可以得到最大吸收值,并以此确定两者的最佳用量。
3.2.2 显色对照品选择 很多文献测定总三萜酸时均采用熊果酸作为对照品,但阿里红药材中并不含有熊果酸类成分,并且阿里红药材中三萜酸类成分与熊果酸成分母核结构相差较大,因此选择熊果酸作为对照测定阿里红总三萜酸含量并不可行。阿里红药材中三萜酸类成分较多,选择不同的成分作为对照品会对阿里红药材总三萜酸的测定产生不同的结果。本实验分别以阿里红中5个典型的三萜酸类成分(齿孔酸、阿里红酸A、3-酮基去氢硫色多孔菌酸、Versisponic酸和硫色多孔菌酸)为对照品,考查阿里红药材中总三萜酸的测定方法,结果表明以齿孔酸或者阿里红酸A为对照品时,测定方法最为准确、可信,见图2。
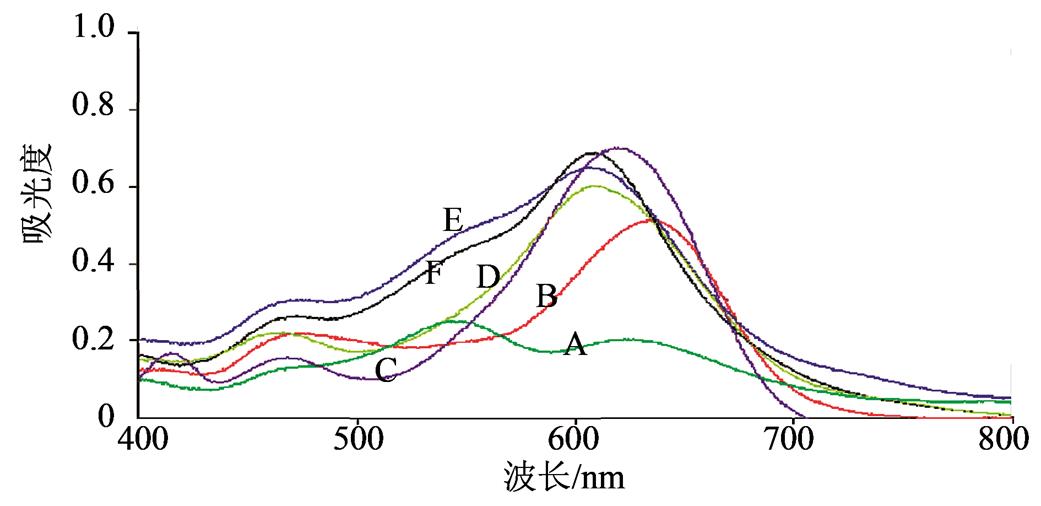
图2 5个对照品及样品溶液的紫外-可见光吸收光谱图
A-样品溶液;B-硫色多孔菌酸;C-Versisponic酸;D-3-酮基去氢硫色多孔菌酸;E-齿孔酸;F-阿里红酸A。
Fig. 2 UV-Vis absorption spectrum of 5 standards and sample solution
A-sample solution; B-sulfurenic acid; C-versisponic acid; D-3-keto-dehydrosulfurenic; E-eburicoic acid; F-officinalic acid A.
REFERENCES
[1] Jiangsu New Medical College. Dictionary of Chinese Materia Medicia [M]. Shanghai: Shanghai People’s Publishing House, 1977.
[2] ZHANG H F, GUO S Y, SHEN L, et al. Research status of Uygur medicineFomes officinalissporophore [J]. J Jilin Med Coll(吉林医药学院学报), 2014, 35(5) : 354-357.
[3] YANG F, MENG L, WANG P. Study on extraction of total tritepenoidic acid fromFomes officinalisAmes based on central composite design [J]. Chin J Inf Tradit Chin Med(中国中医药信息杂志), 2015, 22(12): 86-89.
[4] TURAHUN Y, IBRAHIM M, MUHAMMAD T. Optimization of ultrasonic extraction technology and content determination of total tritepenoidic acid fromFomes officinalis[J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2012, 18(17): 24-27.
[5] WU X, YANG J S, YAN M. Four new triterpenes from fungus ofFomes officinalis[J]. Chem Pharm Bull(Tokyo), 2009, 57(2): 195-197.
[6] GRIENKE U, ZOLL M, PEINTNER U, et al. European medicinal polypores-a modern view on traditional uses [J]. J Ethnopharmacol, 2014, 154(3): 564-583.
[7] ZHANG H F, GUO S Y, SHEN L, et al. Extraction total triterpenes fromFomes officinalisAmes with response surface methodology [J]. J Jilin Med Coll(吉林医药学院学报), 2014, 35(6): 401-406.
[8] WU X, YANG J S, DONG Y S. Chemical constituents ofFomes officinalis(Ⅰ) [J]. Chin Tradit Herb Drugs(中草药), 2005, 36(6): 811-814.
[9] P ABULIZI, R TUOHENIYAZI, CONG Y Y, et al. Study on the anti-aging effect ofFomes officinalisAmes. polysaccharides [J]. Chin J Tradit Chin Med Pharm(中华中医药杂志), 2013, 28(2): 340-342.
[10] W YIMING, P ABULIZI, BAI L, et al. The immune-potentiation effect ofFomes officinalis[J]. J Xinjiang Med Univ(新疆医科大学学报), 2003, 26(6): 563-565.
[11] CONG Y Y, A ABULIZI, P ABULIZI, et al. Studies on extraction and the immunity activity of polysaccharide fromFomes officinalisAmes [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2010, 27(7): 569-571.
[12] ZHOU Y. The effects of antioxidant and anti-tumor and immunoregulation activity of polysaccharides fromFomes officinalisAmesin vivoandin vitro[D]. Xinjiang Medical University, 2016.
Determination of Eburicoic Acid and Total Tritepenoidic fromFomes OfficinalisAmes
REN Jiawei1, MA Yuemei2, CHEN Xinjing3, LI Mengwei3, WANG Hao3, LIU Yang3*
(1.North China Electric Power University, Beijing 102206, China; 2.Beijing Institute of Drug Research, Yabao Pharmaceutical Group Co., Ltd., Beijing 101111, China; 3.Beijing University of Chinese Medicine, Beijing 102488, China)
ABSTRACT:OBJECTIVETo determine the content of total tritepenoidic and eburicoic acid fromFomes officinalisAmes.METHODSThe content of total tritepenoidic was determined by ultraviolet spectrophotometry. The content of eburicoic acid was determined by HPLC. The analysis was performed on a RP-C18column(4.6 mm×250 mm, 5mm) with acetonitrile-0.4% phosphoric acid (68∶32) as mobile phase at a flow rate of 1.0 mL·min-1, and temperature was 30 ℃. The detection of wavelength was set at 210 nm.RESULTSThe contents of eburicoic acid in 3 batches ofFomes officinalisAmes were 2.6%, 2.3%, 3.1%, and the contents of total tritepenoidic were 32.1%, 27.2%, 35.9%, respectively.CONCLUSIONThe method is suitable for the determination of tritepenoidic components fromFomes officinalis Ames.
KEY WORDS:Fomes officinalisAmes; total tritepenoidic; content determination; eburicoic acid
中图分类号:R284.1;R917.103
文献标志码:B
文章编号:1007-7693(2018)10-1478-04
DOI:10.13748/j.cnki.issn1007-7693.2018.10.010
引用本文:任佳伟, 马月梅, 陈新晶, 等. 阿里红中齿孔酸和总三萜酸的含量测定[J]. 中国现代应用药学, 2018, 35(10): 1478-1481.
收稿日期:2018-02-28
作者简介:任佳伟,男,硕士,主任医师 Tel: 18501256515 E-mail: rjw@ncepu.edu.cn
*通讯作者:刘洋,男,博士,教授 Tel: 13810283092 Email: netug@126.com
(本文责编:李艳芳)