毒代动力学(toxicokinetic,TK)作为药动学(pharmacokinetics,PK)和毒理学的交叉学科,在毒性条件下进行研究,是药动学在全身暴露评价中的延伸,其试验目的是评估受试物和/或代谢物的全身暴露量,探讨药物毒性发生机制和预测用药安全性[1-2],是安全性评价的重要组成部分[3-4]。TK研究的样品分析和数据处理工作除需遵守《药物非临床药动学研究技术指导原则》的技术要求外,还需严格遵循GLP[5]。
4-氯-2-氟-3-甲氧基苯硼酸(4-chloro-2-fluoro-3-methoxybenzeneboronic acid,PBA)是重要的有机合成中间体,属于硼酸类化合物,在胰岛素控释[6]、肿瘤靶向[7]、基因递释[8]等方面,基于硼酸类衍生物的糖敏感材料受到广泛的应用。PBA的吸收、转运、分布、代谢和排泄特征报道少见,目前没有相关的实验动物的毒代动力学完整资料。本实验按照Organisation for Economic Co-operation and Development(OECD)的有关“毒物动力学 ADME试验 417”要求[9],通过建立一种高效、重复性好的高效液相色谱串联质谱法(LC-MS/MS)[10],以探索并完成PBA的血浆毒代动力学研究,对此类化学物质的规范管理和进一步完善提供参考和依据,可为人群接触的危险性评价及其毒性作用机制提供参考。
1 材料
1.1 试剂
PBA对照品[联化科技股份有限公司,批号:LT-PBA(S)13002,纯度:97.8%]。对甲氧基苯甲酸对照品[内标,阿拉丁试剂(中国)有限公司,批号:M104368,纯度:98 %]。甲醇与乙腈(北京百灵威科技有限公司,色谱纯);乙酸铵(国药集团化学试剂有限公司,分析纯);甲酸(北京百灵威科技有限公司)。
1.2 仪器
Agilent 1200+ABI 4000+液质联用仪(美国应用生物系统公司,AB SCIEX);XS205电子分析天平(梅特勒托尔多公司);Eppendorf 5417R离心机(德国 Eppendorf公司);KQ3200B 超声波清洗器(昆山市超声仪器有限公司);Vortex-6多功能涡旋混合器(江苏海门其林贝尔仪器制造有限公司);PureLab OptionS7纯水仪(英国ELGA LabWater公司)。
1.3 动物
SD大鼠(32只,♀♂各半,6~8周)购于上海西普尔-必凯实验动物有限公司(合格证编号:2008001635199)。大鼠饲养于不锈钢铁丝笼中(体积500 mm×350 mm×200 mm)中,饲养室温度保持在 20~26 ℃,湿度保持在 40%~70%,每笼≤6只,♀♂分笼饲养。同时给予辐照繁殖饲料(北京科澳协力饲料有限公司)和饮用水进行喂养。
1.4 对照品溶液的配制
精密称取10.0 mg PBA对照品溶解在50 mL甲醇中得到浓度为200 mg·mL-1的PBA储备溶液,将储备溶液进一步用甲醇稀释获得浓度分别为0.2,0.5,1,2,5,10 和 25 μg·mL-1的系列对照品溶液。以相同方式在 3个浓度水平(50,200,2 000 ng·mL-1)独立制备质控样品。内标对甲氧基苯甲酸储备溶液以 200 mg·mL-1的初始浓度制备,使用甲醇稀释储备溶液制备内标溶液(400 ng·mL-1)。所有储备溶液、对照品、质控样品均立即置4 ℃保存备用。
2 方法
2.1 色谱条件
日本 COSMASIL C18色谱柱(4.6 mm×150 mm,5 µm),柱温为 30 ℃。流动相为甲醇-10 mmol·L-1醋酸铵-甲酸(90∶10∶0.15),流速为0.8 mL·min-1,进样体积为 10 mL。
2.2 质谱条件
离子源为电喷雾电离源(Turbo Ionspray),喷射电压为-4.5 kV;温度为550 ℃。离子源气体1(GAS1)压力为50 psi;离子源气体2(GAS2)压力为50 psi;气帘气体(CUR)压力为30 psi。去簇电压(DP)分别为-55 eV(PBA)和-92 eV(内标)。扫描方式为选择离子监测(SIM),用于定量分析的离子为 m/z 203.1(PBA),m/z 150.4(内标),扫描时间为 200 ms。
2.3 血浆样品处理
将冷冻的血浆样品放置室温解冻。取血浆样本90 mL,分别加入甲醇5 mL,内标溶液(对甲氧基苯甲酸 400 ng·mL-1)5 mL,涡旋混合 1 min;加入乙腈 0.3 mL,涡旋混合 2 min,离心 10 min(13 000 r·min-1),分离上清液于另一试管中,取10 mL进行分析。
2.4 方法学验证
2.4.1 方法专属性 通过比较空白血浆样品的色谱图、掺加了PBA对照品系列溶液及内标溶液的空白血浆的色谱图,记录内标和PBA对照品的保留时间;取灌胃染毒PBA的SD大鼠1.5 h时间段的血浆样品的色谱图来评估方法特异性,结果见图 1。从图 1可以看到,PBA的出峰时间约为2.8 min,内标的出峰时间约为2.5 min。PBA对照品和内标分离良好,内源性物质没有明显的干扰。
2.4.2 线性范围与灵敏度 取血浆样本90 mL,加入 PBA系列浓度对照品液 5 μL,配制成为 PBA血浆终浓度分别为20,50,100,200,500,1 000和2 500 ng·mL-1的血浆工作曲线。按“2.3”项下方法进行处理,按“2.1”项下色谱条件进样30 μL,进行HPLC分析。所得结果以PBA血浆浓度为横坐标,以所得PBA及内标峰面积比值为纵坐标,以最小二乘法进行回归运算,求得的回归方程为y=0.001 11x+0.031 6,r=0.991 4,在 20~2 500 ng·mL-1内线性良好。定量下限(LLOQ)为 20 ng·mL-1(RSD%=9.67%,n=5),满足方法学样品测定要求。

图1 大鼠血浆样品中PBA和内标的代表性色谱图
A-空白血浆样品;B-质控血浆样品(含 400 ng·mL-1PBA);C-大鼠灌胃给药1.5 h后的血浆色谱图。
Fig. 1 Representative chromatograms of PBA and I.S. in rat plasma samples
A-blank plasma; B-QC sample spiked with 400 ng·mL-1of PBA; C-rat plasma sample in 1.5 h after administrated with 100 mg·kg-1of PBA.
2.4.3 精密度及准确度 按“2.3”项下方法处理高、中、低 3 种浓度(50,200 和 2 000 ng·mL-1)质控样品。通过3 d内连续检测3种质控样品浓度(每浓度5个样品),30 μL进样,考察日内与日间的精密度与准确度,结果见表1。结果表明,该方法准确并具有良好的可重复性。
表1 大鼠血浆中质控样品的精密度和准确度(n=5)
Tab. 1 Precision and accuracy for PBA in rat plasma (n=5)

2.4.4 提取回收率的测定 在空白血浆中配制低、中、高3个浓度梯度的PBA血浆样品(50,200和2 000 ng·mL-1),按“2.3”项下方法进行处理,30 μL进样。将血浆样品的 PBA峰面积除以血浆中已知量的PBA应得到的峰面积比值,得到该方法下血浆提取回收率为88.8%~94.4%。
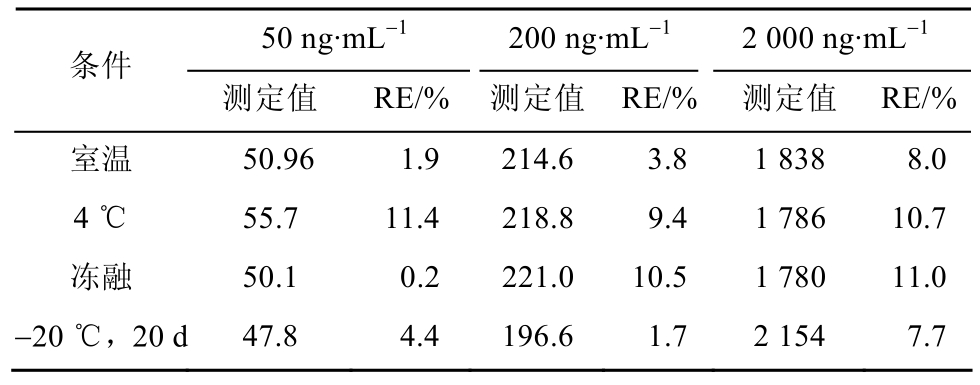
2.4.5 稳定性 用低、中、高浓度质控样品放置于不同储存条件下来反映PBA的稳定性:室温,4℃,冻融和-20 ℃长期储存(20 d)。通过5次重复分析暴露于不同条件下的3种浓度水平(50,200,2 000 ng·mL-1)的血浆样品来测试血浆中的稳定性。短期稳定性通过检测在室温暴露8 h后的已加对照品的血样,及样品处理后在4 ℃放置24 h后进行测定。置-20 ℃冰箱保存,考察血浆样品3次解冻冻融的稳定性。已加对照品的血浆样品置-20℃冰箱保存20 d后评价长期稳定性。结果见表2,各指标均符合方法学要求。
表2 不同条件下PBA血浆样品的稳定性结果(n=5)
Tab. 2 Stability results of PBA in rat plasma in different conditions (n=5).
2.4.6 基质效应 取空白血浆90 mL,分别加入甲醇 5 mL,内标溶液(对甲氧基苯甲酸 400 ng·mL-1)5 mL,涡旋混合1 min;加入乙腈 0.3 mL,涡旋混合 2 min,离心 10 min(13 000 r·min-1)。取上清液200 mL,加入系列PBA对照品溶液5 mL,使其浓度与 50,200和 2000 ng·mL-13种质控样品按“2.3”项下方法处理后相同,作为A样品。取含与A样品相同内标浓度的乙腈溶液(乙腈∶水=3∶1)200 mL,加入系列PBA对照品5 mL,使其浓度与 50,200和 2 000 ng·mL-13 种质控样品按“2.3”项下方法处理后相同,作为B样品。A和B样品分别进样10 mL,分别获得PBA和内标的峰面积。以A样品中PBA的峰面积和内标峰面积的比值除以B样品中PBA的峰面积和内标峰面积的比值,获得 50,200和 2 000 ng·mL-13个浓度质控样品的基质效应,分别为102.7%,107.6%和101.3%。符合生物样品测定的要求。
3 PBA的毒代动力学研究
3.1 染毒方法
取32只SD大鼠,随机分为灌胃低、中、高剂量组和静脉注射组4组,每组8只,♀♂各半。用0.5%的羧甲基纤维素钠配制成1,3和10 mg·mL-1供 试 品 混 悬 液 用 于 灌 胃 低 (10 mg·kg-1)、 中(30 mg·kg-1)和高剂量(100 mg·kg-1)组染毒。动物染毒后从眼眶静脉丛取血并肝素抗凝,取血量为0.5 mL。血样采集时间分别为染毒前,染毒后10,30 min,1,1.5,2,3,4,6,8,12,24 h。血样采集后立即放入碎冰中保存。静脉注射组的给药剂量为5 mg·kg-1。静脉注射组以灭菌生理盐水配制0.5 mg·kg-1的PBA溶液作为静脉注射样品溶液,每只给药10 mL·kg-1。动物染毒后从眼眶静脉丛取血并肝素抗凝,取血量为0.5 mL。血样采集后立即放入碎冰中。血样采集时间分别为染毒前,染毒后 5,15,30,45 min,1,2,4,6,8,12,24 h。血样在3 000 r·min-1下离心(4 )℃获得血浆,-20 ℃保存备测。
3.2 毒代动力学特征
采用 DAS药动学软件对所测数据进行分析,拟合获得毒代动力学参数,AUC、Cmax、Tmax、t1/2等,结果见表 3。大鼠单次灌胃给予 10,30,100 mg·kg-1PBA后的血药浓度-时间曲线见图2,低、中、高剂量组的绝对生物利用度分别为13.1%,9.5%和 4.0%。随着染毒剂量的增加,大鼠血浆中 PBA的AUC和Cmax未呈线性升高,口服生物利用度明显下降,说明PBA在大鼠体内的吸收具有饱和性。
表3 SD大鼠静脉注射和灌胃给予PBA后的主要动力学参数
Tab. 3 Main kinetic parameters of PBAin rats after iv or ig administration of PBA

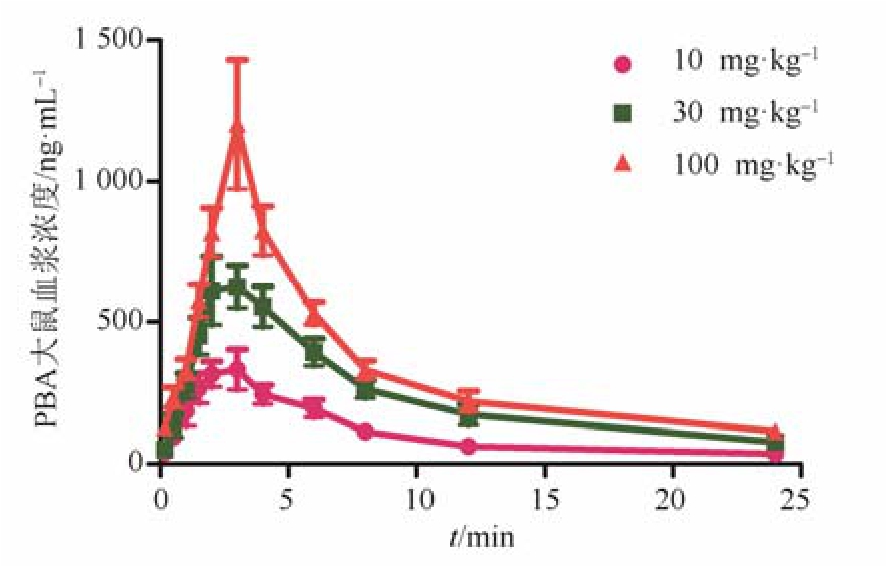
图2 大鼠灌胃给予PBA后的血药浓度-时间曲线
Fig. 2 The plasma concentration-time curve of PBA in rats.
4 结论
本研究建立了一种快速、灵敏的用于测定大鼠血浆中PBA的LC-MS/MS,血浆样品中内源性杂质不干扰PBA测定。方法学考察结果和稳定性试验结果都符合要求,证明本方法适合于大鼠血浆样品中PBA的分析。大鼠经PBA灌胃染毒后,约在 3 h血药浓度达到峰值。随着染毒剂量的增加,其在大鼠体内的暴露量没有呈线性上升,口服生物利用度下降显著,说明其在大鼠体内的吸收呈现饱和性。
REFERENCES
[1] LANDRUM P F, CHAPMAN P M, NEFF J, et al. Influence of exposure and toxicokinetics on measures of aquatic toxicity for organic contaminants: a case study review [J]. Integr Environ Assess Manag, 2013, 9(2): 196-210.
[2] WANG S J, YOU L, DENG M J. Progress in drug toxicokinetics [J]. Chin Pharm Aff(中国药事), 2015, 29(8):814-819.
[3] LIN L H, DUAN M Y, CHEN G. An LC-MS/MS method for determination of novel fungicide pyraoxystrobin in rat plasma and tissues: Toxicokinetics and tissue distribution study [J].Talanta, 2015(136): 183-189.
[4] YU M, LI Z G. Status and prospects in drug toxicokinetics [J].Chin J New Drugs(中国新药杂志), 2017, 26(7): 742-748
[5] 国家食品药品监督管理总局. 药物毒代动力学研究技术指导原则[S]. 北京, 2014.
[6] LI L, JIANG G H, DU X X, et al. Preparation of glucose-responsive and fluorescent micelles via a combination of R AFT polymerization and chemoenzymatic transesterification for controlled release of insulin [J]. RSC Adv, 2015, 5(92): 75766-75772.
[7] WANG J, WU W, ZHANG Y, et al. The combined effects of size and surface chemistry on the accumulation of boronic acid-rich protein nanoparticles in tumors [J]. Biomaterials,2014, 35(2): 866-878.
[8] PIEST M, ANKONÉ M, ENGBERSEN J F J.Carbohydrate-interactive pDNA and siRNA gene vectors based on boronic acid functionalized poly (amido amine)s [J].J Control Release, 2013, 169(3): 266-275.
[9] OECD. OECD Guidelines for Testing of Chemicals, 417 Toxicokinetics, 1-10 [DB/OL]. Paris: OECD, 2010.
[10] ZOU H L, WANG S H, ZHOU Y F. Determination the concentration of barlerin in rat plasma by UPLC-MS/MS [J].Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(4):440-444.