缓控释制剂的全部或绝大部分药物在短时间内快速释放[1],被广泛地定义为剂量倾泻。缓释制剂的发展和应用给患者带来很多便利,但其通常规格较大,一旦发生剂量倾泻产生突释,尤其是对毒性大、治疗窗窄的药物,会带来一定的安全性问题。因此,需通过适当的体外试验研究处方的释放行为,考察其在酒精诱导下发生剂量倾泻的风险[2],指导缓释制剂产品的开发,降低体内试验的风险。日本医药品医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,PMDA)也提出了以搅拌强度来验证缓释制剂发生剂量倾泻的可能性[3]。
酒精的摄入对口服固体缓释制剂的体内药物释放行为具有潜在的影响。大量酒精饮料的摄入会导致阿片类镇痛药——氢吗啡酮从其控释微丸剂型中地意外短时间内快速释放[4]。此外,非阿片类镇痛药如琥珀酸美托洛尔、盐酸美金刚、复方西他列汀二甲双胍等广泛用于治疗慢性疾病的处方药物也存在类似的用药风险[5]。根据世界卫生组织2016年统计报告[6],2015年中国成年人饮酒量为每年7.6公升,远超全球平均水平每年1.3公升,可见饮酒在国人的生活中较为常见,因而深入研究酒精诱导缓释制剂剂量倾泻的风险,对拟在中国上市的缓控释制剂尤为重要。
盐酸普拉克索是一种非麦角碱类选择性多巴胺受体激动剂,是目前治疗早发型帕金森病的首选药物[7]。但是,长期服用盐酸普拉克索也会带来一定的不良反应[8],最常见的为嗜睡、头晕和呕吐;其中,国外文献报道[9],频繁增加盐酸普拉克索的用药量可能会引起突然性嗜睡,这对帕金森病患者日常生活和出行都会带来影响,尤其是潜在的驾驶安全性风险[10]。
本实验主要从酒精以及转速 2个方面研究以羟丙甲纤维素(HPMC)为亲水凝胶骨架的盐酸普拉克索缓释片自制制剂以及市售制剂(Sifrol®,德国勃林格殷格翰药业有限公司)的体外释放情况,考察其发生剂量倾泻风险的可能性,为处方的后续开发以及体内试验提供参考依据。
1 仪器与试药
AT-7smart自动取样溶出仪(瑞士 SOTAX);LC-20AT高效液相色谱系统(日本岛津,含LC-20AT泵、SPD-M20A检测器、SIL-20A进样器,日本岛津株式会社)。
盐酸普拉克索缓释片(Sifrol®,规格:0.75 mg,批号:501672);盐酸普拉克索缓释片(自制,规格:0.75 mg,批号:161021);盐酸普拉克索对照品(USP,批号:GOL469,含量:99.8%);磷酸二氢钾(南京化学试剂有限公司,分析纯);氢氧化钠(天津博迪化工股份有限公司);辛烷磺酸钠(北京百灵威科技有限公司);磷酸(国药集团化学试剂有限公司);盐酸(南京奥佳化工有限公司,分析纯);乙醇(无锡市亚盛化工有限公司,分析纯);乙腈(色谱纯,TEDIA);水为纯净水。
2 方法与结果
2.1 HPLC测定盐酸普拉克索的释放度
2.1.1 色谱条件[11]色谱柱ODS-C18柱(150 mm×4.6 mm,5 μm);流动相 A(pH 3.0 PBS):流动相B(pH 3.0 PBS∶乙腈=50∶50)=50∶50;流速:1.0 mL·min-1;检测波长:262 nm;进样体积:100 μL;柱温:35 ℃。
2.1.2 专属性 取 pH 6.8 PBS介质中的空白溶液、空白辅料溶液、对照品溶液和供试品溶液,按“2.1.1”项下色谱条件进样分析,记录色谱图,见图1。试验结果表明,空白溶剂、空白辅料均对主峰的测定无干扰,并且供试品溶液主峰位置与对照品溶液中的主峰位置一致,理论板数>2 000。
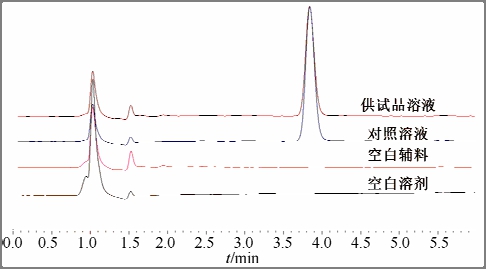
图1 高效液相色谱图
Fig. 1 HPLC chromatograms
2.1.3 线性关系考察 取盐酸普拉克索对照品适量,精密称定,用pH 6.8 PBS溶解并稀释制成浓度为1.489 0 mg·mL-1的线性母液。分别用不同介质,即 0.1 mol·L-1盐酸溶液、0.1 mol·L-1盐酸-乙醇溶液(含乙醇5%,20%和40%)、pH 6.8 PBS,分别稀释制成浓度分别为0.014 9,0.074 5,0.297 8,0.744 5,1.489 0,1.786 8 μg·mL-1的对照品溶液。分别将上述不同浓度的对照品溶液依次进样,测定盐酸普拉克索的峰面积。以峰面积(Y)对浓度(X)绘制标准曲线,在不同介质中的标准曲线分别为 Y=102 654.428 9X+357.706 1(r2=0.999 6),Y=100 824.854 2X-82.263 9(r2=0.999 6),Y=101 635.357 8X+651.174 6(r2=0.999 6),Y= 98 241.258 7X- 821.541 9(r2=0.999 2),Y=100 203.782 6X-974.989 7(r2=0.999 8),表明盐酸普拉克索在 0.014 9~1.786 8 μg·mL-1内不同介质中呈现良好的线性关系,符合试验要求。
2.1.4 仪器精密度 取高、中、低3个浓度的pH 6.8 PBS盐酸普拉克索供试品溶液以“2.1.1”项下色谱条件分别进样 6次,测定盐酸普拉克索的浓度,仪器精密度 RSD分别为 0.32%,0.14%和0.28%(n=6),表明仪器精密度良好。
2.1.5 回收率 精密称取盐酸普拉克索对照品,加入适量比例的辅料溶液,加适量pH 6.8 PBS定容,过0.45 μm微孔滤膜,进行测定。分别制备高、中、低3个浓度(即100%,70%,50%水平),色谱条件下分析,盐酸普拉克索的回收率分别为101.45%,100.36%和102.76%,RSD分别为0.67%,1.21%和0.54%(n=3),表明回收率良好。
2.1.6 稳定性 分别取不同介质的供试品溶液分别在室温下放置 0,2,4,8,12,24,48 h,按“2.1.1”项下色谱条件测定,计算各介质下不同时间峰面积的RSD分别为0.48%,0.10%,0.06%,0.93%和0.23%(n=3)。
2.2 对照品溶液配制
贮备液的配制:取盐酸普拉克索对照品3 mg,精密称定,置20 mL量瓶中,加不同介质使溶解,并稀释至刻度,摇匀,即得。
精密移取贮备液1 mL至100 mL量瓶中,加不同介质稀释至刻度,摇匀,即得100%对照。
精密移取100%对照5,2 mL分别至10 mL量瓶中,加不同介质稀释至刻度,摇匀,即得 50%对照、20%对照。
2.3 体外溶出度试验
2.3.1 常规试验释放条件 取本品,按释放度测定法(中国药典2015年版四部通则0931第一法),采用第一法的装置,分别以0.1 moL·L-1盐酸和pH 6.8 PBS为释放介质,介质体积为500 mL,温度为(37.0±0.5)℃,转速为 100 r·min-1,每个取样时间点取溶液5 mL,滤过,取续滤液作为供试品溶液,并即时在溶出杯中补充相同体积,相同温度的释放介质。其中0.1 moL·L-1盐酸的取样时间点为15,30,60,90和120 min,pH 6.8 PBS的取样时间点为2,4,9,16和24 h。
2.3.2 乙醇诱导剂量倾泻试验的释放条件 取本品,按“2.3.1”项下条件,分别以0.1 moL·L-1盐酸中含5%,20%和40%乙醇溶液为释放介质,在15,30,60,90和120 min时分别取溶液5 mL,滤过,取续滤液作为供试品溶液,并即时在溶出杯中补充相同体积,相同温度的释放介质。
2.3.3 机械诱导剂量倾泻试验的释放条件 取本品,按“2.3.1”项下条件,以 pH 6.8 PBS为释放介质,转速分别为 75 r·min-1和 200 r·min-1,在 2,4,9,16和24 h时分别取溶液5 mL,滤过,取续滤液作为供试品溶液,并即时在溶出杯中补充相同体积,相同温度的释放介质。
2.4 相似因子f2
目前最为常用的比较试验制剂和参比制剂的方法为非模型依赖法,即通过差异因子 f1和相似因子 f2定量评价试验制剂和参比制剂溶出曲线的差异。相似因子 f2较差异因子 f1更为常用,是曲线平均方差的对数转化。其计算公式如下:

当2条曲线完全相同时f2值为100,2条曲线相差10%时f2值为50。因此,FDA与EMA规定:若受试与参比制剂的溶出曲线间的 f2值≥50,则认为两者相似。
3 结果
3.1 酒精诱导剂量倾泻试验
分别以 0.1 mol·L-1盐酸,含 5%,20%,40%乙醇的 0.1 mol·L-1盐酸为释放介质,转速为100 r·min-1,计算 120 min内的盐酸普拉克索缓释片的累积释放度,以药物累积释放度为纵坐标,取样时间点 t为横坐标绘制累积释放曲线图,结果见图 2~3。在相同乙醇浓度下,120 min后自制制剂比市售制剂的累积释放度略低,分别低1.6%,3.1%和3.3%;在不同的乙醇浓度下,120 min后自制制剂的累积释放度:5%>20%>40%,且均<0.1 mol·L-1盐酸介质。
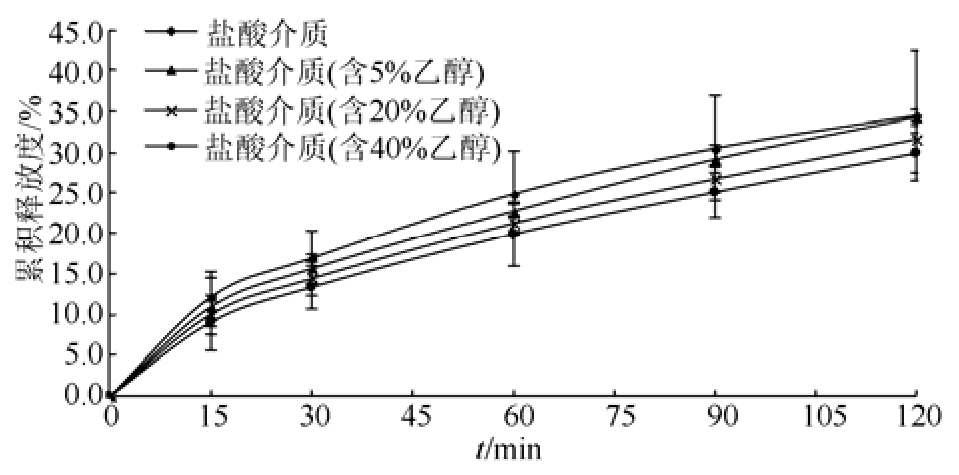
图 2 市售制剂在不同水醇浓度介质中的累积释放度(n=12,x± s )
Fig. 2 Cumulative release of the commercial formulation in different concentration of hydroalcoholic media (n=12,x± s )
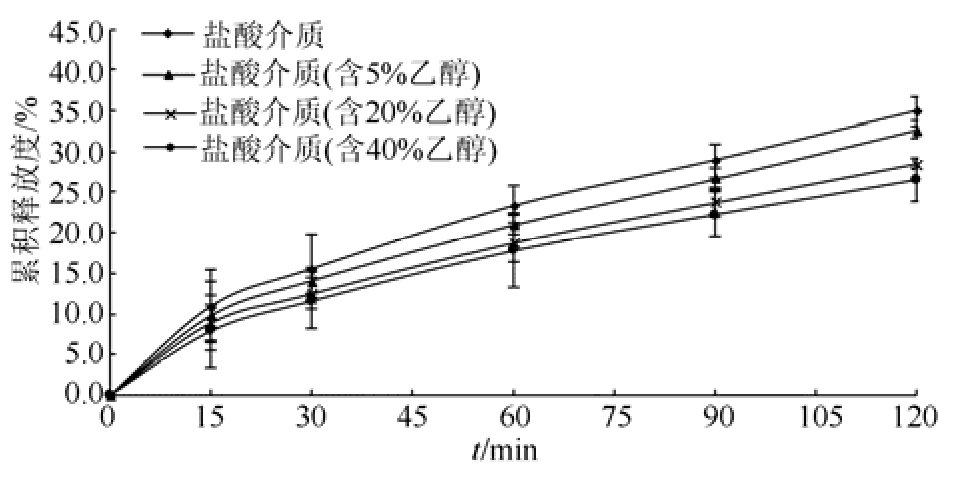
图 3 自制制剂在不同水醇浓度介质中的累积释放度(n=12,x± s )
Fig. 3 Cumulative release of the test formulation in different concentration of hydroalcoholic media (n=12,x± s )
3.2 机械诱导剂量倾泻试验
以pH 6.8 PBS为释放介质,转速分别为75,100 和 200 r·min-1,测定 24 h 内的盐酸普拉克索缓释片的累积释放度,以药物累积释放度为纵坐标,取样时间点t为横坐标绘制累积释放曲线图,见图4~5。在 75,100 和 200 r·min-1的 pH 6.8 PBS 介质中,与市售制剂相比,自制制剂的f2分别为 62,64和64。

图4 市售制剂在不同转速中的累积释放度(n=12,x± s )
Fig. 4 Cumulative release of the commercial formulation at different roation speed of paddle (n=12,x± s )

图5 自制制剂在不同转速中的累积释放度(n=12,x± s )
Fig. 5 Cumulative release of the test formulation at different roation speed of paddle (n=12,x± s )
3.3 释放机制
对自制制剂和市售制剂在常规介质以及不同水醇浓度介质中的释药数据进行拟合,结果见表1~2。采用 Higuchi方程进行拟合,相关系数均>0.99;采用Ritger-pappas方程对释药数据进行拟合,释药参数为 0.45~0.89,表明自制和市售盐酸普拉克索缓释片释药过程为非 Fick 扩散,释药机制属于药物扩散和骨架溶胀或溶蚀的协同作用,且以扩散机制为主。因此,采用 Diffusionrelaxation方程拟合更为显著;通过Upadrashta 等提出的 Diffusion-erosion方程(Mt/M∞=k4t1/2+Kt+k2t2+k3t3)拟合[12],可以综合考虑扩散,溶蚀及松弛的作用,更精确地描述药物的释药行为,其中 K是与溶蚀和松弛模型有关的综合常数,k2,k3与溶蚀释放有关,k4与纯Fick扩散有关。
结果表明,市售制剂在常规介质和不同水醇浓度介质中的释药参数为 k4>K>k2>k3,即绝大部分盐酸普拉克索从骨架中以扩散形式释放,少部分由于骨架松弛释放,极少部分依靠骨架溶蚀释放的释药机制,乙醇浓度的增加虽然在一定程度上阻碍了药物的扩散释放,但对亲水凝胶骨架整体的释药行为的影响不大。自制制剂在常规介质和部分水醇浓度介质中,与市售制剂的拟合结果一致,而在 20%乙醇浓度介质中,药物溶蚀释放超过了松弛释放,但仍以扩散为主,其亲水凝胶骨架对乙醇诱导的释药行为可控,这与药物释放曲线相一致。
表 1 自制制剂在常规介质和不同水醇浓度介质中释药动力学的不同模型
Tab. 1 Kinetic release equations of different models of the test formulation in conventional media and different concentration of hydroalcoholic media

表 2 市售制剂在常规介质和不同水醇浓度介质中释药动力学的不同模型
Tab. 2 Kinetic release equations of different models of the commercial formulation in conventional media and different of concentration hydroalcoholic media


4 讨论
释放曲线和释药机制的研究结果表明,随着乙醇浓度的增加,自制和市售制剂120 min的释放度相似;随着转速的增加,自制和市售制剂 24 h的释放度行为也相当,故不同浓度乙醇和不同转速对盐酸普拉克索缓释片体外的释放行为影响不大,自制和市售缓释制剂发生剂量倾泻的风险均可控。
聚合物水合和凝胶层形成的速度决定了聚合物的溶胀程度,从而影响药物的释放行为。HPMC在 95%乙醇中几乎不溶,虽然其在低于 50%的水醇介质中溶解,但与纯水相比,HPMC无法在短时间内迅速与水分子接触[13],形成凝胶层的速度稍滞后。根据释药机制的动力学方程拟合,盐酸普拉克索亲水凝胶骨架片在水醇介质中的释药行为以非Fick扩散为主,同时还包括部分溶蚀和溶胀作用。随着乙醇浓度的增加,骨架溶蚀的比重逐渐增加,但药物仍缓慢释放,没有观察到剂量倾泻现象。由于水醇介质对HPMC凝胶层形成的影响相对较小[14-15],故在此亲水凝胶骨架片中,药物的溶解性影响了其在水醇介质中的释药行为[16],而盐酸普拉克索作为BCS Ⅰ 类药物,在 95%乙醇中微溶,药物扩散则受到抑制,表现为药物的释放度降低,因此,自制和市售缓释制剂发生剂量倾泻的风险可控。
REFERENCES
[1] MEYER R J, HUSSAIN A S. Awareness topic: mitigating the risks of ethanol induced dosedumping from oral sustained/controlled release dosage forms [EB]. [2014-10-30].https://www.fda.gov/ohrms/dockets/ac/05/briefing/2005-4187 B1_01_08-Alcohol-Induced.pdf.
[2] ANAND O, YU L X, CONNER D P, et al. Dissolution testing for generic drugs: an FDA perspective [J]. AAPS J, 2011,13(3): 328-335.
[3] PMDA. Regarding concepts on bioequivalence test of production change of oral solid preparation [EB].[2013-04-19]. http://www.pmda.go.jp/files/000157176.pdf#pa ge=16.
[4] FDA. Information for healthcare professionals:Hydromorphone Hydrochloride Extended-Release capsules(marketed as Palladone) [OL]. [2005-7].http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyI nformationforPatientsandProviders/ucm129288.htm.
[5] FRIEBE T P, ASGARZADEH F, GRAY A, et al. Regulatory considerations for alcohol-induced dose dumping of oral modified-release formulations [J]. Pharm Technol, 2015,39(10): 40-46.
[6] WHO. World Health Statistics 2016: monitoring health for the SDGs, sustainable development goals. 2016 [EB].[2016-04-16]. http://www.who.int/gho/publications/world_hea lth_statistics/en/.
[7] 中华医学会神经病学分会帕金森病及运动障碍学组. 中国帕金森病治疗指南(第三版)[J]. 中华神经科杂志, 2014,47(6): 428-433.
[8] XU J, XU D, XIA S. Data analysis of abverse drug reactions caused by pramipexole [J]. World Clin Drugs(世界临床药物),2012, 33 (11): 681-683.
[9] ZESIEWICZ T A, HAUSER R A. Sleep attacks and dopamine agonists for Parkinson’s disease : what is currently known? [J].CNS Drugs, 2003, 17(8): 593-600.
[10] ÁLVAREZ F J. Parkinson's disease, antiparkinson medicines,and driving [J]. Expert Rev Neurother, 2016, 16(9):1023-1032.
[11] LI J, SHI S, YANG J. Determination of related substances of pramipexole hydrochloride by correction factor [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(11):1366-1370.
[12] 唐星. 口服缓控释制剂[M]. 北京: 人民卫生出版社, 2007:77.
[13] ROBERTS M, CESPI M, FORD J L, et al. Influence of ethanol on aspirin release from hypromellose matrices [J]. Int J of Pharm, 2007, 332(1/2): 31-37.
[14] LEVINA M, VUONG H, RAJABI-SIAHBOOMI A R. The influence of hydro-alcoholic media on hypromellose matrix systems [J]. Drug Dev Ind Pharm, 2007, 33(10): 1125-1134.
[15] ASARE-ADDO K, CONWAY B R, HAJAMOHAIDEEN M J,et al. Aqueous and hydro-alcoholic media effects on polyols[J]. Colloids Surf B Biointerfaces, 2013, 111(1): 24-29.
[16] JEDINGER N, KHINAST J, ROBLEGG E. The design of controlled-release formulations resistant to alcohol-induced dose dumping -- a review [J]. Eur J Pharm Biopharm, 2014,87(2): 217-226.