艾滋病(acquired immune deficiency syndrome,AIDS)由艾滋病病毒(human immunodeficiency virus,HIV)感染引起,自20世纪80年代发现首例患者以来在世界范围迅速传播,严重威胁人类健康。据WHO统计,截止2015年底,全球共3 670万人感染AIDS,其中2015年新感染者210万,死亡人数达到 110万,成为人类死亡的一个重要原因。核苷类抗病毒药,如齐多夫定、去羟肌苷、扎西他滨、拉米夫定,是一类重要的抗HIV药物[1],但它们需在细胞内通过胸苷激酶转化为三磷酸酯才能发挥药效,其中单磷酸化是限速步骤,见图1。已知 AIDS患者的胸苷激酶活性仅为正常人的1/3;并且长期应用核苷类药物会进一步降低胸苷激酶活性。因此核苷类药物的单磷酸化过程对其发挥药效至关重要。巨噬细胞已被证明是HIV的宿主,感染HIV后,可携带HIV游走到其他重要器官如脑、肝、肺,成为HIV贮库和感染源[2-3]。核苷类药物一般极性较强,跨越细胞膜进入巨噬细胞内的数量有限,同时巨噬细胞内的胸苷激酶活性小,也影响了其磷酸化。
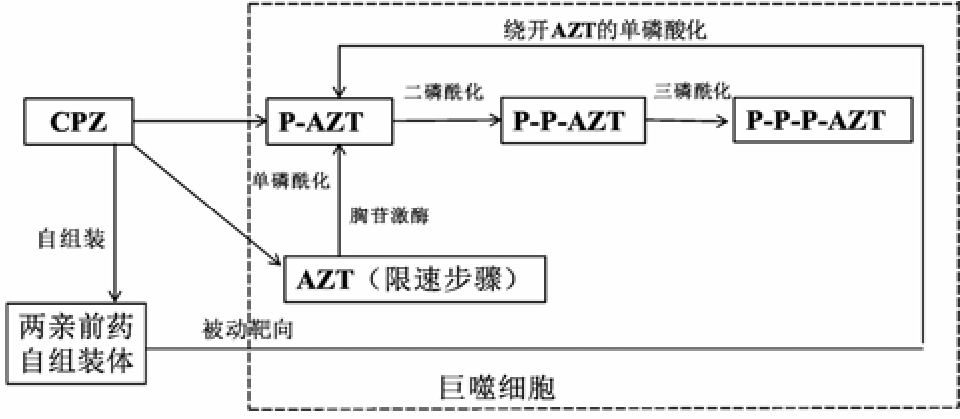
图1 CPZ的作用机制
Fig. 1 Mechanisms of CPZ
自组装药物传递系统(self-assembled drug delivery system,SADDS)是由金义光教授首次提出的一种新型药物传递系统,它是指两亲性药物或前药在水中自组装成囊泡、脂质体、胶束等高度分散的有序聚集体[4]。一般地,极性药物与长脂肪链共价结合形成两亲前药,在水中发生分子自组装形成纳米组装体。如果药物分别连接在脂质分子的两端,称为“双头基两亲前药”,其自组装体也属于 SADDS。SADDS是药物与载体的有机结合,具备稳定性好、载药量大、靶向控释、容易跨越生物膜等特点,已成功应用于阿昔洛韦[5-6]、去羟肌酐[7-8]、异烟肼[9]、吉西他滨[10-11]、齐多夫定[12-14]、氟尿嘧啶[15],涉及抗艾滋病[16]、抗病毒[17]、抗肿瘤[11]、抗结核病[9]等领域,为上述疾病治疗提供了新思路。
胆固醇基磷酰齐多夫定(5’-cholesterylphosphoryl zidovudine,CPZ)是基于SADDS理论指导、由本实验室首次合成的齐多夫定单磷酰化衍生物,结构式见图2A。齐多夫定极性大,细胞膜渗透性差、体内半衰期短,因此给药剂量大、给药次数频繁,且难以在巨噬细胞内分布清除残留 HIV。CPZ的优势在于:①分子能自组装形成纳米级囊泡状结构,见图2B,体内易被巨噬细胞吞噬;②降解成单磷酰齐多夫定,绕开了核苷类药物单磷酸化的限速步骤,与“鸡尾酒”疗法互为补充,最终根除藏匿在巨噬细胞内的HIV。CPZ自组装体是两亲分子在热力学规律下自发形成的,稳定性好,没有辅料参与,载药量高,不再存在所谓“包封率”,见图3。单分子 CPZ无法实现被动靶向,必须形成自组装体后才能被动靶向到巨噬细胞发挥药效。

图 2 胆固醇基磷酰齐多夫定的化学结构式(A)及自组装过程(B)
Fig. 2 Structure (A) and self-assembling process(B) of CPZ

图3 药物自组装体的特点
Fig. 3 Features of drug self-assemblies
注射用制剂包括灭菌或无菌的溶液和临用前制备成溶液或混悬液的无菌粉末等[18],特点是作用迅速、吸收快、剂量准确、作用可靠、避免肝脏首过效应、可局部定位给药。供注射用的制剂应符合无菌、无热原、无不溶性微粒等,并尽可能与血液等渗。本研究在前期完成CPZ规模化合成的基础上,重点研究注射用CPZ自组装体冻干粉的规模化制备及灭菌工艺,为AIDS治疗提供一种新选择。
1 材料与方法
1.1 药物与试剂
CPZ(自制,批号:20150624,含量:99.9%);十六烷基三甲基溴化铵(CTAB,分析纯,国药集团化学试剂有限公司);无水乙醇、冰醋酸(分析纯,国药集团化学试剂有限公司);K2HPO4、KH2PO4(分析纯,天津市博迪化工有限公司);甘露醇(分析纯,天津市博迪化工有限公司);氨水(分析纯,西陇化工有限公司);甲醇、异丙醇(色谱纯,Fisher公司)。
1.2 仪器
New Classic MS十万分之一天平(瑞士METTLER TOLEDO);Zetasizer Nano ZS 纳米激光粒度仪(英国马尔文仪器有限公司);LGJ-30冷冻干燥机(华中松源科技有限公司);Agilent 1260高效液相色谱仪(美国 Agilent);HI2221精密 pH计(Hanna仪器有限公司);H-7650透射电镜(日本日立);Nano DeBEE高压均质机(美国DeBEE公司);SENCO 电动搅拌器(上海申生科技有限公司);ISP01-1A微量注射泵(保定兰格恒流泵有限公司)。
1.3 CPZ测定方法的建立
采用 HPLC测定 CPZ含量,色谱柱:Diamonsil®C18(250 mm×4.6 mm,5 μm);流动相:甲醇∶异丙醇=90∶10,加入 2 mmol·L-1CTAB、2%乙酸、0.5%氨水;流速:1.0 mL·min-1;柱温:30 ℃;检测波长:266 nm;保留时间:8.7 min。
1.3.1 标准曲线的建立 精密称取CPZ 10.04 mg,置于10 mL量瓶中,加流动相溶解并定容,作为贮备液,分别移取 0.05,0.1,0.2,0.4,0.8,1.0 mL置于10mL量瓶中,流动相定容,摇匀,得到浓度分别为 5.02,10.04,20.08,40.16,80.32,100.4 µg·mL-1的样品溶液,进样并记录色谱图。以浓度 C(µg·mL-1)对峰面积 A进行线性回归,得到标准曲线。
1.3.2 精密度 精密称取 CPZ 10.34 mg,置于10 mL量瓶中,加流动相定容,摇匀。分别移取0.4,0.5,0.6 mL置于10 mL量瓶中,流动相定容,摇匀,得到浓度分别为 41.36,51.70,62.04 µg·mL-1的样品溶液,分别记为A,B,C样品溶液。再取制备的约 2 mg·mL-1CPZ 自组装体 2 mL 置于10 mL 量瓶中,制得约 400 µg·mL-1的 CPZ 制剂样品溶液。上述溶液在4 ℃存放,分别于0,3,6,9 h进样,记录CPZ色谱峰面积,计算相对标准偏差(RSD),得到日内精密度。同上操作,样品溶液分别于1,2,3 d进样,记录CPZ色谱峰面积,计算相对标准偏差(RSD),得到日间精密度。
1.3.3 回收率 取 CPZ 6 mg,准确称定,置于10 mL量瓶中,取2 mL CPZ自组装体于上述量瓶中,流动相定容,摇匀,制得回收率待测样品溶液,进样测定,记录峰面积,计算回收率。
1.3.4 检测限与定量限 移取0.1 mL CPZ贮备液于 10 mL量瓶中,流动相定容,摇匀,得到10.04 µg·mL-1的 CPZ 对照品溶液。分别移取 0.2,0.5 mL的CPZ对照品溶液于5 mL量瓶中,流动相定容,摇匀,分别得到 A,B样品溶液。移取0.5 mL B样品溶液于5 mL量瓶中,流动相定容,摇匀,得到C样品溶液。将A,C样品溶液分别进样,记录峰面积。以CPZ色谱峰高与噪音(基线波动幅度)的比值为10∶1时的浓度作为最低定量限,比值为3∶1时的浓度为最低检测限。
1.4 CPZ自组装体冻干粉的制备工艺优化
1.4.1 制备设备的组装 用注入法制备CPZ自组装体[19]。取0.25 g CPZ干燥药粉末于50 mL棕色量瓶中,加适量无水乙醇溶解,定容,用 20 mL注射器吸取CPZ乙醇溶液,并固定于微量注射泵上。取100 mL水加入250 mL两颈烧瓶,使用适宜长度的橡胶软管连接装有CPZ乙醇溶液的注射器口端和烧瓶口胶塞中固定的注射器针头,见图4A,4B。在600 r·min-1机械搅拌条件下,将上述CPZ乙醇溶液以 0.5 mL·min-1的推注速度注入到水中。注入完毕,得到乳白色的CPZ自组装体微混悬液,见图4C。将其转移至茄形瓶中,在60 ℃减压旋转蒸发除去乙醇。将除去有机溶剂的 CPZ自组装体混悬液进行高压均质,在200 MPa压力下循环4次均质,得到CPZ自组装体,为呈现淡蓝色乳光的混悬液,见图 4D。重复上述制备过程,可在1 d内连续制备得到CPZ自组装体300 mL以上。

图4 连续注入法制备CPZ自组装体的装置和产品
Fig. 4 Device for preparing CPZ self-assemblies with a continuous injection method and the products
1.4.2 搅拌速度的影响 考察水相搅拌速度(500,600,700 r·min-1)对 CPZ 自组装体的影响。按油水相比例为 1∶2,油相推注速度为 0.5 mL·min-1,制备CPZ自组装体,测定粒径及Zeta电位。
1.4.3 注射器针头规格的影响 考察 2种不同针头 4.5#(内径 210 μm),5#(内径 232 μm)对 CPZ 自组装体的影响。油水相比例为 1∶2,油相推注速度为 0.5 mL·min-1,按“1.4.1”项下方法制备 CPZ自组装体,测定粒径及Zeta电位。
1.5 灭菌工艺优化
分别采用过0.45 µm无菌滤膜和60Co γ射线照射2种方法灭菌[20],测定灭菌前后CPZ含量,粒径和Zeta电位的变化。
1.6 CPZ自组装体冻干粉的处方优化
1.6.1 冻干保护剂用量的筛选 为得到CPZ自组装体冻干粉,在注入法中的水溶液中加入甘露醇作为冻干保护剂。CPZ与甘露醇比例分别为10∶1,5∶1,2∶1,1∶1,1∶2(表 1),按表 2中冻干曲线冻干。根据CPZ自组装体冻干粉的形貌,水重分散情况,粒径,Zeta电位等指标,筛选甘露醇最佳比例。
表1 注入法制备CPZ自组装体中甘露醇用量的优化
Tab. 1 Optimization of additive mannitol in the injection method for CPZ self-assemblies
表2 CPZ自组装体冻干粉的冻干曲线
Tab. 2 Lyophilization curves of CPZ self-assemblies freeze-dried powders

1.6.2 水溶液 pH对 CPZ自组装体制备的影响CPZ结构中磷酰基上的羟基可解离得到磷酰负离子,由于同性相斥,造成CPZ自组装体不稳定。弱酸性环境可能抑制CPZ的解离,增强自组装体的稳定性。分别用 pH 6.5,7.0,7.4,8.0的磷酸盐缓冲液(PBS)作为水相,用注入法制备CPZ自组装体冻干粉,测得冻干前后粒径及Zeta电位的变化,考察不同pH值对CPZ解离的影响。另外分别取0%,0.05%,0.1%,0.15%醋酸水溶液作为水相,制备CPZ自组装体冻干粉,同上考察,筛选最优pH值。
1.7 性质表征
1.7.1 形貌表征 取适量CPZ自组装体冻干粉加水重新分散并稀释至适宜浓度,取100 µL置于铜网上,1 min后用2%磷钨酸溶液(pH=7.0)负染,在透射电镜(transmission electron microscopy,TEM)下观察CPZ结构。
1.7.2 粒径和zeta电位 取适量CPZ自组装体冻干粉加水重新分散并稀释至适宜浓度,采用纳米激光粒度测定仪测定粒径及Zeta电位,温度为25℃,体积1 mL。
1.7.3 含量测定 取5 mg CPZ,准确称定,置于10 mL量瓶中,流动相定容,摇匀,再吸取1 mL稀释至10 mL量瓶,摇匀,制得CPZ对照品溶液。再取CPZ自组装体冻干粉5 mg,准确称定,置于10 mL量瓶中,流动相定容,摇匀,制得CPZ自组装体样品溶液,进样测定CPZ自组装体的含量。
2 结果与讨论
2.1 CPZ含量测定方法的建立
CPZ在HPLC中的保留时间为8.72 min,其峰形对称,分离完全,无杂质峰干扰,表明此方法专属性良好,见图5。
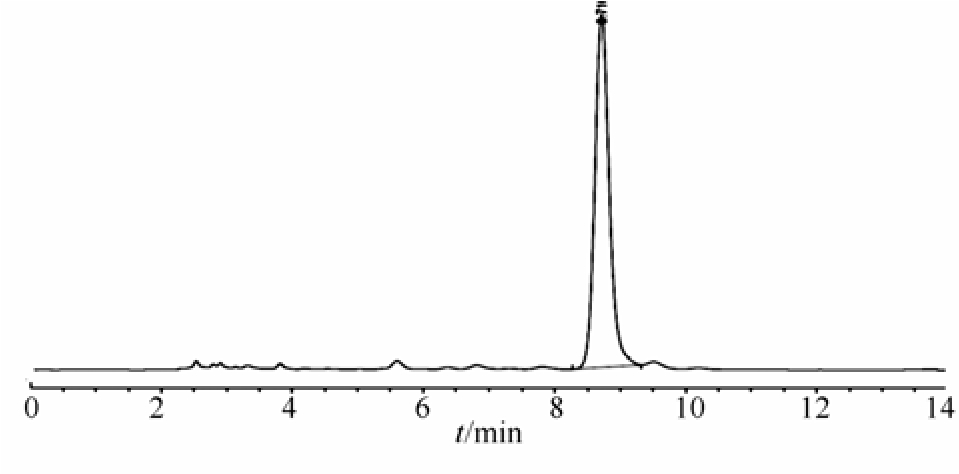
图5 CPZ的HPLC色谱图
Fig. 5 HPLC chromatogram of CPZ
以浓度 C(µg·mL-1)对峰面积 A 对进行线性回归,线性方程为A=13.404 0C-23.956 0(r=0.999 2),线性范围为 5~100 µg·mL-1,线性关系较好,可满足CPZ含量测定要求。CPZ和CPZ自组装体制剂的日内,日间精密度 RSD<2%,符合要求。最低定量限为 8 ng(信噪比 10∶1),最低检测限为2 ng(信噪比 3∶1)。
回收率(%)=(加 CPZ的自组装体样品中 CPZ含量-自组装体中CPZ含量)/加入CPZ×100%。测得加样回收率为95%~105%,表明该方法回收率良好。结果见表3。
表3 CPZ测定的回收率测定结果
Tab. 3 Recovery of CPZ determination

2.2 CPZ自组装体的最佳制备工艺
在注入法制备CPZ自组装体的过程中,机械搅拌器的搅拌速度初步选择在 500~700 r·min-1。注射器针头规格对CPZ自组装体的粒径与Zeta电位影响不大。当搅拌速度在 700 r·min-1时,整个装置容易出现晃动,并且溶液容易从烧瓶中溅出,所以最后选择了600 r·min-1。其他最佳制备工艺还包括5#针头(内径0.232 mm),CPZ乙醇溶液的推注速度为 0.5 mL·min-1,最后的油相/水相体积比为1∶2。
2.3 CPZ自组装体的最佳处方
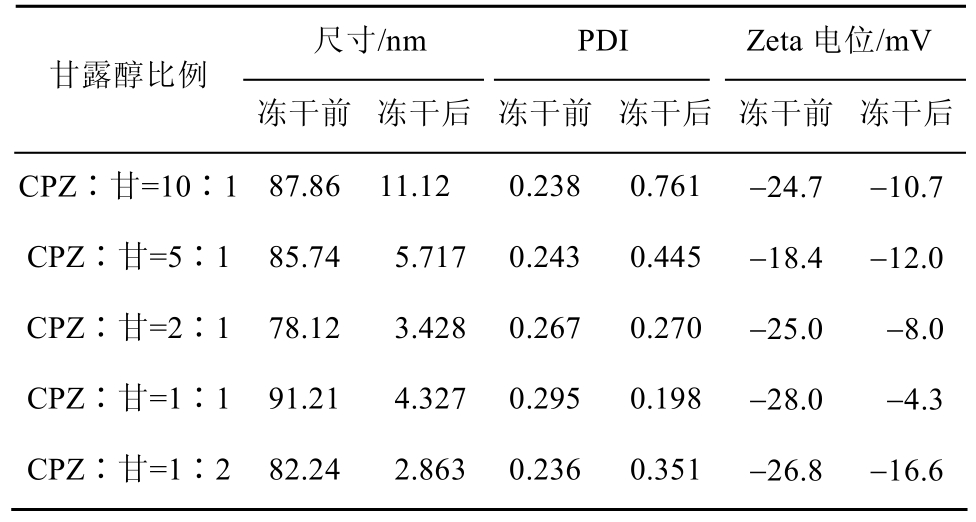
2.3.1 最佳甘露醇用量 与脂质体类似,为了维持CPZ分子双分子层构成的自组装体囊泡结构,CPZ自组装体冻干时需加入冻干保护剂。本研究选择了可注射和常用的甘露醇作为冻干保护剂。CPZ自组装体的冻干粉在水重分散后的粒径及Zeta电位比冻干前的原始自组装体混悬液相应参数水平均显著下降,但PDI值除CPZ∶甘露醇(1∶1)组外,其余各组均明显升高,见表4。这可能是因为CPZ自组装体冻干过程中,CPZ双分子层发生破裂,在水重新分散时,双分子层重新组合,出现了粒径下降和不均匀的情况。
表4 甘露醇用量对冻干前后CPZ自组装体参数的影响Tab. 4 Influence of mannitol on the sizes and zeta potentials of CPZ self-assemblies before and after lyophilization
注:甘=甘露醇。
Note: “甘” refers to mannitol.
当CPZ∶甘露醇质量比为1∶2时,CPZ冻干粉外观饱满,质地疏松,无干瘪结块现象,见图6。加水重新分散后,前 4组分散速率较慢并且有可见颗粒,而CPZ∶甘露醇(1∶2)组分散快,混悬均匀。因此CPZ自组装体处方的甘露醇比例越大,冻干粉的外观越趋于疏松饱满,重分散性更好。最终确定甘露醇用量为CPZ∶甘露醇=1∶2。
甘露醇是最常用的冻干保护剂[21]。甘露醇性质稳定,其多元醇基团可取代水分子为双分子层囊泡结构提供支持。在本研究中,甘露醇能与CPZ自组装体中的极性头形成氢键而代替了原有水的位置,起到保护作用[22]。本研究中随甘露醇比例增大,CPZ自组装体冻干粉外观趋于疏松饱满,水重分散性好,也说明了上述机制。
2.3.2 最佳水溶液 pH值 在注入法制备CPZ自组装体的过程中,水溶液的pH值是重要参数。水相的pH差异可直接影响CPZ分子解离,从而影响CPZ自组装体的稳定性和冻干粉重分散后的稳定性。本研究首先考察了常用的磷酸缓冲液,并在其基础上进一步研究了不同浓度的醋酸水溶液,对CPZ自组装体对其冻干粉的影响。

图6 不同比例的CPZ/甘露醇处方的CPZ自组装体冻干粉外观
Fig. 6 Appearance of CPZ self-assemblies freeze-dried powders with different CPZ/mannitol ratios
不同pH值的PBS作为水相制得的CPZ冻干粉重分散后,并不能抑制CPZ分子解离,CPZ分子间斥力强,粒径小于10 nm甚至更小。用0%~0.15%浓度范围的醋酸溶液作为水相,考察对CPZ自组装体的影响。当0.05%醋酸溶液作为水相时,CPZ自组装体冻干前后粒径,PDI基本不变,Zeta电位稍有下降,结果见表5。因此选择0.05%醋酸溶液作为最优pH调节剂,可有效抑制CPZ分子解离,得到稳定的CPZ自组装体。
2.4 CPZ自组装体的灭菌
用HPLC测定过滤和辐照对CPZ自组装体中CPZ含量的影响。未灭菌组CPZ含量为9.51%;过0.45 μm无菌滤膜后CPZ含量为9.50%;而60Cog射线照射后CPZ含量为7.5%,有部分CPZ经辐照后转化为齐多夫定,见图7。最终确定过0.45 μm无菌滤膜作为灭菌方法。
规模化生产时过滤灭菌是保证制剂无菌的一种有效手段[23]。 CPZ自组装体属于纳米级别,粒径约为100 nm左右。0.22 μm无菌滤膜过滤灭菌比较彻底,但会截留较多自组装体,药物损失较多。60Coγ射线照射灭菌会引起CPZ降解。因此最终确定0.45 μm无菌滤膜作为CPZ自组装体制备的灭菌方法[24]。
2.5 CPZ自组装体的性质
2.5.1 微观结构 在 TEM 下发现 CPZ自组装体为囊泡结构,粒径100 nm左右,呈类球形,见图8。
表5 醋酸溶液对CPZ自组装体冻干前后参数的影响(n=3)
Tab. 5 Effect of acetic acid solutions on the parameters of CPZ self-assemblies (n=3)


图7 CPZ自组装体冻干粉灭菌前后HPLC色谱图
Fig. 7 HPLC chromatograms of CPZ lyophilized powder before and after sterilization

图8 最佳处方工艺制备的CPZ自组装体TEM照片
Fig. 8 TEM images of CPZ self-assemblies prepared with the optimal formulation and preparation method
2.5.2 粒径和Zeta电位 采用最优处方工艺制备的CPZ自组装体冻干粉,水重新分散后其粒径为(80.77±10.88)nm(n=3),PDI值 0.20±0.02(n=3),Zeta电位为-(29.43±0.90)mV(n=3),绝对值接近30 mV,可增强自组装体稳定性。
2.5.3 药物含量 采用HPLC测定CPZ自组装体中的药物含量,采用外标一点法计算得到CPZ自组装体冻干粉中CPZ含量为(15.43±0.39)%(n=3)。
3 结论
本研究系统考察了CPZ自组装冻干粉的规模化制备工艺及灭菌方法。目前本实验室已按照此制备工艺和灭菌方法进行了中试规模制备,稳定性试验正在进行中,未来还需要进一步开展其药动学和安全性评价。本研究为AIDS治疗提供了一种新选择。
REFERENCES
[1] LIU X N, CHAI Q, HAN W N. Research progress of nucleoside sulfur compounds [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(2): 246-249.
[2] AQUARO S, CALIO R, BALZARIN J, et al. Macrophages and HIV infection: therapeutical approaches toward this strategic virus reservoir [J]. Antiviral Res, 2002(55): 209-225.
[3] AQUARO S, BAGNARELLI P, GUENCI T, et al. Long-term survival and virus production in human primary macrophages infected by human iImmunodeficiency virus[J]. J Med Virol,2002, 68(4): 479-488.
[4] 金义光. 自组装药物传递系统[J]. 国际药学研究杂志, 2010,37(3): 165-169.
[5] JIN Y. Effect of temperature on the state of the self-assembled nanoparticles prepared from an amphiphilic lipid derivative of acyclovir [J]. Colloids Surfaces B: Biointerfaces, 2007, 54(1):124-125.
[6] JIN Y, TONG L, AI P, et al. Self-assembled drug delivery systems. 1. Properties and in vitro/in vivo behavior of acyclovir self-assembled nanoparticles (SAN)[J]. Int J Pharm,2006, 309(1/2): 199-207.
[7] JIN Y, AI P, XIN R, et al. Morphological transformation of self-assembled nanostructures prepared from cholesteryl acyl didanosine and the optimal formulation of nanoparticulate systems: effects of solvents, acyl chain length and poloxamer 188[J]. J Colloid Interface Sci, 2008, 326(1): 275-282.
[8] JIN Y, AI P, XIN R, et al. Self-assembled drug delivery systems. Part 3. In vitro/in vivo studies of the self-assembled nanoparticulates of cholesteryl acyl didanosine [J]. Int J Pharm,2009, 368(1/2): 207-214.
[9] JIN Y, CHEN S, XIN R, et al. Monolayers of the lipid derivatives of isoniazid at the air/water interface and the formation of self-assembled nanostructures in water [J].Colloids Surf B Biointerfaces, 2008(64): 229-235.
[10] JIN Y, LIAN Y, DU L. Self-assembly of N-acyl derivatives of gemcitabine at the air/water interface and the formation of nanoscale structures in water [J]. Colloids Surf A:Physicochem Eng Asp, 2012, 393(1): 60-65.
[11] JIN Y, LIAN Y, DU L, et al. Self-assembled drug delivery systems. Part 6: In vitro/in vivo studies of anticancer N-octadecanoyl gemcitabine nanoassemblies [J]. Int J Pharm,2012, 430(1/2): 276-281.
[12] JIN Y, QI N, TONG L, et al. Self-assembled drug delivery systems. Part 5: Self-assemblies of a bolaamphiphilic prodrug containing dual zovudine [J]. Int J Pharm, 2010, 386(1/2):268-274.
[13] JIN Y, XIN R, TONG L, et al. Combination anti-HIV therapy with the self-assemblies of an asymmetric bolaamphiphilic zidovudine/didanosine prodrug [J]. Mol Pharm, 2011, 8(3):867-876.
[14] JIN Y, XING L, TIAN Y, et al. Self-assembled drug delivery systems. Part 4. In vitro/in vivo studies of the self-assemblies of cholesteryl-phosphonyl zidovudine [J]. Int J Pharm, 2009,381(1): 40-48.
[15] JIN Y, YANG F, DU L. Nanoassemblies containing a fluorouracil/zidovudine glyceryl prodrug with phospholipase A2-triggered drug release for cancer treatment [J]. Colloids Surf B Biointerfaces, 2013(112): 421-428.
[16] DU L N, LI M, SU C, et al. In vitro pharmacodynamic evaluation of anti-HIV cholesteryl-phosphoryl zidovudine self-assemblies [J]. J Int Pharm Res(国际药学研究杂志),2013, 40(1): 69-72.
[17] JIN Y, XIN R, AI P, et al. Self-assembled drug delivery systems. 2. Cholesteryl derivatives of antiviral nucleoside analogues: Synthesis, properties and the vesicle formation [J].Int J Pharm, 2008, 350(1/2): 330-337.
[18] XIE H, YUAN H L, CHEN Y F, et al. Clinical rational drug use for pharmaceutical excipients of injection [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(4): 488-492.
[19] DU L, JIA J, GE P, et al. Self-assemblies of 5'-cholesteryl-ethyl-phosphoryl zidovudine [J]. Colloids Surf B Biointerfaces, 2016(148): 385-391.
[20] SANDLE T. Sterility, Sterilization and Sterility Assurance for Pharmaceuticals: Technology, Validation and Current Regulations [M]. UK: Woodhead Publishing, 2013: 1-20.
[21] PATEL K, MUNJAL B, BANSAL A. Effect of cyclophosphamide on the solid form of manitol during lyophilizatian [J]. Eur J Pharm Sci, 2017(101): 251-257.
[22] 田晓娜. 一种新型三联苯衍生物的纳米混悬液的制备及体内外评价[D]. 山东: 山东大学, 2014.
[23] SANDLE T. Pharmaceutical Microbiology: Essentials for Quality Assurance and Quality Control [M/OL]. Elsevier,2016: 147-160.
[24] 兰姗. 清肺注射液的药学研究[D]. 北京: 北京中医药大学,2016.