严重创伤失血引起的血管收缩功能障碍是导致患者发生难治性低血压甚至死亡的重要原因。目前临床用于治疗难治性低血压的首选血管活性药物是儿茶酚胺类,包括去甲肾上腺素(norepinephrine,NE)、肾上腺素和多巴胺等。然而,大量研究资料表明,脓毒性休克和失血性休克常发生儿茶酚胺抵抗[1]。因此,其他种类血管活性药物,特别是精氨酸血管加压素(arginine vasopressin,AVP)及其衍生物得到了广泛关注,它的治疗效果也得到证实[2]。笔者前期研究显示,在休克状态下,小剂量 AVP能增强 NE的血管收缩作用[3]。但是AVP能否作为临床休克治疗的一线药物仍存在争议,一个重要原因是AVP的血管作用机制尚未完全阐明。缝隙连接(gap junction,GJ)是介导细胞间直接进行物质和信息交流的膜通道结构,在血管舒缩过程中扮演非常重要的角色[4-5]。GJ由相邻细胞膜上的连接蛋白(connexin,Cx)六聚体组成的连接子衔接而成,目前发现人类GJ蛋白家族包括21个成员,在心血管系统中发现的有Cx37、Cx40、Cx43、Cx45和Cx46。但是,GJ是否在AVP介导的血管舒缩功能调节过程中发挥作用,是哪种Cx参与,尚不清楚。本实验采用失血性休克大鼠模型和缺氧培养的血管平滑肌细胞(vascular smooth muscle cells,VSMC),首先观察了2种广泛使用的GJ阻断剂对AVP诱导血管收缩作用的影响,随后用各Cx蛋白特异性的反义寡核苷酸(antisense oligodeoxynucleotide,AODN),筛选参与AVP作用的Cx亚型,再进一步观察它们对AVP调节休克血管钙敏感性和缺氧 VSMC内钙离子浓度([Ca2+]i)的影响。
1 材料与方法
1.1 动物与试剂
清洁级SD大鼠218只,体质量190~230 g,♀♂各半,第三军医大学大坪医院实验动物中心提供,实验动物合格证号:SCXK(渝)2012-0005。
AVP(纯度>97%,批号:109K5060)、甘珀酸(carbenoxolone,CBX,纯度>98%,批号:SLBH1990V)、辛醇(octanol,纯度>99%,批号:STBG1046V)、钙离子荧光探针 Fura-2/AM(纯度>95%,批号:MKBS7357V)均来自美国Sigma公司;GJ蛋白亚型的反义寡核苷酸 Cx37AODN、Cx40AODN、Cx43AODN、Cx45AODN 和Cx46AODN均由Invitrogen公司合成(PAGE纯化,批号:HS100428800)。慢病毒载体Cx37-siRNA和Cx43-siRNA 由纽恩(上海)生物科技公司构建。其他试剂均为国产分析纯。
1.2 AVP诱导正常和失血性休克大鼠血管收缩与GJ的关系
48只大鼠随机分为6组(n=8):正常组、正常+CBX组、正常+octanol组、休克组、休克+CBX组、休克+octanol组。本实验室常规方法建立失血性休克模型[6]:用戊巴比妥钠(30 mg·kg-1)腹腔注射麻醉后,大鼠右侧股动脉插管并连接血压计,用于观察血压和放血。10 min内放血至血压降至40 mmHg,并维持 2 h。开腹,取肠系膜上动脉(superior mesenteric artery,SMA)制备血管环。采用离体血管张力测定技术检测AVP诱导的血管收缩反应[7]。将 SMA环挂于离体器官浴槽中平衡2 h,CBX 组和 octanol组分别用 CBX(10-4mol·L-1)和 octanol (10-3mol·L-1)孵育 30 min。然后检测不同 浓 度 AVP(10-3, 3×10-3, 10-2, 3×10-2,10-1U·mL-1)诱导的收缩反应。以量-效曲线和最大收缩反应(Emax)评价AVP的血管收缩作用。
1.3 AVP诱导正常和失血性休克大鼠血管收缩与Cx亚型的关系
96只大鼠随机分为 12组(n=8):正常组、正常+Cx37AODN组、正常+Cx40AODN组、正常+Cx43AODN组、正常+Cx45AODN组、正常+Cx46AODN组、休克组、休克+Cx37AODN组、休克+Cx40AODN组、休克+Cx43AODN组、休克+Cx45AODN组、休克+Cx46AODN组。取正常和休克大鼠 SMA环,按照前期实验方法用不同 Cx亚型的AODN孵育血管环[8],然后按“1.2”项下方法检测AVP诱导的血管收缩反应。
1.4 AVP调节正常和失血性休克大鼠血管钙敏感性与Cx37、Cx43的关系
64只大鼠分为8组(n=8):正常组、正常+AVP组、正常+AVP+Cx37AODN组、正常+AVP+Cx43AODN组、休克组、休克+AVP组、休克+AVP+Cx37AODN组、休克+AVP+Cx43AODN组。按“1.3”项下方法取正常和休克大鼠SMA环并分别用Cx37AODN和Cx43AODN孵育,然后将血管环挂于浴槽中平衡,各 AVP处理组用3×10-2U·mL-1AVP 孵育 20 min,然后按累积浓度法向浴槽高 K+液中依次加入梯度浓度的 CaC12,检测血管的钙敏感性。以量-效曲线和不同Ca2+浓度下 SMA环的最大收缩反应(Emax)来评价血管的钙敏感性[3]。
1.5 AVP、Cx37-siRNA和 Cx43-siRNA对缺氧VSMC内[Ca2+]i的影响
用缺氧培养的VSMC来模拟在体休克状态[7]。本实验室常规方法提取并培养大鼠肠系膜上动脉VSMC。实验分为正常组、缺氧组、缺氧+AVP组、缺氧+AVP+Cx37-siRNA 组、缺氧+AVP+Cx43-siRNA组。将VSMC接种至共聚焦培养皿,达到 60%~70%生长融合后,转染慢病毒载体Cx37-siRNA或Cx43-siRNA,转染48 h后给予缺氧 2 h 处理和 AVP(3×10-2U·mL-1,20 min)孵育。加入 Ca2+荧光探针 Fura-2/AM (2 µmol·L-1),37 ℃孵育20 min。在共聚焦显微镜(Leica,SP5,德国)下观察Fura-2的荧光水平变化。
1.6 统计学分析
所有数据均以x± s 表示。采用SPSS 13.0统计软件进行方差分析,P<0.05为统计学差异显著。
2 结果
2.1 AVP诱导血管收缩与GJ的关系
休克后AVP诱导的血管收缩反应有所降低。CBX和octanol均明显抑制了AVP诱导的正常和休克大鼠SMA的收缩反应(P<0.01),并且它们对休克后AVP的血管收缩作用显示了较强的抑制作用。正常+CBX组和正常+octanol组的SMA环对AVP的 Emax分别为正常组的 63.8%和 67.4%,而休克+CBX组和休克+octanol组的Emax分别为休克组的52.0%和54.1%。结果见图1。

图1 CBX和octanol对AVP诱导的正常和休克大鼠血管收缩反应的影响(n=8)
A-CBX;B-octanol;与正常组比较,1)P<0.01;与休克组比较,2)P<0.01。
Fig. 1 Effects of CBX and octanol on AVP-induced constriction of SMAs from normal and hemorrhagic shock rats (n=8)
A-CBX; B-octanol; compared with normal group,1)P<0.01; compared with shock group,2)P<0.01.
2.2 AVP诱导血管收缩与Cx亚型的关系
在所有表达于血管的 GJ通道蛋白(Cx37、Cx40、Cx43、Cx45和 Cx46)中,Cx37AODN 和Cx43AODN明显抑制了AVP对正常和休克血管的收缩作用(P<0.01),同样的,它们也对休克后AVP的血管收缩作用有较强的抑制作用。而Cx40AODN、Cx45AODN和 Cx46AODN对 AVP的血管收缩作用无明显影响。结果见图2。
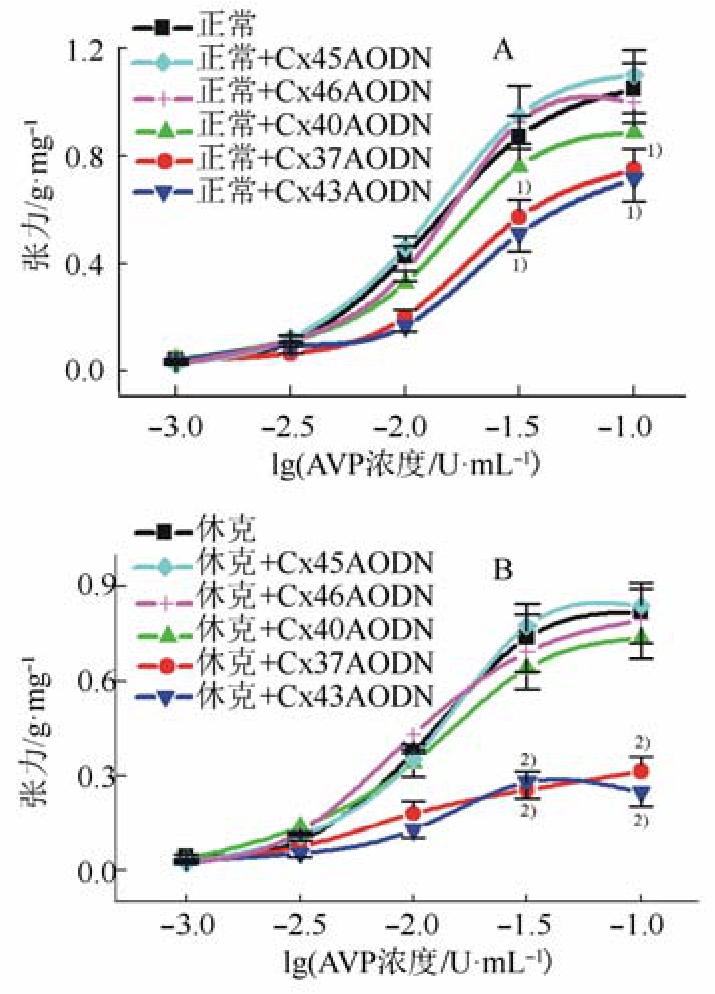
图2 不同Cx亚型AODNs对AVP诱导的正常和休克大鼠血管收缩反应的影响(n=8)
A-正常;B-休克;与正常组比较,1)P<0.01;与休克组比较,2)P<0.01。
Fig. 2 Effects of the AODNs of Cxs on AVP-induced constriction of SMAs from normal and hemorrhagic shock rats (n=8)
A-normal; B-hemorrhagic shock; compared with normal group,1)P<0.01;compared with shock group,2)P<0.01.
2.3 AVP调节血管钙敏感性与Cx37、Cx43的关系
与笔者前期研究结果相似[3],休克后血管钙敏感性降低,AVP孵育能明显改善休克后降低的钙敏感性,对正常血管钙敏感性有轻度升高作用。在正常和休克状态下,Cx43AODN都显著拮抗了AVP诱导的钙敏感性升高(P<0.01),且这种抑制作用在休克状态下更为明显。而Cx37AODN仅轻度降低了血管钙敏感性,与AVP组相比无统计学差异。结果见图3。
2.4 AVP、Cx37-siRNA和 Cx43-siRNA对缺氧VSMC内[Ca2+]i的影响
缺氧后 VSMC内 Fura-2的荧光亮度有所增加,表明缺氧 VSMC的[Ca2+]i升高。AVP、Cx37-siRNA和Cx43-siRNA对缺氧VSMC的[Ca2+]i无明显影响。结果见图4。

图3 Cx37和Cx43在AVP调节正常(A)和休克(B)大鼠血管钙敏感性中的作用(n=8)
A-正常;B-休克;与正常+AVP组比较,1)P<0.01;与休克+AVP组比较,2)P<0.01。
Fig 3 Effects of Cx37 and Cx43 on AVP-regulating the calcium sensitivity of SMAs from normal and after hemorrhagic shock rats (n=8)
A-normal; B-shock; compared with normal+AVP group,1)P<0.01;compared with shock+AVP group,2)P<0.01.
3 讨论
严重创伤、休克、脓毒症等临床重症常存在顽固性的低血压,主要原因是血管对儿茶酚胺类升压药物的反应性降低。大量研究显示,在这些疾病状态下,AVP仍然有良好的血管收缩和维持血压的作用[2]。AVP诱导血管收缩的经典机制是通过激活其V1a受体来增加细胞内钙离子浓度[9]。然而,有研究显示,在休克状态下VSMC存在钙超载,即是说休克后VSMC内钙离子浓度反而高了。因此,V1a受体介导的经典机制难以解释AVP对休克血管的良好的收缩作用。积极探索休克等病理状态下,AVP调节血管收缩的新的机制,对阐明AVP的作用机制及其临床应用具有重要意义。
GJ是广泛存在的一种细胞间膜通道结构[4-5]。在血管组织中,GJ主要分布在血管内皮细胞之间、平滑肌细胞之间以及内皮细胞和平滑肌细胞之间(称为肌内皮 GJ,MEGJ)。目前许多实验显示,MEGJ为血管内皮层和平滑肌层之间的直接联系提供了通道,参与了血管紧张性和血管舒缩反应的调节。笔者前期研究也发现,MEGJ在失血性休克大鼠内皮依赖的血管收缩和舒张功能调节中有重要的作用[8]。进一步用去除内皮的方法检测MEGJ是否参与AVP介导的血管收缩调节,发现去除内皮并不影响AVP的收缩作用。本实验结果显示,2种GJ阻断剂CBX和octanol可显著抑制AVP诱导的血管收缩反应。上述结果提示,不是内皮细胞和平滑肌细胞之间的MEGJ,而是VSMC之间的GJ参与了AVP的血管收缩作用。这个发现为AVP介导的血管功能和GJ间的关系提供了新的视点。
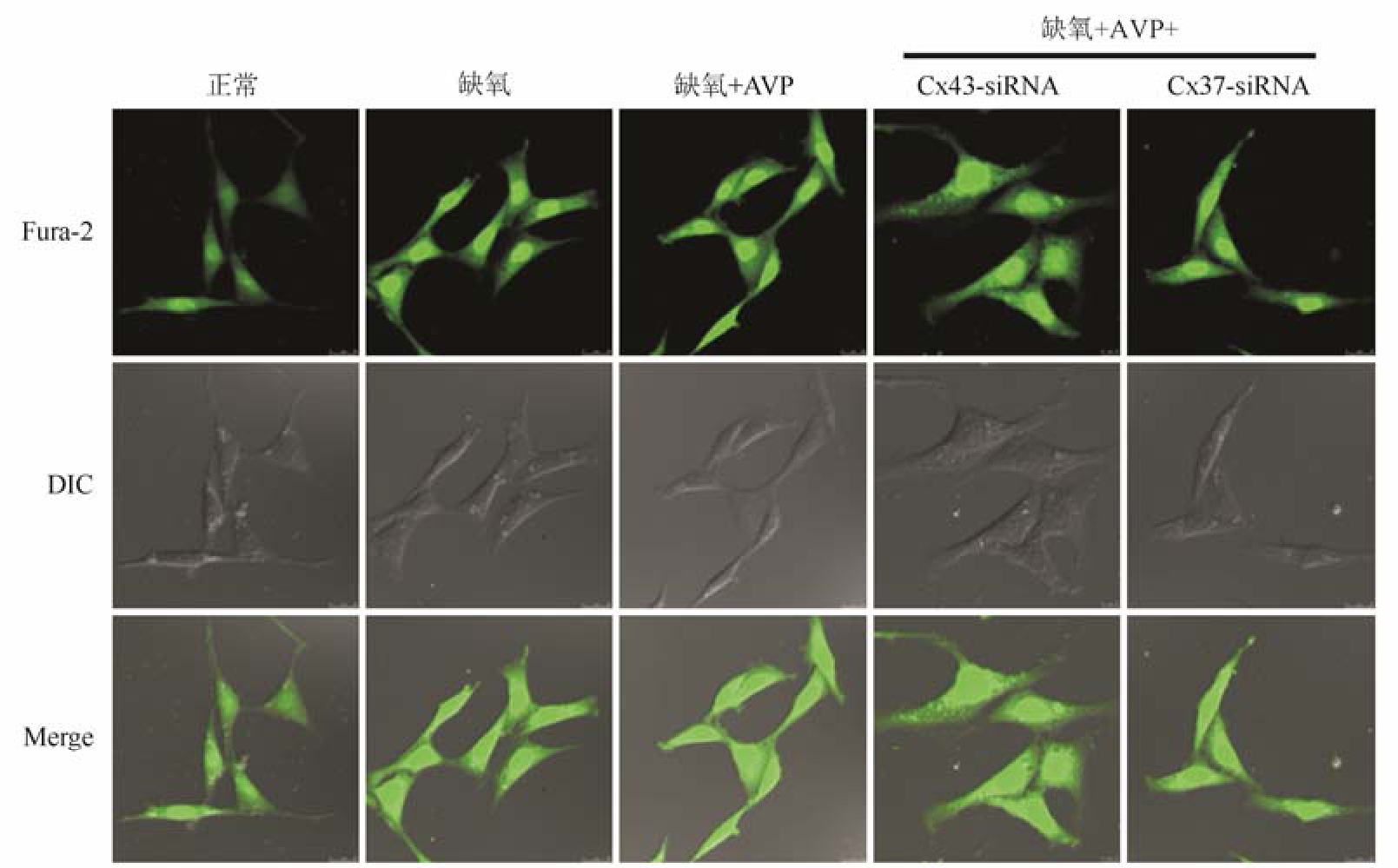
图4 AVP、Cx37-siRNA和Cx43-siRNA对缺氧VSMC内Ca2+浓度的影响
Fig. 4 Effects of AVP, Cx37-siRNA and Cx43-siRNA on the intracellular calcium concentration in VSMCs after hypoxia
进一步观察参与AVP作用的Cx类型,结果显示,用各 Cx亚型的反义寡核苷酸处理后,Cx37AODN和Cx43AODN对AVP诱导的血管收缩有明显抑制作用,而Cx40AODN、Cx45AODN和Cx46AODN无明显作用。提示在所有表达于血管的Cx蛋白中,Cx37和Cx43参与了AVP对血管收缩的调节。基础研究表明,平滑肌细胞的舒缩与肌球蛋白轻链(MLC20)的磷酸化水平密切相关,而 MLC20主要受肌球蛋白轻链激酶(MLCK)和肌球蛋白轻链磷酸酶(MLCP)的调节。MLCK/MLCP的调节途径包括钙依赖途径和非钙依赖途径,钙依赖途径是以细胞内 Ca2+浓度升高为核心的相关途径,非钙依赖途径是指不依赖于Ca2+浓度升高,而是取决于肌肉收缩蛋白对 Ca2+的敏感性,也称为钙敏感性途径[10]。因此,本实验进一步观察了Cx37和Cx43对AVP调节休克血管钙敏感性和缺氧VSMC内[Ca2+]i的影响。结果显示,Cx43AODN抑制了AVP升高休克血管钙敏感性的作用,而Cx37无明显作用。此外,AVP、干扰Cx37和Cx43对缺氧VMSC内[Ca2+]i均无明显影响。上述结果提示,Cx43可能是通过钙敏感性调节途径参与 AVP介导的血管收缩调节。而Cx37并不通过钙敏感性途径、也不影响细胞内Ca2+水平,可能通过其他机制发挥作用,有待进一步研究。
REFERENCES
[1] GROEBEN H, BÖTTIGER B W, SCHÄFER M, et al.Catecholamine-resistant hypotension--an update [J].Anasthesiol Intensivmed Notfallmed Schmerzther, 2005, 40(7):412-418.
[2] HESSLER M, KAMPMEIER T G, REHBERG S. Effect of non-adrenergic vasopressors on macro- and microvascular coupling in distributive shock [J]. Best Pract Res Clin Anaesthesiol, 2016, 30(4): 465-477.
[3] YANG G, LI T, XU J, et al. PKC plays an important mediated effect in arginine vasopressin induced restoration of vascular responsiveness and calcium sensitization following hemorrhagic shock in rats [J]. Eur J Pharmacol, 2010, 628(1-3):148-154.
[4] SKERRETT I M, WILLIAMS J B. A structural and functional comparison of gap junction channels composed of connexins and innexins [J]. Dev Neurobiol, 2017, 77(5): 522-547.
[5] JOHNSTONE S, ISAKSON B, LOCKE D. Biological and biophysical properties of vascular connexin channels [J]. Int Rev Cell Mol Biol, 2009(278): 69-118.
[6] YANG G M, TANG J, LI T, et al. Effects of myo-endothelial gap junction on the endothelium-dependent and -independent vascular relaxation/constriction in hemorrhagic shock rats [J].Chin J Mod Appl Pharm(中国现代应用药学), 2011, 28(1):1-4.
[7] YANG G, PENG X, HU Y, et al. 4-Phenylbutyrate benefits traumatic hemorrhagic shock in rats by attenuating oxidative stress, not by attenuating endoplasmic reticulum stress [J]. Crit Care Med, 2016, 44(7): e477-491.
[8] MING J, LI T, ZHANG Y, et al. Regulatory effects of myoendothelial gap junction on vascular reactivity after hemorrhagic shock in rats [J]. Shock, 2009, 31(1): 80-86.
[9] WASILEWSKI M A, MYERS V D, RECCHIA F A, et al.Arginine vasopressin receptor signaling and functional outcomes in heart failure [J]. Cell Signal, 2016, 28(3):224-233.
[10] UEHATA M, ISHIZAKI T, SATOH H, et al. Calcium sensitization of smooth muscle mediated by a Rho-associated protein kinase in hypertension [J]. Nature, 1997, 389(6654):990-994.