腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是调节糖、脂肪和蛋白质代谢,维持细胞能量稳态的关键代谢调节酶[1],其主要调节体质量及葡萄糖和脂肪的代谢等过程,而这些都与糖尿病的发生发展密切相关。现在已有许多AMPK的激动剂作为治疗糖尿病的药物被广泛使用,比如二甲双胍、罗格列酮。但近几年深入研究发现AMPK还与胰岛β细胞的凋亡有关。同时越来越多的证据证明,胰岛 β细胞的数量和功能的下降也是糖尿病发病机制中一个重要因素,而β细胞死亡的最主要形式可能就是细胞凋亡。因此,深入研究AMPK与β细胞凋亡的关系,将使我们更全面的了解AMPK的作用及机制,以便于今后更合理的应用于糖尿病治疗。
1 AMPK简介
AMPK是一种高度保守的丝/苏氨酸蛋白激酶,由α、β、γ 3个亚基构成[2]。α为催化亚基,有 3种同型异构体α1、α2、α3。胰岛β细胞中主要分布有α1亚型。α亚基上苏氨酸172位点的磷酸化修饰是AMPK活性所必需的。β和γ为调节亚基。其中β有β1、β22种同型异构体,γ有γ1、γ2、γ33种同型异构体。β和γ亚基在维持三聚体稳定性和作用底物特异性方面发挥重要作用。α、β、γ 3个亚基对于AMPK活化都是必需的。AMPK可通过变构激活、上游蛋白激酶的磷酸化及体内某些激素和细胞因子等途径被激活[3]。作为细胞能量重要的调节酶,AMPK系统对机体的能量状态进行着密切的监视与调节。当能量供应不足时,体内AMP/ATP比例升高,AMPK通过AMPKα亚基172位苏氨酸磷酸化或直接通过变构而激活[4]。一旦被激活,AMPK就会通过使ATP的合成增加,AMP的合成减少,同时抑制肝脏、脂肪、骨骼肌等部位的糖原、脂肪和蛋白质的合成代谢,来调节机体的能量状态,使机体度过暂时的能量危机,抵抗不利于生长的各种影响因素[5]。
2 AMPK对胰岛β细胞的促凋亡效应
研究表明,AMPK的激动剂5-氨基咪唑-4-甲酰胺核苷酸(5-aminoim idazole-4-carboxamide lβ-D-ribofuranoside,AICAR)作用于小鼠胰岛素瘤细胞株MIN6细胞,可剂量、时间依赖性激活半胱氨酸天冬氨酸特异性蛋白酶-3(cysteine aspartic acid specific protease-3,caspase-3)而诱导细胞凋亡,并且与AMPKα2敲除小鼠相比,AICAR显著增加野生型小鼠胰岛 β细胞凋亡,进一步表明AMPK 激活可导致胰岛 β细胞凋亡[6]。Ribouletchavey 等[7]报道,细胞因子 TNF-α、IFN-γ和IL-1β诱导的MIN6细胞和鼠分离的胰岛β细胞的凋亡也具有通过 AMPK通路的机制,而抑制AMPK的活性可减少CD8+ T细胞对非肥胖型糖尿病小鼠胰岛的细胞毒性效应。Kefas等[8]研究表明,低浓度葡萄糖或 AMPK激动剂刺激活化的AMPK通过激活 c-Jun氨基末端激酶(C-Jun N-terminal kinase,JNK)而诱导caspase-3依赖的细胞凋亡。Guan等[9]研究表明,Compound K通过抑制AMPK/JNK通路,保护2型糖尿病小鼠胰岛β细胞和MIN6细胞抗凋亡;及Miao等[10]发现,人类胰高血糖样类似物利拉鲁肽通过抑制AMPK/mTOR/P70S6K信号通路而增加胰岛β细胞的增殖,这些研究进一步表明了AMPK具有诱导胰岛β细胞凋亡的效应。
3 AMPK促胰岛β细胞凋亡的机制
3.1 AMPK与线粒体凋亡途径
3.1.1 AMPK 促胰岛 β细胞凋亡的线粒体途径研究表明[8],低糖条件或AICAR激活的AMPK可激活JNK,而后JNK激活caspase-3而导致细胞凋亡;其后,Cai等[11]继续研究发现,低糖条件或AICAR激活 AMPK后可引起线粒体功能紊乱和ROS的产生,同时增加促凋亡蛋白Bid、Bim等的表达,这些标志着细胞线粒体途径的发生。在对金属元素钼对胰岛 β细胞影响的研究中发现[12],长期作用或高浓度的钼可通过线粒体凋亡途径诱导胰岛RIN-m5F细胞凋亡。用AMPK和JNK的抑制剂或干扰RNA处理细胞后线粒体凋亡途径标志物细胞色素 C的释放减少,关键凋亡蛋白酶caspase-3表达降低;且JNK或AMPK的抑制剂预处理细胞后再用钼处理细胞,JNK和AMPK的磷酸化都被抑制,这些研究结果表明活化的 AMPK和JNK相互作用,相互影响,共同调控下游的线粒体凋亡通路而诱导胰岛β细胞凋亡。Kim等[13]的研究也发现AMPK的激动剂AICAR可通过加强线粒体凋亡途径的机制而加强长期高糖诱导的胰岛β细胞MIN6N8细胞的凋亡。
3.1.2 AMPK与活性氧(reactive oxygen species,ROS) ROS是一类氧的单电子还原产物,是指分子氧在还原过程中的一系列中间产物,包括以自由基形式存在和不以自由基形式存在的具有高活性的中间产物,包括氢氧自由基、过氧化物、超氧化物、单线态氧等。线粒体是产生ROS的主要场所。普遍认为低剂量的ROS就可诱导细胞凋亡。近年来研究表明,在线粒体凋亡途径中活性氧ROS扮演着重要的角色。Cai等[11]研究发现,在低糖条件或AICAR激活 AMPK的条件下,伴随线粒体功能紊乱,MIN6细胞氧自由基的形成增加,以维生素E、N-乙酰半胱氨酸、超氧化物歧化酶类似物MnTBAP等抗氧化剂处理细胞后,细胞凋亡减少,这些结果表明,AMPK的激活还可通过增加细胞活性氧的生成而诱导细胞凋亡。Kim等[13]在研究中阐明AICAR通过激活AMPK下调葡萄糖激酶(glucorinase,GCK)的表达,加强长期高糖诱导的β细胞凋亡,AICAR加强高糖条件下ROS的产生,ROS又可反过来增加AMPK的磷酸化及活性,AMPK和ROS之间相互作用,同时发生,共同的下调GCK表达,诱导细胞的凋亡,而GCK的过度表达抑制 AICAR/高糖条件下细胞的凋亡,不影响AMPK的激活,但抑制ROS的产生和线粒体跨膜电位的下降,所以ROS和GCK之间又具有相互抑制的作用。
3.1.3 线粒体凋亡通路 线粒体凋亡途径是目前研究最多的,也是细胞最主要的凋亡途径之一。各种对机体不利的刺激信号通过 Bcl-2家族蛋白的促凋亡蛋白BH3-only蛋白引起Bax蛋白移位到线粒体外膜并多聚化,形成膜通道,刺激线粒体释放细胞色素 C和 Smac(second mitochondrialderived activator of caspase),细胞色素C通过凋亡蛋白酶激活因子(Apaf-1因子)的多聚化与细胞凋亡蛋白酶caspases-9形成凋亡小体,导致下游的细胞凋亡蛋白酶的级联反应,最后使细胞中底物蛋白质被水解,而引起细胞凋亡。而凋亡蛋白抑制因子(IAP)和 Smac通过抑制和促进胱天蛋白酶的级联反应来调控细胞凋亡[14]。
综上,一些外界刺激因素(金属元素、长期高糖、低糖条件或 AMPK的激动剂等)可通过激活AMPK诱导胰岛β细胞凋亡。AMPK的激活可通过调控线粒体固有凋亡途径诱导细胞凋亡,而这一过程中产生的ROS也可诱导胰岛β细胞的凋亡,并且产生的ROS与AMPK之间又具有相互调控的作用,具体见图1。

图1 AMPK促线粒体凋亡途径
Fig. 1 The facilitation of AMPK in mitochondrial apoptosis pathway
3.2 AMPK与内质网应激凋亡途径
3.2.1 AMPK促胰岛β细胞凋亡的内质网应激途径 研究显示[15]在线粒体功能紊乱导致的胰岛 β细胞凋亡机制中发现,线粒体功能紊乱激活AMPK,增加一氧化氮(NO)的产生,诱导内质网应激,内质网应激相关凋亡因子CHOP、磷酸化的JNK和活化的caspase-12表达增加。用AMPK的抑制剂 Compound C预处理细胞或突变的阴性AMPK过度表达的细胞,伴随AMPK活性的抑制,细胞凋亡、内质网应激及NO的产生被抑制,且用NO合成基因(iNOS)的抑制剂 1400W 处理MIN6N8细胞后,线粒体功能紊乱导致的内质网应激及细胞凋亡被阻止。这提示我们,线粒体功能紊乱激活AMPK,活化的AMPK通过增加NO的产生,诱导内质网应激而导致胰岛 β细胞凋亡。Yang等[12]的研究不仅发现钼可以通过激活AMPK和JNK调控线粒体凋亡途径诱导胰岛β细胞凋亡,同时AMPK和JNK的激活也可促进内质网应激凋亡途径的发生。
3.2.2 内质网应激凋亡通路 近几年研究发现,内质网应激也可导致细胞凋亡,并且是细胞凋亡的又一重要途径。内质网应激凋亡途径,是当内质网应激严重而持续时间过长时,内质网应激不能被解除,内质网稳态不能恢复,未折叠蛋白反应(unfolded protein response,UPR)可激活细胞内的凋亡信号诱导细胞凋亡[16]。UPR主要通过CHOP(C/EBP homologous protein,C/EBP同源蛋白)、Caspase-12及JNK等通路引起细胞凋亡。
CHOP/GADD153(生长停滞及 DNA 损伤基因,growth arrest and DNA-damage-inducible gene 153)是内质网应激特异的一个转录因子,属于C/EBP转录因子家族成员[17]。感受并传递UPR信号的 3个主要的转录因子肌醇酶 1(inositol requiring enzyme-1,IRE-1)、活化转录因子-6(activating transcription factor-6,ATF-6)和蛋白激酶 R 样内质网激酶(protein kinase R-like ER kinase,PERK)都能诱导CHOP的转录。在正常情况下,CHOP主要存在于细胞质中,含量很低。当细胞处于应激状态下,CHOP的表达量大大增加并聚集在细胞核内,过量表达的 CHOP能促进细胞凋亡[18]。
Caspase-12定位于内质网外膜,是介导内质网应激凋亡的关键分子,实验发现caspase-12缺陷鼠能抵抗内质网应激引起的凋亡,而对其他死亡刺激仍可发生细胞凋亡,这说明caspase-12与内质网应激凋亡有关,而与非内质网应激诱导的凋亡无关[19]。caspase-12与其他的caspases一样以无活性的酶原形式存在。内质网应激激活caspase-12,激活的 caspase-12切割并激活 caspase-9,活化的caspase-9激活caspase-3等效应caspases,导致细胞凋亡[20]。
IRE-l介导的 X盒结合蛋白 1(X-box binding protein1,XBPl)剪接诱导的未折叠蛋白反应能促进细胞的生存,但过表达的IRE-l胞浆的酶结构域会连接接头分子 TRAF2(TNF-receptor-associated factor2)和ASK1(apoptosis signal-regulating kinase 1)共同形成IRE1-TRAF2-ASK1复合物,从而激活JNK,活化后的JNK可从细胞质转移到细胞核中。通过磷酸化激活c-JUN、c-Fos、ElK-1等转录因子而调节下游凋亡相关靶基因的表达诱导细胞凋亡[16]。
综上,一些刺激因素可激活胰岛 β细胞的AMPK,活化的AMPK引起严重而持久的内质网应激及UPR,而后通过CHOP、caspase-12及JNK等通路诱导细胞凋亡,但CHOP及JNK的下游具体通过何种途径诱导凋亡尚不清晰,具体见图2。

图2 AMPK促内质网应激凋亡途径
Fig. 2 The facilitation of AMPK in endoplasmic reticulum stress apoptosis pathway
3.3 AMPK与mTOR(mammalian target of rapamycin)
3.3.1 mTOR mTOR是雷帕霉素的靶分子,是一种丝氨酸/苏氨酸激酶,其在感受营养信号、调节细胞生长与增殖中起着关键性的作用[21]。mTOR对细胞蛋白质的合成具有重要作用[22],其下游的S6激酶(S6 kinase,S6K)和真核细胞翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1,4E-BP1)均可参与这方面的调控。其中4E-BP1的磷酸化可维持真核细胞翻译起始因子4F(eIF4F)复合体的稳定,推动蛋白翻译启动。S6K磷酸化核糖体蛋白 S6(ribosome protein S6,rpS6),后者的磷酸化激活对于核糖体的生物合成以及细胞生长有着重要作用。同时mTOR对细胞生长和增殖的调控具有重要作用[23]。mTOR能够加快细胞周期G1-S期的转换,促进细胞增殖。mTOR的mRNA的翻译产物中有与细胞周期G1-S相转换有关的蛋白质成分,mTOR的失活将会减少蛋白质翻译,抑制细胞的增殖。
3.3.2 AMPK/mTOR凋亡通路 有研究表明,在胰岛或胰岛素瘤细胞系中,mTOR的抑制剂雷帕霉素均能负向调控糖刺激的胰岛素分泌[24],而Bussiere等[25]的研究认为,雷帕霉素同时可降低胰岛细胞活力,并对其有促进凋亡作用。因此认为,作为雷帕霉素在体内的特异性靶点,mTOR信号通路对维持 β细胞功能性总质量(functional β-cell mass)具有相当重要的作用。研究表明,活化的AMPK可以磷酸化mTOR上游的关键负性调节因子结节性硬化复合体TSC1/TSC2中TSC2保守的丝氨酸位点,抑制 mTOR的活性[26]。Miao等[10]的研究发现,利拉鲁肽可通过抑制AMPK的磷酸化而增加mTOR及其下游P70S6K和4EBP1的磷酸化,提高胰岛β细胞的生存能力、促进β细胞增殖。通路阻断剂 AMPK的激动剂 AICAR或mTOR的抑制剂雷帕霉素抑制利拉鲁肽促进 β细胞增殖的效应,降低细胞的生存能力。因此我们认为,活化的AMPK可通过抑制mTOR及其下游的效应器P70S6K和4EBP1的磷酸化降低β细胞的生存能力而促进细胞凋亡。Ying等[27]的研究,Akt通过刺激mTOR可抑制AMPK介导的β细胞凋亡,也证明AMPK可通过抑制mTOR通路而促进胰岛 β细胞凋亡。Ying等还发现低糖条件或AICAR或雷帕霉素可抑制低氧诱导因子HIF-1α的合成、减少抗凋亡蛋白Bcl-2的合成,而Akt增加HIF-1α、Bcl-2的表达依赖mTOR,这些结果提示,AMPK/mTOR通路可能通过减少抗凋亡蛋白Bcl-2的合成及减少HIF-1α的合成诱导细胞凋亡。
综上,活化的AMPK可通过抑制mTOR及其下游的效应器P70S6K和4EBP1,抑制其对胰岛β细胞总质量的正调控,降低 β细胞的生存能力而促进细胞凋亡,但其下游途径尚不清楚,具体见图3。
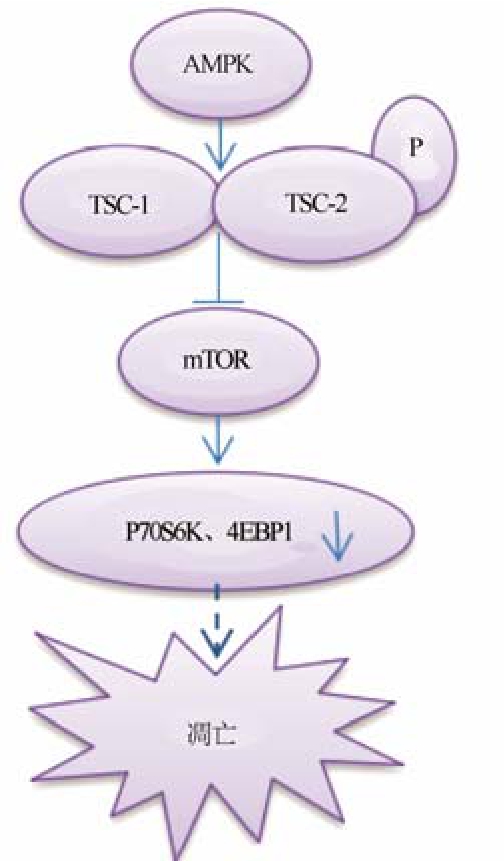
图3 AMPK/mTOR凋亡通路
Fig. 3 AMPK/mTOR apoptosis pathway
4 结语
随着人们生活水平的提高,糖尿病的发病率不断增加,已成为一种严重危害人类健康的慢性疾病。在糖尿病中,胰岛 β细胞的数量和功能的下降是1型和2型糖尿病的一个共同特征,而细胞凋亡可能是 β细胞死亡的主要形式。因此,对胰岛 β细胞凋亡机制的研究具有重要的意义。AMPK作为细胞能量稳态的关键感受器和调节器,与糖尿病的发生发展及临床治疗防治具有密切的联系,近几年研究发现其还具有诱导胰岛 β细胞凋亡的作用,其可通过线粒体固有凋亡途径、内质网凋亡途径以及 ROS、mTOR等因子诱导细胞的凋亡。而这些凋亡过程的具体机制及它们之间错综复杂的关系尚不清晰,因此,对AMPK诱导细胞凋亡机制有待进一步深入研究,而这些问题的深入研究有望为糖尿病治疗提供新的思路。
REFERENCES
[1] HARDIE D G. AMPK: positive and negative regulation, and its role in whole-body energy homeostasis [J]. Curr Opin Cell Biol, 2015(33): 1-7.
[2] XU Y Z, LIAO H, ZHANG L Y, et al. Advances in research on AMPK activators [J]. Prog Pharm Sci(药学进展), 2014(2):125-131.
[3] CHEN J C, ZHANG Y. Research progress of AMPK and hepatic glucolipid metabolism [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(7): 1062-1067.
[4] HARDIE D G, SCHAFFER B E, BRUNET A. AMPK: an energy-sensing pathway with multiple inputs and outputs [J].Trends in Cell Biology, 2016, 26(3): 190-201.
[5] SUN W Q, WANG L H, LI H, et al. Research progress on energy sensor-AMPK [J]. J Beihua Univ: Nat Sci(北华大学学报:自然), 2017, 18(2): 213-216.
[6] KEFAS B A, HEIMBERG H, VAULONT S, et al. Bb AICA-riboside induces apoptosis of pancreatic beta cells through stimulation of AMP-activated protein kinase [J].Diabetologia, 2003, 46(2): 250-254.
[7] RIBOULETCHAVEY A, DIRAISON F, SIEW L K, et al.Inhibition of AMP-activated protein kinase protects pancreatic beta-cells from cytokine-mediated apoptosis and CD8+T-cell-induced cytotoxicity [J]. Diabetes, 2008, 57(57):415-423.
[8] KEFAS B A, CAI Y, LING Z, et al. AMP-activated protein kinase can induce apoptosis of insulin-producing MIN6 cells through stimulation of c-Jun-N-terminal kinase [J]. J Mol Endocrinol, 2003, 30(2): 151-161.
[9] GUAN F Y, GU J, LI W, et al. Compound K protects pancreatic islet cells against apoptosis through inhibition of the AMPK/JNK pathway in type 2 diabetic mice and in MIN6 β-cells [J]. Life Sciences, 2014, 107(1/2): 42-49.
[10] MIAO X Y, GU Z Y, LIU P, et al. The human glucagon-like peptide-1 analogue liraglutide regulates pancreatic beta-cell proliferation and apoptosis via an AMPK/mTOR/P70S6K signaling pathway [J]. Peptides, 2013, 39(1): 71-79.
[11] CAI Y, MARTENS G A, HINKE S A, et al. Increased oxygen radical formation and mitochondrial dysfunction mediate beta cell apoptosis under conditions of AMP-activated protein kinase stimulation [J]. Free Radic Biol Med, 2007, 42(1):64-78.
[12] YANG T Y, YEN C C, LEE K I, et al. Molybdenum induces pancreatic β-cell dysfunction and apoptosis via interdependent of JNK and AMPK activation-regulated mitochondriadependent and ER stress-triggered pathways [J]. Toxicol Appl Pharmacol, 2016(294): 54-64.
[13] KIM W H, LEE J W, SUN Y H, et al. AICAR potentiates ROS production induced by chronic high glucose: Roles of AMPK in pancreatic β-cell apoptosis [J]. Cell Signal, 2007, 19(4):791-805.
[14] ZHOU J J. Progress in mitochondrial pathways of apoptosis [J].Chem Life(生命的化学), 2002, 22(6): 506-508.
[15] LEE J W, KIM W H, YEO J, et al. ER stress is implicated in mitochondrial dysfunction-induced apoptosis of pancreatic beta cells [J]. Mol Cell, 2010, 30(6): 545-549.
[16] 杨方万,穆茂媛,肖娟娟,等. 内质网应激诱导细胞凋亡机制的研究进展[J]. 医学研究杂志, 2014, 43(10): 176-186.
[17] LI Y M, ZANG Y, GUO Y S, et al. Advances of insights into the roles of CHOP-induced apoptosis in ER stress [J]. Prog Mod Biomed(现代生物医学进展), 2016, 16(11): 2178-2182.
[18] XU B, LI L H, YANG T Y, et al. Effect of manganese on stress signaling molecules of endoplasmic reticulum in neural cells [J]. Pract Prev Med(实用预防医学), 2013, 20(10): 5-7.
[19] XIA Y P, WANG L H, FAN Y R, et al. Cell apoptosis and endoplasmic reticulum stress [J]. Pharm Clin Res(药学与临床研究), 2010, 18(3): 291-293.
[20] ZHANG Q, LIU J, CHEN S, et al. Caspase-12 is involved in stretch-induced apoptosis mediated endoplasmic reticulum stress [J]. Apoptosis, 2016, 21(4): 432-442.
[21] ALBERT V, HALL M N. mTOR signaling in cellular and organismal energetics [J]. Curr Opin Cell Biol, 2015, 33(1):55-66.
[22] LAPLANTE M, SABATINI D M. mTOR signaling in growth control and disease [J]. Cell, 2012, 149(2): 274-293.
[23] 宋辉, 袁洪亮. mTOR信号通路研究进展[J]. 生物技术世界,2015(8): 9.
[24] BARLOW A D, NICHOLSON M L, HERBERT T P.Evidence for rapamycin toxicity in pancreatic beta-cells and a review of the underlying molecular mechanisms [J]. Diabetes,2013, 62(8): 2674-2682.
[25] BUSSIERE C T, LAKEY J R, SHAPIRO A M, et al. The impact of the mTOR inhibitor sirolimus on the proliferation and function of pancreatic islets and ductal cells [J].Diabetologia, 2006, 49(10): 2341-2349.
[26] RAJU R M, UNNIKRISHNAN M, RUBIN D H, et a1.Myco-bacterium tuberculosis ClpP1 and ClpP2 function together in protein degradation and are required for viability in vitro and during infection [J]. PLoS Pathog, 2012, 8(2):e1002511.
[27] YING C, WANG Q, LING Z, et al. Akt activation protects pancreatic beta cells from AMPK-mediated death through stimulation of mTOR [J]. Biochem Pharmacol, 2008, 75(10):1981-1993.