黄酮类化合物具有抗氧化、抑菌、抗炎等诸多生物活性[1],属于植物次级代谢产物,不能在动物细胞中合成[2]。通常,黄酮类化合物可被应用于药物制剂或保健产品中,供人类使用。但由于黄酮类化合物的极性大、脂溶性差导致其口服吸收难,生物利用度低,限制了其在临床方面的应用。因此,关于提高黄酮类成分在体内的吸收及生物利用度等方面的研究越来越受到重视。磷脂为两性分子,一端为亲水的含氮或磷的头,另一端为疏水(亲油)的长烃基链。将磷脂与黄酮在一定条件制备成黄酮磷脂复合物是一种新型的技术。该复合物呈无定形态,增强了黄酮的脂溶性,促进其在消化道中的吸收,提高了生物利用度[3],为黄酮类活性成分在临床上的应用提供了极大便利。本文综述了国内外黄酮磷脂复合物的制备、药动学及功能活性应用研究,旨在为日后黄酮类化合物的进一步开发利用提供依据。
1 黄酮磷脂复合物的制备与鉴定
目前,磷脂复合物在中药制剂研究方面贡献突出,它与脂质体是完全不同的[4],结构见图1。在脂质体中,活性药物成分溶解在磷脂形成的腔的中心部分,彼此之间没有通过化学键结合。而磷脂复合物的形成是由于磷脂结构中磷原子上羟基中的氧原子有较强的得电子倾向,而氮原子有较强的失电子倾向。因此,在一定条件下,具有给电子或接受电子能力的药物分子可与磷脂分子间通过电荷迁移力、氢键作用以及范德华作用力形成磷脂复合物。黄酮类化合物和磷脂的化学结构式见图2,黄酮类化合物结构中电负性较强的部位,在一定条件下与磷脂带正电荷的极性端发生相互作用,通过氢键或分子间作用力而结合并有序排列形成多层囊状形式磷脂复合物,且使得磷脂的两性作用不被破坏。此外,磷脂复合物的制备工艺较脂质体简便,成本低廉,适合用于规模化生产。
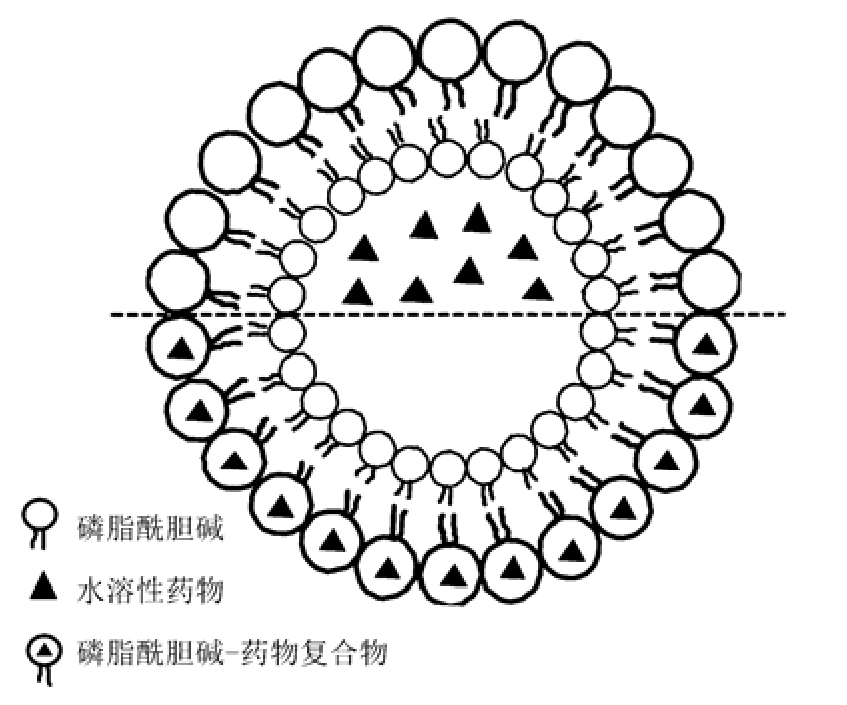
图1 脂质体(上)与磷脂复合物(下)的分子结构比较
Fig. 1 Major difference between liposome (up) and phytosome (down)

图2 黄酮类化合物C6-C3-C6母核结构图(A)和磷脂酰胆碱的化学结构式(B)
Fig. 2 The structure of flavonoids (A) and phosphatidylcholine(B)
黄酮磷脂复合物的制备以溶剂法为主,即在一定的溶剂介质中进行,一般选择使用非质子溶剂,如: 甲醇、无水乙醇、四氢呋喃、丙酮和氯仿等。黄酮磷脂复合物的复合率除受体系反应溶剂影响以外,还受黄酮与磷脂的投料比、反应物浓度、反应温度、反应时间等因素影响。为获得最佳工艺条件,提高黄酮磷脂复合物的复合率,通常采用单因素、正交等试验设计方法进行制备条件优化。例如,钱晓翠等[5]通过正交试验设计研究了制备参酮IIA磷脂复合物的最佳工艺条件为:丹参酮IIA与磷脂的投料比(摩尔比)为1∶1.5,以乙酸乙酯为反应溶剂,丹参酮 IIA浓度为0.5 mg·mL-1,反应温度为 60 ℃,反应时间为 2 h。许鹭等[6]利用乙醇提取法结合大孔吸附树脂分离纯化技术,从柚皮中分离纯化出纯度为 92.44%柚皮苷,再利用制得的柚皮苷与卵磷脂按质量比1∶2混合,在四氢呋喃介质中室温反应5 h,制得柚皮苷卵磷脂该复合物。张胜海等[7]与石森林等[8]利用单因素和正交试验方法对制备条件进行优化,最终以无水乙醇作为反应溶剂,按投料比1∶2,于 30 ℃下反应至反应液澄清,分别制得柿叶总黄酮磷脂复合物和山楂叶总黄酮磷脂复合物,其复合率均达 93%以上,可用于工业化生产。利用黄酮类化合物经与磷脂复合后溶解度的改变,可实现黄酮类化合物磷脂复合物的分离纯化。例如黄酮类化合物几乎不溶于氯仿,而磷脂复合物易溶于氯仿,待反应结束后,减压除去反应溶剂,再加入适量氯仿溶解后过滤,即可将复合物和未反应的化合物分离。
黄酮类化合物经制备形成黄酮磷脂复合物后,其理化性质(如脂溶性、熔点、吸收系数、光谱特征)和生物学活性等均发生很大程度的改变,例如,脂溶性提高,相变温度发生改变,呈无定型特征,其红外光谱中的吸收峰也发生相应变化。研究表明[5-6,9-10],采用差式扫描量热分析(DSC)、X-射线衍射分析(X-ray)、红外光谱分析(IR)可对所制备的黄酮磷脂复合物进行理化性质验证。此外,核磁共振氢谱技术也可对该复合物进行结构验证。例如,孟庆国等[9]按照1∶1摩尔比将葛根素和磷脂溶于 95%乙醇中制得葛根素磷脂复合物,利用核磁共振氢谱技术分析比较了葛根素磷脂复合物与物理混合物之间的显著差异,并对该复合物进行了结构验证。另外,高效液相色谱技术可用于对黄酮磷脂复合物进行含量测定。张卿等[10]以橙皮苷和大豆卵磷脂为原料,二甲亚砜-甲醇混合溶液为反应溶剂,在50 ℃下搅拌1 h,制得橙皮苷磷脂复合物,并建立了利用高效液相色谱对橙皮苷磷脂复合物进行含量测定的方法。这也为后续的黄酮磷脂复合物功能活性的研究提供了量化的基础。
2 黄酮磷脂复合物促生物利用度研究
磷脂是一种具有亲水性和亲油性的两亲性分子,结构中存在极性与非极性部分,类似于哺乳动物的细胞膜,因而与人体的生理系统具有高度兼容性。磷脂作为一个特殊的载体,能在不破坏细胞膜磷脂双分子层的情况下,以非能量依赖的方式穿透管腔吸收细胞的脂膜[11],见图3 ,达到传递黄酮类化合物药物的效果,且在体内具有一定的缓释功能,整个迁移过程对细胞无毒性作用[12]。基于国内外对黄酮磷脂复合物的药动学研究发现,黄酮磷脂复合物既能够有效地提高黄酮类药物的脂溶性,增强药物吸收,又能降低药物不良反应发生率,提高药物的生物利用度[3,13-14]。
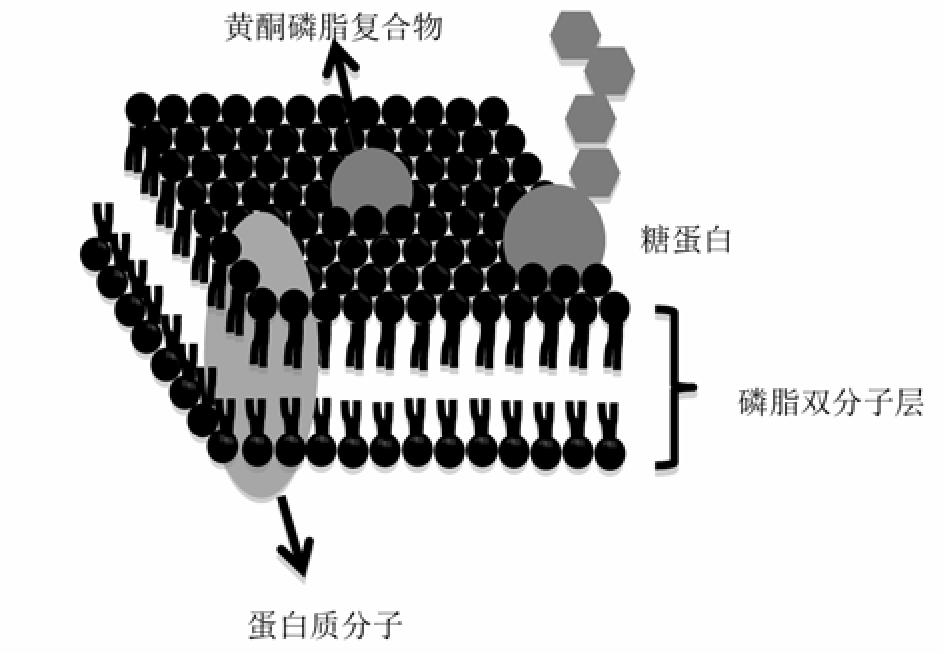
图3 黄酮磷脂复合物与生物膜的相互作用
Fig. 3 Interaction of the flavonoid phospholipid complex with the biological membrane
Jin等[15]对淫羊藿次苷和淫羊藿次苷磷脂复合物在Caco-2肠道细胞模型的吸收效果进行比较。结果表明,淫羊藿次苷磷脂复合物能明显增加淫羊藿次苷的运输率,且形成淫羊藿次苷磷脂复合物后,淫羊藿次苷的外排率下降23.5%。由此可见,磷脂复合物可以增加肠道细胞对淫羊藿次苷的吸收。童丽娇等[16]研究了山楂叶总黄酮磷脂复合物在大鼠体小肠吸收动力学特征。采用大鼠体肠单向灌流模型,以山楂叶总黄酮原料药为对照,考察药物浓度与 pH值对山楂叶总黄酮磷脂复合物肠吸收的影响。结果表明,在总黄酮浓度和pH值相同的条件下,山楂叶总黄酮磷脂复合物在大鼠体肠中的吸收明显优于山楂叶总黄酮。李楠等[17]研究了黄芩苷磷脂复合物在大鼠胃、肠的吸收动力学特征。采用大鼠体胃、肠吸收模型进行灌注法给药,以高效液相色谱法测定并比较黄芩苷、黄芩苷磷脂复合物、黄芩苷和卵磷脂的物理混合物在胃、全肠段及分肠段的吸收代谢特性。结果显示,黄芩苷、黄芩苷磷脂复合物以及黄芩苷和卵磷脂的物理混合物在胃的每小时吸收百分率差异不大;但在小肠全肠段,黄芩苷磷脂复合物的吸收程度明显优于黄芩苷以及黄芩苷和卵磷脂的物理混合物,且在十二指肠最优。由此可见,当黄芩苷制备成磷脂复合物后,可促进其在胃肠道的吸收率。
Wang等[18]制备了总黄酮磷脂复合物(TFH-PC),发现溶解度与总黄酮(TFH)相比提高了22.0~26.8倍。为大鼠口服TFH-PC后,发现TFH-PC中异鼠李素、山奈酚、槲皮素的生物利用度相对于TFH为223%,172%和242%。其生物利用率的提高主要是由于黄酮制成复合物后溶解度和溶出速率增加。Li等[19]制备了松果菊苷磷脂复合物,发现该复合物与松果菊苷相比亲脂性增强。为大鼠口服给药后,在不同时间下采集大鼠血浆,利用高效液相色谱法测定其中松果菊苷的含量。结果显示,与松果菊苷单独或物理混合相比,复合物中的松果菊苷在肠道中的吸收率改善了 2.82倍,有效渗透系数增加了3.39倍,生物利用度显著提高。Zhang等[20]制备了山萘酚磷脂复合物,发现山奈酚磷脂复合物较山奈酚单体具有更高的脂溶性,且在Sprague-Dawley大鼠中山萘酚复合物的生物利用度较单体山萘酚显著提高。由此可见,黄酮经磷脂复合后,其脂溶性显著提高,增强了在肠道内的吸收代谢,提高了生物利用度。
2.1 不同制剂形式对黄酮磷脂复合物生物利用度的影响
黄酮磷脂化合物的制剂形式(如水分散体、固体分散体、油制剂等),对其生物利用度有一定的影响。吴先闯等[21]比较了姜黄素磷脂复合物以水分散体、固体分散体及油制剂形式给药时对SD大鼠口服吸收生物利用度的影响。结果显示,姜黄素磷脂复合物以油制剂给药时,可显著地提高其生物利用度,这可能与其在油中有更高的稳定性有关。
为了研究芒果苷磷脂复合物的口服吸收情况,张杰等[22]制备了芒果苷磷脂复合物的不同油制剂形式,比较不同复合物油制剂在大鼠灌胃后的生物利用度。结果显示,芒果苷磷脂复合物在水中及正辛醇中的溶解性能较芒果苷明显改善,且磷脂复合物溶解在油酸和中链甘油三酯的混合油中的药动学参数分别为 Cmax为(2391.43±711.40)ng·mL-1和 AUC0~12h为(466.54±39.41)×103ng·mL-1·min-1,是芒果苷复合物水混悬液的5.76和3.17倍。由此可见,芒果苷复合物在油酸和中链脂肪酸酯混合油中有更高的相对生物利用度,这可能与该混合油增加了芒果苷复合物的溶解性并具有促进其吸收的作用有关。
2.2 粒径大小对黄酮磷脂复合物生物利用度的影响
除制剂形式影响黄酮磷脂复合物的生物利用度外,复合物的粒径大小对其在生物体内的利用度也有很大影响。一般来说,粒径越小,利用度越高。Jin等[23]制备了纳米级宝藿苷I磷脂复合物,并与普通尺寸的宝藿苷I磷脂复合物相比,发现大鼠口服后,粒径越小越易穿过Caco-2细胞单层并快速吸收。一种纳米尺寸为(81±10)nm的宝藿苷I磷脂复合物的相对口服生物利用度为 342%。然而,一种尺寸为(227.3±65.2)nm的宝藿苷 I磷脂复合物的口服相对利用度为165%。因此,可以通过减少磷脂复合物的颗粒尺寸到纳米水平,来提高口服生物利用度,从而提高其潜在的临床应用价值。
2.3 多糖包合物对黄酮磷脂复合物生物利用度的影响
有研究表明多糖包合物对黄酮磷脂复合物生物利用度有改善效果。例如,罗见春等[24]比较了姜黄素羟丙基-β-环糊精磷脂复合物、姜黄素羟丙基-β-环糊精包合物、姜黄素磷脂复合物、姜黄素原料药在大鼠体内的药动学特征。对SD大鼠以口服灌胃形式给予这四类药物制剂,并于不同时间点对大鼠进行眼底静脉丛取血,采用 HPLC测定血浆中姜黄素的浓度。结果显示,姜黄素羟丙基-β-环糊精磷脂复合物、姜黄素羟丙基-β-环糊精包合物、姜黄素磷脂复合物、原料药姜黄素的生物利用度倍数比为:5.89∶5.03∶3.95∶1。可见羟丙基-β-环糊精包合和磷脂复合物均提高姜黄素的生物利用度,其中姜黄素羟丙基-β-环糊精磷脂复合物效果最高。
3 磷脂复合物增强功能活性
目前,国内外对黄酮磷脂复合物的开发及功能活性应用的研究越来越多。基于黄酮磷脂复合物较黄酮类化合物具有更为优良的功能活性,此类复合物可被用作护肝、促进细胞增殖、减少细胞氧化损伤、降尿酸、降血脂、改善记忆力等活性药物,并具备开发为临床药物的潜力。
3.1 护肝作用
黄酮类化合物,如水飞蓟宾、槲皮素、木犀草素等对肝脏都有一定的保护功能。但由于其不易被肠道吸收,而造成利用率低,效果不够显著等问题。而黄酮磷脂复合物可增强其脂溶性,提高肠道吸收及生物利用度,从而改善黄酮类药物的护肝效果。
Kidd等[25]对近年来水飞蓟素磷脂复合物的体外与体内的护肝机制研究进行了综述。水飞蓟素含黄酮类化合物(以水飞蓟宾为主,其次是水飞蓟、水飞蓟亭),可清除肝内自由基,具有良好的护肝活性。然而水飞蓟素不易被小肠上皮细胞吸收。经研究表明,水飞蓟素磷脂酰胆碱复合物可提高传统的水飞蓟素的生物利用度,增强其对肝脏的保护功能,并且不良反应低,可用于临床药物的开发。Grattagliano等[26]研究了水飞蓟宾磷脂复合物对大鼠脂肪肝退化与线粒体氧化的作用机制。结果表明,水飞蓟宾磷脂复合物可有效减少肝细胞脂肪的沉积、NO衍生物的生成,以及线粒体的改变,保持肝脏中的谷胱甘肽和硫氧还蛋白抗氧化的活性。Zhang等[27]制备了槲皮素磷脂复合物,并分别比较了槲皮素和槲皮素磷脂复合物对四氯化碳(CCl4)诱导的急性肝损伤的SD大鼠的保护作用。结果表明,二者都具保肝作用,且槲皮素磷脂复合物的护肝效果与槲皮素相比显著增强。Khan等[28]制备并研究了木犀草素磷脂复合物在大鼠体内的药动学及对GalN/LPS诱导的肝损伤的保护作用。结果发现,磷脂复合物使木犀草素的生物利用度提高到535.31%,且木犀草素磷脂复合物对炎症性肝损伤的疗效较木犀草素更高。
3.2 促进细胞增殖作用
黄酮类化合物,如柚皮苷、槲皮素,具有促进细胞增殖和分化的作用。韦敏等[29]采用体外培养法从乳鼠中分离出成骨细胞,然后用不同浓度的柚皮苷、柚皮苷磷脂复合物作用于成骨细胞,并利用四甲基偶氮唑蓝比色法和通过测定碱性磷酸酶含量法来观察其对成骨细胞增殖和分化功能的影响。结果发现,柚皮苷、柚皮苷磷脂复合物均能促进成骨细胞增殖和分化,具有较好的抗骨质疏松活性。其中,柚皮苷磷脂复合物稍强于柚皮苷,但两者无显著性差异。Xu等[30]制备了槲皮素磷脂复合物并作用于人体ARPE-19细胞。结果显示,槲皮素磷脂复合物可以有效促进 ARPE-19细胞增殖,当槲皮素磷脂复合物的浓度达400 μmol·L-1时,ARPE-19 细胞增殖率达 78.89%;而且槲皮素磷脂复合物还可以减少ARPE-19细胞的凋亡。当槲皮素磷脂复合物浓度达 200 μmol·L-1时,ARPE-19细胞的凋亡率减少到3.1%。
3.3 减少氧化损伤作用
黄酮类化合物具有抗氧化作用,可减少细胞的氧化受损程度。黄酮类化合物经磷脂复合后,其抗氧化效果得到明显地提高。例如,张锦等[31]研究了银杏黄酮磷脂复合物对大鼠缺血再灌注状态下血管内皮的保护作用。结果发现,大鼠在心肌缺血30 min再灌注120 min状态下,银杏黄酮磷脂复合物可通过减少自由基对内皮细胞的氧化损伤和内源性血管活性物质血浆内皮素(ET1)释放,显著降低血清NO含量和ET1水平,同时改善血管内皮超微结构的破坏程度,减少大鼠心肌再灌注血管内皮的氧化损伤,且效果较银杏黄酮组显著。Chen等[32]研究了水飞蓟宾及其磷脂酰胆碱复合物对脑缺血再灌注损伤的大鼠脑组织含水量、病理学改变、血浆丙二醛含量的影响。结果表明,水飞蓟宾磷脂酰胆碱复合物提高了水飞蓟宾在胃肠道的吸收及生物利用度,而且磷脂酰胆碱与水飞蓟宾产生了协同抗自由基、抗脂质过氧化作用,从而使其水飞蓟宾磷脂酰胆碱复合物药效作用优于水飞蓟宾。
3.4 降尿酸作用
Zhang等[33]使用钾氧嗪酸诱导的大鼠高尿酸血症模型,研究桑色素磷脂复合物的降尿酸疗效。结果表明,桑色素磷脂复合物卓越的降尿酸疗效是由于该复合物可抑制肝细胞中黄嘌呤脱氢酶/黄嘌呤氧化酶(XDH/XO)的mRNA表达,并能通过调节葡萄糖转运蛋白(mGLUT9),肾有机阴离子转运蛋-1(mOAT1)和尿酸转运蛋白(mURAT1)的 mRNA水平来减少尿酸盐的重吸收。由此可见,桑色素磷脂复合物可作为治疗高尿酸血症的口服活性剂。
3.5 降血脂作用
黄酮类化合物由于具有显著的清除自由基和抗氧化作用,可改善脂质代谢,通过降低血三酰甘油和总胆固醇的含量而降低心脑血管疾病的发病率和死亡率。闫莉萍等[34]研究发现葛根素可显著降低高胆固醇大鼠模型的血清总胆固醇和肝脏总胆固醇,具有保护心肌,调节血脂和舒血管的作用。姜洪芳等[35]研究了忍冬叶黄酮磷脂复合物对高脂饲料喂养鹌鹑致高血脂症的影响,结果发现,忍冬叶黄酮磷脂复合物能够减轻肝细胞水肿和脂肪浸润,显著降低脂肪含量(P<0.05),具有降低血脂和抗脂肪肝的作用。
3.6 改善记忆功能
王芳等[36]采用避暗法和水迷宫法评价银杏叶提取物磷脂酰胆碱复合物对血管性痴呆模型大鼠学习记忆的影响,并测定大鼠海马组织中单胺氧化酶及超氧化物歧化酶活性和丙二醛的含量。结果显示,银杏叶提取物和银杏叶提取物磷脂酰胆碱复合物均能改善血管性痴呆大鼠学习记忆功能,而且银杏叶提取物磷脂酰胆碱复合物改善记忆的功能显著强于相同剂量的银杏叶提取物。
3.7 其他
黄酮类磷脂复合物还具有促进伤口愈合、抗肿瘤等效果。例如,Du等[37]利用大鼠皮肤创伤模型,对姜黄素和姜黄素磷脂复合物对伤口愈合的效果进行研究。结果表明,姜黄素磷脂复合物比姜黄素表现出更高的伤口愈合效果,这可能与姜黄素磷脂复合物具有较高的脂溶性有关。姜黄素磷脂复合物可用来作为一种有效的伤口辅料配方。Giacomelli 等[38]研究发现水飞蓟素磷脂复合物还能增强顺铂的抗肿瘤作用, 通过体内试验发现单独应用顺铂(6 mg·kg-1)的肿瘤重量抑制率为44%,而加用水飞蓟素磷脂复合物(1800 mg·kg-1)可使顺铂的肿瘤质量抑制率提高到68%。
4 总结与展望
综上所述,磷脂复合物能够改善生物膜的透过性,在增加生物利用度的同时能降低药物不良反应,将黄酮类活性成分制备成磷脂复合物用来增强其药效,这既是一种新的思路,又是一种有效的手段。目前研究表明,黄酮磷脂复合物同时具备开发为动物用药和人类临床药物的潜力。然而,相关研究多集中于磷脂复合物的制备、理化性质鉴定、临床前药动学、药效学研究,对于临床疗效研究较少。因此,黄酮磷脂复合物的临床药效研究有待进一步深入,使其准确的临床价值得到证实和开发,从理论转化为实际,为人类健康事业做出贡献。
REFERENCES
[1] NIJVELDT R J, VAN NOOD E, VAN HOORN D E, et al.Flavonoids: A review of probable mechanisms of action and potential applications [J]. Am J Clin Nutr, 2001, 74(4):418-425.
[2] TARAHVOSKY Y S, KIM U A, YAGOLNIK E A, et al.Flavonoid-membrane interactions: Involvement of flavonoid-metal complexes in raft signaling [J]. Biochimica et Biophysica Acta, 2014, 1838 (5): 1235-1246.
[3] WU H Y, LONG X Y, CHEN L, et al. Phospholipid complex and its effect on membrane transport of active constituents of Chinese materia medica [J]. Chin Tradit Herb Drugs(中草药),2012, 43 (2): 393-398.
[4] SEMALTY A, SEMALTY M, SINGH M, et al.Supramolecular phospholipids-polyphenolics interactions: The phytosome strategy to improve the bioavailability of phytochemicals [J]. Fitoterapia, 2010, 81(5): 306-314.
[5] QIAN X C, LI W, LI J S. Preparation and identification of tanshinone ⅡA phospholipid complex [J]. J Nanjing Univ Tradit Chin Med(南京中医药大学学报), 2015, 31(3):269-273.
[6] 许鹭. 柚皮中柚皮苷的提取、分离纯化及其固体分散体与卵磷脂复合物的制备及表征[D]. 广州: 华南理工大学.
[7] ZHANG S H, WANG Y Z, DUAN F P, et al. Preparation technology for phospholipids complex of total flavonoids from leaves of Diospyros kaki [J]. Chin Tradit Herb Drugs(中草药),2013, 44(2): 3136-3140.
[8] 石森林, 高敏, 童丽姣, 等. 山楂叶总黄酮磷脂复合物的制备工艺[J]. 中华中医药刊, 2013, 28 (1): 243-246.
[9] MENG Q G, GAO E, WANG R Q, et al. The study on puerarin phytosomes preparation and its1H-NMR &TLC [J]. J Weifang Med Coll(潍坊医学院学报), 2001, 23(1): 4-5.
[10] ZHANG Q, GUAN H Y, JIN Z, et al. Determination of hesperidin content in Hesperidin-Phospholipid Complex by HPLC [J]. China Pharm(中国药业), 2015(13): 30-31.
[11] KHAN J, ALEXANDER A, AJAZUDDIN, et al. Recent advances and future prospects of phyto-phospholipid complexation technique for improving pharmacokinetic profile of plant actives [J]. J Control Release, 2013, 168(1): 50-60.
[12] GODA T, GOTO Y, ISHIHARA K. Cell-penetrating macromolecules: Direct penetration of amphipathic phospholipid polymers across plasma membrane of living cells[J]. Biomaterials, 2010, 31(8): 2380-2387.
[13] SINGH D, RAWAT M S, SEMALTY A, Semalty M.Rutin-phospholipid complex: an innovative technique in novel drug delivery system- NDDS [J]. Curr Drug Deliv, 2012, 9(3):305-314.
[14] ZHENG L, LI Y, DENG S Q, et al. The effect on oral absorption of phospholipid compound of traditional Chinese medicine [J]. Chin J Antibiot(中国抗生素杂志), 2015, 40(6):468-473.
[15] JIN X, ZHANG Z, SUN E, et al. Preparation of icariside II-phospholipid complex and its absorption across Caco-2 cell monolayers [J]. Pharmazie, 2012, 67(4): 293-298.
[16] TONG L J, GAO M, WANG X B, et al. Study on the adsorption kinetics of Hawthorn Leaves Flavonoids Phospholipids complex in rats intestine[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2014, 31(8): 921-926.
[17] LI N, FENG L L, JIANG X H, et al. The absorption of Baicalin Phospholipid complex in rat stomach and intestine [J].Chin Pharm J(中国药学杂志), 2016, 51(12): 994-998.
[18] WANG H, CUI Y, FU Q, et al. A phospholipid complex to improve the oral bioavailability of flavonoids [J]. Drug Dev Ind Pharm, 2015, 41(10): 1693-1703.
[19] LI F, YANG X, YANG Y, et al. Phospholipid complex as an approach for bioavailability enhancement of echinacoside [J].Drug Dev Ind Pharm, 2015, 41 (11): 1777-1784.
[20] ZHANG K, GU L, CHEN J, et al. Preparation and evaluation of kaempferol-phospholipid complex for pharmacokinetics and bioavailability in SD rats [J]. J Pharm Biomed Anal,2015(114): 168-175.
[21] WU X C, HAO H J, ZHANG Y Z, et al. The bioavailability influence of oral curcumin-phospholipid complex preparations on SD rats [J]. Chin Tradit Pat Med(中成药), 2015, 37(10):2163-2166.
[22] ZHANG J, SUN M J, PING Q N, et al. Enhanced oral bioavailability of mangiferin phospholipid complexes prepared by its oil-based formulations in rats [J]. Chin J New Drugs(中国新药杂志), 2014, 23(9): 1092-1098.
[23] JIN X, ZHANG Z, SUN E, et al. Preparation of a nanoscale baohuoside I-phospholipid complex and determination of its absorption: in vivo and in vitro evaluations [J]. Int J Nanomed,2012(7): 4907-4916.
[24] LUO J C, HU X Y, WU J Y, et al. Pharmacokinetics study on Curcumin Hydroxypropyl-β-Cyclodextrin Phospholipid Complex in rats [J]. J Chin Med Mater(中药材), 2015, 38(3):572-575.
[25] KIDD P, HEAD K. A A review of the bioavailability and clinical efficacy of milk thistle phytosome: a silybin-phosphatidylcholine complex (Siliphos). [J]. Altern Med Rev, 2005, 10(3): 193-204.
[26] GRATTAGLIANO I, DIOGO C V, MASTRODONATO M, et al. A silybin-phospholipids complex counteracts rat fatty liver degeneration and mitochondrial oxidative changes [J]. World J Gastroenterol, 2013, 19 (20): 3007-3017.
[27] ZHANG K, ZHANG M, LIU Z, et al. Development of quercetin-phospholipid complex to improve the bioavailability and protection effects against carbon tetrachloride-induced hepatotoxicity in SD rats [J]. Fitoterapia, 2016(113): 102-109.
[28] KHAN J, SARAF S, SARAF S. Preparation and evaluation of luteolin–phospholipid complex as an effective drug delivery tool against GalN/LPS induced liver damage [J]. Pharm Dev Technol, 2016, 21(4): 475-486.
[29] WEI M, YANG Z L, LI P. Comparative study on the effects of naringin and phospholipids complex on osteoblasts cultured in vitro and in situ intestinal absorption [J]. Chin J Nat Med(中国天然药物), 2007, 5(5): 366-369.
[30] XU X, YU H, YANG Y, et al. Quercetin phospholipid complex significantly protects against oxidative injury in ARPE-19 cells associated with activation of Nrf2 pathway [J].Eur J Pharmacol, 2016(770): 1-8.
[31] ZHANG J, LUO S, GAO E. Ginkgo flavonoid-phospholipid complex study on the protective effect of vascular endothelial[J]. J Mathematic Med(数理医药学杂志), 2013, 26(2):201-204.
[32] CHEN Z, XU J, ZHANG G. Protective reactione of silybin-phosphatidylcholine compound on cerebral ischemic reperfusion injury in rats [J] . Chin J Clin Rehabil(中国临床康复), 2004, 8(22): 4629-4631 .
[33] ZHANG J, SHUAI X, LI J, et al. Biodistribution,hypouricemic efficacy and therapeutic mechanism of morin phospholipid complex loaded self-nanoemulsifying drug delivery systems in an experimental hyperuricemic model in rats [J]. J Pharm Pharmacol, 2016, 68(1): 14-25.
[34] 闫莉萍. 葛根素心肌保护, 调节血脂和舒血管的药理作用机制[D]. 中国协和医科大学, 北京.
[35] JIANG H F, SHI B J, ZHAO B T, et al. Effect of flavonoid-phospholipid complex from Lonicera japonica on hyperlipidemia [J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2011, 17(18): 165-168.
[36] WANG F, YU E X, WU D F. The protective effects of Ginkgo biloba extract phosphatidylcholide complex on the learning amd memory impairment in cerebral ischemia rats [J]. Chin Pharm J(中国药学杂志), 2004, 39(2): 114-116.
[37] DU L, FENG X, XIANG X, et al. Wound Healing Effect of an in Situ Forming Hydrogel Loading Curcumin-Phospholipid Complex [J]. Curr Drug Deliv, 2016, 13(1): 76-82.
[38] GIACOMELLI S, GALLO D, APOLLONIO P, et al. Silybin and its bioavailable phospholipid complex (IdB 1016)potentiate in vitro and in vivo the activity of cisplatin [J]. Life Sci, 2002, 70(12): 1447-1459.