苦豆子别名苦豆根、苦甘草,是豆科槐属植物苦豆子Sophora alopecuroides L.的干燥全草、根及种子。苦豆子中含有生物碱类、黄酮类、挥发油类以及甾类、酚类等多种化学成分,能够发挥抗炎、抗肿瘤、抗病毒及免疫调节等作用[1-3]。现有研究表明,苦豆子中的生物碱类物质是通过作用于 T淋巴细胞、B淋巴细胞、巨噬细胞及胞内信使物质的方式起到免疫抑制的作用[4]。本实验室利用提取过生物碱的剩余苦豆子药渣提取多糖成分,对苦豆子的二次开发利用起到了重要作用[5]。现有研究虽已证实多糖类物质能够起到增强机体免疫的功能[6],但苦豆子多糖(polysaccharide extracted from Sophora alopecuroides,SAP)对免疫功能的调节作用尚未见详细报道。因此,本研究以MTT法体外观察SAP在不同浓度对小鼠脾淋巴细胞增殖的影响,并以贞芪扶正胶囊为阳性对照,探讨 SAP对环磷酰胺(cytoxan,CTX)所致免疫抑制小鼠的免疫调节作用,为开发SAP免疫调节剂提供实验依据。
1 仪器与试剂
1.1 动物
昆明种(KM)小白鼠,Ⅱ级实验动物,♀♂兼用,购自北京大学医学部实验动物科学部,实验动物合格证编号:0190751,许可证编号:SCXK(京)2006-2009。
1.2 药物与试剂
SAP,由天津市医药科学研究所制剂中心提供;RPMI1640 培养基(Gibco 公司,批号:8117203);FCS新生小牛血清(杭州四季青生物工程有限公司,批号:090605);四甲基偶氮哇盐(MTT,Amresco公司,批号:03-2014);脂多糖(Sigma公司,批号:026M4808V);贞芪扶正胶囊(甘肃扶正药业科技股份有限公司,批号:090420);CTX(江苏恒瑞医药股份有限公司,批号:06052021,规格:每支200 mg);印度墨汁(北京中预卫科生物工程公司,批号:20101029);Na2CO3(天津市化学试剂批发公司);都氏试剂:碳酸氢钠1.00 g,氰化钾0.05 g,高铁氰化钾0.20 g,加蒸馏水至1 000 mL;Alesver溶液:葡萄糖1.87 g,柠檬酸钠0.80 g,氯化钠0.42 g,加蒸馏水至100 mL;绵羊红细胞(SRBC)混悬液[7]。
1.3 仪器
752紫外光栅分光光度计(上海精密仪器厂);倒置相差显微镜(日本OLYMPUS);超净工作台(苏州安泰空气技术有限公司);酶联免疫检测仪(芬兰Labsystems Dragon);CO2孵箱(美国 REVCO);96孔培养板(德国Greinerbio-one)。
2 方法
2.1 动物分组及给药
选取健康昆明种小鼠,♀♂各半,随机分组。SAP对小鼠脾淋巴细胞增殖作用实验分为正常对照组、脂多糖组及8个不同浓度的SAP+脂多糖组,每组10只。
碳粒廓清及溶血素实验分为正常对照组、模型组、阳性药组及SAP高、中、低剂量组,每组14只。对照组灌胃给予蒸馏水 20 mL·kg-1,SAP高、中、低剂量组分别灌胃给予SAP 400,200,100 mg·kg-1,上述各组均每天灌胃给药 1次,于灌胃第25天,除正常对照组外,其余各组均腹腔注射CTX 80 mg·kg-1,每天1次,连续3 d,造成免疫功能低下模型。
2.2 体外对正常小鼠脾淋巴细胞增殖作用的影响
试剂的配制:将多糖样品用含 10%灭活的小牛血清的RPMI 1640培养液配成1 mg·kg-1的储备液,微孔过滤器(0.22 μm)除菌,备用。
小鼠脾单个淋巴细胞的制备[8]:将小鼠脱颈椎处死,浸泡在75%的乙醇中10 min,在超净工作台上打开小鼠腹腔,用消毒过的剪刀和镊子取出小鼠脾脏置于无菌的平皿中,去除外周结缔组织,并用不含血清的RPMI 1640培养液清洗脾脏,用无菌的针筒研磨脾脏成单个脾细胞,200目的尼龙筛网滤过,用无菌 PBS 1 500 r·min-1离心 5 min 洗涤细胞2次,细胞沉淀加入2 mL灭菌双蒸水,吹打混匀 15 s以破坏红细胞,立即加入等体积的1.8%的无菌盐水充分混匀以恢复等渗,用无菌PBS再洗涤两次,最后用含10%小牛血清的RPMI 1640培养液悬浮细胞,置37 ℃恒温5% CO2孵箱中孵育 48 h,除去贴壁的巨噬细胞,悬浮的即为小鼠脾淋巴细胞。用10%胎牛血清的RPMI 1640培养液调整细胞数为 5×106·mL-1。
将细胞悬液加入 96孔细胞培养板,每孔80 μL,多糖溶液加入平板中,等比稀释成为终浓度 0.01~2.5 mg·mL-1系列 8个浓度,再加入2 μg·mL-1的脂多糖,并设相应对照。
培养与检测[9]:在 37 ℃、5% CO2条件下培养 48 h,然后各孔加入 5 mg·mL-1MTT 20 μL,继续培养 4 h。终止反应,4 h后,弃去上清液,加入DMSO 150 μL,静置30 min,振荡溶解,用酶标仪在570 nm处读取吸光值,数据结果用生物统计学方法处理。
增殖率计算:增殖率(%)=(OD样-OD对照)/OD对照×100%。
2.3 对免疫低下小鼠非特异性免疫功能的影响(小鼠碳粒廓清实验)[10]
各组小鼠在末次给药后 24 h,于眼球后按0.1 mL·(10 g)-1体质量注入印度墨汁(按 1︰3 稀释),在注入墨汁后2 min及10 min从小鼠眼眶球后静脉丛取血0.025 mL,立刻吹入0.1% Na2CO3液2 mL,以分光光度计(λ=650 nm)比色,记录吸光度值,以下列公式计算廓清指数 K值和吞噬系数(校正吞噬系数)α 值:K=(logA1-logA2)/(t2-t1);α=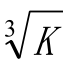 ×体质量/(肝质量+脾质量);其中,A1,A2分别表示2,10 min时吸光度值,t1表示2 min,t2表示 10 min。取血后将小鼠颈椎脱臼处死,取动物肝、脾,并称重。
×体质量/(肝质量+脾质量);其中,A1,A2分别表示2,10 min时吸光度值,t1表示2 min,t2表示 10 min。取血后将小鼠颈椎脱臼处死,取动物肝、脾,并称重。
2.4 对免疫功能低下小鼠特异性体液免疫功能的影响(血清溶血素实验)[11]
末次给药后 l h小鼠摘眼球取血,室温放置l h,2 000 r·min-1离心 10 min 分离血清,将血清用生理盐水500倍稀释供测定。反应管内加入1 mL待测血清,10% SRBC 0.5 mL,10%补体(补体按照参考文献[7]制备)1 mL,置 37 ℃恒温水浴中保温30 min,然后移至冰浴中终止反应,2 000 r·min-1离心10 min,取上清液1 mL,加都氏液3 mL,摇匀,放置10 min,于540 nm波长处比色读取吸光度。测定SRBC半数溶血值:取10% SRBC 0.25 mL加都氏试剂至 4 mL,比色读取吸光度值,作为SRBC半数溶血值。样品血清半数溶血值(HC50)=样品的吸光度值/SRBC半数溶血值×稀释倍数。
3 结果
3.1 SAP对体外对正常小鼠脾淋巴细胞增殖作用的影响
脂多糖组与空白对照比较有显著性差异,各浓度SAP溶液协同脂多糖对淋巴细胞的增殖能力不同程度地增强,在0.6~2.5 mg·mL-1内有较好的增殖作用。结果见表1。
表1 SAP对小鼠脾淋巴细胞增殖作用的影响(n=10,x± s )
Tab. 1 The effects of SAP on proliferation of splenic lymphocytes in mice(n=10,x± s )

注:与空白对照组相比,1)P<0.001。
Note: Compared with control group,1)P<0.001.
3.2 SAP对 CTX致免疫功能低下小鼠非特异性免疫功能的影响
与正常对照组相比较,模型组廓清指数 K和吞噬指数a显著降低,差异有统计学意义;与模型组比较,SAP组及贞芪扶正组均能够显著增强小鼠单核巨噬细胞的吞噬功能(P<0.05),改善小鼠巨噬细胞吞噬功能的抑制状态。结果见表2。
表2 SAP对小鼠非特异性免疫功能的影响(x± s , n=14)
Tab. 2 The effects of SAP on nonspecific immune function in mice (x± s , n=14)

注:与正常对照组相比,1)P<0.01;与模型组相比,2)P<0.05,3)P<0.01。Note: Compared with control group,1)P<0.01; Compared with model group,2)P<0.05,3)P<0.01.
3.3 SAP对免疫抑制小鼠溶血素抗体生成的影响
与模型对照组比较,SAP100,200 mg·kg-1能够显著提高小鼠的血清溶血素水平(P<0.05),改善小鼠血清溶血素水平产生的抑制作用,具体结果见表3。
表 3 SAP对小鼠特异性体液免疫功能的影响(n=14,x± s )
Tab. 3 The effects of SAP on specific humoral immune function in mice (n=14,x± s )

注:与正常对照组相比,1)P<0.01;与模型组相比,2)P<0.05。
Note: Compared with control group,1)P<0.01; Compared with model group,2)P<0.05.
4 讨论
本实验结果表明,SAP能够不同程度地协同脂多糖提高小鼠脾淋巴细胞转换的能力,说明SAP对脾淋巴B细胞的增殖有促进作用;在非特异性细胞免疫方面,SAP能够提高碳粒廓清能力;在体液免疫方面,SAP能够提升小鼠血清溶血素水平。说明SAP在免疫系统的多个方面起到了提升的作用,具有良好的免疫调节功能。另外,碳粒廓清与溶血素实验结果显示,高剂量SAP组相较于低、中剂量未获得更好的免疫效果,而这一结果也同本实验室开展的小鼠体内抗肿瘤实验结果相一致,但与小鼠体外脾淋巴细胞增殖实验结果相反,说明SAP在体内的免疫效果不呈剂量依赖性,这可能与高浓度SAP溶解性较差,溶液黏稠,影响实验动物吸收代谢有关。然而前期预实验结果显示,在低浓度的基础上继续降低给药浓度无免疫和抗肿瘤作用,故设置高剂量组。针对以上实验结果的具体原因及SAP免疫机制本实验室将通过后续的多糖代谢定位定量研究,以期取得进一步的结果。
REFERENCES
[1] 杨巧丽, 顾政一, 黄华. 中药苦豆子的研究进展[J]. 西北药学杂志, 2011, 26(3): 232-236.
[2] 郝伟亮, 孟根达来, 解红霞. 苦豆子的化学成分及药理作用研究进展[J]. 中国药房, 2016, 27(13): 1848-1850.
[3] WANG X M, LI J. Review on the studies for Sophora alopecuroide and its comprehensive utilization [J]. J Agric Sci(农业科学研究), 2013, 34(4): 61-65.
[4] 李莉, 张文学, 张顺利. 苦豆子生物碱的免疫调节作用及其作用机制研究进展[J]. 中草药, 2007, 38(4): 附7-8.
[5] TAO Z W. A method for extracting polysaccharides from the remaining residue after extracting the total alkaloids of Sophora alopecuroides: China, 201110007902.4 [P].2014-6-11.
[6] ZHAO G Z, WANG X J, YU Z M. Influence of Phellinus igniarius polysaccharides on growth and peripheral blood cells of rats treated by cyclophosphamide [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(6): 832-835.
[7] SHI J, DENG X A, ZHOU L, et al. Effects of crude polysaccharides from Polygonati Rhizoma on immune function in normal mice [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2011, 28(1): 18-21.
[8] ZHONG Y Y, YANG X H, ZHANG Y W, et al. Impact of Panax polysaccharides on immune function in mice [J]. West China J Pharm Sci(华西药学杂志), 2016, 31(6): 573-576.
[9] ZHAO X H, YIN Z Q, JIA R Y, et al. Effect of Chuanmingshen violaceum polysaccharides and its solfated derivatives on proliferation of mice spleen lymphocytes in vitro [J]. Chin J Immun(中国免疫学杂志), 2014, 30(2):213-215.
[10] WU Y G, ZHAO Z R, ZHANG P, et al. Effects of Dendrobium Compound granules on immune function in mice[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(2):182-185.
[11] 谷仿丽, 黄仁术, 刘玉曼. 金荞麦多糖对环磷酰胺致免疫低下小鼠免疫功能的影响[J]. 中药材, 2015, 38(2): 370-372.