复方对乙酰氨基酚片是由乙酰氨基酚126 mg、阿司匹林230 mg、咖啡因30 mg组成的复方制剂,是一种解热镇痛类的非处方药,其现行标准是卫生部药品标准化学药品及制剂第一册,国外标准中USP36版收载有类似处方的制剂外[1],其他均未收载。复方对乙酰氨基酚片作为一种口服固体制剂,现行标准中并没有溶出度的检查项目[2],一些文献报道了复方对乙酰氨基酚片的溶出度的研究[3-4],但并没有对不同厂家的产品进行考察比较,溶出度方法是否能反应不同厂家产品的差异还值得探讨。本研究参考文献[5]建立了新的溶出度测定方法,仅对处方中难溶性的阿司匹林进行溶出度的测定,并对国内11个生产厂家的产品进行溶出曲线的考察,方法简便可靠,区分力强,能够为质量标准的提高和产品质量的评价提供实验依据。
1 仪器与试药
RC8MD溶出度仪(配备 RZQ-8D取样收集系统,天津市天大天发科技有限公司);Waters2695高效液相色谱仪(美国Waters公司,包括2998检测器、自动进样器和 Empower色谱工作站);CPA2250型电子天平(德国赛多利斯公司)。
阿司匹林对照品(批号:100113-201104,含量100.0%)、水杨酸对照品(批号:100106-201104,含量99.9%)购自中国食品药品检定研究院;11批样品均为抽样样品,规格:对乙酰氨基酚0.126 g,阿司匹林 0.230 g,咖啡因 30 mg(厂家 1:批号150707;厂家 2:批号 150201;厂家 3:批号 150801;厂家 4:批号 20141003;厂家 5:批号 150805;厂家6:批号20160113;厂家7:批号1502001;厂家8:批号20150603;厂家9:批号20160301;厂家10:批号1602013;厂家11:批号160301);水为纯化水,磷酸二氢钾、磷酸为分析纯,甲醇为色谱纯。
2 方法与结果
2.1 溶液的制备
阿司匹林对照品溶液:精密称取阿司匹林对照品适量,加1%冰乙酸的甲醇溶液溶解并稀释定容制成约2.5 mg·mL-1阿司匹林对照品储备液,精密移取阿司匹林对照品储备液5 mL,置50 mL量瓶中,加1%冰乙酸的甲醇溶液稀释至刻度,摇匀。
水杨酸对照品溶液:精密称取阿司匹林对照品适量,加1%冰乙酸的甲醇溶液溶解稀释制成约0.2 mg·mL-1的溶液,作为水杨酸对照品储备液,精密移取阿司匹林对照品储备液5 mL,置50 mL量瓶中,加1%冰乙酸的甲醇溶液稀释至刻度,摇匀。
溶出介质:盐酸溶液(取稀盐酸24 mL加水至1 000 mL)。
供试品溶液:精密称取样品细粉适量(相当于阿司匹林25 mg)置100 mL量瓶中,加溶出介质约70 mL振摇使阿司匹林溶解,稀释至刻度,摇匀,过滤,取续滤液。
2.2 溶出度测定方法的建立与验证
2.2.1 色谱条件 色谱柱:Sepax Amethyst C18-H(4.6 mm×150 mm,5 μm);流动相:磷酸盐缓冲液(取 0.01 mol·L-1磷酸二氢钾溶液,用磷酸调节 pH 值至 2.6±0.1)-甲醇(70︰30);流速:1.0 mL·min-1;柱温:35 ℃;检测波长:波长切换,0~12.5 min,波长为275 nm,12.5~16 min,波长为303 nm;进样量:10 μL。结果见图1。

图1 高效液相色谱图
A-阿司匹林对照品溶液;B-水杨酸对照品溶液;C-供试品溶液;1-对乙酰氨基酚;2-咖啡因;3-阿司匹林;4-水杨酸。
Fig. 1 HPLC chromatograms
A-aspirin standard solution; B-salicylic acid standard solution; C-sample solution; 1-paracetamol; 2-caffeine; 3-aspirin; 4-salicylic acid.
2.2.2 仪器精密度 取阿司匹林对照品溶液和水杨酸对照品溶液分别进样 6针,测定阿司匹林和水杨酸峰面积的RSD分别为0.66%,0.78%。
2.2.3 定量限 取阿司匹林对照品溶液用 1%冰乙酸的甲醇溶液不断稀释并进样测定,当 S/N为10左右时测得阿司匹林的定量限浓度为1.81 μg·mL-1。
2.2.4 线性关系考察 精密量取阿司匹林对照品储备液 0.25,0.5,1.0,2.0,2.5,4.0,5.0,10.0 mL分别置50 mL量瓶中,加1%冰乙酸的甲醇溶液稀释至刻度,摇匀,作为阿司匹林线性考察用线性测定溶液;精密称取水杨酸对照品储备液 0.25,0.5,1.0,2.5,5.0,7.5,10.0 mL分别置 50 mL量瓶中,加1%冰乙酸的甲醇溶液稀释至刻度,摇匀,作为水杨酸线性考察用线性测定溶液。取上述线性测定溶液进样测定,分别以峰面积 A为纵坐标,以浓度 C为横坐标,得到回归方程和相关系数。阿司匹林:A=3 772.99C-270.29(r=1.000 0);水杨酸:A=15 098.0C-2 067.5(r=0.999 9)。由此可知,阿司匹林和水杨酸分别在12.54~501.60 μg·mL-1和 0.99~39.76 μg·mL-1内线性关系良好。
2.2.5 重复性试验 精密称取样品(厂家5,批号:150805)细粉适量(相当于阿司匹林 25 mg)置100 mL量瓶中,加溶出介质约70 mL振摇使阿司匹林溶解,稀释至刻度,摇匀,过滤,取续滤液,同法配制 6份溶液,分别进样测定,计算阿司匹林折算含量(水杨酸的含量×1.304+阿司匹林的含量)的RSD为0.37%。
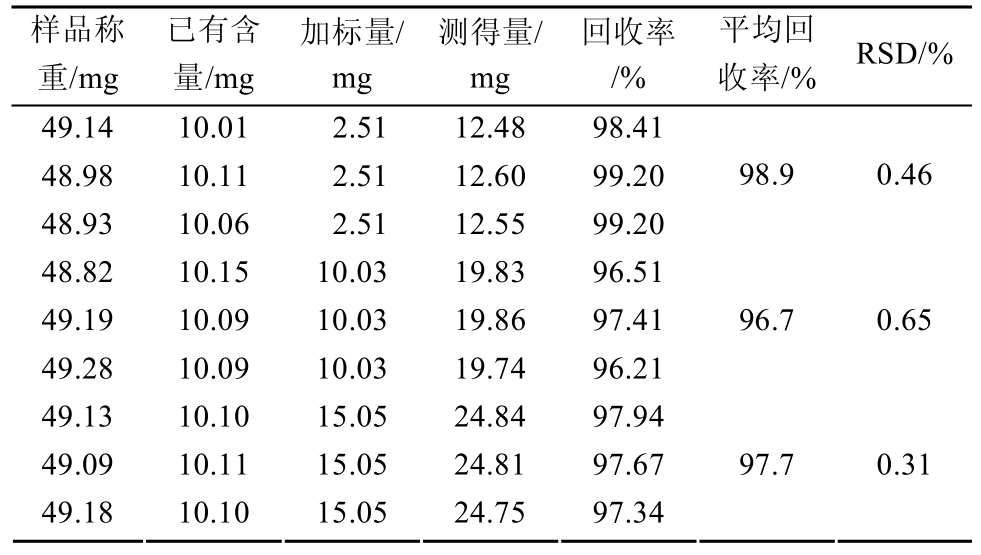
2.2.6 回收率试验 精密称取已知含量的样品(厂家 5,批号:150805)细粉适量(相当于阿司匹林12.5 mg),9份,分别置100 mL量瓶中,各精密加入阿司匹林对照品贮备液1.0,4.0,6.0 mL各3份,再加溶出介质约70 mL振摇使阿司匹林溶解,稀释至刻度,摇匀,过滤,取续滤液分别作为50%,80%,100%供试溶液,每个浓度各制备3份溶液,分别进样测定,计算回收率,结果见表1。
表1 回收率试验结果(n=9)
Tab. 1 Results of recovery test (n=9)
2.2.7 溶液稳定性 按“2.2.5”项下的方法采用溶出介质配制供试品溶液一份,分别放置0,0.5,1,2,4,6,8,10,12 h后进样考察供试品溶液的稳定性,计算得出阿司匹林折算含量的RSD为0.77%,表明供试品溶液在12 h内稳定。
2.3 溶出方法的确定和溶出曲线比较
2.3.1 试验装置和溶出体积的选择 本试验选择阿司匹林作为溶出度测定的对象。美国药典、英国药典、日本橙皮书含阿司匹林复方制剂的溶出度方法均采用桨法,本品为含阿司匹林的复方片剂,故本试验采用桨法。
阿司匹林37 ℃在不同pH值水溶液中的溶解度均>5 mg·mL-1,按本品的规格(每片含阿司匹林230 mg)采用常规的900 mL完全能满足漏槽条件,同时,溶液中的阿司匹林浓度较高,能满足HPLC测定法的灵敏度要求,不需要采用小杯法,故选择900 mL作为溶出体积。
2.3.2 转速的选择 采用桨法考察转速的影响,取样品(厂家5,批号:150805),以盐酸溶液(稀盐酸24 mL加水至1 000 mL,即得)900 mL为溶出介质,分别以 50,75 r·min-1的转速进行溶出试验,在5,10,15,20,30,45,60,90 min取样,并同时补充溶出介质。滤过,取续滤液作为供试品溶液按“2.2.1”项下色谱条件进行测定,绘制溶出曲线,结果见图2。由图可知,转速为75 r·min-1时,样品溶出过快,而转速为50 r·min-1时,溶出曲线较平缓,60 min时累积溶出量能够达到91%,为使方法有区分力,选择转速为50 r·min-1较合理。
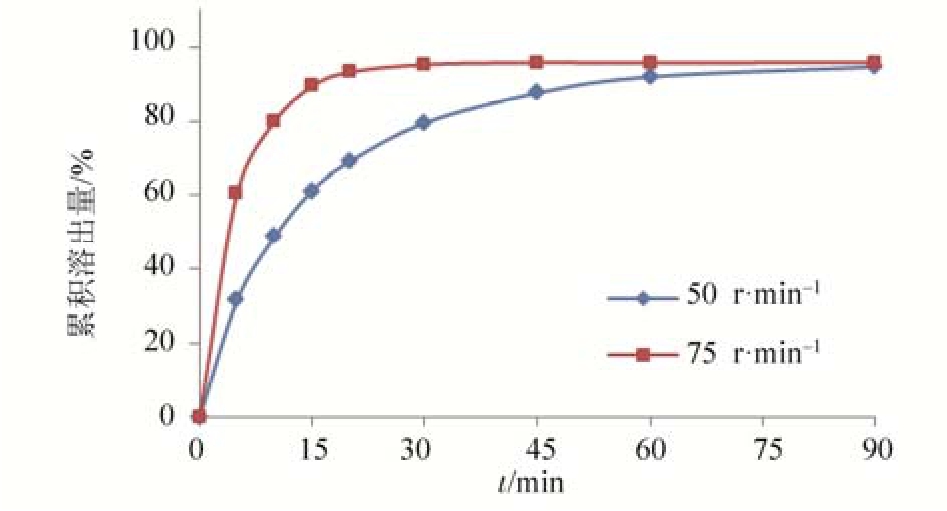
图2 不同转速的溶出曲线(厂家5,批号:150805)
Fig. 2 Dissolution curves of different rotation rates(mfr5,batch: 150805)
2.3.3 溶出介质的确定 根据阿司匹林在各种不同pH值的水溶液中的溶解度数据来看,溶解度均较好,而且均能达到漏槽条件。本实验采用桨法,转速为 50 r·min-1,取样品(厂家 5,批号:150805),分别在下列5种不同pH值的介质中按“2.3.2”的方法测定溶出曲线,结果见图3。由图可知,各个pH介质条件下的的溶出曲线大致接近(pH 6.8的缓冲液中的溶出略高于其他溶出介质,而在60 min时的累积溶出量的极差≤4%,之后更趋于接近),没有显著差异,说明pH对阿司匹林的溶出影响不大,本方法中选择盐酸溶液(稀盐酸24 mL,加水至1 000 mL)作为溶出介质。
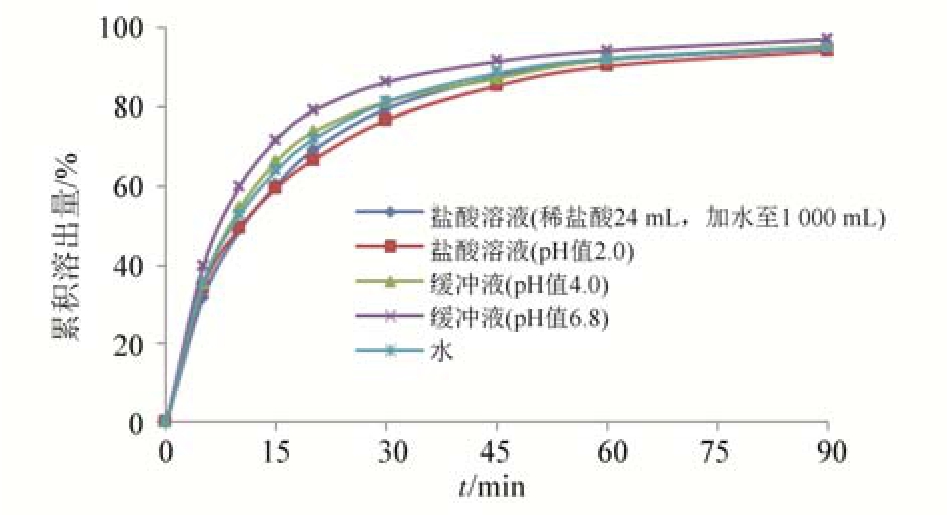
图3 不同溶出介质的溶出曲线比较图(厂家5,批号:150805)
Fig. 3 Dissolution curves of different mediums(mfr5, batch:150805)
2.3.4 取样时间的确定 根据图 3各种溶出介质的溶出曲线,在60 min后样品的累积溶出量变化不大,综合考虑,故确定取样时间为60 min。
2.3.5 溶出曲线考察 采用中国药典2015年版四部通则中规定的桨法,以900 mL盐酸溶液(稀盐酸24 mL,加水至1 000 mL)为溶出介质,转速为50 r·min-1,取 11 个厂家各 1 批样品,按“2.3.3”的方法测得溶出曲线,结果见图4。
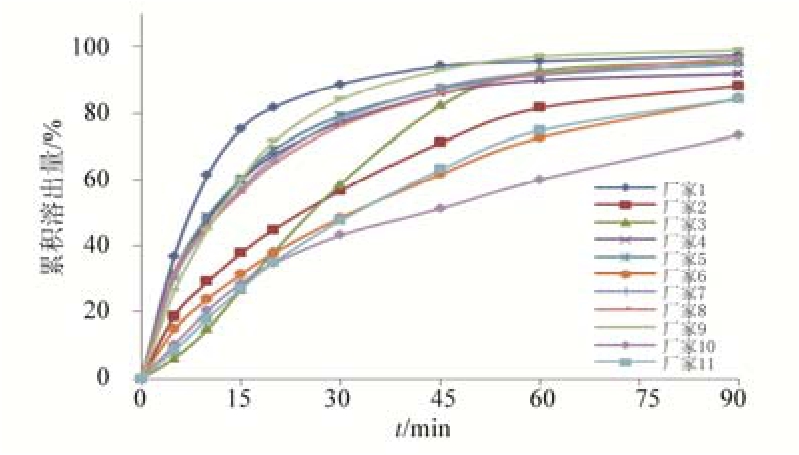
图4 不同厂家样品的溶出曲线结果
Fig. 4 Dissolution curves of samples from different manufacturers
3 讨论
3.1 溶出度测定方法的确定
由于阿司匹林在水溶液中易水解成游离水杨酸,溶出度试验时,如果在溶出取样后供试品溶液不尽快测定,只计算阿司匹林的含量则会导致溶出度结果偏低,特别取样时间很长的话,结果更低。中国药典2015年版阿司匹林片的溶出度计算方法采用把水解后产生的水杨酸折算成阿司匹林来计算,“2.2.7”项下的溶液稳定性的结果也表明这样折算后的阿司匹林总量与水解前一致,而且溶液稳定性好。因此本法采用将水杨酸含量×1.304后,与阿司匹林含量相加作为每片溶出量。
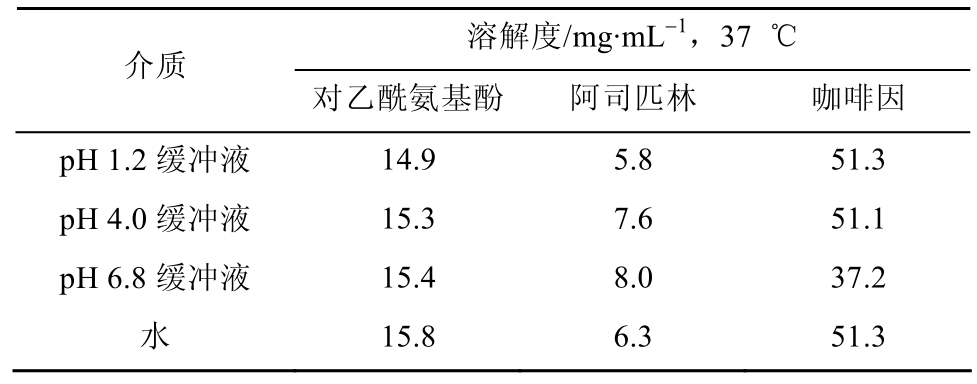
3.2 溶解度与考察对象的确定
根据复方对乙酰氨基酚片的处方,3个活性组分中阿司匹林的含量最高,根据日本橙皮书查询到的溶解度数据(表2),阿司匹林的溶解度远低于其他 2个组分,因此,阿司匹林能否有效地溶出是本品质量控制的关键,文献[3-4]也证明了这一点,因此测定并考察本品中阿司匹林的溶出度即可达到控制本品药品质量的目的,不需要对 3个组分都进行溶出度的测定,故选择阿司匹林作为本品溶出度测定的考察对象。
表2 各成分在不同介质中的溶解度
Tab. 2 Solubility of three ingredient in different medium
3.3 关于转速和取样时间的选择
本实验对转速进行考察时,75 r·min-1的溶出速度比50 r·min-1快,30 min时即溶出曲线可达到90%以上并达到平台期,表面上看其溶出效果比50 r·min-1好。但是好的溶出度测定方法并不是使药物溶出快,溶出量大,而是要能评价不同厂家不同批次药品的内在品质,确保药品质量和疗效的一致性,区分不同厂家不同批次之间药品的质量差异。根据文献[6]不建议随意采用高于50 r·min-1的转速,这将极大地弱化对不同制剂或处方溶出行为的区分力,而通常考虑在低转速下延长取样时间的方法。本实验中50 r·min-1的转速下60 min时溶出量也能达到90%,即达到平台区,因此本法采用50 r·min-1和60 min的取样时间。
3.4 结果和建议
根据溶出曲线考察结果显示,11个厂家样品的溶出曲线差异明显,方法具有较好的区分度,其中厂家2、厂家4、厂家6、厂家11这4个厂家的样品的溶出曲线显示整个溶出过程相对偏慢,60 min时的溶出度有3批均<80%,剩余1批也处于边缘,提示这 4个厂家的样品的制剂处方及生产工艺需改进提高;厂家 3样品的溶出行为是初期很缓慢,但随着时间推移溶出越来越快,45 min时已到达到80%,60 min时>90%,通过进一步分析发现其按法定标准检查崩解时限超出 15 min,说明其产品在溶出介质中的崩解行为不理想,其处方及制剂工艺也应改进提高;其余 6个生产厂家样品的溶出曲线比较一致,60 min时的溶出度均>90%。
REFERENCES
[1] USP-NF31 [S]. 2012: 2298-2299.
[2] 中华人民共和国卫生部药典委员会. 中华人民共和国卫生部药品标准化学药品及制剂[S]. 第一册: 84.
[3] QIAN Z Y, GE W W. HPLC Determination of the content and dissolution of compound paracetamol tablets [J]. Chin J Pharm Anal(药物分析杂志), 2012, 32(1): 155-158
[4] XU L, MANG Y L, YIN M, et al. Research of the in vitro dissolution of main ingredient in compound paracetamol tablets by similar factor method [J]. Chin J Clin Rat Drug Use(临床合理用药杂志), 2012, 10(5): 4-6
[5] ZHU P X, WEI W, LU J X, et al. Study of method for dissolution test of compound aminopyrine phenacetin tablets[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 34(2):272-275.
[6] XIE M F. How to develop and validate the dissolution test on the quality criteria [J]. Chin J Pharm(中国医药工业杂志),2012, 43(3): A23-A32.