高乌头为毛莨科乌头属植物高乌头 Aconitum sinomontanum Nakai的根,又名麻布七、辫子七、破骨七等,是我国甘肃等中西部地区民间习用中药,在《中华本草》《中药大辞典》等本草著作中均有记载[1-2],具有祛风除湿、理气止痛、活血散瘀的功效,用于治疗风湿痹痛、关节肿痛、跌打劳伤、急慢性菌痢等,现收载于《甘肃省中药材标准》(2009年版)[3]。现代研究表明,高乌头具有镇痛、抗炎、解热、局麻、抗心律失常等广泛的药理作用[4],临床上常用于治疗类风湿性关节炎和局部镇痛[5]。但由于高乌头具有一定的毒性,临床使用中常见不良反应报道而使其应用受限[6-7]。临床使用过程中多为高乌头制品,但炮制方法不尽相同,课题组在前期对高乌头炮制工艺进行研究[8],得到了科学的炮制工艺,而现有的标准及各省炮制规范均没有高乌头炮制品的记载。因此,为了确保高乌头制品临床应用安全有效、完善高乌头制品的质量控制,本实验首次采用HPLC建立10批不同产区高乌头制品的指纹图谱,通过主成分分析和聚类分析对不同来源的高乌头制品进行识别研究,评价不同产区高乌头制品的质量差异,为更加客观、全面、系统地控制高乌头制品质量提供科学依据。
1 材料
1.1 高乌头药材
高乌头药材分别购于甘肃、青海、西藏等地,经甘肃中医药大学药学院杨扶德教授鉴定为毛茛科乌头属植物高乌头(Aconitum sinomontanum Nakai)的干燥根。将高乌头原药材净制,润软,切制为约5 mm的段,自然干燥,筛去碎屑得高乌头饮片。取高乌头饮片,用10%的甘草汁(3 mL含有1 g甘草)润透后,置立式压力蒸汽灭菌器内,在127 ℃,0.15 MPa条件下蒸制5 h,取出,晾干,筛去碎屑得高乌头制品[8],见表1。
表1 高乌头药材样品来源
Tab. 1 The source of medicinal Aconitum sinomontanum Nakai samples
1.2 仪器与试剂
BT125D电子天平(赛多利斯科学仪器有限公司);KQ3200DB超声波清洗器(昆山市超声仪器有限公司);LDZX-30FA 立式压力蒸汽灭菌器(上海中安医疗器械厂);FW-400A高建万能粉碎机(北京科伟永兴仪器有限公司);HHS-11S数显恒温水浴锅(上海宜昌仪器纱筛厂);Agilent 1100 Series型高效液相色谱仪(美国Agilent科技有限公司),DAD检测器;SHB-3循环水多用真空泵(郑州杜甫仪器厂)。
高乌甲素对照品(甘肃神龙药业股份有限公司,批号:20001001,纯度≥97.50%);冉乌头碱对照品(成都克洛玛生物科技有限公司,批号:150404,纯度≥98.00%);乙腈、甲醇、三乙胺、磷酸二氢钠均为色谱纯;三氯甲烷、氨水、异丙醇、乙酸乙酯、95%乙醇为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:DiKMA spursil C18(4.6 mm×250 mm,5 μm);流动相:0.05 mol·L-1磷酸二氢钠水溶液(A)-乙腈(B);梯度洗脱:0~10 min,4%→20%B,流速为 1.0→0.5 mL·min-1;10~25 min,20%→25%B,流速为 0.5 mL·min-1;25~50 min,25%→30%B,流速为 0.5~0.4 mL·min-1;50~55 min,30%→50%B,流速为 0.4→0.8 mL·min-1;55~63 min,50%B,流速为 0.8→0.6 mL·min-1;63~65 min,50%→60%B,流速为 0.6 mL·min-1;65~70 min,60%→80%B,流速为 0.6 mL·min-1;70~78 min,80%→100%B,流速为 0.6→1.0 mL·min-1;78~85 min,100%B,流速为 1.0 mL·min-1;检测波长为 254 nm;柱温为35 ℃。
2.2 对照品溶液的制备
精密称定冉乌头碱、高乌头甲素对照品适量,加甲醇溶解,制备浓度分别为 0.296 0,0.800 4 g×L-1混合对照品溶液,存贮于4 ℃冰箱中备用。
2.3 供试品溶液的制备
取高乌头制品粉末1 g(过四号筛),精密称定,置于具塞锥形瓶中,加氨试液-三氯甲烷(6∶44)50 mL,称定重量,超声处理(功率 300 W;频率50 kHz;水温25 ℃)45 min,放冷,补足失重,摇匀,滤过,精密量取续滤液20 mL,40 ℃以下减压回收溶剂,残渣加甲醇溶解,定容至10 mL,密塞,摇匀,进样前用0.45 μm微孔膜过滤,作为供试品溶液。
2.4 高乌头炮制品HPLC指纹图谱的建立
2.4.1 专属性考察 取甲醇、“2.2”项下对照品溶液以及“2.3”项下供试品溶液,按“2.1”项下色谱条件进样分析,进样量为5 μL,结果表明溶剂无干扰,专属性良好,结果见图1。

图1 高效液相色谱图
Fig. 1 HPLC chromatogram
2.4.2 仪器精密度试验 取同一批供试品溶液5 µL,按“2.1”项下色谱条件进样分析,连续进样 6次,记录色谱图,以高乌甲素色谱峰为参照峰,计算指纹图谱中共有峰的相对保留时间和相对峰面积,结果各共有峰的相对保留时间、相对峰面积的 RSD分别为 0.37%,1.58%(n=6),表明仪器精密度良好。
2.4.3 稳定性试验 取同一供试品溶液5 µL,按“2.1”项下色谱条件进样,分别于0,3,6,9,12,24 h测定,记录色谱图,以高乌甲素色谱峰为参照峰,计算指纹图谱中共有峰的相对保留时间和相对峰面积,结果各共有峰的相对保留时间、相对峰面积的 RSD分别为 0.47%,1.89%(n=6),结果表明24 h内样品的稳定性良好。
2.4.5 重复性试验 取同一批样品粉末(过四号筛),按“2.3”项下方法,平行制备6份供试品溶液,按“2.1”项下色谱条件进样分析,记录色谱图,以高乌甲素色谱峰为参照峰,计算指纹图谱中共有峰的相对保留时间和相对峰面积,结果各共有峰的相对保留时间、相对峰面积的RSD分别为0.53%,1.59%(n=6),结果表明本法有良好的重复性。
2.4.6 不同产区高乌头炮制品指纹图谱建立与共有峰的标定 取10批高乌头制品供试液,按“2.1”项下色谱条件进样分析,记录色谱图,并将数据导入“中药色谱指纹图谱相似度评价系统2012版”软件,采用中位数矢量法进行多点校正生成高乌头制品指纹图谱共有模式及对照指纹图谱,确定共有峰18个,见图2。通过与对照品的色谱图相比对,确定其中10号峰为高乌甲素,11号峰为冉乌头碱。由于高乌甲素在各批次高乌头制品中均有出现,分离度良好且峰面积较大,故选择高乌甲素作为参照峰,计算各共有峰与参照峰的相对保留时间和相对峰面积,结果见表2。每批样品中的非共有峰面积占总峰面积的比值均<20%,符合指纹图谱技术要求。
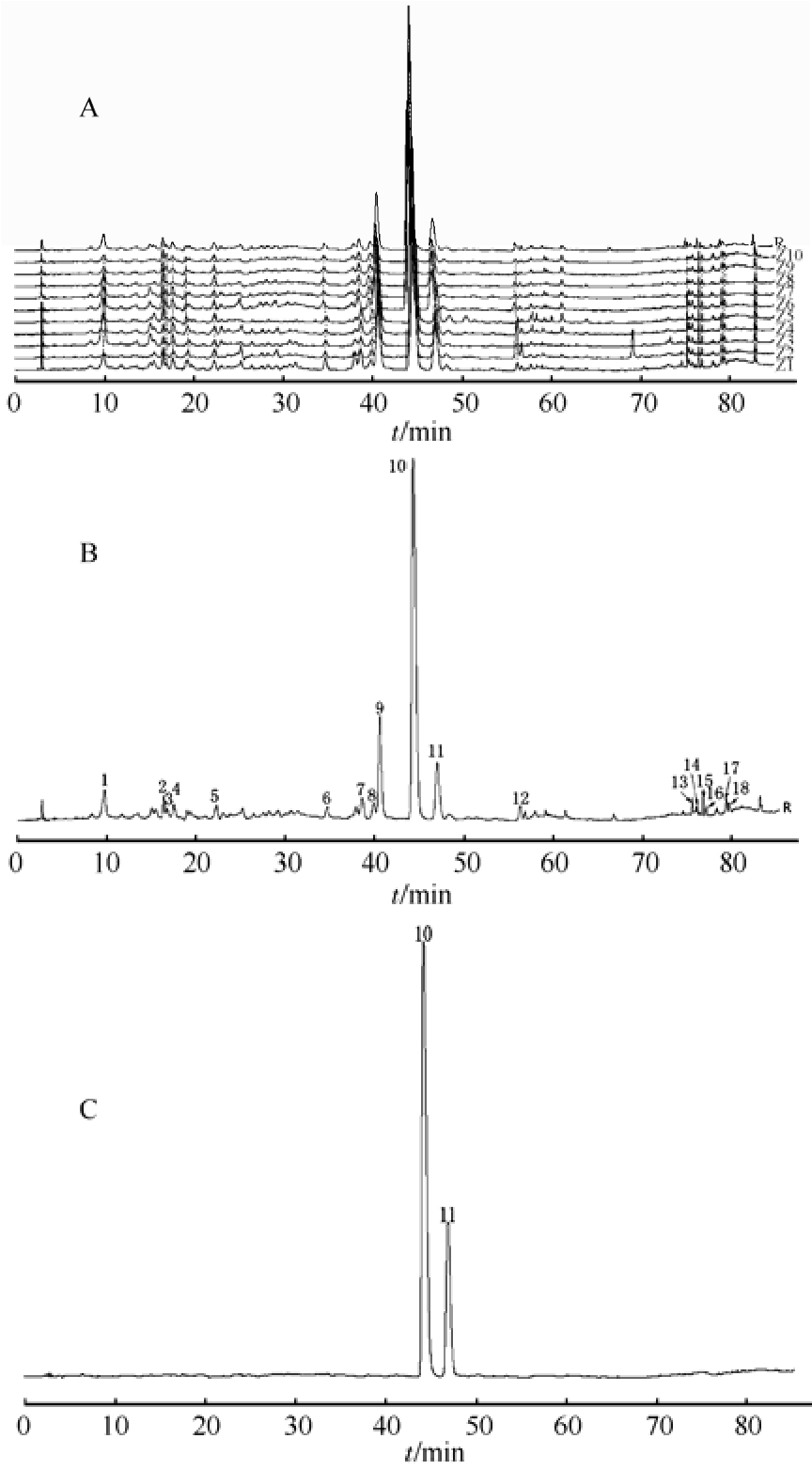
图2 10批高乌头炮制品指纹图谱共有模式(A)、对照指纹图谱(B)及混合对照色谱图(C)
10-高乌甲素;11-冉乌头碱;1~9,12~18-共有峰。
Fig. 2 Fingerprint patterns(A), reference fingerprint (B) and mixed reference substances (C) of 10 batches of processed Aconitum sinomontanum Nakai
10-lappacontine; 11-ranaconitine; 1-9, 12-18-common peaks.
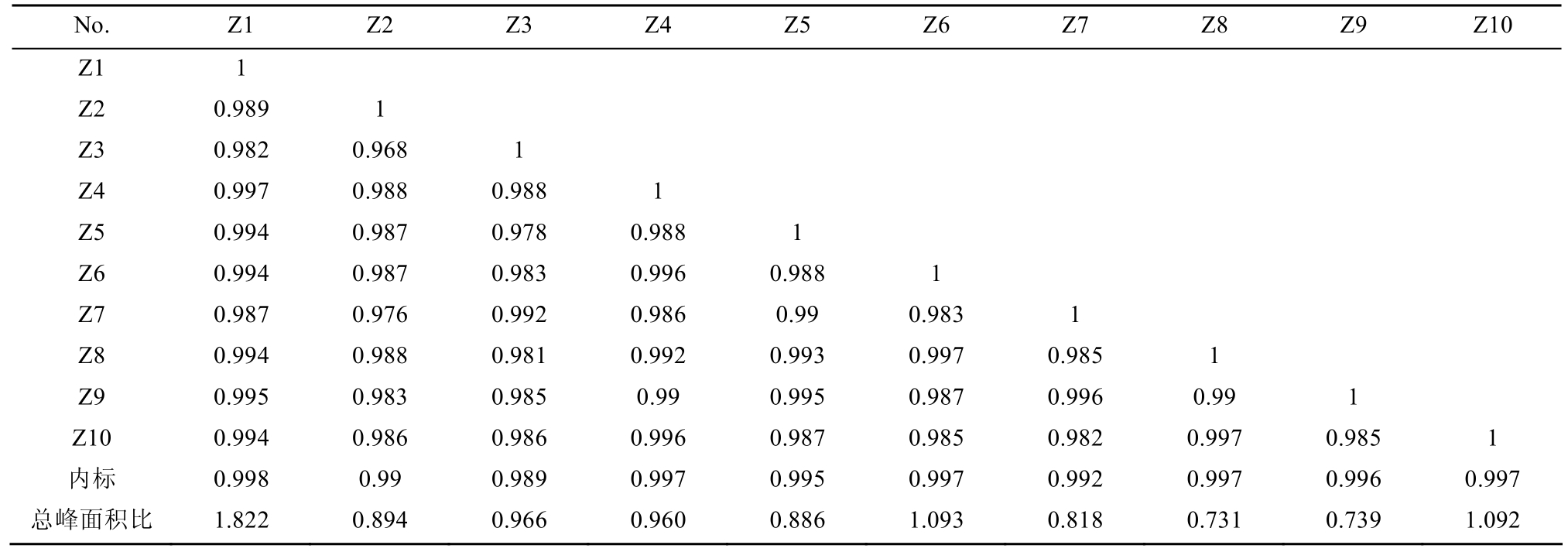
2.4.7 高乌头炮制品 HPLC指纹图谱的解析 通过《中药色谱指纹图谱相似度评价系统》(2012版)分析处理,生成高乌头制品指纹图谱共有模式图,得到相似度评价结果。相似度可体现不同批次样品之间各成分在种类和相对含量上的相似程度;由于相似度不能反映不同批次样品间成分绝对含量的差异,所以同时采用总峰面积比(总峰面积比=样品总峰面积/10批次样品平均总峰面积)和相似度 2个指标共同对样品的相似度进行评价,结果见表 3。相似度均>90%,表明各批次样品间有较高相似性;而从总峰面积比值上分析,各批次之间比值不同,可能受产地、采集时间不同的影响。
表2 10批高乌头炮制品HPLC指纹图谱共有峰相对峰面积
Tab. 2 Relative peak area of common peaks of 10 batches processed Aconitum sinomontanum Nakai
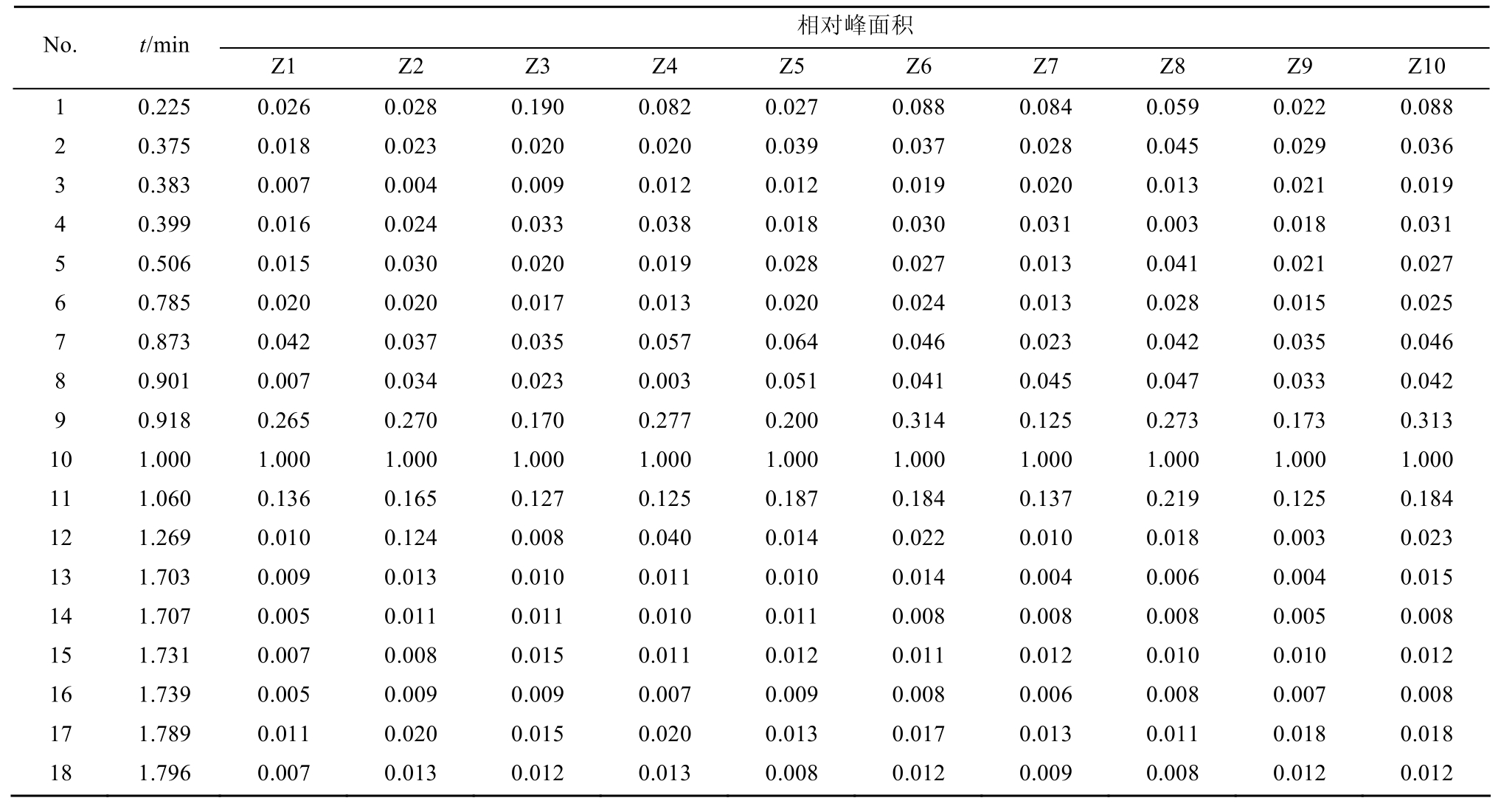
表3 10批高乌头炮制品相似度评价结果
Tab. 3 Result of similarity comparison of 10 batches of processed Aconitum sinomontanum Nakai
2.4.8 不同产区高乌头炮制品聚类分析 以不同产区高乌头制品的18个共有峰的峰面积为原始数据,运用 SPSS 21.0软件对药材进行系统聚类分析,采用组间平均数联结,以夹角余弦为样品相似度的距离公式,聚类分析结果见图3。由图可知,高乌头炮制品被分为4大类,Z1、Z4、Z6、Z8、Z10为Ⅰ类;Z5、Z7、Z9为Ⅱ类;Z3为Ⅲ类;Z2为Ⅳ类。结合高乌甲素和冉乌头碱的含量情况可以认为,Z1、Z4、Z6、Z8、Z10(西藏、青海等产区)质量最优,Z5、Z7、Z9(甘肃和政等产区)质量较好,Z3质量次之,Z2质量较差。
2.4.9 不同产区高乌头炮制品主成分分析 采用SPSS 21.0软件中的因子分析对原始数据进行标准化处理,以主成分的特征值及贡献率为依据,对10个不同产地高乌头药材指纹图谱中18个共有峰(变量)进行主成分分析,表4结果显示,前4个主成分累计贡献率达到88.8%,其中,第一主成分的特征值为8.2,贡献率为45.5%;第二主成分的特征值为3.7,贡献率为20.5%,特征值均>3。以第一、第二主成分为变量,得到二维投影图见图4。以 X轴为例,在投影图中选取距离原点较远的几个点,得到第一主成分中变量的权重值,权重值越大,表明该化合物在高乌头炮制品中作用越大,其中前7个变量的权重值为0.962,0.951,0.876,0.817,0.808,0.801,0.792,分别为 11号峰、6号峰、9号峰、7号峰、5号峰、13号峰、10号峰,其中10号峰为高乌甲素,11号峰为冉乌头碱,5号峰、6号峰、7号峰、9号峰、13号峰未知,需要进一步分析确认。
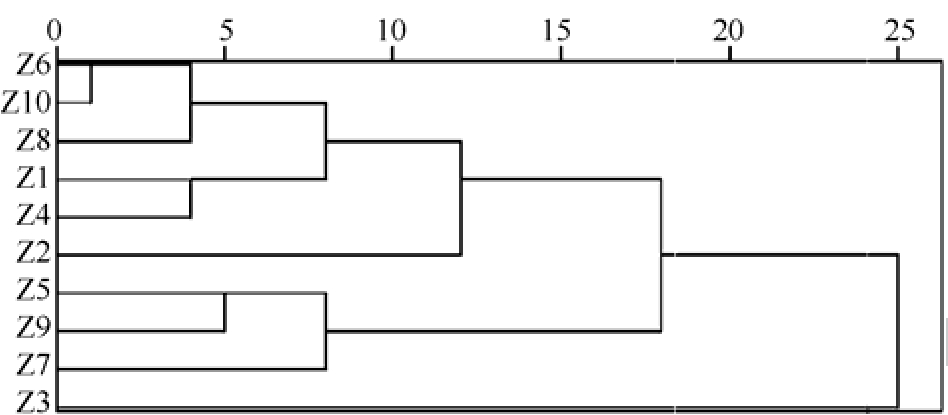
图3 聚类分析树状图
Fig. 3 Dendrogram of cluster analysis
表4 特征值表
Tab. 4 Table of characteristic values

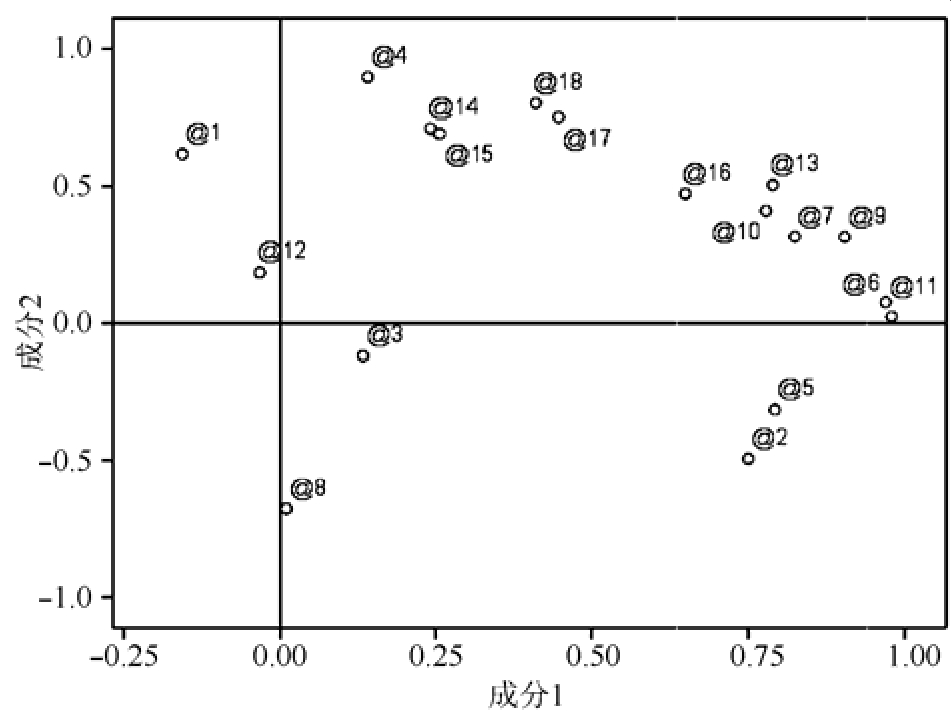
图4 HPLC指纹图谱二维投影图
Fig. 4 2D projection map of HPLC fingerprint
2.5 高乌头炮制品中高乌甲素与冉乌头碱含量测定
2.5.1 线性关系的考察 精密吸取混合对照品贮备液 0.25,0.5,1.0,1.5,2.0,2.5,5.0 mL,用甲醇定容至5.0 mL,摇匀。分别按“2.1”项下色谱条件进样分析,进样量5 μL,测定峰面积,以峰面积(Y)对浓度(X)进行线性回归。结果表明,高乌甲素在0.200 1~4.002 μg内线性关系良好,回归方程Y=10 954X+4.741 9,r = 0.999 8;冉乌头碱在0.074 0~1.480 0 μg内线性关系良好,回归方程Y=10 005X-3.252 6,r=0.999 7。
2.5.2 仪器精密度试验 精密吸取混合对照品溶液5 µL,按“2.1”项下色谱条件进样分析,连续进样6次,结果冉乌头碱、高乌甲素峰面积的RSD分别为0.57%,0.69%(n=6),表明仪器精密度良好。
2.5.3 稳定性试验 取同一供试品溶液,按“2.1”项下色谱条件进样,分别于0,3,6,9,12,24 h测定,记录冉乌头碱与高乌甲素的峰面积。其峰面积的 RSD分别为 1.15%,1.22%(n=6)。结果表明24 h内样品的稳定性良好。
2.5.4 重复性试验 取同一批样品粉末(过四号筛),按“2.3”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样分析,计算样品中高乌甲素和冉乌头碱的含量。结果表明,本法有良好的重复性,高乌甲素和冉乌头碱 RSD分别为2.00%,1.81%。
2.5.5 加样回收率试验 取已知含量的高乌头制品粉末0.5 g(高乌甲素含量为0.949%,冉乌头碱含量为0.142%)共6份,精密称定。分别加入相当于样品成分量100%的高乌甲素和冉乌头碱对照品,按“2.3”项下制备方法制备,依法测定,计算高乌甲素和冉乌头碱的平均回收率均分别为98.84%,101.63%,RSD分别为1.51%,1.16%,表明方法的回收率良好。
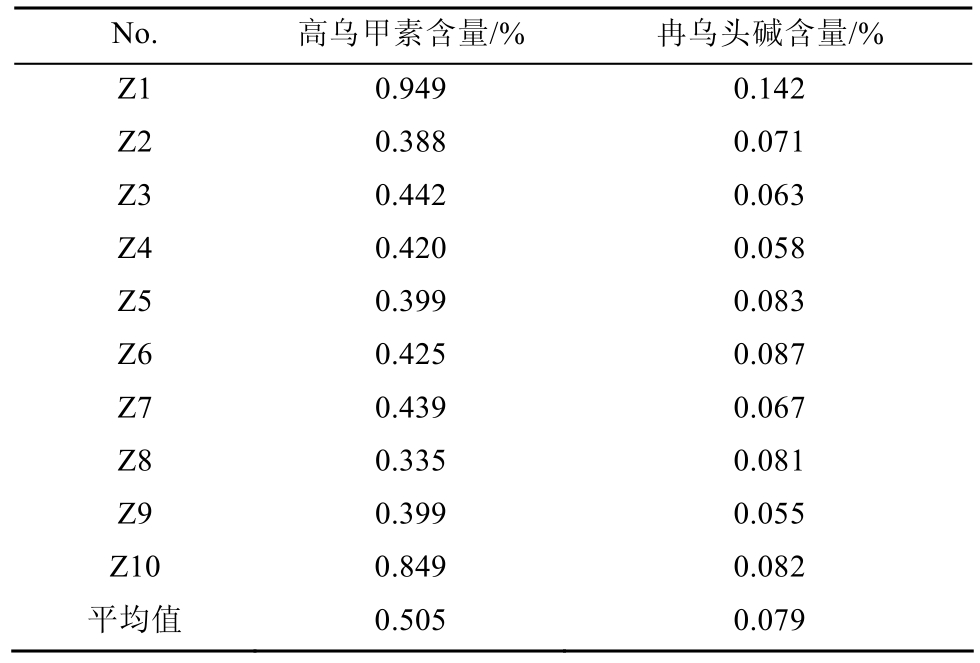
2.5.6 样品含量测定 取 10批高乌头制品供试液,按“2.1”项下色谱条件进样分析,测定样品高乌甲素和冉乌头碱的含量,结果见表5。不同产地的高乌头制品中高乌甲素和冉乌头碱成分均有不同程度的差异。推测可能由于受到药材产地、采集时间等因素影响。
表5 10批高乌头炮制品中高乌甲素和冉乌头碱的含量
Tab. 5 The contents of lappacontine and ranaconitine of 10 batches of processed Aconitum sinomontanum Nakai samples
3 讨论
3.1 提取溶剂和提取方式的选择
实验分别考察了稀氨水-异丙醇-乙酸乙酯(3∶25∶25)、氨水-三氯甲烷(6∶44)、氨水-95%乙醇(6∶44)、95%乙醇各50 mL作为提取溶剂。结果显示氨水-三氯甲烷作为提取溶剂时,出峰数目较多,而 95%乙醇作为提取溶剂时,出峰数目过多很难分离,综合分析最终选择氨水-三氯甲烷作为提取溶剂。同时,实验考察了超声30,45,60 min及回流60 min 4种提取方法,结果表明超声45 min的方法提取效率高且简单方便,故采用超声45 min提取方法。
3.2 色谱条件的选择
本实验分别采用了甲醇-水、乙腈-水作流动相,梯度洗脱,高乌头制品中部分化学成分能够较好的基线分离,但采用甲醇-水作为流动相在254 nm时基线漂移较为严重,故采用乙腈-水作为流动相。高乌甲素和冉乌头碱结构相似,极性相近,在上述 2种流动相系统中,两者很难达到基线分离。因此,分别加入三乙胺和磷酸二氢钠作为缓冲剂,两者均能够达到很好的基线分离,但采用三乙胺作为缓冲溶剂时pH不稳定,故采用加入磷酸二氢钠做为缓冲剂。同时也考察了波长,柱温对分离的影响,最终确定波长为254 nm,柱温为35 ℃。
3.3 指标性成分的选择
实验选择高乌甲素和冉乌头碱作为指标性成分,一方面由于高乌甲素和冉乌头碱具有很好的镇痛、抗炎、解热、抗心律失常等药理作用[4,9],而活性成分之一高乌甲素已开发出不同剂型应用于临床[10-12],两者均是高乌头制品中主要有效成分;另一方面高乌头中主要含有二萜类生物碱,目前研究已发现高乌头中含有28种生物碱成分[4],其中高乌甲素和冉乌头碱含量最高,并且有市售的相应对照品,其他生物碱含量较低,研究较少无市售的对照品,故最终将其作为指标性成分。
3.4 分析方法评价
本研究运用 HPLC建立了高乌头制品指纹图谱,并测定了 2种主要生物碱成分的含量,同时应用聚类分析和主成分分析对不同产区高乌头制品进行分类和质量评价,两者起到相互验证,相互补充的作用,可以为高乌头制品质量评价提供参考。植物类药材由于受生长环境、气候、土壤、采集时间等因素影响,其成分种类和含量也有所不同,表现在色谱图中则是色谱峰的个数、保留时间以及相同保留时间下色谱峰峰面积的差异。聚类分析可以将不同产区药材聚为一类。本实验所收集药材来源批次有限,后期可以增加收集样品来源批次数量,为筛选出质量最优药材产区提供依据。而主成分分析则能够筛选出共有的特征成分,找出决定因素,为高乌头制品药材质量评价提供参考依据。本实验共选出 7个特征成分,分别为高乌甲素、冉乌头碱和未知的5号峰、6号峰、7号峰、9号峰、13号峰,可以通过质谱进一步确定,从整体上反映高乌头制品的特征,为高乌头制品的质量控制提供有效手段。
REFERENCES
[1] 国家中医药管理局《中华本草》编委会编. 《中华本草》第七卷[M]. 上海科学技术出版社, 1999: 1746-1747.
[2] 江苏新医学院编. 中药大辞典(下册)[M]. 上海科技出版社,2001: 751-752.
[3] 甘肃省食品药品监督管理局. 甘肃省中药材标准[S]. 甘肃:甘肃文化出版社, 2009: 117-118.
[4] 徐斌, 张琴, 郭夫江, 等. 高乌头的研究进展[J]. 中成药,2016, 38(4): 882-890.
[5] WANG Y Z, XIAO Y Q, ZHANG C, et al. Study of analgesic and anti-inflammatory effects of Lappaconitine gelata [J]. J Trad Chin Med(中医杂志), 2009, 29(2): 141-145.
[6] 魏华波, 范艾玲, 秦争平. 注射用氢溴酸高乌甲素致耳毒性不良反应 2例[J]. 中国医院药学杂志, 2012, 32(17): 1413-1414.
[7] 肖紫英. 氢溴酸高乌甲素致变态反应 1例[J]. 医药导报,2017, 36(z1): 150-150.
[8] 李 芸, 胡昌江, 侯桃霞, 等. 正交实验优选高乌头解毒的炮制工艺研究[J]. 中成药, 2015, 37(4): 905-909.
[9] VAKHITOVA I V, FARAFONTOVA E I,KHISAMUTDINOVA R I, et al. To the mechanisms of antiarrhythmic action of allapinine [J]. Bioorg Khim, 2013,39(1): 105-116.
[10] 王海兰, 张文燕, 呼巧娜, 等. 肌注氢溴酸高乌甲素用于取环术镇痛效果的临床观察[J]. 现代养生, 2014(5): 162-163.
[11] WEN X S, TUN G D, CHUN M D. Crystal structure analysis and antinociceptive property of Lappaconitine hydrochloride[J]. Adv Mater Res, 2011(343): 1049-1052.
[12] MA J Y, CHEN X L, SHENG A X, et al. Preparation of lappaconitine-loaded nanoparticles and its pharmacokinetic behaviors in rats[J]. Chin J Hosp Pharm(中国医院药学杂志),2016, 36(4): 276-281.