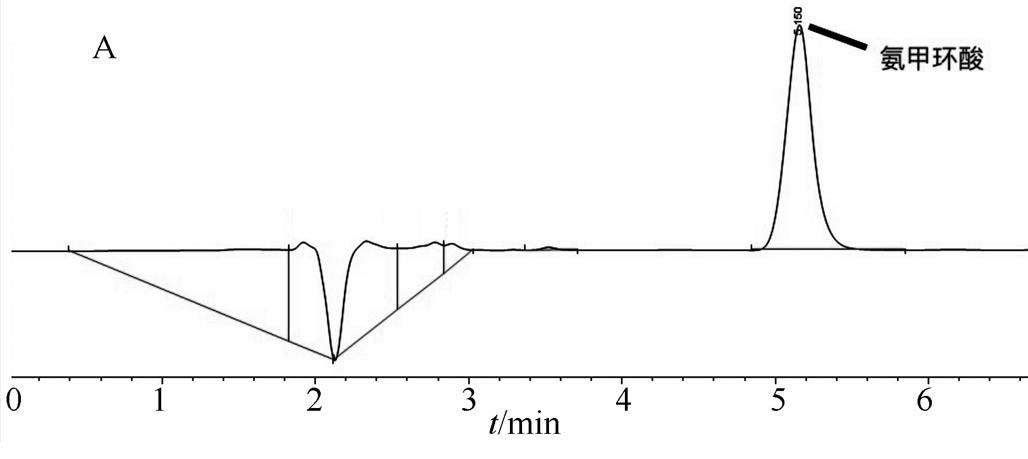

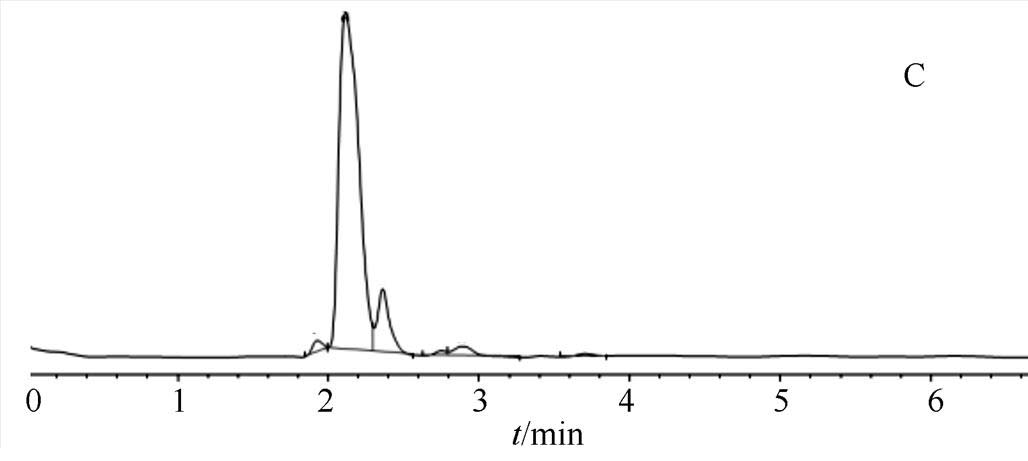
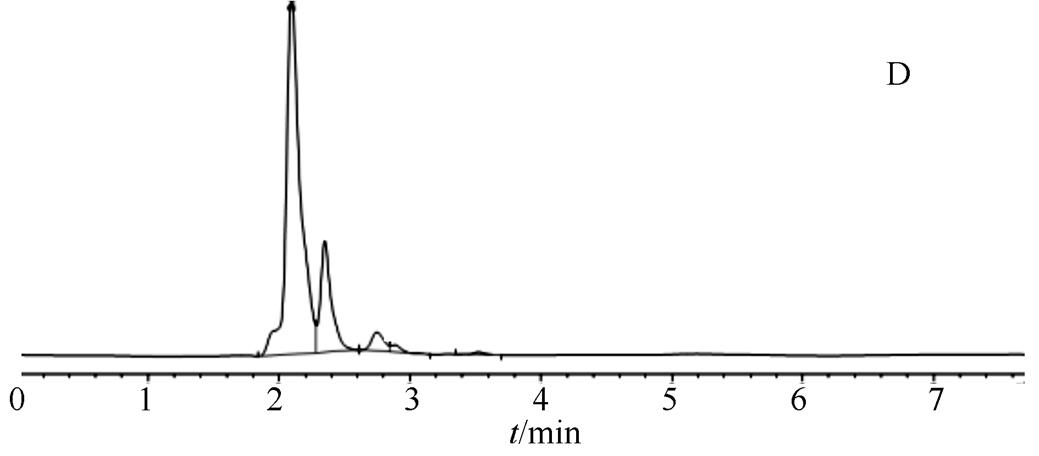
图1 高效液相色谱图
谢丽晓,蔡啸静,谢兵
(温州医科大学附属第三医院药学部,浙江瑞安 325200)
摘要:目的 考察注射用氨甲环酸在果糖、转化糖、果糖氯化钠3种溶媒中的配伍稳定性。方法 注射用氨甲环酸与三种溶媒分别配伍后,置于室温,分别于0,1,2,4,6,8 h取样,选用高效液相色谱法测定氨甲环酸的含量以及用酸度计测定pH并观察配伍溶液的外观变化。结果 注射用氨甲环酸与果糖、转化糖、果糖氯化钠3种溶媒配伍后的配伍液在8 h内均无色澄清,pH及氨甲环酸含量基本无改变。结论 注射用氨甲环酸可以与果糖、转化糖、果糖氯化钠3种溶媒配伍使用。
关键词:注射用氨甲环酸;高效液相色谱法;输液配伍;稳定性
两种或两种以上药物的配伍使用,临床上已经非常普遍,在强调合理用药的今天,药物配伍稳定性的考察在医院药学范畴内正逐步受到重视。近年来,药物配伍稳定性已成为了一个研究热点[1-4]。
目前,国内外学者对氨甲环酸、果糖和转化糖已做了大量研究[5-9]。然而,国内外尚未有关于注射用氨甲环酸粉针剂与其他输液的配伍稳定性报道[10]。注射用氨甲环酸粉针剂说明书中也未明确写明将多少克的药物溶于多少体积的何种注射液中进行静脉滴注[11]。国内曾有发表过探讨氨甲环酸粉针剂输液配制的最佳方法[12],滴定法测定含量[13]以及使用高效液相色谱法测定粉针剂中氨甲环酸的含量[14]。
本实验将药品与注射液按照临床使用浓度配伍,配伍后0~8 h内,采用高效液相色谱法测定药品的含量变化;观察配伍溶液的外观(颜色、沉淀、气泡等);测定配伍溶液的pH值;通过上述3个的指标,对注射用氨甲环酸与果糖、转化糖、果糖氯化钠3种溶媒配伍后的配伍稳定性进行考察。并充分考虑了在临床应用中使用注射用氨甲环酸时,胰岛素抵抗患者不能使用葡萄糖注射液时可以采用果糖注射液、转化糖注射液和果糖氯化钠注射液等输液为配伍液的情况,从而为临床用药提供参考。
Agilent Technologies 1260型高效液相色谱仪(美国Agilent公司),包括Agilent G-1311B四元泵、VWD可变波长检测器、色谱工作站;TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司); RHSJ-4F pH计(广州市新英电器有限公司);万分之一电子天平(瑞士梅特勒)。
注射用氨甲环酸(浙江金华康恩贝生物制药有限公司,批号:D11507003-3,规格:0.4 g);果糖注射液(江苏正大丰海制药有限公司,批号1508131,规格:250 ml: 12.5 g);转化糖注射液(四川美大康佳乐药业有限公司,批号:15111932,规格:250 ml:果糖12.5 g与葡萄糖12.5 g);果糖氯化钠注射液(四川科伦药业股份有限公司,批号:T15070802,规格:250 ml:果糖12.5 g与氯化钠2.25 g)。
2.1 紫外检测波长的确定
称取氨甲环酸适量,用纯化水溶解,以纯化水为空白对照,参考中国药典2015版二部中有关氨甲环酸含量及有关物质的测定波长,通过TU-1901双光束紫外可见分光光度计对供试品溶液和对照品溶液的扫描,结果在210 nm的波长处有较大吸收,因此选择210 nm为测定波长。
2.2 色谱条件
色谱柱:十八烷基硅烷键合硅胶;流动相:0.23%十二烷基硫酸钠溶液(取磷酸二氢钠18.30 g,加水 800 mL溶解,加三乙胺8.30 mL混匀后,再加十二烷基硫酸钠2.3 g,振摇使溶解,用磷酸调节pH至2.50,加水至1 000 mL,摇匀)-甲醇(50∶50);流速:1 mL·min-1;检测波长:210 nm;柱温:35 ℃;保留时间:5.15 min,进样量20 µL。
2.3 溶液的制备
2.3.1 对照品溶液制备 精密称取氨甲环酸粉针剂938.00 mg,置于25 mL量瓶中,加纯化水溶解并定容至刻度,摇匀,制得氨甲环酸储备液(37.52 mg·mL-1)。精确吸取氨甲环酸储备液6 mL,置于50 mL量瓶中,加水溶解并定容至刻度,摇匀,制得氨甲环酸对照品溶液。
2.3.2 供试品溶液制备 精密称取适量样品(约相当于氨甲环酸100 mg),置于25 mL量瓶中,分别加果糖注射液、转化糖注射液、果糖氯化钠注射液溶解并定容至刻度,摇匀,制得3种供试品溶液。
2.3.3 空白溶剂干扰试验 空白对照采用3种输液,以上3种溶液分别进样20 µL注入HPLC,测定结果,见图1。图1显示果糖注射液、转化糖注射液和果糖氯化钠注射液3种注射液在氨甲环酸吸收峰附近无吸收,对测定结果无干扰。
2.4 线性关系考察
精密吸取对照品储备液(37.52 mg·mL-1)1.0,2.0,3.0,4.0,5.0,6.0 mL,分别置于25 mL量瓶中,加水稀释并定容至刻度,制得6种不同浓度的溶液,即1.50,3.00,4.50,6.00,7.50,9.00 mg·mL-1。每种浓度取20 µL,重复进样3次,并记录峰面积,以氨甲环酸浓度C为横坐标,以峰面积(A)为纵坐标,测得标准曲线,回归方程为A= 461.8C+41.98,r2=0.998。结果表明,氨甲环在1.50~ 9.00 mg·mL-1内,浓度与峰面积呈良好线性关系。




图1 高效液相色谱图
A-氨甲环酸对照品;B-果糖注射液;C-转化糖注射液;D-果糖氯化钠注射液。
Fig. 1 HPLC of Tranexamic acid
A-tranexamic acid reference; B-fructose injection; C-invert sugar injection; D-fructose and sodium chloride injection.
2.5 重复性试验
精密称取样品6份,按“2.3.2”项下方法,共制备6份浓度约为4 mg·mL-1的供试品溶液,分别进样以上溶液各20 µL,按“2.2”项下色谱条件重复进样并进行测定,记录峰面积,计算RSD。结果测得峰面积的RSD为0.61%,表明该方法重复性好。
2.6 仪器精密度试验
精密吸取4.50 mg·mL-1的对照品溶液,进样20 µL,重复进样6次,记录峰面积。计算各色谱峰面积的RSD。测得峰面积的RSD为0.95%,表明仪器精密度符合要求。
2.7 加样回收率实验
取已知浓度的氨甲环酸9份,分为3组,分别加入为标示量80%,100%和120%溶液的氨甲环酸对照品,加水溶解并定容至刻度,按“2.2”项下色谱条件进样20 µL,并测定含量,平行操作3次,计算加样回收率,结果见表1。加样回收率实验的回收率为100.2%,RSD为0.45%,表明系统误差小,方法准确度高。
表 1 氨甲环酸回收率测定结果
Tab. 1 The recovery of Tranexamic acid

2.8 配伍稳定性考察
2.8.1 外观、pH测定 取“2.3.2”项下3种供试品(约4 mg·mL-1),在室温(25 ℃)放置,分别于0,1,2,4,6,8 h,观察溶液外观变化并测定pH,结果见表2。观察从配制开始至配制后8 h的溶液外观,结果显示注射用氨甲环酸与3种溶媒配伍后的配伍液在8 h内均澄清透明,外观无变化。由表2可知,配伍后的配伍液pH在8 h内变化小,范围在0.03~0.07之间。
2.8.2 含量测定 分别量取上述3种供试品,按“2.2”项下色谱条件进样20 µL测得峰面积,用外标法计算出0,1,2,4,6,8 h时氨甲环酸的含量,并将0 h的药物含量作为100%,计算出其他时间氨甲环酸的相对百分含量,结果见表3。注射用氨甲环酸与果糖、转化糖和果糖氯化钠3种输液配伍后的含量变化小,稳定性好。
表2 氨甲环酸与不同输液配伍后溶液pH变化
Tab. 2 The pH value of Tranexamic acid in different infusion solution

表3 氨甲环酸与不同输液配伍后的含量变化
Tab. 3 The content of Tranexamic acid in different infusion solution

实验条件的设置应考虑到药品本身的性质并要结合药品临床实际应用情况而定。通常情况下,药物的配制都在室温、光照条件下进行,所以配伍稳定性研究应考察配伍液在室温、光照条件下的稳定性。
在选择流动相时,调节水相和有机相的比例,结果选用0.23%十二烷基硫酸钠溶液(取磷酸二氢钠18.30 g,加水 800 ml溶解,加三乙胺8.30 ml混匀后,再加十二烷基硫酸钠2.30 g,振摇使溶解,用磷酸调节pH至2.5,加水至1 000 ml,摇匀)-甲醇(50∶50)为流动相时,出峰时间适宜且峰形较好。
在流动相中,选择三乙胺作为扫尾剂,可以有效地改善峰形,抑制拖尾。另外,使用磷酸调节pH至2.5时,主成分的出峰时间适宜且峰形较好,而且不会对色谱柱造成损害,除此之外还能提高药物的稳定性。
本次研究在文献[15-16]基础上对高效液相色谱条件进行了部分的改进。实验结果显示所测的氨甲环酸峰形对称,且3种注射液在此条件下不存在峰干扰氨甲环酸的含量测定。表1结果表明该方法回收率高,重复性好,线性范围宽,可以用于该产品的含量测定。
注射用氨甲环酸与输液配伍时的稳定性和输液的pH、温度及配伍后的放置时间密切相关。本次试验考察了注射用氨甲环酸在3种溶媒的配伍稳定性。表2结果显示,在室温条件下,0~8 h内3种配伍液的外观无变化,其pH变化范围在0.05个单位以内。
虽然研究结果表明注射用氨甲环酸与果糖、转化糖以及果糖氯化钠注射液配伍稳定性良好,但是由于药品说明书中未载明,使得临床使用存在超药品说明书的法律风险。药品说明书是医务人员获取药物多方面信息的重要渠道。注射用氨甲环酸的说明书上存在信息不足的问题,缺乏如何稀释、配制、用何种溶媒等相关信息,这无疑增加了医护人员的操作难度,同时也为患者埋下了不安全隐患。建议制药企业增加相关的临床试验,完善注射用氨甲环酸与果糖、转化糖、果糖氯化钠等其他溶剂配伍的临床资料。对此,在临床使用过程中,应当持有谨慎的态度并加强监测。
在配伍稳定性实验中,由于配伍药物会产生降解产物,故实验中定量方法的选择以是否能排除降解产物的干扰为准则。对含多种成分样品的测定,HPLC同时具有分离和定量的功能。所以该方法是药物配伍稳定性实验定量分析方法的较佳选择。表3结果表明注射用氨甲环酸与果糖、转化糖和果糖氯化钠3种输液配伍后8 h内的含量变化小,稳定性好。药物配伍稳定性研究的目的就是要确定药物配伍后有无相互影响、降解产物或新物质产生。在进行研究时,对药物配伍后可能发生的变化并不清楚的情况下,若应用紫外分光光度计法可能会严重影响结果的准确性,给临床安全配伍用药留下极大隐患。
输液的配伍稳定性中,配伍后的药物含量、溶液的外观和溶液的pH值是稳定性的主要内容之一,输液中的不溶性颗粒是考察药物进入人体安全的重要指标,其不溶性微粒数越多,就越不稳定,越容易引起不良反应[17],因此本研究者将进一步考察氨甲环酸与不同溶媒配伍后的输液中的不溶性微粒,为临床使用提供一些依据。
本实验考察了注射用氨甲环酸与三种溶媒的配伍稳定性,通过对药物的含量、配伍溶液的外观、配伍溶液的pH值3个指标的考察进行配伍稳定性研究。研究结果表明,注射用氨甲环酸与三种溶媒配伍后8 h内稳定。
[1] ROBINSON L E, VAN SOEREN M H. Insulin in resistance and hyperglycemia in critical illness: Role of insulin control [J]. AACN Clin Issues, 2004, 15(1) : 45-62.
[2] ZHAO Y, TANG J F, ZHANG H, et al. Compatible stability of Danhong injection mixed with vitamin B6 injection [J]. Chin J New Drugs(中国新药杂志), 2016, 25(14): 1647-1651.
[3] 史长城, 朱慧, 李亚芳. 临床常用药物与果糖注射液配伍稳定性的文献分析 [J]. 中国药房, 2015, 26(5): 718-720.
[4] LIANG Y H. Content determination and compatibility stability of fat-soluble vitamins injection(Ⅱ) in eight kinds of clinical commonly used injections of compound amino acids [J]. Chin J New Drugs Clin Rem(中国新药与临床杂志), 2015, 34(9): 721-725.
[5] HORROW J C, VAN RIPER D F, STRONG M D, et al. The dose response relationship of tranexamic plasma [J] . Blood, 1998, 72(10): 1530-1535.
[6] LUO X M, JIN L, XU R J, et al. Determination of tranexamic acid in human plasma by two-dimensional high performance liquid chromatography and its application in patients with joint arthroplasty [J]. Chin J Hosp Pharm(中国医院药学杂志), 2016, 36(23): 2092-2096.
[7] WANG X, YANG W Y, PU S, et al. The effect of fructose infusion on the levels of blood glucose and insulin in T2DM [J]. Chin J Diab(中华糖尿病杂志), 2005, 13(5): 380.
[8] 陈洁, 赵郁, 徐王廷, 等. 果糖的研究进展[J]. 华西医学杂志, 2000, 15(2): 111-112.
[9] WANG J P, DUAN G M. A study of compatible stability between 54 antibiotics for injection and invert sugar infusion after mixing [J]. Chin J Nosocomiol(中华医院感染学杂志), 2011, 21(14): 3029-3031.
[10] 林洁, 吴明钗. 异甘草酸镁与3种含果糖输液配伍的稳定性考察[J]. 中国药师, 2013, 16(1): 142-144.
[11] 栾家杰. 促进注射剂的安全使用 [J]. 中国执业药师, 2009, 6(4): 43-45.
[12] 李立红. 氨甲环酸粉针剂配制时出现浑浊及解决方案的探讨[J]. 安徽医药, 2010, 14(8): 985-985.
[13] 中国药典. 二部 [S]. 2010, 1-710.
[14] 黄小琴. HPLC法测定注射用氨甲环酸中氨甲环酸的含量 [J]. 海峡药学, 2013, 25(9): 106-108.
[15] HORVATH P, BALOGH G, BRLIK J, et al. Estimation of impurity profiles of drugs and related materials part 16: identification of side products of the ethinylation step in the synthesis of contraceptive gestogens [J]. J Pharma Biomed A nal, 1997, 15(9/10): 343-1349.
[16] XIAO Y, NI K Y. Study of specified impurity in new drugs [J]. Chin J New Drugs(中国新药杂志), 2002, 11(5): 364-367.
[17] ZHAO Y J, XIE S Y, QIAN S, et al. .Measurement of insoluble particles in Salvianolate injection in pharmacy intravenous admixture service [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(8): 1005-1008.
(本文责编:曹粤锋)
XIE Lixiao, CAI Xiaojing, XIE Bing
(Department of Pharmacy, The Third Affiliated Hospital of Wenzhou Medical University, Ruian 325200, China)
ABSTRACT:OBJECTIVE To investigate the compatibility stability of tranexamic acid injection mixed with fructose injection, invert sugar injection, fructose and sodium chloride injection. METHODS To mix with tranexamic acid injection and three kinds of solvent respectively, a variety of physical and chemical properties included the appearance of the liquid at different time (0, 1, 2, 4, 6 and 8 h) at room temperature and pH determined by pH-meter were observed. In addition, the content of tranexamic acid was determined by high performance liquid chromatography. RESULTS The three kinds of compatibility solution (the tranexamic acid injection mixed with fructose injection, invert sugar injection, fructose and sodium chloride injection) were transparent and clear liquid in 8 h. The pH value and the content of tranexamic acid didn’t change basically. CONCLUSION The tranexamic acid injection can be used to mix with fructose injection, invert sugar injection, fructose and sodium chloride injection.
KEY WORDS:tranexamic acid injection; HPLC; compatibility; stability
中图分类号:R917.101
文献标志码:B
文章编号:1007-7693(2017)09-1313-04
DOI:10.13748/j.cnki.issn1007-7693.2017.09.021
引用本文:谢丽晓, 蔡啸静, 谢兵. 注射用氨甲环酸与三种溶媒的配伍稳定性研究[J]. 中国现代应用药学, 2017, 34(9): 1313-1316.
作者简介:谢丽晓,女,副主任药师 Tel: (0577)65862021 E-mail: xlx0922@126.com
收稿日期:2017-04-08