
图1 阿西替尼及内标伊马替尼的质谱图
冯炎林,洪滟,田伟强
(温州医科大学附属五院丽水市中心医院药学部,浙江丽水323000)
摘要:目的 建立UPLC-MS/MS对舌下静脉注射大鼠血浆中阿西替血药浓度的检测方法,并进行其药动学研究。方法 乙腈沉淀法处理样品,以伊马替尼为内标,Waters Acquity BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),流动相为0.1%甲酸水和乙腈。流速为0.3 mL·min-1,柱温35 ℃。质谱条件为电喷雾电离源(ESI),检测方式为正离子电离、多离子反应监测(MRM)检测。结果 阿西替尼血药浓度在0.1~100 ng·mL-1内线性关系良好(r=0.999 6),定量下限为0.1 ng·mL-1。日内、日间精密度RSD<5.56%,提取回收率>87.87%。大鼠血浆中的阿西替尼在室温、4 ℃,-80 ℃,12 h后以及反复冻融3次后均有良好的稳定性,且不存在基质效应。结论 建立的测定阿西替尼血药浓度的方法准确、简单、快速,可以为阿西替尼的临床研究提供实验参考和依据。
关键词:阿西替尼;超高效液相色谱串联质谱法;静脉给药
阿西替尼是一个有效的选择性酪氨酸激酶抑制剂(TKI),能够有效抑制血管内皮生长因子受体(VEGFR)1,2和3[1-2]。VEGFR能够供应肿瘤的氧气和营养物质,在肿瘤快速增长的阶段发挥着重要的作用。在早期实验研究中发现,阿西替尼在体外能够阻断由血管内皮生长因子介导的内皮细胞存活[3]和下游信号通路,抑制血管生成和肿瘤生长[4-5]。近期,阿西替尼由于其良好的抗肿瘤作用在临床治疗上得以广泛的应用,包括肾细胞癌、甲状腺癌、非小细胞肺癌[6-9]。尽管阿西替尼的药理学特征已经有广泛报道,但静脉注射给予阿西替尼的药动学研究却少有报道。为此本研究通过对大鼠舌下静脉注射阿西替尼后的药动学研究,进一步确定阿西替尼在体内的代谢过程,有助于更好地为阿西替尼的临床研究提供更多有效的信息。
1.1 试剂
阿西替尼(上海创赛博飞美科,批号:C84- 1394,纯度>99%);内标甲磺酸伊马替尼(美国Sellect Chemicals LLC,批号:S1026,纯度>99%)。水为经由Milli-Q A10超纯水系统进行过滤的超纯水。色谱纯甲醇和乙腈(德国默克公司)。其余的有机试剂均为分析纯。
1.2 仪器
Waters ACQUITY I超高效液相色谱(美国Waters公司),Waters XEVO TQD 三重四级杆质谱(美国Waters公司),含有电喷雾化离子源(ESI),色谱工作站:Masslynx 4.1;高速离心机(上海安亭科学仪器厂);涡旋混合器(江苏海门其林贝尔仪器制造有限公司);电子分析天平(上海方瑞仪器有限公司);Milli-Q A10超纯水系统(美国Millipore公司)。
1.3 动物
6只SD大鼠,♂,体质量250~280 g,均来自温州医科大学动物实验中心,实验动物许可证号:SYXK(浙)2015-0009。所有的SD大鼠饲养在相对恒定和自然通风的实验环境下[温度为(25±1)℃,相对湿度为(55±10)%]。同时给予标准的饲料(20%蛋白质,3%脂肪,2%纤维,6%矿物质和69%淀粉及维生素添加剂)和水进行喂养。适应7 d后(300~350 g)进行相关实验。
1.4 对照品溶液的配制
分别用电子分析天平精密称取阿西替尼和内标甲磺酸伊马替尼对照品10 mg于10 mL的量瓶中,用甲醇溶解并定容至刻度线,混匀,得浓度为1 mg·mL-1的阿西替尼和内标甲磺酸伊马替尼对照品储备液,于4 ℃冰箱保存备用。
2.1 色谱条件
Waters Acquity BEH C18色谱柱(2.1 mm× 100 mm,1.7 μm);流动相:乙腈(A)-0.1%甲酸水溶液(B);梯度洗脱:0~0.5 min,35%→90%A,0.5~1.3 min,90%A,1.3~1.5 min,90%→35%A,1.5~3 min,35%A;流速:0.3 mL·min-1;柱温35 ℃。
2.2 质谱条件
扫描方式为多反应离子监测模式(MRM),定量的正离子对分别为: 阿西替尼:m/z387.3/355.8和内标伊马替尼:m/z494.2/394.2。驻留时间:63 ms;毛细管电压:2.99 kV;离子源温度:150 ℃;去溶剂气温度:498 ℃;喷雾气和锥气分别为1 000 L·h-1和50 L·h-1的N2。
2.3 样品处理方法
将保存于-80 ℃冰箱的血浆样品置于室温下解冻并涡旋混匀;取100 μL于1.5 mL的EP管中,加入乙腈溶剂200 μL沉淀蛋白,再加入500 ng·mL-1的伊马替尼甲醇溶液20 μL,涡旋混匀2 min;1 3000 r·min-1离心10 min,取上清100 μL与100 μL超纯水(1∶1)稀释混匀;取5 μL的稀释液注入UPLC-MS/MS系统进行分析检测。
2.4 方法学验证
2.4.1 专属性 配制500 ng·mL-1阿西替尼和伊马替尼经UPLC-MS/MS检测分析得到质谱图。空白血浆、空白血浆中加入阿西替尼和伊马替尼对照品以及大鼠血浆样品,经 UPLC-MS/MS检测分析得到色谱图。
2.4.2 标准曲线 配制阿西替尼浓度分别为 0.1,0.5,1,2.5,5,10,50,100 ng·mL-18个浓度梯度的血浆标准溶液,按“2.3”项下方法处理后用 UPLC-MS/MS检测,绘制标准曲线。
2.4.3 精密度 在空白血浆中中配制低、中、高3个浓度梯度的阿西替尼样品(分别为0.2,10和100 ng·mL-1),对每一浓度进行6个样本分析,按“2.3”项下方法进行样品处理,5 μL UPLC-MS/MS进样,连续6 d测定,计算日内和日间精密度。
2.4.4 提取回收率 分成2组进行处理,第1组是在空白血浆中配制低、中、高3个浓度梯度的阿西替尼样品(分别为0.2,10和100 ng·mL-1),对每一浓度进行6个样本分析,按“2.3”项下方法进行处理,进样后,记录得到的阿西替尼的平均峰面积为A1。
第2组是另取空白血浆200 μL,加入400 μL乙腈,涡旋2 min,13 000 r·min-1离心10 min,取上清液,在上清液中加入阿西替尼对照品配制成低(0.2 ng·mL-1)、中(10 ng·mL-1)、高(100 ng·mL-1) 3个浓度,直接进样,对每一浓度进行6个样记录得到的阿西替尼的平均峰面积为A2。
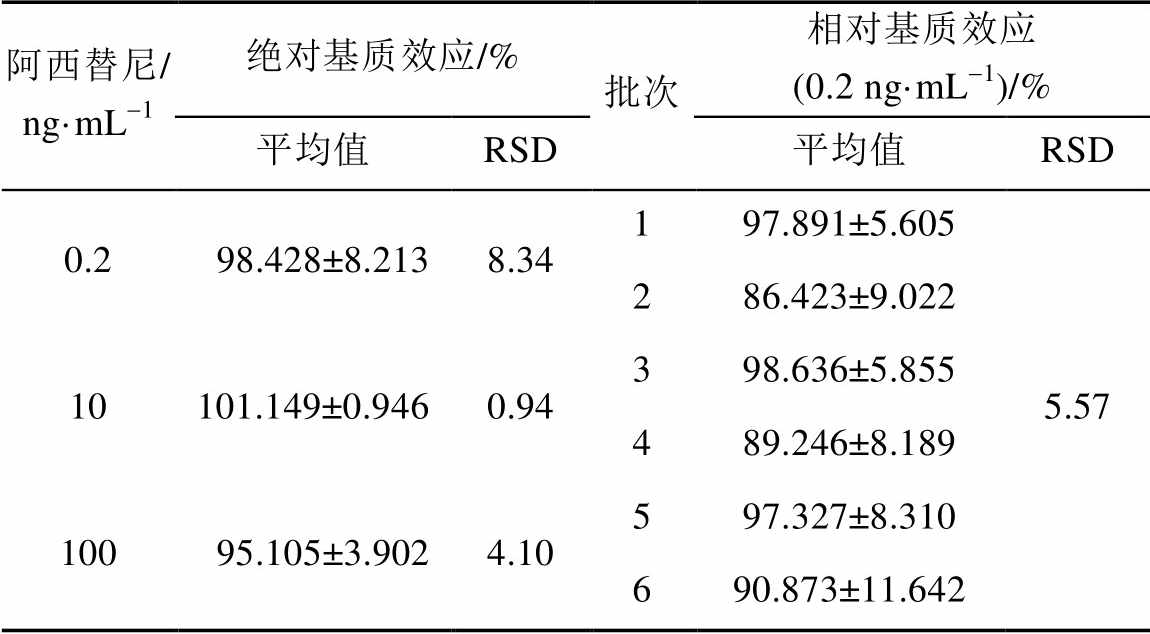
2.4.5 绝对基质效应和相对基质效应 取空白血浆200 μL,加入400 μL乙腈,涡旋2 min,13 000 r·min-1离心10 min,取上清液,在上清液中加入阿西替尼对照品配制成低(0.2 ng·mL-1)、中(10 ng·mL-1)、高(100 ng·mL-1)3个浓度,直接进样,对每一浓度进行6个样本分析,记录得到阿西替尼的平均峰面积V;分别取6个不同批次的空白血浆200 μL,加入400 μL乙腈,涡旋2 min,13 000 r·min-1离心10 min,取上清液,在上清液中加入阿西替尼标准品配制成0.2 ng·mL-1,直接进样,对每一批次血浆进行6个样本分析,记录得到阿西替尼的平均峰面积V1-6;
同时配制低(0.2 ng·mL-1)、中(10 ng·mL-1)、高(100 ng·mL-1)3个浓度梯度的阿西替尼纯甲醇标准品溶液,直接进样,对每一浓度进行6个样本分析,记录得到的阿西替尼的平均峰面积为VS。
2.4.6 稳定性 在空白血浆中配制低、中、高3个浓度梯度的阿西替尼样品(分别为0.2,10和100 ng·mL-1),按“2.3”项下方法处理后,把样本放置在室温,4 ℃,-80 ℃ 12 h后以及反复冻融3次,再进行检测,对每一浓度进行6个样本分析记录不同浓度在不同条件影响后阿西替尼由标准曲线计算所得浓度。
2.5 方法学应用
将6只SD大鼠舌下静脉给于阿西替尼(1 mg·kg-1),于第0.083,0.167,0.33,0.5,1,2,3,4,6,8,12,24 h采集血样各0.5 mL,4 ℃ 13 000 r·min-1离心10 min取血浆保存在-80 ℃冰箱备用。
2.6 数据处理
本实验采用非房室模型统计矩参数的方法,血药浓度数据经DAS 3.0软件拟合计算,得到药动学参数如峰浓度(Cmax)、药物-时间曲线下面积(AUC)、半衰期(t1/2)、清除率(CL/F)等。根据实验中测定的大鼠血浆的阿西替尼浓度和时间,经Origin 8.0绘制血浆药物浓度-时间曲线。
3.1 方法学验证
3.1.1 方法的专属性 500 ng·mL-1阿西替尼和伊马替尼经UPLC-MS/MS检测分析所得的质谱图见图1。
空白血浆、空白血浆中加入阿西替尼和伊马替尼对照品以及大鼠血浆样品,经 UPLC-MS/MS检测分析测定得到色谱图见图2。由图可见,在该实验条件下,各物质不相互干扰,血浆中没有内源性物质干扰目标物质出峰,方法专属性良好;阿西替尼保留时间为0.87 min,伊马替尼保留时间为0.64 min。
3.1.2 线性关系及定量下限 配制阿西替尼浓度分别为0.1,0.5,1,2.5,5,10,50,100 ng·mL-18个浓度梯度的血浆标准溶液,按“2.3”项下方法处理后用UPLC-MS/MS 检测,测定阿西替尼峰面积As,内标峰面积Ai。以As/Ai为纵坐标(y),阿西替尼对应各点浓度为横坐标(x)绘制标准曲线,权重系数为1/x2,得阿西替尼标准曲线为y= 0.020 038 3x+ 0.009 276 77,r=0.999 6。阿西替尼的定量下限为0.1 ng·mL-1。

图1 阿西替尼及内标伊马替尼的质谱图
A-阿西替尼;B-伊马替尼。
Fig. 1 The chemical structures and daughter scan ion spectra ofAxitinib and IS in the present study
A-Axitinib; B-Imatinib(IS).
3.1.3 精密度 日内和日间精密度RSD均<5%,满足实验条件。结果见表1。
表1 UPLC-MS/MS法测定血浆中阿西替尼的日内、日间精密度(n=6)
Tab. 1 Determination of intra-day and inter-day precision of Axitinib in plasma by UPLC-MS/MS(n=6)

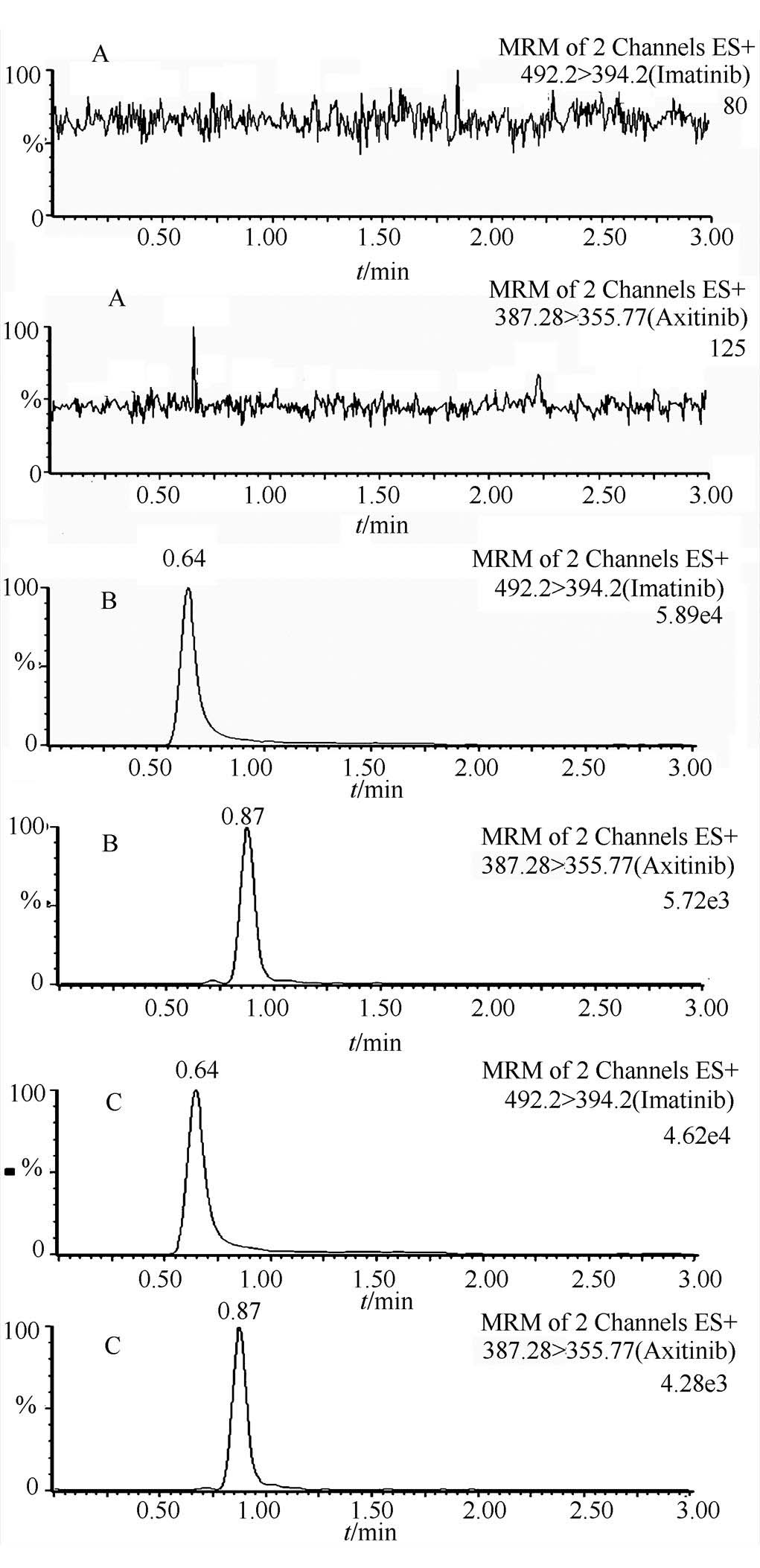
图2 阿西替尼及内标伊马替尼的UPLC色谱图
A-空白血浆;B-空白血浆中加入对照品阿西替尼和伊马替尼;C-血浆样品。
Fig. 2 Representative chromatograms of Axitinib and IS in rat plasma samples.
A-blank plasma sample; B-blank plasma sample spiked with Axitinib and IS; C-plasma sample from a rat after intravenous administration 1 mg·kg-1Axitinib.
3.1.4 提取回收率 按“2.4.4”项下方法进行处理和测定。记录不同浓度阿西替尼的峰面积。其中提取回收率为A1/A2×100%。结果见0.2,10,100 ng·mL-1阿西替尼的提取回收率分别为(94.798±6.102)%,(94.839±0.505)%,(87.864± 2.12)%,RSD分别为6.44%,0.53%,2.41%。
3.1.5 绝对基质效应和相对基质效应 按“2.4.5”项下方法进行处理和测定。其中绝对基质效应为V/VS×100%,相对基质效应为V1-6/VS×100%。结果见表2。
表2 UPLC-MS/MS法测定空白血浆中阿西替尼的绝对基质效应和相对基质效应(n=6)
Tab. 2 Determination of absolute ME andrelative ME of Axitinib in plasma by UPLC-MS/MS(n=6)
3.1.6 稳定性 按“2.4.6”项下方法处理后,记录不同浓度不同条件影响后阿西替尼由标准曲线计算所得的浓度,结果见表3。由表3的结果可以看出血浆样品经过处理后在室温,4 ℃,-80 ℃ 12 h以及反复冻融后均有良好的稳定性。
3.2 方法学应用及数据分析
6只SD大鼠单剂量舌下静脉注射阿西替尼后得到的平均血药浓度-时间曲线见图3,采用DAS 3.0对阿西替尼的药动学参数进行分析,结果见表4。
现在越来越多的液相分析方法在分离各项化合物中得到广泛应用[10]。其中UPLC–MS/MS由于其快速的分析过程、精确的分析方法、简单的样品处理方式,而应用于各项生物样品的定量测定[11]。本实验使用阳离子检测的电喷雾离子化质谱检测得到更好的灵敏度,每个样品阿西替尼和内标的完全分离时间仅在3 min内完成。通过用简单的乙腈蛋白沉淀法制备样品,与液液萃取或固相萃取相比,简化了样品处理过程,减少了样品制备时间,为临床阿西替尼的药动学的研究提供了准确、简单、快速的检测方法。
表3 UPLC-MS/MS法测定空白血浆中阿西替尼的方法稳定性(n=6)
Tab. 3 Stability results of Axitinib in rat plasma in different conditions(n=6)

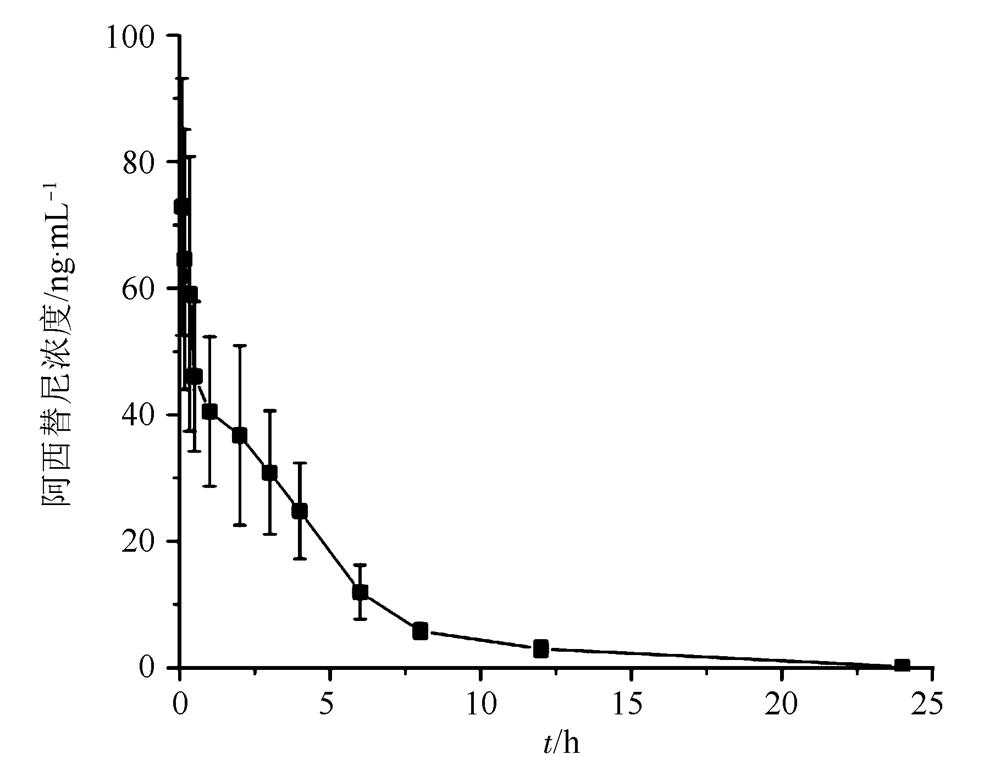
图3 大鼠舌下静脉注射1 mg·kg-1阿西替尼的药时曲线图(n=6)
Fig. 3 Concentration versus time curves of axitinib in rats after a single intravenous administration at 1 mg·kg-1(n=6)
表4 大鼠舌下静脉注射阿西替尼(1 mg·kg-1)的药动学参数(n=6)
Tab. 4 The pharmacokinetic parameters of axitinib in rat plasma after intravenous administration 1 mg·kg-1(n=6)

[1] Brennan M, Williams J A, Chen Y, et al. Meta-analysis of contribution of genetic polymorphisms in drug-metabolizing enzymes or transporters to axitinib pharmacokinetics [J]. Eur j Clin pharm, 2012, 68(5): 645-655.
[2] FANG X X, GUO W Y. Study of preparation andin vitroactivity of stearyl alcohol galactosidase modified axitinib liposomes [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(8): 1034-1040.
[3] Rini B I, Wilding G, Hudes G, et al. Phase II study of axitinib in sorafenib-refractory metastatic renal cell carcinoma [J]. J Clin Oncol, 2009, 27(27): 4462-4468.
[4] Rugo H S, Herbst R S, Liu G, et al. Phase I trial of the oral antiangiogenesis agent AG-013736 in patients with advanced solid tumors: pharmacokinetic and clinical results [J]. J Clin Oncol, 2005, 23(24): 5474-5483.
[5] Pithavala Y K, Chen Y, Toh M, et al. Evaluation of the effect of food on the pharmacokinetics of axitinib in healthy volunteers [J]. Cancer chemother pharmacol, 2012, 70(1): 103-112.
[6] Garrett M, Poland B, Brennan M, et al. Population pharmacokinetic analysis of axitinib in healthy volunteers [J]. Br J clin pharmacol, 2014, 77(3): 480-492.
[7] Cohen E E, Rosen L S, Vokes E E, et al. Axitinib is an active treatment for all histologic subtypes of advanced thyroid cancer: results from a phase II study [J]. J Clin Oncol,2008, 26(29): 4708-4713.
[8] Bagcchi S. Axitinib: VEGF inhibition in advanced thyroid cancer [J]. Lancet Oncol, 2014, 15(8): e310.
[9] Rini B I, Garrett M, Poland B, et al. Axitinib in metastatic renal cell carcinoma: results of a pharmacokinetic and pharmacodynamic analysis [J]. J clin pharmacol, 2013, 53(5): 491-504.
[10] Beri J, Rosenblatt M M, Strauss E, et al. Reagent for evaluating liquid chromatography-tandem mass spectrometry (LC-MS/MS) performance in bottom-up proteomic experiments [J]. Anal chem, 2015, 87(23): 11635-11640.
[11] Bouchet S, Chauzit E, Ducint D, et al. Simultaneous determination of nine tyrosine kinase inhibitors by 96-well solid-phase extraction and ultra performance LC/MS-MS [J]. Clin Chim Acta, 2011, 412(11-12): 1060-1067.
(本文责编:曹粤锋)
Feng Yanlin, Hong Yan, Tian Weiqiang
(Department of phmarcy, the Fifth Affiliated Hospital of Wenzhou Medical University, Lishui Municipal Central Hospital, Lishui 323000, China)
Abstract:Objective To develop a ultra high-performance liquid chromatography–tandem mass spectrometry separation method(UPLC-MS/MS) for the pharmacokinetic study of Axitinib after intravenous administration. Methods Plasma samples were treated by acetonitrile precipitation. The effective UPLC-MS/MS separation of the examined compounds was applied on an Acquity BEH C18column (2.1 mm×50 mm, 1.7 μm) column with a gradient mobile phase system consisting of 0.1% formic acid in water and acetonitrile. The analysis was performed with a flow rate of 0.3 mL·min-1. An electrospray ionization (ESI) was used to detect in a positive ion mode. The scanning mode was MRM.Results The assay was validated over concentration ranges of 0.1–100 ng·mL-1, with a lower limit of quantification (LLOQ) of 0.1 ng·mL-1. Intra- and inter-assay precision values for replicate quality control samples were within 5.56%. Assay recoveries of Axitinib was higher than 87.87%. Axitinib were stable in rat plasma for at least 24 h at room temperature, 30 days at 4 ℃ and −20 ℃, and following at least three freeze–thaw cycles. Furthermore, no notable matrix effect was observed for Axitinib. Conclusion The accurate and simple method developed can be provided the basis and applied to clinical pharmacokinetic study.
Key words:Axitinib; UPLC–MS/MS; intravenous administration
中图分类号:R917.101
文献标志码:B
文章编号:1007-7693(2017)09-1304-05
DOI:10.13748/j.cnki.issn1007-7693.2017.09.019
引用本文:冯炎林,洪滟,田伟强. UPLC-MS/MS测定大鼠舌下静脉注射阿西替尼的血药浓度及其药动学研究[J]. 中国现代应用药学, 2017, 34(9): 1304-1308.
作者简介:冯炎林,男,硕士,主管药师 Tel: (0578)2285722 E-mail: e.t.1225@126.com
收稿日期:2017-03-30