表1 3组患者的临床病理资料比较(n=35)
Tab. 1 Comparison of clinical data between the three groups(n=35)

闫鼎鼎,周建松,徐小仙,殷卓敏,刘南芳,袁淑慧,倪镌,李莉,楼寒梅*
(浙江省肿瘤医院妇瘤放疗科,杭州310022)
摘要:目的 比较3种同步化疗方案在中晚期宫颈癌放疗中的疗效及不良反应。方法 将符合入组标准的105例IIB-IIIB中晚期宫颈癌患者随机分为DDP组、FP组、TP组,每组各35例,均行根治性放疗,DDP组放疗期间给予顺铂单药周疗,共4~5程,FP组给予氟尿嘧啶及顺铂联合化疗,间隔3周疗法,共2程,TP组给予紫杉醇及顺铂联合化疗,间隔3周疗法,共2程,对3组患者的疗效及不良反应分别进行记录。结果 根治性放疗结束1月后3组患者的完全缓解率(complete remission rate,CR)分别为88.6%,82.9%,82.9%,部分缓解率(partial remission rate,PR)分别11.4%,17.1%,11.4%;治疗结束3月后3组患者的CR率分别为97.1%,97.1%,94.3%,3组比较差异均无统计学意义。3组的2年总生存率分别为97.1%,85.7%,91.4%,2年的无瘤生存率分别为82.9%,85.7%,88.6%,差异均无统计学意义。主要近期不良反应为骨髓抑制和胃肠道反应,TP组3~4度白细胞减少及中性粒细胞减少的发生率最显著,FD组3~4度恶心、呕吐、腹泻及肠梗阻的发生率最显著,差异均有统计学意义(P<0.05),远期不良反应为放射性肠炎及放射性膀胱炎,3组的发生率均无统计学意义。结论 中晚期宫颈癌根治性放疗中3种同步化疗方案的近期疗效相似,2年的总生存率及无瘤生存率无差异,紫杉醇联合顺铂组的骨髓抑制最严重,氟尿嘧啶联合顺铂组的胃肠道反应最严重。
关键词:宫颈癌;同步放化疗;顺铂;氟尿嘧啶;紫杉醇
宫颈癌是最常见的妇科恶性肿瘤之一,发病率仅次于乳腺癌,居女性肿瘤致死原因的第2位。早期宫颈癌的治疗以手术为主,中晚期宫颈癌的治疗以放疗为主。1999年,5个大型前瞻性的临床随机试验的研究结果表明,以顺铂(cisplatin,DDP)为基础的同步放化疗提高了中晚期宫颈癌患者的生存率,死亡风险下降了30%~50%[1-5]。由此美国国立癌症研究院(NCI)和美国国家综合癌症网络(NCCN)的指南均提出将放疗联合含有顺铂的同步化疗作为中晚期宫颈癌的标准治疗。近年来临床尝试发现更高效低毒的化疗组合[6],但至今最佳的同步化疗方案仍未有定论,因此笔者比较顺铂单药周疗(DDP)、氟尿嘧啶联合顺铂(5-fluorouracil+DDP,FP)、紫杉醇联合顺铂(paclitaxel+DDP,TP)这3种同步化疗方案在中晚期宫颈癌放疗中的疗效及不良反应,寻求优势化疗方案。
1.1 一般资料
研究对象为浙江省肿瘤医院2014年4月—2015年9月收治的IIB-IIIB 105例中晚期宫颈癌患者,入组标准:①年龄范围18~65岁;②宫颈的病理组织学确诊为鳞癌、腺癌、腺鳞癌;③FIGO分期为IIB-IIIB期;④既往无放疗、化疗史;⑤无导致放化疗禁忌的严重内科疾病,KPS评分≥70分。排除标准:①同时存在第2部位原发恶性肿瘤且未治愈者;②对化疗药物顺铂、氟尿嘧啶、紫杉醇药物过敏者;③有严重内科疾病不能耐受化疗;④由于心理、社会、家庭及地理原因不能执行治疗计划或进行实验室检查,依从性差不能配合定期随访的。
1.2 治疗方法
1.2.1 放疗 所有患者均接受统一标准的根治性放疗(体外放疗+后装治疗)。①体外放疗:采用西门子PRIMUS H直线加速器10MV-X线盆腔三维适形放疗,盆腔剂量45~50 Gy,影像学或病理提示盆腔转移淋巴结局部加量至55~60 Gy,另外影像学或病理提示髂总或腹主动脉旁淋巴结转移者,则给予盆腔及腹主动脉旁延伸野的调强放疗。②后装治疗:体外放疗结束后给予Ir192后装腔内放疗,A点剂量25~30 Gy,根据阴道受侵范围给予阴道黏膜下0.5 cm剂量10~25 Gy。
1.2.2 化疗方案 105例患者采用随机数字表法随机分入DDP组、FP组和TP组,每组35例,放疗开始即予以化疗。DDP组:顺铂40 mg·m-2静滴1 d,每周1次,共4~5疗程;FP组:氟尿嘧啶4.0 mg·m-2微泵维持96 h+顺铂65 mg·m-2静滴1 d,间隔3~4周重复,共2疗程;TP组:紫杉醇135 mg·m-2静滴1 d+顺铂65 mg·m-2静滴1 d,间隔3~4周重复,共2疗程。
1.3 疗效及不良反应评价
患者在治疗期间每周行血常规及肝肾功能检查,分别记录胃肠道反应、骨髓毒性、肝肾功能、电解质,急性期不良反应评价标准参照《常见不良反应事件评价标准CTCAE4.0》。
患者在治疗前、治疗结束时及治疗后随访期间行妇科检查、血清相关肿瘤标志物、盆腔MRI和/或腹盆腔CT检查,评价疗效。近期疗效评价依据RECIST 1.1疗效评定标准:①完全缓解(CR):所有靶病灶消失,全部病理性淋巴结(包括靶结节和非靶结节)的短直径必须减少至<10 mm;②部分缓解(PR):靶病灶直径之和比基线水平减少至少30%;③疾病进展(PD):以整个治疗过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%,除此之外,必须满足直径和的绝对值增加至少5 mm(出现一个或多个新病灶也视为疾病进展);④病情稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平。
1.4 统计学方法
采用SPSS 20.0软件对所采集的数据进行统计学分析,生存分析采用Kaplan-Meier法,行Logrank检验,计数资料采用c2检验,P<0.05为差异有统计学意义。
105例入组患者的年龄范围为31~65岁,中位年龄51岁。3组间各项临床指标无统计学差异,3组患者的临床病理资料见表1。
2.1 近期疗效比较
所有患者均完成治疗,治疗结束后1个月及3个月行妇科检查及盆腔MRI或盆腔CT评价近期疗效。治疗结束后1个月时DDP组的CR 88.6%,PR 11.4%,FP组的CR 82.9%,PR 17.1%,TP组的CR 82.9%,PR 11.4%,PD 5.7%,3组之间的CR、PR、PD的差异均无统计学意义,结果见表2。
表1 3组患者的临床病理资料比较(n=35)
Tab. 1 Comparison of clinical data between the three groups(n=35)

表2 3组患者治疗结束后1个月的疗效比较(n=35)
Tab. 2 Comparison of clinical effects after the end of treatment for 1 month between three groups(n=35)

治疗结束后3个月时DDP组的CR 97.1%,PD 2.9%,FP组的CR 97.1%,PR 2.9%,TP组的CR 94.3%,PD 5.7%,3组之间的CR、PR、PD的差异均无统计学意义,结果见表3。
表3 3组患者治疗结束后3个月的疗效比较(n=35)
Tab. 3 Comparison of clinical effects after the end of treatment for 3 months between three groups(n=35)
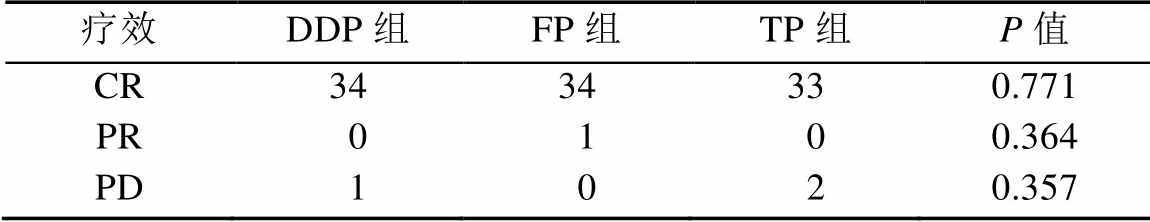
DDP组和TP组患者1个月和3个月的CR率无明显差异,FP组患者3个月的CR高于1个月的CR,差异有统计学意义(P<0.05),结果见表4。
2.2 急性期不良反应的比较
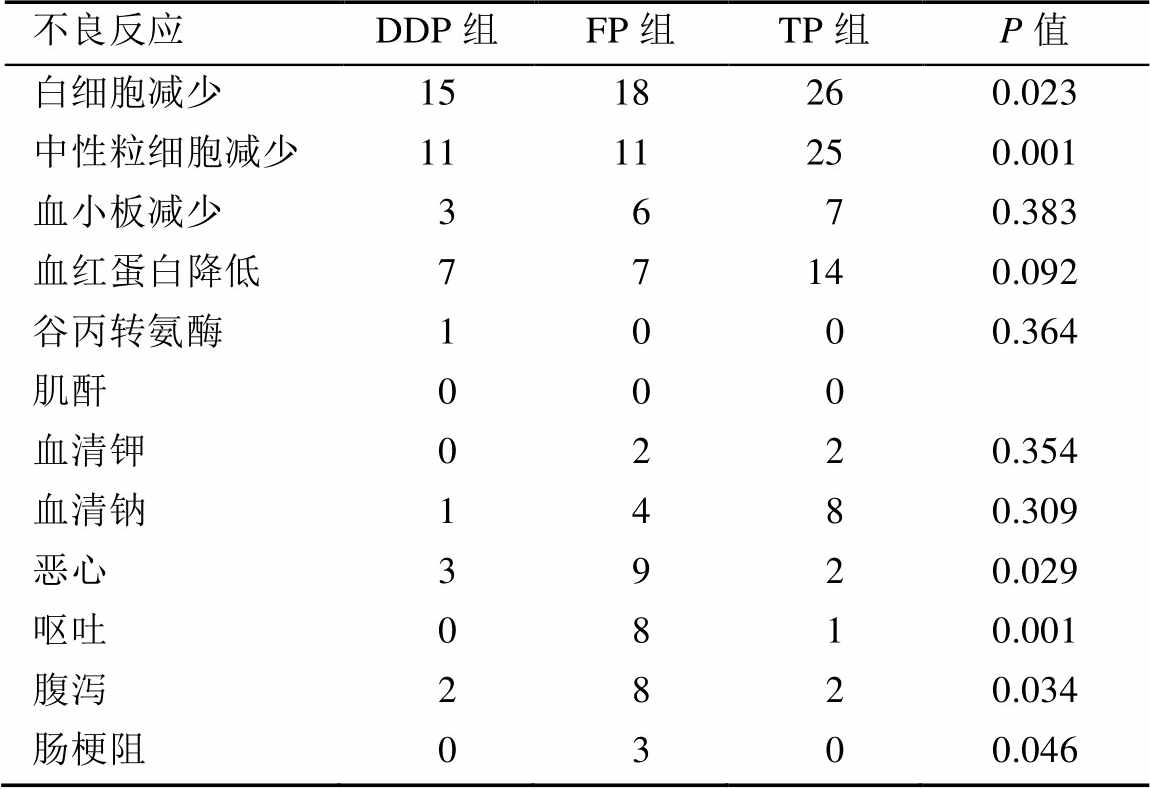
放化疗期间患者主要的急性不良反应为血液学毒性及胃肠道反应。血液学毒性:TP组的3~4度白细胞减少及中性粒细胞减少的发生率分别为74.3%和71.4%,高于其他2组(P=0.023、P=0.001),3~4度的贫血及血小板减少发生率3组无统计学差异。胃肠道反应:FP组的3~4度恶心、呕吐、腹泻、肠梗阻发生率分别为25.7%,22.9%,22.9%,8.6%,均显著高于其他2组(P<0.05)。其他反应:DDP组1例发生3度肝功能损伤,余无明显3~4度肝肾功能损伤;3组3~4度电解质紊乱的差异无统计学意义。结果见表5。
表4 3组患者治疗结束后1个月和3个月之间的疗效比较(n=35)
Tab. 4 Comparison of clinical effects after the end of treatment for 1 month and 3 months of three groups(n=35)

表5 3组患者的3~4度急性期不良反应比较(n=35)
Tab. 5 Comparison of grade 3-4 acute adverse reactions between three groups(n=35)
2.3 急性期不良反应的处理
放化疗期间出现3度及以上血液学毒性反应,需要积极对症处理,处理方式如下:白细胞及中性粒细胞下降者予以皮下注射粒细胞集落刺激因子(G-CSF);血小板下降者予以重组人白介素-11 (rhIL-11)治疗;Hb<90 g·L-1者,应用促红细胞生成素或输注红细胞;4度毒性反应则停放疗。所有患者采用统一的化疗止吐方案:盐酸甲氧氯普胺、盐酸托烷司琼注射液联合地塞米松,化疗后仍发生3度以上的恶心、呕吐再次予以盐酸甲氧氯普胺±盐酸托烷司琼注射液治疗;4度的腹泻或肠梗阻者予停放疗,并予以禁食补液对症支持治疗。
DDP组4例出现4度白细胞减少和(或)粒细胞减少,均予停放疗1 d及G-CSF治疗,次日恢复,1例出现4度血小板减少,予停放疗4 d及rhIL-11治疗后好转,1例因肠梗阻停放疗3 d。FP组2例出现4度的白细胞减少和/或粒细胞减少,停放疗1 d及G-CSF治疗后次日恢复,3例因肠梗阻停放疗3~7 d。TP组9例出现4度白细胞减少和(或)粒细胞减少,予停放疗1~2 d及G-CSF治疗后恢复,1例出现4度血色素减少,予以输血治疗后好转,1例出现4度血小板减少,停放疗3 d及rhIL-11治疗后好转,1例因肠梗阻停放疗3 d。3组患者的治疗时间范围分别为DDP组43~83 d,FP组50~83 d,TP组49~81 d,中位时间均为58 d (P=0.486)。
2.4 远期疗效比较
所有患者治疗结束后开始进入随访,随访截至2017年4月30日,随访时间为17~34个月,中位随访时间为24个月,DDP组、FP组、TP组的2年总生存率分别为97.1%,85.7%,91.4%,2年无瘤生存率分别为82.9%,85.7%,88.6%,3组的2年总生存率及无瘤生存率差异均无统计学意义。DDP组局部复发2例,远处转移5例;FP组局部复发2例,远处转移4例,TP组局部复发3例,远处转移1例。结果见图1~2。
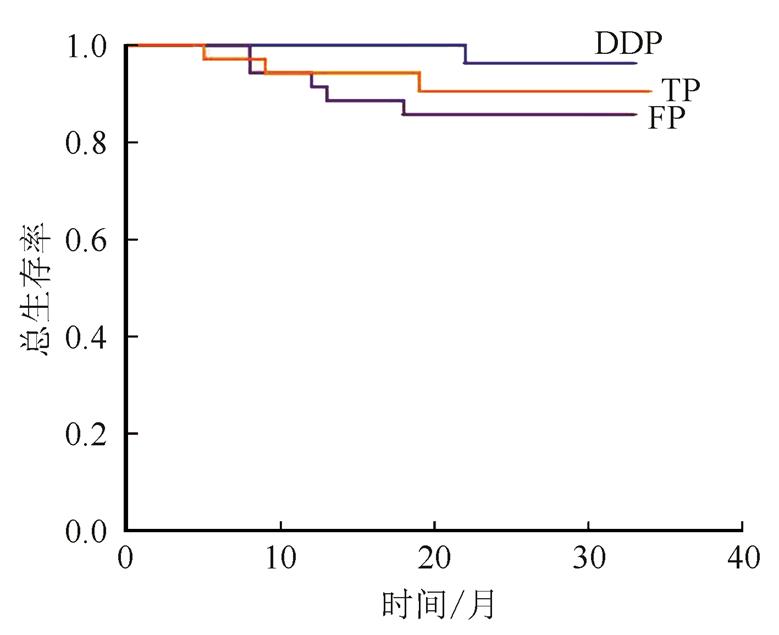
图1 3组患者2年总生存率比较
Fig. 1 The 2-year overall survival rate between three groups
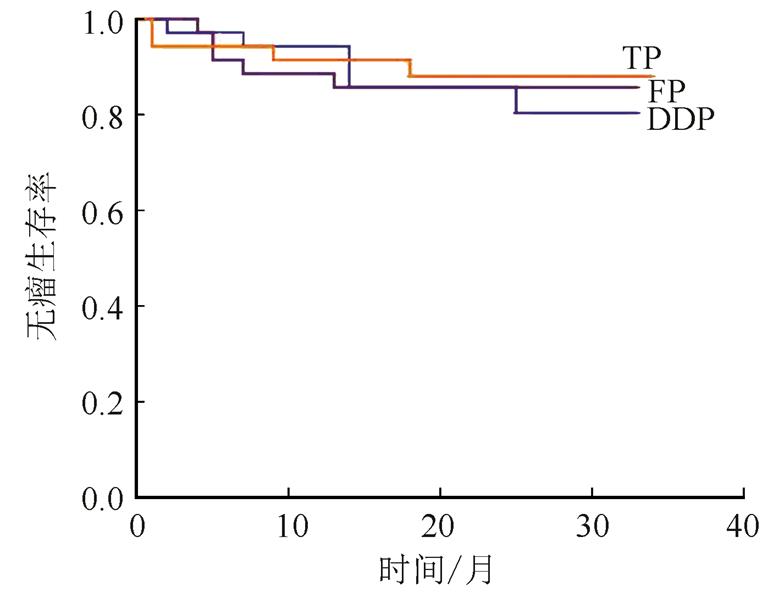
图2 3组患者2年的无瘤生存率比较
Fig. 2 The 2-year disease-free survival rate between three groups
2.5 远期不良反应的比较
在随访期间,常见的不良反应为放射性肠炎及放射性膀胱炎,多数为轻度,DDP组、FP组、TP组放射性肠炎的发生率为20.0%,17.1%,17.1%,放射性膀胱炎的发生率为2.9%,2.9%,5.7%,3组差异均无统计学意义。其中FP组有2例因肠瘘行手术治疗,TP组有1例因肠梗阻行手术治疗。结果见表6。
表6 3组患者远期不良反应比较(n=35)
Tab. 6 Comparison of long-term adverse reactions between three groups(n=35)

Petrelli等[7]对1990—2014年期间的8项宫颈癌同步放化疗研究的meta分析表明,以顺铂为基础的同步放化疗分别能提高9%、7%的总生存率、无进展生存率。在推荐方案DDP或FP的基础上,目前的研究方向为其他的细胞毒性药物如紫杉醇、卡铂、健择、拓扑替康等的联合化疗[6]。两项针对健择+顺铂的同步放化疗研究表明其疗效略优于顺铂单药,但不良反应大,作为优选方案尚值得斟酌[8-9]。因此宫颈癌同步放化疗诸多方案的疗效以及不良反应需要进一步综合评估,寻求最佳方案。
一些小样本关于DDP周疗与FP方案的回顾性研究显示出不同的临床结局,李小凡等[10]回顾性分析了IB-IVA宫颈癌放疗患者,59例行DDP周疗,87例行FP方案化疗,结果2组的疗效相当,但FP组的消化道反应明显高于DDP组,认为铂类单药更具有优势。Nedovic等[11]的研究结果却表明FP方案的疗效优于DDP周疗。近年来TP方案成为复发转移或IV期宫颈癌的标准化疗方案[12],理论上紫杉醇通过促进微管蛋白聚合,抑制解聚,从而保持微管蛋白稳定,抑制细胞有丝分裂,使细胞中止于对放疗敏感的G2/M期,有助于增强肿瘤的放射敏感性,且体外实验也证实了紫杉醇具有显著的放射增敏作用[13]。Miglietta等[14]的一项非对照临床研究表明在局部中晚期宫颈癌及中心性复发宫颈癌的放疗中使用紫杉醇175 mg·m-2联合顺铂75 mg·m-2,间隔3周重复,是可以耐受且有较好的疗效。I期临床试验证实紫杉醇联合顺铂周疗在局部中晚期宫颈癌同步放化疗中有良好的疗效[15]。
宫颈癌化疗中TP方案(间隔3周疗法)紫杉醇的剂量一般为135~175 mg·m-2 [12-14],考虑到同步放化疗的不良反应重,中晚期宫颈癌患者常合并慢性消耗、感染、失血性贫血等,故本研究的紫杉醇剂量为135 mg·m-2,仍观察到TP组明显的血液学毒性,3~4度白细胞减少和中性粒细胞减少发生率分别为74.3%和71.4%,高于文献报道[14],但与韩国学者的报道[16]相近,可能与亚洲人群的耐受度有关。本研究中的白细胞减少和中性粒细胞减少均可经G-CSF治疗后快速恢复正常。3组的贫血和血小板减少的发生率类似,与文献[16]报道相近。
在相同止吐方案的基础上,FP组3~4度的恶心、呕吐、腹泻及肠梗阻的发生率均显著高于另外2组,与文献报道[10-16]相似。3组治疗中发生电解质紊乱的状态无明显差异,FP组3~4度低钠的发生率相对常见(22.9%),与该组患者胃肠道反应较大有关。
3组患者3个月的CR高于1个月的CR,符合放射治疗肿瘤消退的规律,因此临床常需要3个月的观察以确定近期疗效。3组患者之间的CR、PR相比较无统计学差异。3组患者2年的总生存率及无瘤生存率比较无统计学差异。由于中晚期宫颈癌放疗后的5年生存率约为33%~75%[17],因此近期疗效仅反应了疗效的一面,需进一步随访以比较5年生存率。
综上所述,本研究的3组同步放化疗方案胃肠道反应以及血液学毒性各有特点,部分患者因不良反应暂停治疗,但3组比较总治疗时间并无差异。可考虑治疗中,根据不同的化疗方案给予相应的临床处理,TP组可预防性使用G-CSF以减轻血液学毒性,FP组可预防性使用肠道黏膜保护剂以减轻胃肠道反应。本研究尚需要扩大样本,进一步观察远期不良反应以及长期生存情况,结果有望为中晚期宫颈癌同步放化疗提供指导意见。
[1] Keys H M, Bundy B N, Stehman F B, et al. Cisplatin, radiation and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma [J]. N Engl J Med, 1999, 340(15): 1154-1161.
[2] Morris M, Eifel P J, Lu J, et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer [J]. N Engl J Med, 1999, 340(15): 1137-1143.
[3] Whitney C W, Sause W, Bundy B N, et al. Randomized comparison of fluorouracil plus cisplatin versus hydroxyurea as an adjunct to radiation therapy in stage IIB-IVA carcinoma of the cervix with negative para-aortic lymph nodes: A Gynecologic Oncology Group and Southwest Oncology Group study [J]. J Clin Oncol, 1999, 17(5): 1339-1348.
[4] Peters W A, Liu P Y, Barrett R J, et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix [J]. J Clin Oncol, 2000, 18(8): 1606-1613.
[5] Rose P G, Bundy B N, Watkins E B, et al. Concurrent cisplatinbased radiotherapy and chemotherapy for locally advanced cervical cancer [J]. N Engl J Med, 1999, 340(15): 1144–1153.
[6] González-Cortijo L, Carballo N, González- Martín A, et al. Novel chemotherapy approaches in chemoradiation protocols [J]. Gynecol Oncol, 2008, 110(3 Suppl 2): S45–S48.
[7] Petrelli F, De Stefani A, Raspagliesi F, et al. Radiotherapy with concurrent cisplatinbased doublet or weekly cisplatin for cervical cancer: a systematic review and meta-analysis [J]. Gynecol Oncol, 2014, 134(1): 166-171.
[8] Dueñas-González A, Zarbá J J, Patel F, et al. Phase III, open-label, randomized study comparing concurrent gemcitabine plus cisplatin and radiation followed by adjuvant gemcitabine and cisplatin versus concurrent cisplatin and radiation in patients with stage IIB to IVA carcinoma of the cervix [J]. J Clin Oncol, 2011, 29(13): 1678-1685.
[9] Wang C C, Chou H H, Yang L Y, et al. A randomized trial comparing concurrent chemoradiotherapy with single-agent cisplatin versus cisplatin plus gemcitabine in patients with advanced cervical cancer: An Asian Gynecologic Oncology Group study [J]. Gynecol Oncol, 2015, 137(3): 462-467.
[10] Li X F, Li Y H, Gao Y N, et al. Comparison of two different chemotherapy regimens for concurrent chemoradiotherapy in stage Ib2 to IVa squamous cell carcinoma of the uterine cervix [J]. Zhonghua Fu Chan Ke Za Zhi, 2013, 48(10): 763-767.
[11] Nedovic J, Protrka Z, Ninkovic S, et al. Cisplatin monotherapy with concurrent radiotherapy versus combination of cisplatin and 5-fluorouracil chemotherapy with concurrent radiotherapy in patients with locoregionally advanced cervical carcinoma [J]. J BUON, 2012, 17(4): 740-745.
[12] Monk B J, Sill M W, McMeekin D S, et al. Phase III trial of four cisplatin-containing doublet combinations in stage IVB, recurrent, or persistent cervical carcinoma: a Gynecologic Oncology Group study [J]. J Clin Oncol, 2009, 27(28): 4649-4655.
[13] Jekunen A P, Christen R D, Shalinsky D R, et al. Synergistic interaction between cisplatin and taxol in human ovarian carcinoma cellsin vitro[J]. British J Cancer, 1994, 69(2): 299-306.
[14] Miglietta L, Franzone P, Centurioni M G, et al. A phase II trial with cisplatin-paclitaxel cytotoxic treatment and concurrent external and endocavitary radiation therapy in locally advanced or recurrent cervical cancer [J]. Oncology, 2006, 70(1): 19-24.
[15] Pignata S, Frezza P, Tramontana S, et al. Phase I study with weekly cisplatin-paclitaxel and concurrent radiotherapy in patients with carcinoma of the cervix uteri [J]. Ann Oncol, 2000, 11(4): 455-459.
[16] Sol E S, Lee T S, Koh S B, et al. Comparison of concurrent chemoradiotherapy with cisplatin plus 5-fluorouracil versus cisplatin plus paclitaxel in patients with locally advanced cervical carcinoma [J]. J Gynecol Oncol, 2009, 20(1): 28-34.
[17] 孙健衡, 白萍, 蔡树模. 妇科恶性肿瘤放射治疗学[M]. 北京. 中国协和医科大学出版社. 2002.
(本文责编:蔡珊珊)
Yan dingding, Zhou jiansong, Xu xiaoxian, Yin zhuomin, Liu nanfang, Yuan shuhui, Ni juan, Li li, Lou hanmei*
(Department of Gynecologic Oncology, Zhejiang Cancer Hospital, Hangzhou 310022, China)
ABSTRACT:OBJECTIVE To observe the efficacy and toxicity of three concurrent chemotherapy regimens in the radiotherapy of local advanced cervical cancer. METHODS The 105 patients with FIGO stage IIB-IIIB cervical cancer were treated with concurrent chemoradiotherapy, and all cases were randomly divided into three groups, DDP group(35 cases) received cisplatin weekly for 4-5 cycles, FP group(35 cases) received fluorouracil and cisplatin combined chemotherapy every 3 weeks for 2 cycles, TP group(35 cases) received paclitaxel and cisplatin combined chemotherapy every 3 weeks for 2 cycles. Then compared acute adverse reaction and the efficacy of all patients. RESULTS The complete remission rates of the three groups were 88.6%, 82.9%, 82.9%, the partial remission rates were 11.4%, 17.1%, 11.4% at one month after radiotherapy, the complete remission rates were 97.1%, 97.1%, 94.3% at three months after radiotherapy, there was no significant difference(P> 0.05). The 2-year overall survival rates were 97.1%, 85.7%, 91.4%, the 2-year disease-free survival rates was 82.9%, 85.7%, 88.6%, there was no significant difference. The main acute adverse reactions were bone marrow suppression and gastrointestinal reactions. Grade 3-4 leucopenia and neutropenia incidence was more common in paclitaxel and cisplatin group, Grade 3-4 nausea, vomiting, diarrhea and intestinal obstruction were more common in fluorouracil and cisplatin group (P< 0.05). The main long-term adverse reactions were radiation enteritis and radiation cystitis, and the incidence of the three groups had no significant difference. CONCLUSION The short-term efficacy of the three concurrent chemotherapy for the treatment of advanced cervical cancer are similar. The 2-year overall survival rate and disease-free survival rate between three groups is similar. The paclitaxel and cisplatin group arise more severe bone marrow suppression. The fluorouracil and cisplatin group arise more severe gastrointestinal reactions.
KEY WORDS:cervical cancer; concurret chemoradiotherapy; cisplatin; fluorouracil; paclitaxel
中图分类号:R969.4
文献标志码:B
文章编号:1007-7693(2017)09-1317-05
DOI:10.13748/j.cnki.issn1007-7693.2017.09.022
引用本文:闫鼎鼎, 周建松, 徐小仙, 等. 3种同步化疗方案在中晚期宫颈癌放疗中的疗效及不良反应[J]. 中国现代应用药学, 2017, 34(9): 1317-1321.
基金项目:浙江省医药卫生科技计划项目(2016KYA036);浙江省医药卫生科技平台项目(2017ZD012)
作者简介:闫鼎鼎,女,硕士,主治医师 Tel: (0571)88122032 E-mail:yandingding2003@163.com
*通信作者:楼寒梅,女,硕士,主任医师 Tel: (0571)88122032 E-mail: zjhzlouhanmei@sina.com
收稿日期:2017-02-21