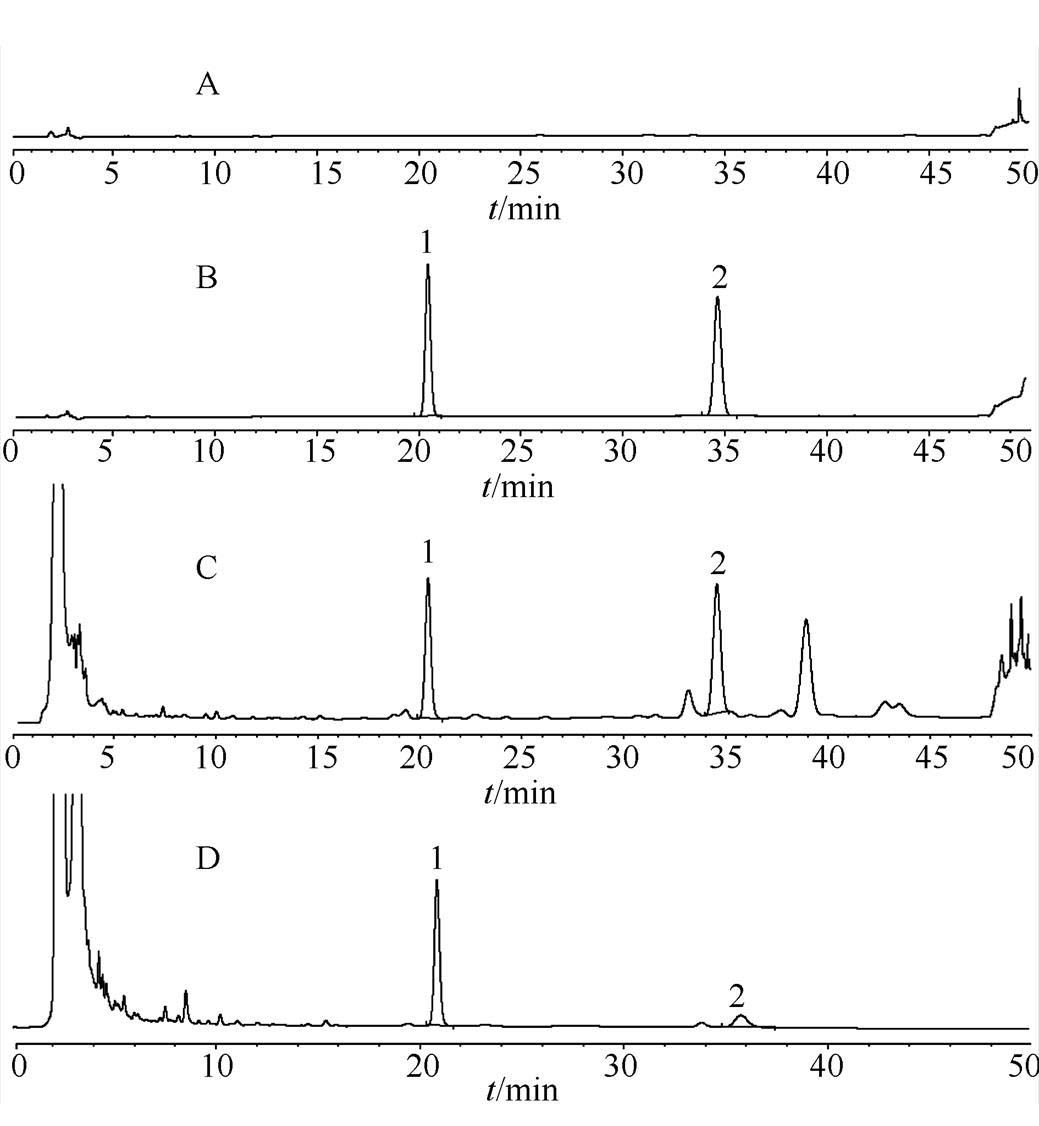
图1 高效液相色谱图
黄妍1,姚建标2,赖云枫2,王如伟2*
(1.浙江中医药大学药学院,杭州 310053;2.浙江康恩贝制药股份有限公司,杭州 310051)
摘要:目的 建立麸炒白术饮片和麸炒白术配方颗粒中白术内酯Ⅲ的含量测定方法,并同时建立麸炒白术配方颗粒的HPLC特征图谱。方法 采用色谱柱为Welch Xtimate C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水溶液,梯度洗脱;体积流量1.0 mL·min-1;柱温30 ℃;检测波长224 nm;进样量10 μL。结果 建立了麸炒白术饮片及颗粒中白术内酯Ⅲ的含量测定方法,白术内酯Ⅲ在0.031 3~0.782 4 μg内与色谱峰面积呈良好的线性关系;麸炒白术饮片和麸炒白术配方颗粒平均加样回收率分别102.0%(RSD=1.88%),101.0%(RSD=1.02%);建立了麸炒白术配方颗粒的HPLC特征图谱,确立了8个特征峰。结论 该方法准确、可靠,为麸炒白术配方颗粒的工艺研究及质量控制提供了参考依据。
关键词:麸炒白术配方颗粒;白术内酯Ⅲ;含量测定;特征图谱;质量研究
白术为菊科植物白术Atractylodes acrocephalaKoidz.的干燥根茎[1],为传统的“浙八味”药材之一,主产地为浙江,在全国各地均有种植。其炮制品主要有土炒白术和麸炒白术,白术麸炒后,其燥性缓和,健脾作用增加,性味归经同白术,常用于脾胃不和,痰饮停滞,脘腹痞满等[2-3]。麸炒白术配方颗粒是麸炒白术饮片经现代提取技术及制剂工艺精制而成,在临床上可代替麸炒白术饮片,因而对其的研究有着十分积极的意义。麸炒白术中的白术内酯类成分为麸炒白术的特征成分,同时也是主要有效成分[4-11]。中国药典2015年版未规定白术的含量测定指标,并且现有的质量研究报道主要为测定白术中内酯类成分的含量,对于麸炒白术配方颗粒的成分研究还鲜有报道。本研究参照《中药配方颗粒管理暂行规定》制备配方颗粒,以此为基础,建立了麸炒白术饮片及颗粒中白术内酯Ⅲ的含量测定方法,同时建立了麸炒白术配方颗粒的特征图谱,确立了8个特征峰,为麸炒白术配方颗粒的质量控制及工艺研究提供了参考依据。
Agilent 1260高效液相色谱仪(美国Agilent公司),配二极管阵列检测器。白术内酯Ⅲ对照品(中国食品药品检定研究院,批号:111978-201501,纯度:99.9%);白术内酯Ⅱ对照品(中国食品药品检定研究院,批号:111976-201501;纯度:99.9%);苍术酮对照品(成都普菲德生物技术有限公司,批号:16030401,纯度≥96%);麸炒白术饮片(金华市益康医药有限公司,批号:150101,150102,150103);Agilent Zorbax XDB-C18色谱柱(250 mm×4.6 mm,5 μm);Kromasil 100 C18Dimensions色谱柱(250 mm×4.6 mm,5 μm);Welch Xtimate C18色谱柱(250 mm×4.6 mm,5 μm)。
2.1 色谱条件
以十八烷基硅烷键合硅胶为填充剂(规定色谱柱:柱长为25 cm,内径为4.6 mm,粒径为5 μm,Welch Xtimate C18柱);以乙腈为流动相A,水为流动相B,梯度洗脱程序:0~30 min,40%→50% A;30~45 min,50% A;45~50 min,95% A;柱温为30 ℃;流速为1.0 ml·min-1;检测波长为224 nm。
2.2 配方颗粒的制备
参照《中药配方颗粒管理暂行规定》,以3批麸炒白术饮片为源头,制备15批麸炒白术配方颗粒。制备工艺:取麸炒白术饮片2 kg,加水煎煮2次,每次加4倍量水,每次煎煮1 h,滤过,滤液浓缩至相对密度约1.20(60 ℃),85 ℃减压干燥,粉碎,加糊精适量,混匀,制粒,即得麸炒白术配方颗粒。
2.3 供试品和对照品溶液制备
2.3.1 对照品溶液的制备 精密称取白术内酯Ⅲ 9.79 mg,白术内酯Ⅱ 3.62 mg,苍术酮9.21 mg,分别用甲醇溶解并定容至50,25,50 ml量瓶中,混匀,即得母液,冰箱中保存备用。
2.3.2 供试品溶液的制备 麸炒白术饮片供试品溶液:取本品粉末1.00 g,精密称定,置锥形瓶中,加入80%甲醇50 ml,密塞,称定质量,超声20 min,放至室温,称定质量,用80%甲醇补足质量,过滤,取续滤液,备用,避光操作。
麸炒白术配方颗粒供试品溶液(供含量测定用):取本品粉末1.00 g,精密称定,置锥形瓶中,加入80%甲醇50 ml,密塞,称定质量,超声20 min,放至室温,称定质量,用80%甲醇补足质量,过滤,取续滤液,备用,避光操作。
麸炒白术配方颗粒供试品溶液(供特征图谱检测用):取本品粉末2.00 g,置锥形瓶中,加入80%甲醇50 ml,密塞,超声20 min,滤过,蒸干,用60%甲醇溶解,转移定容至5 ml,过滤,取续滤液,备用,避光操作。
2.3.3 空白对照溶液制备 麸炒白术饮片空白对照溶液:具塞锥形瓶中加入80%甲醇50 ml,按“2.3.2”项下方法制得空白对照溶液。
麸炒白术配方颗粒空白对照溶液:按配方颗粒有关标准,由相关辅料按“2.2”项下方法制得配方颗粒,再按“2.3.2”项下方法制得空白对照溶液。
2.4 白术内酯Ⅲ含量测定方法学考察
2.4.1 专属性考察 取对照品溶液、供试品溶液及空白对照溶液,按“2.1”项下方法进样检测,结果白术内酯Ⅲ能达到基线分离,空白对照无干扰,结果见图1。

图1 高效液相色谱图
A-阴性供试品溶液;B-对照品溶液;C-麸炒白术饮片供试品溶液;D-麸炒白术配方颗粒供试品溶液;1-白术内酯Ⅲ;2-白术内酯Ⅱ。
Fig. 1 HPLC chromatograms
A-negative sample solution; B-control solution; C-sample solution of bran-processed atractylodes; D-sample solution of bran-processed atractylodesformula granule; 1-atractylenolide Ⅲ; 2-atractylenolide Ⅱ.
2.4.2 线性关系考察 精密量取“2.3.1”项下白术内酯Ⅲ对照品溶液适量,采用倍数稀释法进行稀释,得到6个不同浓度的系列对照溶液,按“2.1”项下色谱条件进行分析,并记录色谱峰面积。以色谱峰峰面积(Y)对进样量(X)进行线性回归,得回归方程、相关系数(r)和线性范围,结果为Y=27.10X-5.128,R2=0.999,线性范围0.031 3~ 0.782 4 μg。
2.4.3 仪器精密度试验 精密吸取“2.3.1”项下白术内酯Ⅲ对照品母液,采用倍数稀释法,稀释至19.58 μg·ml-1。精密吸取白术内酯Ⅲ对照品溶液10 μL,连续进样5次,按“2.1”项下色谱条件测定峰面积值,求得白术内酯Ⅲ精密度RSD为0.57%。
2.4.4 稳定性试验 按“2.3.2”项下方法制备供试品溶液,分别于制备后0,4,8,12,24,36 h注入液相色谱仪,记录白术内酯Ⅲ峰面积。测得麸炒白术饮片和麸炒白术配方颗粒的峰面积的RSD分别为0.86%和0.78%,表明供试品溶液在36 h内稳定。
2.4.5 重复性试验 按“2.3.2”项下方法制备6份供试品溶液,进样分析,测得麸炒白术饮片和麸炒白术配方颗粒含量的RSD分别为1.55%和0.98%,表明本法重复性良好。
2.4.6 回收率试验 取已知含量的同一批样品6份,每份取约0.5 g,精密称定,按“2.3.2”项下方法制备供试品溶液,精密加入白术内酯Ⅲ对照品溶液,进样测定,计算回收率,结果见表1和表2。麸炒白术饮片和麸炒白术配方颗粒的回收率平均值分别为102.0%和101.0%,RSD分别为1.88%和1.02%。麸炒白术饮片和麸炒白术配方颗粒的回收率、RSD均符合要求,说明方法的回收率良好。
2.4.7 样品的测定 取不同批次的麸炒白术饮片和麸炒白术配方颗粒样品,按“2.3.2”项下的方法制备供试品溶液,按“2.1”项下色谱条件进行测定,记录色谱峰面积。含量测定结果见表3,表明相同批次麸炒白术饮片制备的配方颗粒,含量测定结果相近,表明配方颗粒的制备工艺相对稳定。
表1 麸炒白术饮片中白术内酯Ⅲ加样回收率试验(n=6)
Tab. 1 Recovery of atractylenolide Ⅲ in bran-processed atractylodes(n=6)

表2 麸炒白术配方颗粒中白术内酯Ⅲ加样回收率试验(n=6)
Tab. 2 Recovery of atractylenolide Ⅲ in bran-processed atractylodes formula granule(n=6)

表3 样品中白术内酯Ⅲ含量测定结果
Tab. 3 Contents of atractylenolide Ⅲ in bran-processed atractylodesand formula granule

2.5 麸炒白术配方颗粒特征图谱方法学考察
2.5.1 专属性考察 精密量取白术内酯Ⅲ、白术内酯Ⅱ对照品溶液适量配成混合对照品溶液后,取混合对照品溶液、供试品溶液及空白对照溶液,按“2.1”项下方法进样检测,结果空白对照无干扰,见图2。
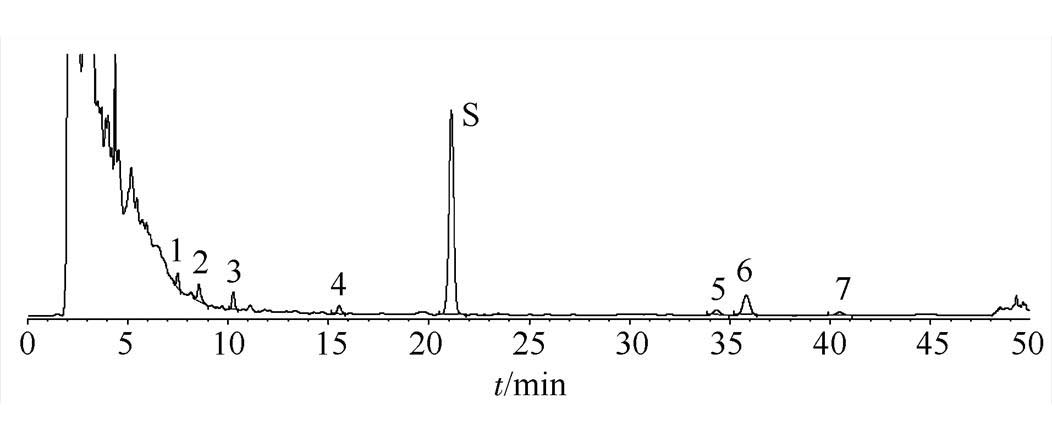
图2 麸炒白术配方颗粒特征图谱
S-白术内酯Ⅲ;6-白术内酯Ⅱ。
Fig. 2 HPLC specific chromatogram of bran-processed atractylodes formula granule
S-atractylenolide Ⅲ ; 6-atractylenolide Ⅱ.
2.5.3 仪器精密度试验 精密吸取同一供试品溶液10 μL,连续进样5次,结果表明各共有峰相对保留时间的RSD<0.106%,以及峰4、峰6相对于S峰的相对峰面积RSD均<0.266%,说明仪器精密度良好。
2.5.4 稳定性试验 取同一供试品溶液10 μL,分别在0,2,4,6,8,12,24 h 进样,检测图谱,结果表明各色谱峰相对保留时间的RSD<0.58%,以及峰4、峰6相对于S峰的相对峰面积RSD均<0.306%,表明供试品溶液在24 h内稳定。
2.5.5 重复性试验 精密称取同一样品6份,制备成供试品溶液,按相同方法检测,结果表明各共有峰相对保留时间的RSD<0.126%,以及峰4、峰6相对于S峰的相对峰面积RSD均<0.401%,表明该方法重复性良好。
2.6 麸炒白术配方颗粒特征峰、相对保留时间及相对峰面积的确定
将麸炒白术配方颗粒按供试品溶液的制备方法进行制备,精密吸取供试品溶液各10 μL,注入高效液相色谱仪进行测定,由图3色谱图可知,白术内酯Ⅲ色谱峰分离良好,峰形稳定,且各样品中均含有此峰,故将保留时间为21.077 min的色谱峰(白术内酯Ⅲ)作为参照峰(S峰),确定了8个特征峰。综合其他品种测定结果[12],其中峰4和峰6相对峰面积较大而且色谱分离良好,因此用来计算相对峰面积。结果见表4,各峰的平均相对保留时间分别为0.357,0.408,0.487,0.737,1.628,1.696,1.922;RSD分别为0.156%,0.161%,0.040%,0.038%,0.221%,0.050%,0.201%;将各峰平均相对保留时间定为特征图谱规定值,此后检测相对保留时间应在规定值的±5%以内。峰4的相对峰面积≥0.03,峰6的相对峰面积≥0.10。
对比麸炒白术饮片、麸炒白术配方颗粒色谱图中各峰面积的峰比,发现麸炒白术配方颗粒与麸炒白术饮片相比,白术内酯Ⅲ的占比明显增加,说明在饮片到颗粒的制备过程中,白术内酯Ⅲ的转移率最高,为颗粒中的主要内酯类成分,因而本次研究建立了麸炒白术饮片、麸炒白术配方颗粒中白术内酯Ⅲ的含量测定方法,为麸炒白术配方颗粒的质量控制提供了参考依据(注:白术内酯Ⅱ在麸炒白术饮片制备成配方颗粒过程中转移率较低,不纳入含量测定指标,因此配置其对照品溶液仅用于定性研究)。另外在麸炒白术饮片含量测定方法建立的过程中,发现用相同的方法制备供试品溶液时,不同人员、不同时间操作每次所测含量值有一定差异。分析其原因,认为可能是在操作过程中苍术酮存在一定转化[12-18],因此对供试品溶液在高温、强光照下的稳定性进行考察。结果见表5,表明麸炒白术饮片样品溶液在65 ℃烘箱放置24 h时苍术酮的峰面积有一定减小趋势,白术内酯Ⅲ有一定增大的趋势,但变化幅度不大。另外,麸炒白术饮片样品溶液在强光照射(4 500 lx)6 h时苍术酮的峰面积从915.44变为58.27,有较大减小趋势,白术内酯Ⅲ的峰面积也一定幅度的增加,因此为保证麸炒白术饮片含量测定方法的准确性和稳定性,所有操作过程均需避光操作。
表4 麸炒白术配方颗粒特征图谱测定结果
Tab. 4 The test of HPLC specific chromatogram of bran-processed atractylodesformula granule

表5 麸炒白术饮片样品溶液的影响因素实验
Tab. 5 The test of influencing factors of bran-processed atractylodes solution

本研究在方法建立的过程中做了提取溶剂的考察,包括不同浓度的甲醇和乙醇,提取倍数的考察,提取时间的考察。最终确定方法为提取溶剂为80%乙醇50 ml,超声20 min。后取同一供试品溶液,比较不同厂家不同型号色谱柱下各峰的分离情况。色谱信息见实验材料。发现Welch Xtimate C18色谱柱(250 mm×4.6 mm,5 μm)各峰的分离效果均良好,故需要规定色谱柱。另考察不同柱温下(25,30,32,35 ℃)色谱峰分离情况,测得各共有峰相对保留时间RSD<1.86%,各共有峰相对峰面积RSD<1.97%,方法耐用性较为良好。但当温度为35 ℃时,各峰保留时间提前,个别峰的分离效果较差,因此建议柱温采用30 ℃。
本实验采用HPLC测定麸炒白术饮片和麸炒白术配方颗粒中白术内酯Ⅲ的含量,线性关系良好,精密度、重复性、回收率均符合要求,样品稳定性好;同时建立麸炒白术配方颗粒的特征图谱,各批颗粒色谱图中各特征峰稳定存在,且共有峰相对保留时间的RSD均<0.2%,仅各色谱峰峰面积有所变化。本研究方法可从多方面多角度控制麸炒白术配方颗粒的质量,为其工艺研究及质量标准的建立提供了参考依据。
[1] 中国药典. 一部[S]. 2015: 310.
[2] FEI Y, WANG N N, LI H Y, et al. Study of processing technology influence onAtractylodes macrocephalaby analysis of volatile oil compositions and atractylenolides contents [J]. Chin Arch Tradit Chin Med(中华中医药学刊), 2016, 34(2): 418-421.
[3] 刘青青, 金传山, 吴德玲, 等. 不同加工工艺对白术中白术内酯Ⅰ和白术内酯Ⅲ含量的影响[J]. 安徽中医药大学学报, 2012, 31(1): 58-61.
[4] YANG E, ZHONG Y M, FENG Y F. Advance on the chemical constituents and pharmacological effects ofAtractylodes macrocephalaKoidz. [J]. J Guangdong Pharm Univ(广东药学院学报), 2012, 28(2): 218-221.
[5] 陈晓萍, 张长林. 白术不同化学成分的药理作用研究概况 [J]. 中医药信息, 2011, 28(2): 124-126.
[6] LI W, WENG H M, CUI X B, et al. Chemical constituents in rhizome ofAtractylodes macrocephala[J]. Chin Tradit Herb Drugs(中草药), 2007, 38(10): 1460-1462.
[7] Wang X, Liu X, Zhu T, et al. Development and validation of an UHPLC-QqQ-MS technique for simultaneous determination of ten bioactive components in Fangji Huangqi Tang [J]. J Anal Method Chem, 2016: 1435106. doi: 10.1155/2016/1435106.
[8] Shan G S, Zhang L X, Zhao Q M, et al. Metabolomic study of raw and processedAtractylodes macrocephalaKoidz by LC-MS. [J]. J Pharm Biomed Anal, 2014, 98C(10): 74-84.
[9] LIANG Y S, ZHUANG Y X, DUANG Q, et al. Fingerprints comparison of four processed products of Rhizoma Atractylodis Macrocephalae by HPLC [J]. Tradit Chin Drug Res Clin Pharmacol(中药新药与临床药理), 2013, 24(3): 285-289.
[10] YE W W, SHAO Y, HU R H. UPLC fingerprint of Rhizoma Atractylodis Macrocephalae [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2010, 27(9): 799-804.
[11] ZHANG W T, HUANG W, HUANG Q W, et al. HPLC specific chromatogram of Belladonna Tincture and determination of scopoletin in Chinese Pharmacopoeia (2015 Edition) [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(5): 626-628.
[12] 郝延军, 桑育黎, 李宝林, 等. 苍术酮的常温稳定性研究 [J]. 中成药, 2007, 29(6): 895-896.
[13] WANG X F, WANG F, ZHANG Y H, et al. Kinetics and mechanism studies on oxidizing reaction of atractylon in essential oil fromAatractylodes macrocephalaKoidz [J]. Chin J Appl Chem(应用化学), 2007, 24(3): 301-305.
[14] 李玲辉, 窦德强. 白术挥发油中苍术酮的稳定性研究[J]. 世界科学技术-中医药现代化, 2014(1): 193-198.
[15] 康立, 徐建中, 俞旭平, 等. 鲜白术一体化加工与炮制工艺研究初探[J]. 浙江中西医结合杂志, 2014(4): 361-363.
[16] ZHANG J L, XIE R J, LIU M G, et al. Effect of different processing method on contents of atractylenolideⅠ, Ⅱ, Ⅲ in Atractylodis Macrocephalae Rhizoma [J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2016(21): 15-18.
[17] RONG S H, LING H, GAO N. Study on processing technology and processing principles of Atractrylodis Macrocephalae Rhizoma [J]. China J Chin Mater Med(中国中药杂志), 2011, 36(8): 1001-1003.
[18] ZHAO H H, YAN K L, LIU H R. Effects of oxidation induced by UV lamps and sunlight on compositions of volatile oil from Atractylodis Macrocephalae Rhizoma [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(7): 809-813.
(本文责编:曹粤锋)
HUANG Yan1, YAO Jianbiao2, LAI Yunfeng2, WANG Ruwei2*
(1.Pharmacy College of Zhejiang Chinese Medicine University,Hangzhou 310053,China; 2.Zhejiang CONBA Pharmaceutical Co., Ltd., Hangzhou 310051,China)
Abstract:Objective To establish an HPLC method for the determination of atractylenolide Ⅲ in bran-processed atractylodes and bran-processed atractylodes formula granule, and to establish the specific chromatogram of bran-processed atractylodes formula granule. Methods The chromatographic separation was performed on a Welch Xtimate C18column (250 mm×4.6 mm, 5 μm). The mobile phase was a mixture of acetonitrile-water in gradient elution at a flow rate of 1.0 mL·min-1. The detection wavelength was 224 nm and the column temperature was set at 30 ℃. Results The linear range of atractylenolide Ⅲ in bran-processedatractylodes and bran-processed atractylodes formula granule was 0.031 3-0.782 4 μg, with average recovery of 102.0%(RSD=1.88%) and 101.0%(1.02%). The HPLC specific chromatogram of bran-processed atractylodes formula granule showed 8 characteristic peaks. Conclusion The method is reliable and accurate, and can provide a reference for the technical study and quality control of bran-processed atractylodes formula granule.
Key words:bran-processed atractylodes formula granule; atractylenolide Ⅲ; content determination; specific chromatogram; quality study
中图分类号:R284.1
文献标志码:B
文章编号:1007-7693(2017)09-1243-05
DOI:10.13748/j.cnki.issn1007-7693.2017.09.006
引用本文:黄妍, 姚建标, 赖云枫, 等. 麸炒白术配方颗粒特征图谱及白术内酯Ⅲ含量测定研究[J]. 中国现代应用药学, 2017, 34(9): 1243-1247.
作者简介:黄妍,女,硕士 Tel: 18868804296 E-mail: 553450948@qq.com
*通信作者:王如伟,男,博士,教授级高工 Tel: (0571)87774668 E-mail: wangrw@conbagroup.com
收稿日期:2017-02-17