表1 不同缓释材料种类与用量处方
Tab. 1 The tablet formulations with different viscosity and dosages of HPMC mg

徐兵勇1,2,潘迎锋1,平丽3
(1.浙江省药品化妆品审评中心,杭州 310012;2.正大青春宝药业有限公司,杭州310012;3.浙江大学药物安全评价研究中心,杭州 310058)
摘要:目的 制备左乙拉西坦缓释片,进行体外释放特性以及Beagle犬体内药动学研究。方法 按照筛选处方制备左乙拉西坦缓释片,以市售左乙拉西坦缓释片(Keppra-XR)为参比制剂,采用相似因子(f2)法进行体外释放行为相似度评价;并将自制左乙拉西坦缓释片与市售普通片进行Beagle犬体内药动学参数比较。结果 自制左乙拉西坦缓释片与市售左乙拉西坦缓释片体外释放行为相似。市售左乙拉西坦普通片和自制左乙拉西坦缓释片的药动学参数Tmax分别为(1.75±0.50)和(5.50±1.00) h,Cmax分别为(30.33±2.00)和(17.29±3.56) mg·L-1,AUC0-t分别为(186.88±8.83)和(202.50±34.20) mg·L-1·h。结论 自制的左乙拉西坦缓释片具有缓释效果。
关键词:左乙拉西坦;缓释片;药动学
左乙拉西坦(levetiracetam,LEV)是一种新型的抗癫痫药物,主要用于治疗继发性局限性全身性癫痫,具有安全性好、治疗指数高等特点,有广阔的应用前景[1-3]。1999年美国FDA批准左乙拉西坦片上市(商品名:Keppra),2007年批准进口(商品名:开浦兰);2008年美国FDA批准比利时优时比(UCB)公司研制的左乙拉西坦缓释片(商品名:Keppra-XR®)上市,规格为每片500 mg与750 mg,每日仅需服药1次,主要用于治疗16岁以上的癫痫病患者,我国尚未进口。
目前国内仅有市售普通片上市[4],每日给药2次,该药极易溶于水,生物利用度较高,口服后释放迅速,血药浓度迅速升高可引发神经系统的不良反应如嗜睡、疲劳、行为失常等[5]。为制备作用持久、疗效稳定、不良反应小的缓释制剂,本实验以UCB公司的左乙拉西坦缓释片为参比制剂,制备左乙拉西坦缓释片,并对其进行体外释放度以及Beagle犬体内药动学研究。
1.1 仪器与试剂
Agilent 1200高效液相色谱仪(美国Agilent公司);色谱柱为Agilent HC-C18(4.6 mm×150 mm,5 µm);ZRS-8G型溶出仪(天津大学无线电厂);XS205型电子天平(瑞士梅特勒公司)。
左乙拉西坦缓释片(比利时UCB公司,批号:57577,规格:每片500 mg);左乙拉西坦片(比利时UCB公司,批号:108698,规格:每片500 mg);左乙拉西坦对照品(珠海联邦制药厂有限司中山分厂,批号:20130902S,含量:99.6%);吡拉西坦对照品(中国食品药品检定研究院,批号:100386-200702,含量:100.0%);羟丙甲纤维素(HPMC,上海昌为医药辅料技术有限公司,型号:K4M、K15M、K100M);硬脂酸镁、微粉硅胶均为药用辅料;乙腈和二氯甲烷为色谱纯;其余试剂均为分析纯;水为纯化水。
1.2 动物
Beagle犬8只,♀♂各半,体质量8.7~10.6 kg,由南京安立默科技有限公司提供,动物生产许可证号:SCXK(苏)2010-0002。
2.1 左乙拉西坦缓释片处方筛选
2.1.1 缓释材料筛选 缓释材料是缓释制剂处方重要组成部分,参考FDA官网公布左乙拉西坦缓释片(商品名:KEPPRA-XR®)处方信息,选择HPMC为本品缓释材料,按照表1中处方1~3对HPMC常用的3种规格K4M、K15M、K100M进行筛选,以释放度(篮法100 r·min-1,pH值6.0磷酸缓冲液900 mL为释放介质)为考察指标,计算自制缓释片与参比制剂释放度的相似因子(f2值)[6],结果表明,采用HPMC K4M缓释材料的自制样品与参比制剂释放度的f2值最大,体外释放行为最相似,因此选择HPMC K4M为本品缓释材料,并按照表1中处方3~5对HPMC K4M用量进行筛选,结果表明HPMC K4M用量为150 mg(相当于处方总量23%)时,自制样品与参比制剂释放度的f2值最大,体外释放行为最相似,因此确定HPMC K4M的用量为处方总量的23%。结果见表2~3。
表1 不同缓释材料种类与用量处方
Tab. 1 The tablet formulations with different viscosity and dosages of HPMC mg

2.1.2 润滑剂用量筛选 为了改善制剂中间体颗粒的流动性和防止压片过程中黏冲,往往需要加入适量助流剂或润滑剂,在已确定缓释材料的基础上,按照表4中处方5~7对润滑剂的种类与用量进行筛选,结果表明,处方5制备颗粒休止角为32.2°,压片过程没有黏冲,处方6制备颗粒休止角为33.5°,压片过程中有少许黏冲,处方7休止角为35.5°,压片过程中无黏冲,综合分析,本品采用微粉硅胶为助流剂,硬脂酸镁为润滑剂。
表2 HPMC种类对药物释放度影响
Tab. 2 The influence of different viscosity of HPMC on drug release degree

表3 HPMC K4M的用量对药物释放度影响
Tab. 3 The influence of different dosages of HPMC K4M on drug release degree

表4 润滑剂与助流剂筛选处方
Tab. 4 The tablet formulations with different flow aid and lubrication prescription mg

2.1.3 包衣工艺筛选 左乙拉西坦具有一定刺激性气味,故需采用包衣工艺,以掩盖药物的不良气味,提高患者的依从性。按照已确定处方制备左乙拉西坦缓释片芯,称重后置包衣锅内,调节适宜转速,向锅内喷包衣溶液(欧巴代胃溶型85G型,浓度为15%)适量,进风温度50~60 ℃,转速10~15 r·min-1,当片芯分别增重约0.5%,1.5%,4.5%时,停止包衣。比较不同包衣增重样品的释放度,结果表明包衣增重为1.5%时,自制样品与参比制剂f2值最大,两者释放行为最相似,本品选择包衣增重为1.5%。结果见表5。
表5 包衣液增重筛选结果
Tab. 5 Results of coating solution weight gain

2.2 处方及工艺验证
按照处方筛选确定左乙拉西坦缓释片处方制备3批左乙拉西坦缓释片。
称取处方量的左乙拉西坦、HPMC K4M等量递加法混合均匀。加入适量50%乙醇制软材,过20目筛制粒,60 ℃干燥,过18目筛整粒。加入处方量的硬脂酸镁和微粉硅胶于颗粒中,混合均匀。测定中间体含量,以∮18×9 mm冲制备左乙拉西坦片片芯。将欧巴代胃溶包衣粉溶于水中,搅拌溶解,取左乙拉西坦片片芯,称重后置包衣锅内,调节适宜转速,向锅内喷包衣溶液适量,同时吹热风,当片剂增重约1.5%时,停止包衣、干燥即得。
2.3 体外释放度测定
参照FDA的溶出度方法数据库中公示的左乙拉西坦缓释片释放度检查方法[7],采用篮法,转速为100 r·min-1,释放介质为0.05 mol·L-1磷酸缓冲液900 mL(pH值6.0)。采用HPLC定量测定,以十八烷基键合硅胶为填充剂,乙腈-pH 5.6缓冲溶液(15︰85)为流动相,检测波长为220 nm。
2.3.1 专属性试验 按照处方量称取约160 mg空白辅料,用900 mL释放介质溶解,滤过,作为阴性空白对照溶液,取20 µL注入液相色谱仪,记录色谱图,试验结果表明,空白辅料色谱图在主峰处均无色谱峰出现,对释放度测定无干扰。
2.3.2 线性关系考察 精密称取左乙拉西坦对照品50 mg,置于10 mL量瓶中,用释放介质溶解并释稀至刻度,摇匀,作为对照品储备液,精密量取对照品储备液0.1,0.5,1.0,1.5,2.0 mL,分别置于10 mL量瓶中,加溶出介质稀释至刻度,摇匀,注入液相色谱仪,记录色谱图,以各对照品浓度为横坐标(C),峰面积为纵坐标(A),得线性回归方程:A=6 084.3C+32.077(R2=0.999 9),结果表明在0.05~1.00 mg·mL-1范围内线性关系良好。
2.3.3 回收率试验 精密称取左乙拉西坦对照品11 mg(相当于处方量80%)、14 mg(相当于处方量100%)、16 mg(相当于处方量120%),分别置于25 mL量瓶中,按处方比例加入空白辅料,用适量释放介质溶解并稀释至刻度,摇匀,用0.45 µm滤膜过滤,取续滤液,取20 µL注入液相色谱仪,记录色谱图,计算平均回收率为99.6%(n=9),RSD值为1.2%。
2.3.4 仪器精密度试验 取“2.3.3”项下配制浓度为0.56 mg·mL-1的供试品溶液,连续进样6次,记录色谱图,计算峰面积的RSD值为0.31%,说明仪器精密度良好。
2.3.5 稳定性试验 取“2.3.3”项下配制浓度为0.56 mg·mL-1的供试品溶液,室温条件下放置2,4,6,8,10,12 h,用0.45 µm滤膜过滤,取续滤液,取20 µL注入液相色谱仪,记录色谱图,主成分峰面积RSD为1.25%,样品溶液在12 h内稳定。
2.3.6 释放度测定 取自制3批左乙拉西坦缓释片,进行释放度测定,3批自制样品体外释放度均符合要求。并将自制样品(平均值)与参比制剂(比利时UCB公司)在水、0.1 mol·L-1盐酸、pH 4.5醋酸盐缓冲液、介质pH 6.0磷酸盐缓冲液4种不同释放介质中释放曲线进行比较,计算相似因子f2值,结果表明自制样品与参比制剂在上述4种释放介质f2值为75~83,均>50,体外释放行为相似,具体释放曲线见图1~4。
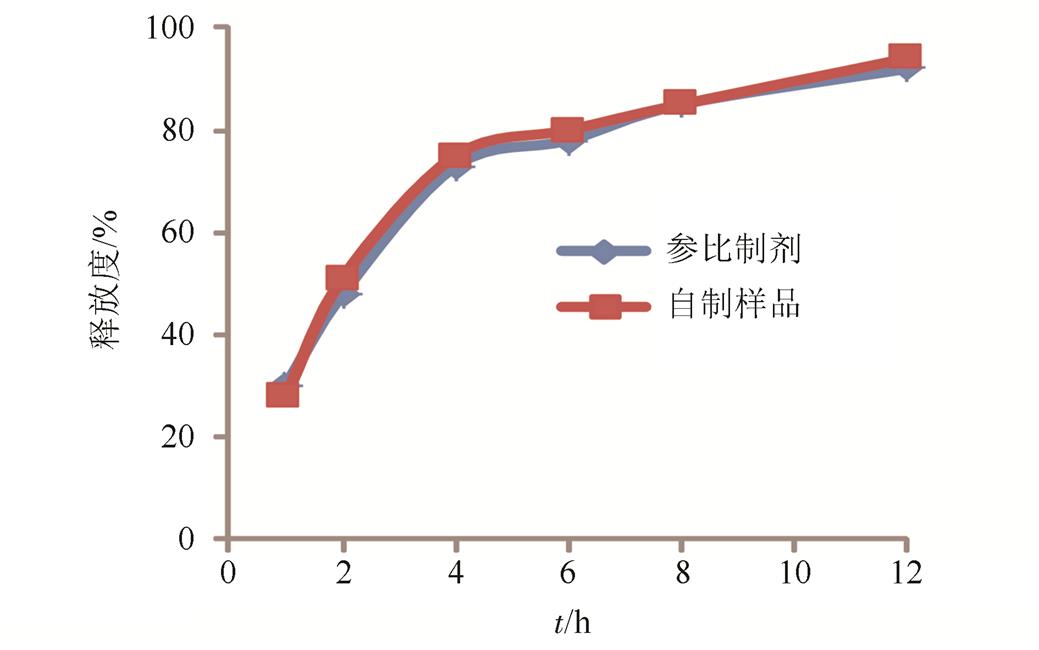
图1 0.1 mol·L-1盐酸释放介质中释放曲线比较
Fig. 1 The release curve comparison in 0.1 mol·L-1hydrochloric acid solution
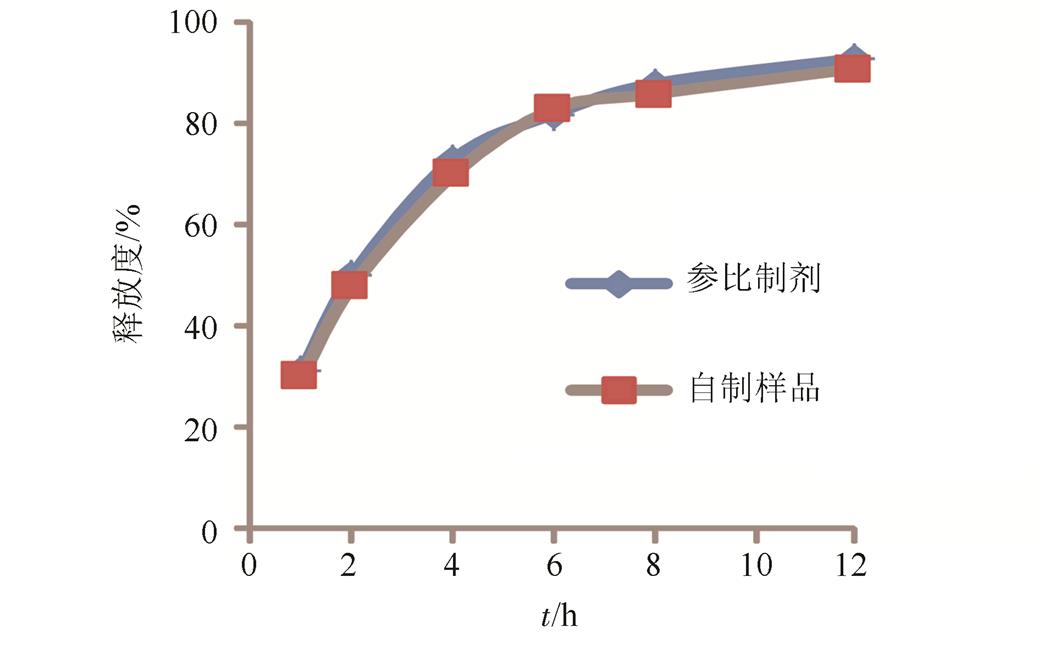
图2 pH 6.0磷酸盐缓冲液释放介质中释放曲线比较
Fig. 2 The release curve comparison in pH 6.0 phosphate buffer solution

图3 pH 4.5醋酸盐缓冲液释放介质中释放曲线比较
Fig. 3 The release curve comparison in pH 4.5 acetate buffer
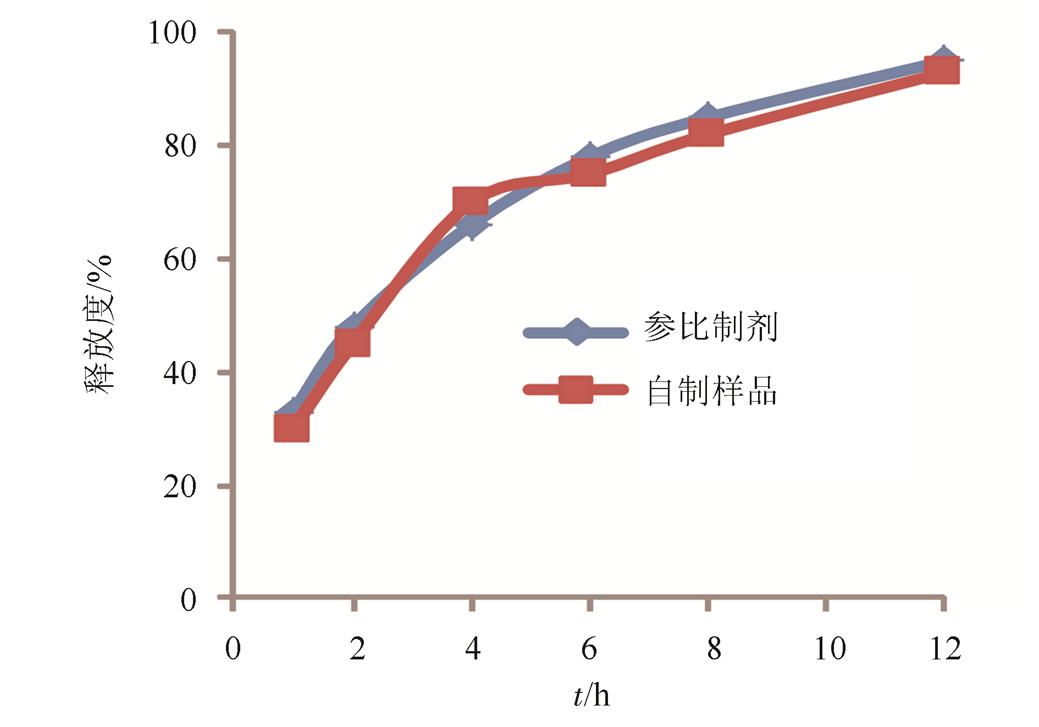
图4 水释放介质中释放曲线比较
Fig. 4 The release curve comparison in water
3.1 色谱条件
Agilent HC-C18色谱柱(4.6 mm×150 mm,5 μm);Inertsil ODS-SP Cartridge Guard Column保护柱(10 mm×4.0 mm),以乙腈-0.05 mol·L-1磷酸二氢钠溶液(4:96)为流动相,流速:0.9 mL·min-1;柱温:25 ℃;检测波长:210 nm;进样量:30 μL。
3.2 贮备液配制
精密称取50 mg左乙拉西坦对照品,用流动相定容至10 mL量瓶中,配制为5 mg·mL-1左乙拉西坦储备液,置低温避光保存备用。量取左乙拉西坦储备液适量,分别用乙腈稀释成不同浓度的左乙拉西坦标准系列溶液。精密称取10 mg内标吡拉西坦对照品,用流动相定容至10 mL量瓶中,配制1 mg·mL-1储备液,用水稀释成浓度为100 μg·mL-1吡拉西坦对照品溶液,置低温避光保存备用。
3.3 血浆样品预处理
使用二氯甲烷液液萃取,取0.2 mL待测血浆样品加入2 mL离心管中,加入20 μL内标,涡旋30 s后,加入二氯甲烷1 mL,涡旋2 min,超声震荡10 min,4 000 r·min-1离心10 min,分离取下层有机层于另一试管,40 ℃氮气吹干。200 μL流动相复溶,涡旋1 min,13 000 r·min-1离心10 min后取上清,进样30 μL。
3.4 给药方案及血样采集
将8只Beagle犬分成2组,每组♀♂各半,一组口服左乙拉西坦缓释片,另一组口服左乙拉西坦片,各每只500 mg。分别于给药前及给药后0.5,1,2,3,4,6,8,10,12,14,24,36,48 h时间点四肢静脉交替采血约2 mL,置含肝素的抗凝试管,3 000 r·min-1离心10 min,分离血浆,置-20 ℃冰箱保存待测。
3.5 专属性
按“3.1”项下色谱条件,血浆中内源性物质不干扰待测物和内标的测定,且左乙拉西坦和内标峰形对称,分离度很好。左乙拉西坦(Ⅰ)和内标(Ⅱ)的保留时间分别为13.02和3.32 min,色谱图见图5。
3.6 线性关系考察及最低定量限测定
取空白Beagle犬血浆200 μL,加入左乙拉西坦系列浓度标准液20 μL,浓度为100 μg·mL-1内标吡拉西坦溶液20 μL,配制成为左乙拉西坦血浆终浓度分别为1,5,10,50,100,200,500 μg·mL-1的血浆样品。按“3.3”项下方法操作,建立标准曲线。以待测物浓度为横坐标(X),待测物与内标物色谱图的峰面积比值为纵坐标(Y),用加权(W=1/X2)最小二乘法进行回归运算[8],得线性回归方程Y=0.030 4X+0.001 08(r=0.999 7),结果表明,左乙拉西坦在1~500 μg·mL-1范围内线性关系良好,定量下限为1 μg·mL-1。
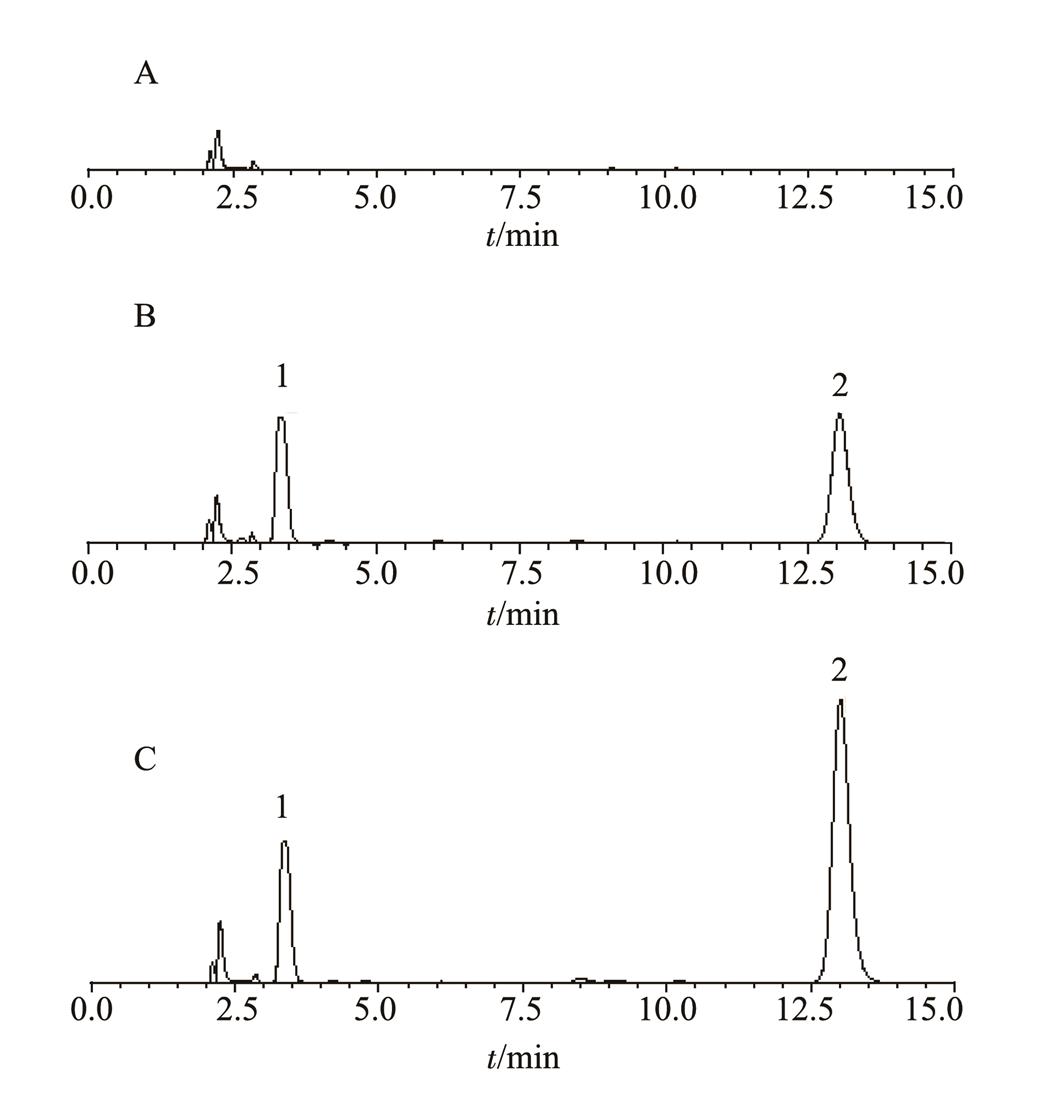
图5 左乙拉西坦和内标HPLC色谱图
A-空白色浆;B-空白血浆+对照;C-给药血浆样品。1-吡拉西坦;2-左乙拉西坦。
Fig. 5 Chromatograms of levetiracetam and internal standard in dog plasma
A-blank plasma; B-blank plasma spiked with levetiracetam and IS; C-plasma sample. 1-piracetam; 2-levetiracetam.
3.7 精密度与回收率试验
取空白Beagle犬血浆200 μL,制备左乙拉西坦低、中、高3个质控浓度(5,50,500 μg·mL-1)的质控(QC)样品,按“3.3”项下方法操作,每个浓度进行5样本分析,连续测定3 d,根据当日的标准曲线,计算QC样品的测得浓度,根据QC样品结果考察本法的日内、日间精密度及相对回收率。另取犬空白血浆200 μL,按“3.3”项下方法操作,吹干前加入相应的对照品溶液及内标溶液,40 ℃氮气吹干。200 μL流动相复溶,涡旋1 min,13 000 r·min-1离心10 min后取上清进样。以每一浓度QC样品获得的峰面积与未经提取直接获得的峰面积之比计算提取回收率,结果见表6。
3.8 稳定性试验
按“3.3”项下方法操作,制备低、中、高(5,50,500 μg·mL-1)3个质控浓度的QC样品,每个浓度进行3样本分析,分别经3次-20 ℃冰冻-室温溶解循环,-20 ℃冰冻放置7 d及处理后的QC样品室温放置24 h考察方法的稳定性,结果见表7。
表6 左乙拉西坦精密度及回收率试验(n=5)
Tab. 6 Results of precision and recovery test(n=5)

表7 左乙拉西坦稳定性结果(n=3)
Tab. 7 Results of stability test(n=3)

3.9 药时曲线及药动学参数计算
按“3.3”项下方法操作,每个分析批制备一条标准曲线,同时制备低、中、高(5,50,500 μg·mL-1)3个质控浓度的QC样品,QC样品数量不少于每个分析批中样品总量的5%。根据每一分析批的标准曲线计算QC样品和血浆样品的浓度,QC样品的浓度不能超出理论值的15%,本实验每个分析批测得的QC样品浓度为理论浓度的89.31%~ 107.82%。8只Beagle犬单剂量口服左乙拉西坦缓释片和左乙拉西坦片的平均药时曲线见图6。采用DAS 3.0软件计算8只Beagle犬单剂量口服左乙拉西坦缓释片和左乙拉西坦片的主要药动学参数,结果见表8。
表8 单剂量口服左乙拉西坦缓释片和左乙拉西坦片的主要药动学参数
Tab. 8 Pharmacokinetic parameters of levetiracetam in Beagle dogs after single dose oral administration of levetiracetam sustained release tablets and levetiracetam tablets
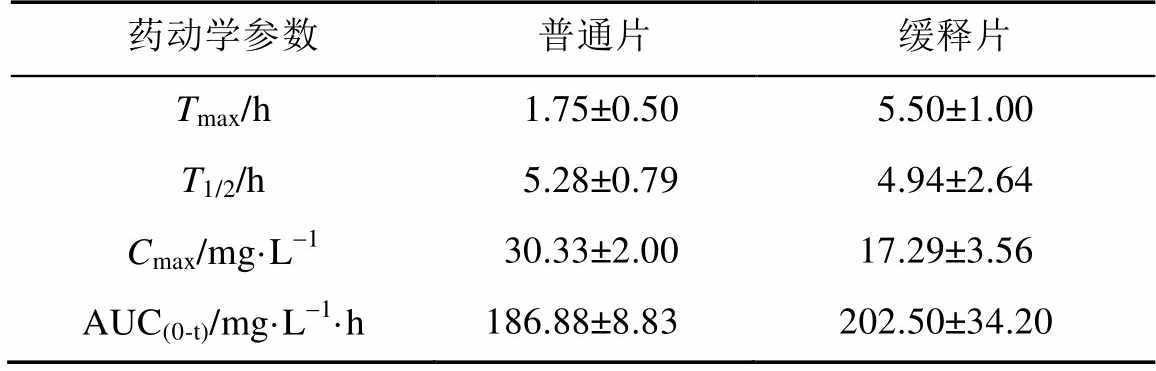
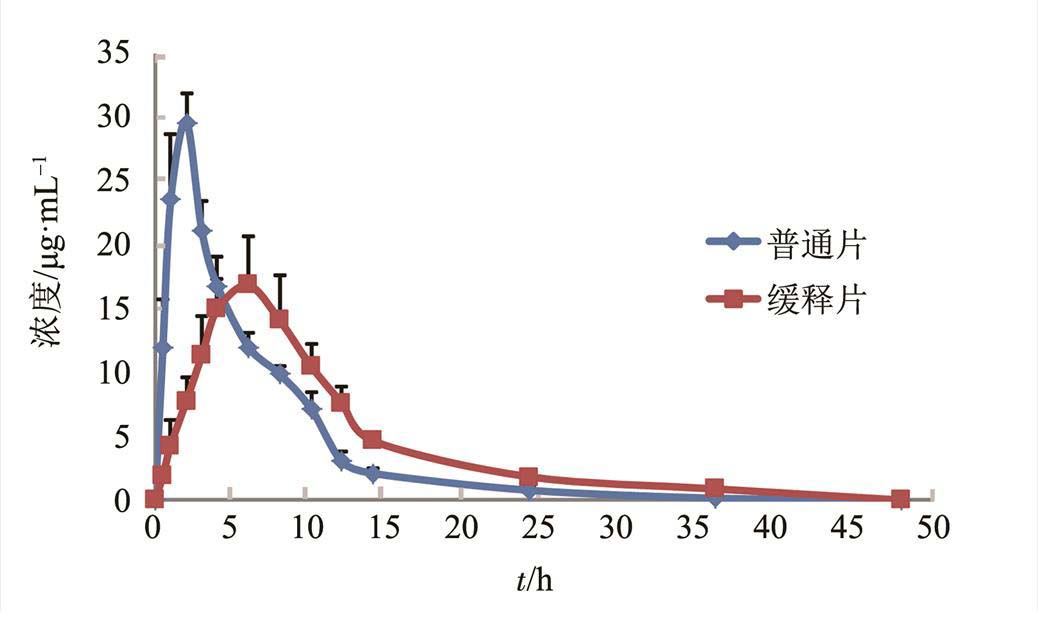
图6 单剂量口服左乙拉西坦缓释片和左乙拉西坦片的平均药时曲线图
Fig. 6 Mean plasma concentration time curves of levetiracetam in Beagle dogs after single dose oral administration of levetiracetam sustained release tablets and levetiracetam tablets
本品服用剂量较大,为了达到理想缓释效果,应尽可能选择种类和用量均较少的辅料,考虑到左乙拉西坦属于高水溶性药物,本品选择HPMC为骨架材料,欧巴代胃溶型85G型为包衣材料,通过对HPMC型号和用量,以及包衣增重进行筛选,确定采用HPMC K4M为缓释材料,用量约为处方量23%,包衣增重为1.5%。采用优化得到处方工艺制备3批样品,3批样品体外释放度符合要求,与市售缓释片在常用4种释放介质f2值均大于>50,体外释放行为相似,本品处方与制备工艺相对简单,重复性好,有利于实现样品的大规模生产。
对制备左乙拉西坦缓释片进行Beagle犬体内药动学研究,建立了HPLC测定Beagle犬血浆中左乙拉西坦的浓度,方法学验证结果符合生物样品分析要求。考察单次给药后左乙拉西坦普通片和左乙拉西坦缓释片的药动学参数,结果表明乙拉西坦缓释片达峰时间(Tmax)明显延长,达峰浓度(Cmax)明显降低,缓释片和AUC(0-48h)与普通片无显著性差异,表明制备左乙拉西坦缓释片体内具有较明显的缓释特征,没有出现突释现象。
后续应对左乙拉西坦缓释片体内药动学深入研究,以获得自制缓释片与市售缓释片生物等效性数据,为本品临床试验的设计和临床合理用药提供参考。
[1] WANG J L, OUYANG Q, ZHONG C G, et al. Research progress in preparation technique of Levetiracetam [J]. Chin J Biochem Pharm(中国生化药物杂志), 2012, 33(4): 504-507.
[2] HU X Q, MA A X. Levetiracetam versus phenytoin for seizure prophylaxis after brain injury:a mete-analysis [J]. Chin J New Drugs Clin Rem(中国新药与临床杂志), 2015, 34(3): 197-204.
[3] LYSENG W K. Levetiracetam: a review of its use in epilepsy [J]. Drugs, 2011, 71(4): 489-514.
[4] DENG M, MA J Y, MENG L J, et al. Bioequivalence test of domestic levetiracetam tablets in healthy volunteers [J]. Chin J New Drugs(中国新药杂志), 2016, 25(19): 2234-2239.
[5] YAN Y K, WANG Z. Progress of Levetiracetam basic research [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2013, 30(5): 565-570.
[6] LIU Q F, LUO G A, WANG Y M. Application development of similarity evaluation on release of susteined and controlled release preparation [J]. Chin Pharm J(中国药学杂志), 2006, 41(15): 1121-1124
[7] http://www.fda.gov/scripts/cder/dissolution/dsp_SearchResults.Cfm
[8] 钟大放. 以加权最小二乘法建立生物分析标准曲线的若干问题[J]. 药物分析杂志, 1996, 16(5) : 343-346.
(本文责编:李艳芳)
XU Bingyong1,2, PAN Yingfeng1, PING Li3
(1.Zhejiang Center for Drug and Cosmetics Evaluation, Hangzhou 310012, China; 2.Chiatai Qingchunbao Pharmaceutical Co., Ltd., Hangzhou 310012, China; 3.Center for Drug Safety Evaluation, Zhejiang University, Hangzhou 310058, China)
ABSTRACT:OBJECTIVE To prepare the Levetiracetam extended-release tablet and investigate its pharmacokinetics in Beagle dogs andin vitrorelease. METHODS Prearation of Levetiracetam extended-release tablet according to optimized prescription, choosed sell products(Keppra-XR) as reference products, evaluation ofin vitrorelease behavior similarity by the similar factor(f2). The pharmacokinetic parameters were compared between the self-made extended-release tablet and the sell tablet. RESULTS The self-made extended-release tablet was similar to the reference productsin vitrorelease,Tmaxof reference products and self-made extended-release tablet were (1.75±0.50) and (5.50±1.00) h,Cmaxwere (30.33±2.00) and (17.29±3.56) mg·L-1, AUC0-twere (186.88±8.83) and (202.50±34.20) mg·L-1·h. CONCLUSION The self-made Levetiracetam extended-release tablet exhibits the sustained release characteristicsin vitro.
KEY WORDS:Levetiracetam; extended-release tablet; pharmacokinetics
中图分类号:R943;R969.1
文献标志码:B
文章编号:1007-7693(2017)09-1266-06
DOI:10.13748/j.cnki.issn1007-7693.2017.09.011
引用本文:徐兵勇, 潘迎锋,平丽. 左乙拉西坦缓释片的制备及其Beagle犬体内药动学研究[J]. 中国现代应用药学, 2017, 34(9): 1266-1271.
作者简介:徐兵勇,男,硕士,工程师 Tel: 13605819823 E-mail: 672852917@qq.com
收稿日期:2017-01-24