表1 5个时间点溶出度考察试验结果
Tab. 1 Test results of five time point dissolution %

张凤妹1,王建1*,李佳妮2
(1.浙江省食品药品检验研究院,杭州310052;2.浙江工业大学,杭州310014)
摘要:目的 建立阿那曲唑片新溶出度检查方法,研究阿那曲唑的溶出行为,评价国内3家片剂产品与原研片溶出曲线的相似性;并建立体内外相关性模型,预测口服阿那曲唑片的药动学参数,评价其生物等效性。方法 新溶出度检查方法:桨法,50 r·min-1,溶出介质为水900 mL,30 min取样,HPLC测定,限度为标示量的80%。通过GastroPlusTM软件,结合体外溶出实验结果,建立体内外相关性模型。结果 新建立的溶出度检查方法在0.22~1.10 μg·ml-1内与峰面积呈良好的线性关系,平均回收率为99.3%(RSD=0.8%,n=9)。国内3 家制药公司产品与原研样品在4种溶出介质中的溶出曲线均相似。溶出曲线与软件模拟的体内行为非常相似,吻合度较高。结论 采用浆法,转速为50 r·min-1,能有效的控制本品的质量。通过体内外相关性的分析,可见建立的体外溶出方法能较好地体现阿那曲唑片在体内的溶出行为。
关键词:阿那曲唑片;溶出度;溶出曲线;相似性评价;GastroPlusTM
阿那曲唑为高效、高选择性的第3代非甾体类芳香化酶抑制剂,用于治疗绝经期后的妇女晚期乳腺癌,具有高溶解性、低渗透性的特点。阿那曲唑片执行标准为新药转正标准第66册[1],所列出的溶出度检查方法为小杯法:100 r·min-1,30 min取样;溶出介质:水125 ml;限度:80% (HPLC,测定波长210 nm)。但USP36版和BP2013、EP7.7、JP16版均未收载该品种,且笔者认为转速为100 r·min-1不合理,因此本实验参照进口注册标准JX20020034及相关文献[2-7],将小杯法改为桨法,转速改为50 r·min-1,用HPLC检测,同时进行方法学研究,拟建立一个准确度比较高的阿那曲唑片溶出度方法。
本实验根据国家食品药品监督管理局仿制药质量一致性评价-溶出试验指导原则[1],用pH 1.2溶液、pH 4.5缓冲液、pH 6.8缓冲液和水4种溶出介质,以原研样品作参比制剂,评价了国内3家片剂产品与原研片溶出曲线的相似性,为中国药典阿那曲唑片质量标准的修订提供科学依据。
本实验通过可模拟药物体内释放吸收行为的GastroPlus软件,依据阿那曲唑的理化性质和文献报道的药动学参数,结合体外溶出实验结果,建立体内外相关性模型,预测口服阿那曲唑片的诸药动学参数,评价其生物等效性。
Agilent 1260液相色谱仪(包括在线真空脱气机,四元泵自动进样系统,美国Agilent 公司); AT7型溶出仪(采用针式取样方式,瑞士SOTAX公司);Hanson在线过滤器(孔径10 μm,美国Hanson公司);Sartorius CPA 2245型电子分析天平(德国赛多利斯公司);Welch Ultimate XB-C18柱(250 mm×4.6 mm,5 μm)。
试药:磷酸二氢钾、氢氧化钠、冰醋酸、醋酸钠以及盐酸均为分析纯,均购自国药集团化学试剂有限公司;溶出介质实验用水:娃哈哈纯净水,均采用脱气装置经40 ℃脱气1 h后立即使用。
阿那曲唑对照品(中国食品药品检定研究院,批号:100770-201302,纯度:99.7%)。
参比制剂阿那曲唑片(Astra Zeneca UK Limited公司,批号:1309071、131001,规格:1 mg);受试样品(A制药公司,批号:13102201,13110201,13110202,规格:1 mg;B制药公司,批号:13122311,13122411,12050411;C制药公司,批号:2011001,2013003,2013005)。
2.1 溶出方法的建立
2.1.1 溶出条件 桨法,以900 ml水为溶出介质,转速为50 r·min-1,30 min取样,HPLC 测定。
2.1.2 色谱条件 色谱柱:Welch Ultimate XB-C18(250 mm×4.6 mm,5 μm);流动相:水-乙腈(60∶40);流速:1.0 mL·min-1;柱温:35 ℃;检测波长:215 nm;进样量:100 μL。
2.2 方法学验证
2.2.1 线性关系 取阿那曲唑对照品约22 mg,精密称定,加乙腈8 mL使溶解,加水稀释制成系列浓度溶液,按“2.1.2”项下色谱条件进行测定。结果回归方程为A=198.0C-0.4,相关系数r=0.999 9,试验表明,对照品溶液浓度在0.22~1.10 μg·ml-1内与峰面积有好的线性关系。
2.2.2 辅料的干扰实验 按处方比例,制成不含主药的空白样品,取适量,加水适量,超声振荡,并稀释至规定浓度,摇匀。滤过,取滤液按“2.1.2”项下色谱条件进行测定,辅料无干扰。
2.2.3 回收率 按处方比分别精密称取相当于样品标示量的60%,80%,100%的阿那曲唑对照品及相应量的空白辅料,加水适量,振摇使阿那曲唑溶解,并加水至规定浓度,摇匀,滤过,按“2.1.2”项下色谱条件测定,对本法的回收率进行考察。结果平均回收率为99.3%,RSD为0.80%(n=9)。结果表明,本法的回收率较高,可用于溶出度的测定。
2.2.4 溶液稳定性 取阿那曲唑供试品溶液,按“2.1.2”项下色谱条件,于0,24,32,42 h测定,结果RSD为0.8%,溶液在42 h内稳定。
2.2.5 溶出曲线 取国内3个主要厂家产品和原研药各1批,按溶出度测定法(附录X C第二法),以水为溶出介质,转速为50 r·min-1,依法操作,在5,10,15,30,45 min时,分别取溶液10 ml,滤过,并及时在操作容器中补充上述溶剂10 ml。另取阿那曲唑对照品约22 mg,精密称定,加乙腈8 ml使溶解,加水稀释制成每1 ml中约含1.1 μg的溶液,作为对照品溶液。按“2.1.2”项下色谱条件,精密量取上述2种溶液各100 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算出每片的溶出量。实验结果见表1和图1。根据溶出曲线试验结果,将取样时间定为30 min。
表1 5个时间点溶出度考察试验结果
Tab. 1 Test results of five time point dissolution %

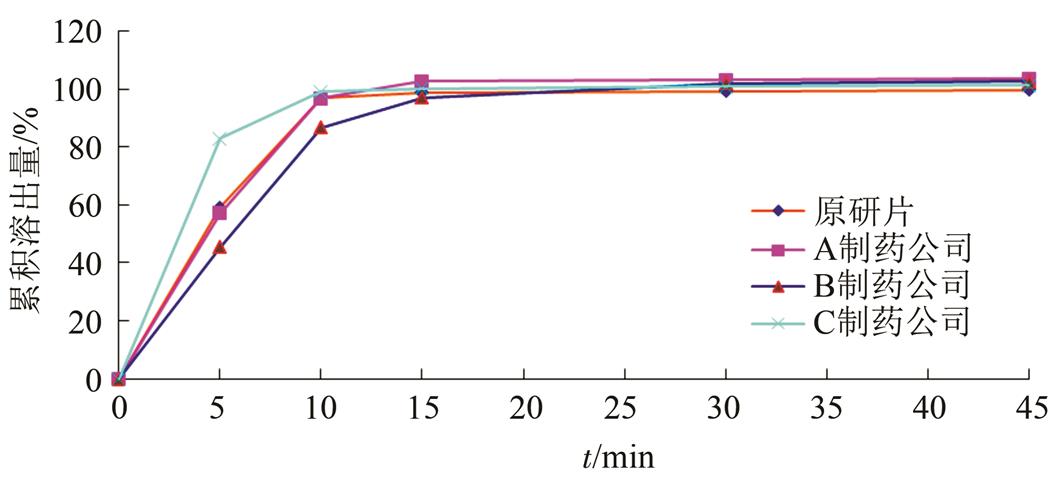
图1 阿那曲唑片溶出曲线
Fig. 1 The dissolution curve of anastrozole tablets
2.3 样品溶出度测定结果
取4个厂家生产的阿那曲唑片,按“2.1”项下溶出度检查方法测定,测得的溶出度结果见表2。根据样品溶出度检查结果,将溶出度检查限度定为80%。
表2 阿那曲唑片溶出度测定结果
Tab. 2 The results of the dissolution of anastrozole tablets

2.4 国内外阿那曲唑片的溶出曲线
取国内3个主要厂家产品和原研药各1批,按“2.1”项下溶出度测定法,分别以4种介质900 mL为溶出介质,在5,10,15,30,45 min时取样,按“2.1”项下方法测定。
4种溶出介质的配制方法:①水:实验用水。②pH 1.2溶出介质:取盐酸7.65 mL,加水稀释至1 000 mL,摇匀即得。③pH 4.5溶出介质:取2 mol·L-1醋酸溶液[取120.0 g(114 mL)冰醋酸用水稀释至1 000 mL]14.0 mL与醋酸钠2.99 g,加水溶解并稀释至1 000 mL,摇匀即得。④pH 6.8磷酸盐缓冲液:取磷酸二氢钾1.7 g和无水磷酸氢二钠1.775 g,加水适量使溶解后,再加水稀释至1 000 mL,摇匀,即得。
国内外阿那曲唑片在4种溶出介质中的溶出曲线测定结果见图2。
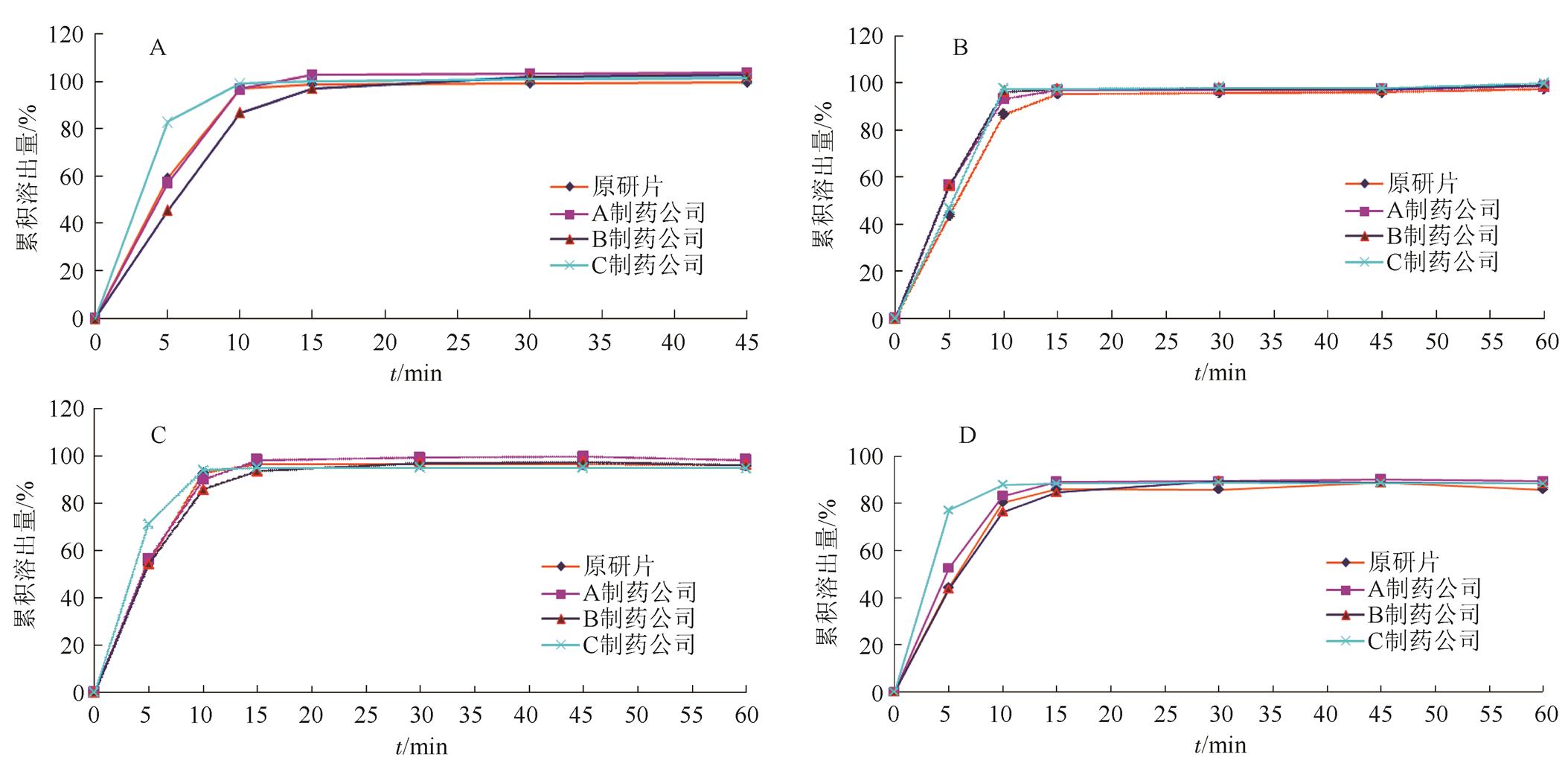
图2 阿那曲唑片在4种介质中的溶出行为
A-水;B-pH 1.2溶液;C-pH 4.5缓冲液;D-pH 6.8缓冲液。
Fig. 2 Anastrozole tablets in the four medium dissolution behavior
A-water; B-pH 1.2 solution; C-pH 4.5 solution; D-pH 6.8 silution.
2.5 国内外阿那曲唑片溶出曲线相似性评价
图2结果显示,A制药公司和C制药公司生产的阿那曲唑片在水、pH 1.2、pH 4.5、pH 6.8溶出介质中,15 min时平均溶出率均>85%;B制药公司的产品在水、pH 1.2、pH 4.5 3种介质中,15 min时平均溶出率均>85%,在pH 6.8溶出介质中与参比制剂平均溶出率的差值<10%,说明3个企业的产品均与原研制剂溶出曲线相似。
GastroPlusTM软件是一款模拟预测药物在体内吸收速度和程度的软件,它采用高级房室吸收模型(ACAT 模型)作为吸收模型,可模拟原料药及其制剂在动物和人体的吸收过程,并且内置多种处置模型,模拟代谢过程。目前该软件在建立药物的体内外相关性、进行虚拟生物等效性实验等方面得到了较为广泛的应用[8-9]。本实验通过可模拟药物体内释放吸收行为的GastroPlusTM软件,依据阿那曲唑的理化性质和文献报道的药动学参数,结合体外溶出实验结果,建立体内外相关性模型,预测口服阿那曲唑片的药动学参数,评价其生物等效性。
3.1 基础模型的创建
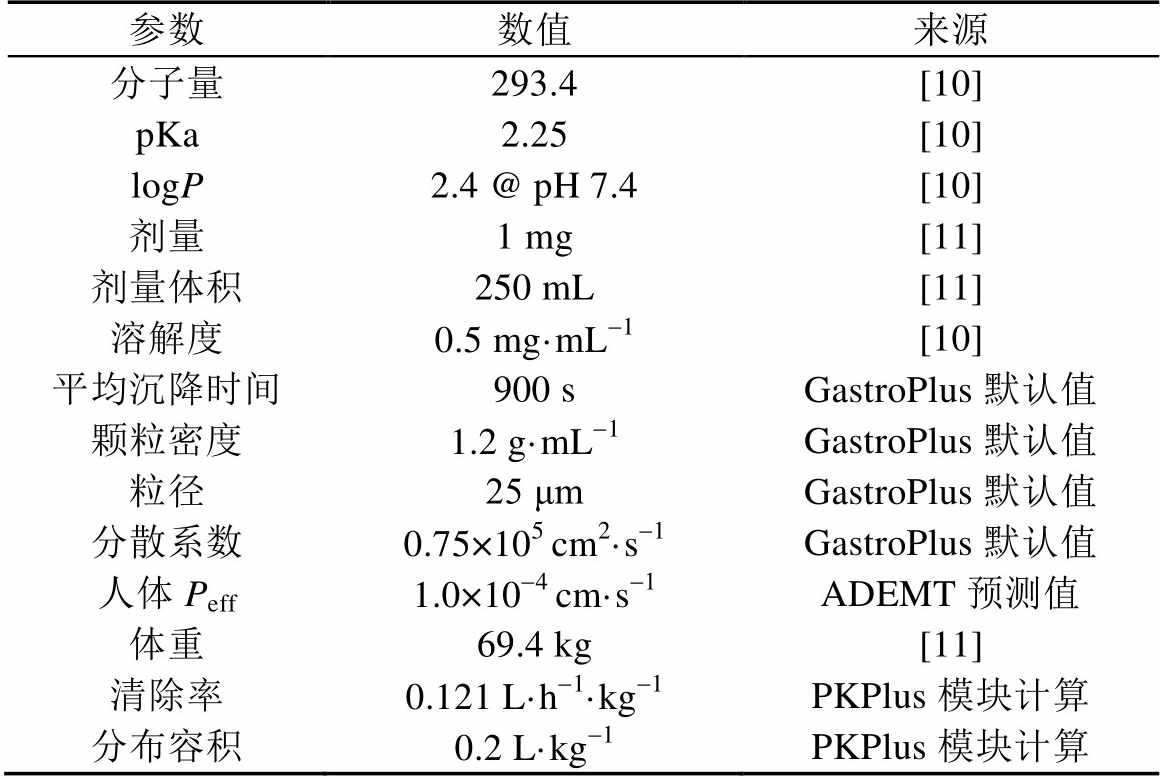
阿那曲唑建模参数主要来自文献以及基于软件计算值,具体数据列举见表3。
表3 模型参数
Tab. 3 Major model parameters
不同的文献中因采用的计算方法、实验人群以及药品剂量的不同,因此得到的药动学参数存在一定程度的差异,但药时曲线基本相似。利用GastroPlusTM,构建阿那曲唑片的体内吸收曲线模型,并且将模型中预测的药时曲线与文献报道中的实际药时曲线进行对比,评价模型的准确性。对模型预测的口服1 mg阿那曲唑的药时曲线与赵春艳等[12]实测的药时曲线进行比较,结果显示,GastroPlusTM软件中构建的模型预测情况与实测的药时曲线相似。通常模型预测的Cmax和AUC值与实际测定的误差在2倍以内,可以证明建立的模型比较准确[13],结果见图3。
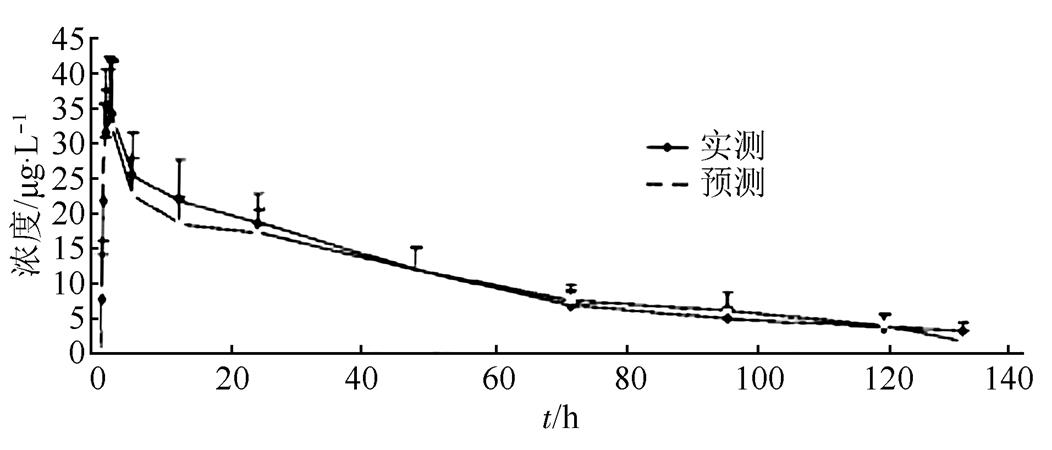
图3 口服阿那曲唑的药时曲线与实测药时曲线的比较
Fig. 3 Comparison of concertration-time curves of anastrozole samples in plasma between predicted by the simulation model and detected by the experiment value
3.2 体内外释放曲线的比较
将原研阿那曲唑片体外各pH值介质中的溶出曲线导入IVIVCPlus模块,进行相关性模型的创建,并考察体外溶出曲线与体内释放曲线的相似性。结果见图4(左侧:体外溶出曲线;右侧:体内溶出曲线)。
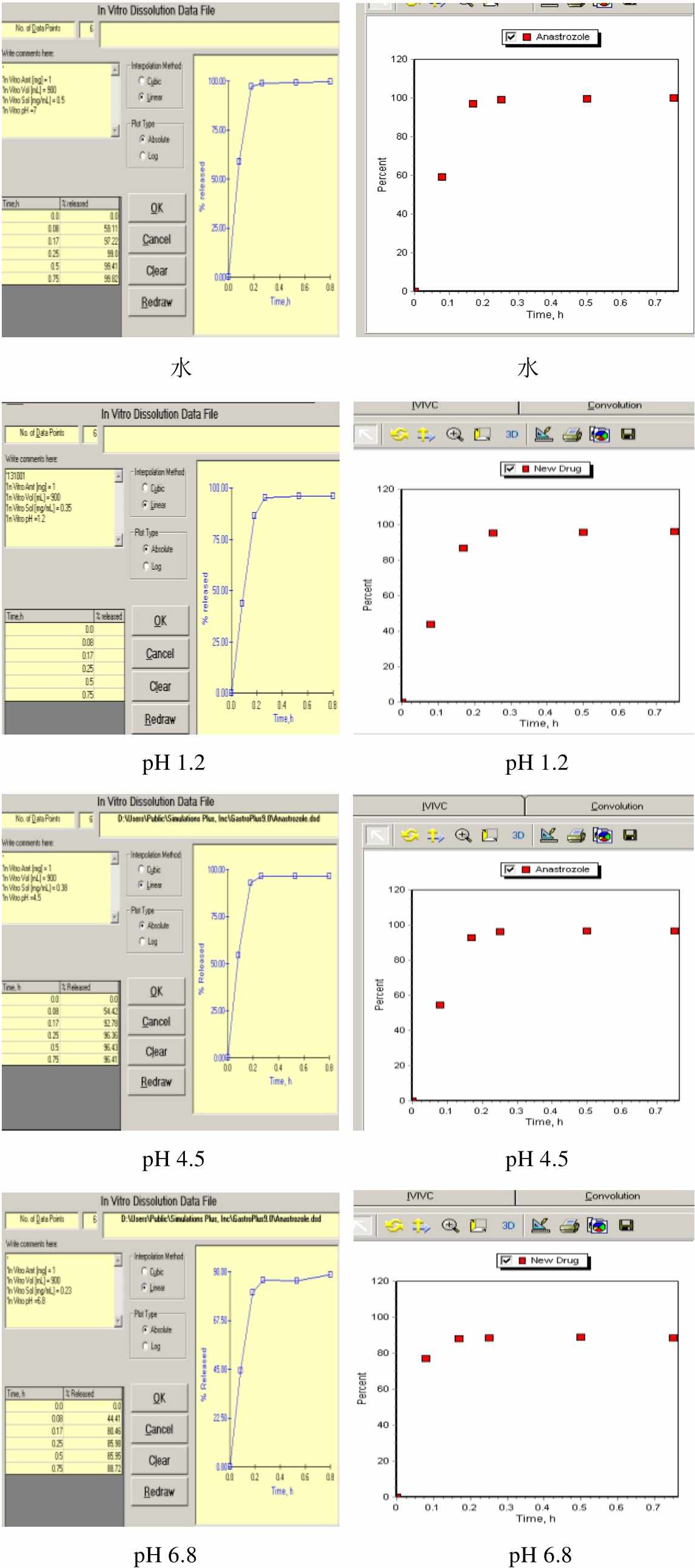
图4 导入水,pH 1.2,pH 4.5,pH 6.8介质中溶出曲线(左侧:体外溶出曲线;右侧:体内溶出曲线)
Fig. 4 Imported release curve in water, pH 1.2, pH 4.5, pH 6.8 medium(Left: release curvein vitro; right: release curvein vivo)
考察4种介质中的溶出曲线体内外相关性,发现4种溶出介质中的溶出曲线与软件模拟的体内行为非常相似,吻合度较高,说明所建立的体外溶出方法能较好地体现阿那曲唑片在体内的溶出行为。
4.1 阿那曲唑片溶出曲线测定方法的选择
根据药物溶出曲线测定和相似性比较技术指导原则,主要参照进口注册标准JX20020034中的溶出度检查方法。
4.2 阿那曲唑片溶出量测定方法的选择
阿那曲唑片规格小、辅料多,实验中较难滤清,且生产厂家众多,辅料不一,可能会影响UV测定的结果,因此采用专属性强的进口注册标准JX20020034中收载的HPLC及液相色谱条件。
4.3 计算机模拟GastroPlusTM软件的建立
通过利用阿那曲唑药动学参数、软件计算数据和文献数据,建立阿那曲唑体内生理药动学预测模型,通过将原研阿那曲唑片体外各pH值介质中的溶出曲线导入IVIVCPlus模块,进行相关性模型的创建,分析阿那曲唑片的体内外相关性。
4.4 结论
本实验研究的阿那曲唑片溶出度分析方法准确度高,能有效测定阿那曲唑片溶出量。溶出曲线质量一致性评价结果,在pH 1.2溶液、pH 4.5缓冲液、pH 6.8缓冲液和水4种介质中,国内A、B、C制药公司的产品与原研片一致。溶出曲线与软件模拟的体内行为非常相似,吻合度较高。
[1] 仿制药质量一致性评价-溶出试验指导原则(草案)[S]. 2016.
[2] GARRIDO M, PONCE C G. Pulmonary thromboembolism in a breast cancer woman receiving anastrozole and prophylactic nadroparin [J]. Chin German J Clin Oncol(中德临床肿瘤学杂志: 英文版), 2007, 6(5): 507-508.
[3] AN F R, CUI L, LIU X Y, et al. Bioanailability and pharmacokinetics of anastrozole in healthy male volunteers [J]. J Shanghai Sec Med Univ(上海第二医科大学学报), 2002, 14(2): 91-95.
[4] ZHAO C Y, JIANG C M. Study on bioequivalence of domestic and imported anastrozole tablets in healthy volunteers [J]. Anti-tumor Pharm(肿瘤药学), 2014, 4(2): 144-152.
[5] LIU K. Select of formulation for anastrozole tablets and quality study [J]. China Pharm(中国药业), 2005, 14(6): 56-57.
[6] WANG L K, CHEN Z Y, WANG W, et al. Similarities and differences of dissolution testing and evaluating methods at home and abroad [J]. Chin J Pharm(中国医药工业杂志), 2015, 46(5): 519-524.
[7] 付晓峰, 柯学. 口服药物溶出技术与体内外相关性的研究进展[J]. 药学与临床研究, 2012, 20(2): 142-147.
[8] Yang Y, Prashanth M, Naresh P, et al. Development and validation ofin vitro–in vivocorrelation (IVIVC) for estradiol transdermal drug delivery systems [J]. J Control Release, 2015(210): 58-66.
[9] LI X D, CHEN Y, LI Y, et al. Evalutionin vivo-in vitrodissolution characteristic of doxazosin mesylate sustained-release tablets by GastroplusTM[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(1): 71-75.
[10] DrugBank. http: //www. drugbank. ca/drugs/DB01217.
[11] LIANG J Y, DUAN G L, CHEN J, et al. Determination of relative bioavailability of anastrozole in healthy volunteers [J]. Chin J New Drugs Clin Remed(中国新药与临床杂志), 2001, 20(3): 159-162.
[12] ZHAO C Y, JIANG C M. Study on bioequivalence of domestic and imported anastrozole talets in healthy volunteers [J]. J Anti-tumor Pharm(肿瘤药学), 2014(2): 144-152.
[13] PAN R X, GAO Y, CHEN W L, et al. Dissolution testing combined with computer simulation technology to evaluate the bioequivalence of domestic amoxicillin capsule [J]. Acta Pharm Sin(药学学报), 2014, 49(8): 1155-1161.
(本文责编:曹粤锋)
ZHANG Fengmei1, WANG Jian1*, LI Jiani2
(1.Zhejiang Institute for Food and Drug Control, Hangzhou 310052, China; 2.Zhejiang University of Technology, Hangzhou 310014, China)
ABSTRACT:OBJECTIVE To develop a new dissolution method of anastrozole tables, study the dissolution behavior, and evaluate the dissolution behavior of consistency between Chinese three companies and the original tablet. And to establishin vivo-in vitrocorrelation model, predict of anastrozole tablets oral pharmacokinetic parameters and evaluate its bioequivalence. METHODS Apparatus 2 was used with 50 r·min-1, the dissolutive medium was water 900 ml, the dissolutive solution was taken and analyzed by HPLC when 30 min and the limitation was 80% in the new method for dissolution test. Combined with the results ofin vitrodissolution curve, establishin vivocorrelation model by GastroPlusTM. RESULTS The new method of dissolution test had good linear relationship with the peak area in the range of 0.22-1.10 μg·ml-1, and the average recovery rate was 99.3% (RSD=0.8%,n=9), which was highly accurate and could be used for the determination of dissolution curve. The threedomestic pharmaceutical company products were all in line with the original research sample in the dissolution curve similarities of the four media. The dissolution curve was similar to thein vivobehavior of the software, and the coincidence was high. CONCLUTION The quality of this product can be effectively controlled by Apparatus 2 used with 50 r·min-1. Through the analysis ofin vivo-in vitrocorrelation, the dissolution behaviorin vitrocan better reflect the dissolution behaviorin vivo.
KEY WORDS:anastrozole tablet; dissolution; dissolution curve; similarity evaluation; GastroPlusTM
中图分类号:R943
文献标志码:B
文章编号:1007-7693(2017)09-1272-05
DOI:10.13748/j.cnki.issn1007-7693.2017.09.012
引用本文:张凤妹, 王建, 李佳妮. 国内外阿那曲唑片溶出曲线相似性评价及采用GastroPlusTM建立体内外相关性模型的研究[J]. 中国现代应用药学, 2017, 34(9): 1272-1276.
作者简介:张凤妹,女,硕士 Tel: (0571)86459422 E-mail: 846628247@qq.com
*通信作者:王建,男,主任药师,博导 Tel: (0571) 87180340 E-mail: wangjianhw2000@yahooo.com.cn
收稿日期:2017-01-07