表1 正交试验因素和水平表
Tab. 1 The orthogonal experiment factors and level table
叶爱琴1,吴凡2,蔡田恬2,蒋芳萍3,白海波3,傅旭春4(1.温州市中医院,浙江 温州 325000;2.浙江省中医院药剂科,杭州 310006;3.杭州华东医药集团新药研究院有限公司,杭州 310012;4.浙江大学城市学院药物研究所,杭州 310015)
摘要:目的 筛选豨莶草的最佳提取工艺。方法用HPLC测定提取物中奇壬醇含量;以豨莶草所含奇壬醇为筛选指标,用正交设计法优化乙醇提取工艺。结果乙醇溶液提取的奇壬醇得率明显高于水提取;豨莶草药材的最佳乙醇提取工艺为:8倍量70%乙醇,浸润2 h,加热回流提取3次(第1次2.5 h,第2次1 h,第3次1 h)。结论乙醇溶液作为豨莶草的提取溶媒优于水;优化后的醇提工艺合理可行。
关键词:豨莶草;奇壬醇;提取工艺;正交设计
豨莶草为菊科植物豨莶Siegesbeckia orientalis L、腺梗豨莶Siegesbeckia pubescens Makino 或毛梗豨莶Siegebeckia glabrescens Makino的干燥地上部分,收载于中国药典2015年版[1],具有祛风湿,通经络,清热解毒之功效,用于风湿痹痛,筋骨无力,腰膝酸软,四肢麻痹,半身不遂,风疹湿疮等。据文献报道,豨莶草能调整机体免疫功能,抑制局部组织炎症介质,减轻关节局部炎症反应,从而达到治疗类风湿性关节炎的作用[2-4];可缓解急性痛风性关节炎疼痛,控制症状[5-7];亦可用于治疗高尿酸血症,能改善高尿酸血症肾损害大鼠的肾功能,对高尿酸血症肾脏病理损害有修复作用[8]。
本实验比较了水和乙醇这2种常用提取溶媒的基础上,用正交设计法进一步优化乙醇提取工艺,确定豨莶草的提取工艺。
1.1 仪器
Agilent1200高效液相色谱仪(美国Agilent公司);XS105和AL204分析天平(Mettler Toleod);RE-2000旋转蒸发仪(上海亚荣生化仪器厂);DKS24电热恒温水浴锅(上海精宏实验设备有限公司);TC-15恒温电热套(海宁市华星仪器厂);Milli-Q BIOCEL超纯水仪(密理博中国有限公司)。
1.2 药品与试剂
豨莶草药材饮片(杭州中药饮片厂,批号:110103,经浙江中医院中药制剂室蒋剑平副主任药师鉴定);奇壬醇对照品(中国药品生物制品检定所,批号:111726 -200601,纯度:98%);甲醇(色谱纯,J&K Scientific Ltd.);乙腈(色谱纯,Promptar Company Ltd.);乙醇(分析纯,杭州化学试剂有限公司)。
2.1 豨莶草中奇壬醇含量的测定
奇壬醇是豨莶草的主要有效成分,也是药典规定的豨莶草质量控制指标成分[1]。按照中国药典2015年版一部豨莶草药材中奇壬醇含量测定方法进行测定[1]。
色谱条件:色谱柱为Phenomenex C18柱(4.6 mm×150 mm,5 μm),以乙腈为流动相A,水为流动相B,梯度洗脱:0~5 min,5%→24%A,5~30 min,24%A。检测波长215 nm,流速1 mL·min-1,柱温30 ℃,进样量20 μL。
取豨莶草药材粉末(过3号筛)约1 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,加热回流提取5 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,过滤,取续滤液,用HPLC测定奇壬醇含量,计算得到豨莶草药材中奇壬醇的含量为1.131 mg·g-1。
2.2 提取溶媒的选择
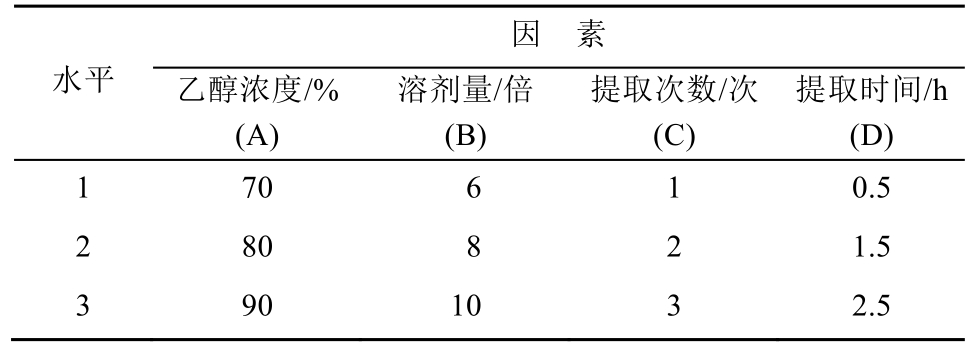
取豨莶草药材饮片2份,各约10 g,称定质量,分别加入纯净水和75%的乙醇100 mL,先浸润2 h,然后加热回流提取1 h,提取液过滤,取滤液,采用HPLC测定奇壬醇的含量,求得水提物中奇壬醇含量为0.25 mg·g-1(以生药量计),乙醇提取物中奇壬醇含量为0.50 mg·g-1,显示乙醇提取得到的奇壬醇含量明显高于水提取。对照品以及水提醇提物HPLC图谱见图1。
2.3 正交试验
进一步用正交设计法优化豨莶草的醇提工艺。以豨莶草药材中有效成分奇壬醇得率为评价指标,乙醇浓度、乙醇用量、提取次数和提取时间为考察因素,按L9(34)表进行试验。
取豨莶草饮片各10 g左右,精密称定,加入乙醇溶液,先浸润2 h,然后分别加热回流提取。正交试验因素和水平列于表1,正交试验方案(每个试验号重复一次)和结果列于表2。
表1 正交试验因素和水平表
Tab. 1 The orthogonal experiment factors and level table

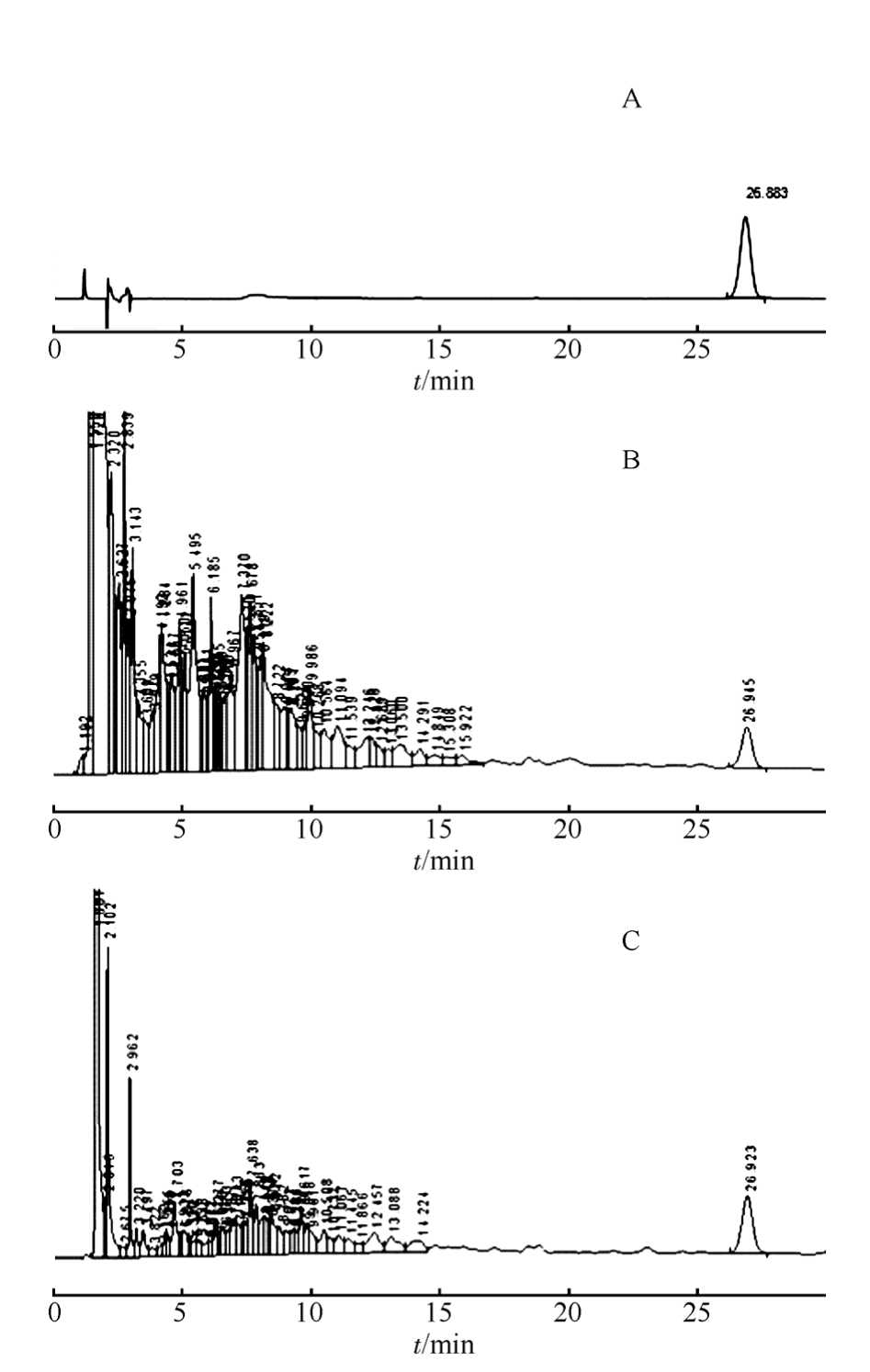
图1 高效液相色谱图
A-奇壬醇对照品溶液;B-豨莶草水提取物溶液;C-豨莶草乙醇提取物。
Fig. 1 HPLC chromatograms
A-sample solution; B-water extract solution; C-ethanol extract solution.
表2 正交试验方案和结果
Tab. 2 The plan and results of orthogonal experiment

对表2正交试验结果进行方差分析,分析结果见表3。
表3 影响因素的方差分析
Tab. 3 Analysis of variance
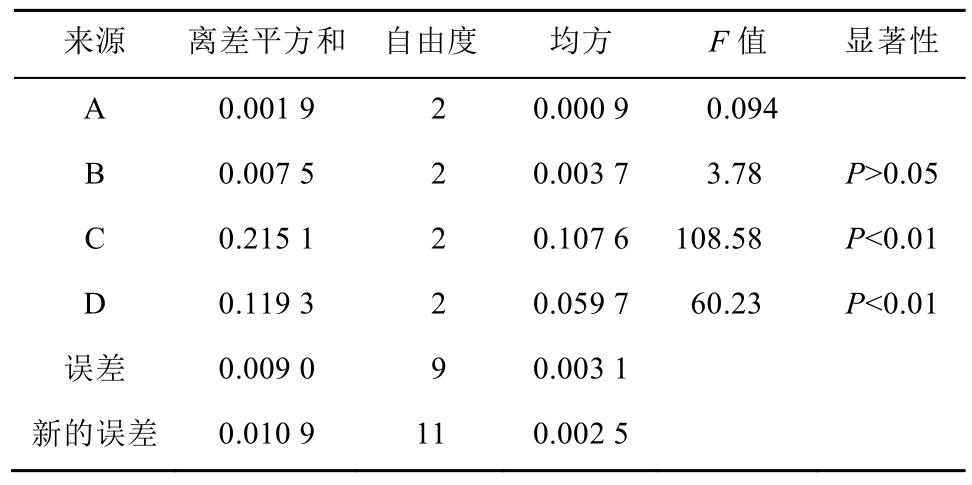
由于A因素的均方小于误差的均方,应该将它们的离差平方和并入误差的离差平方和,构成新的误差离差平方以及新的误差自由度和新的误差均方。
查表得F1-0.05(2,11)=4.26,F1-0.01(2,11)=8.02。表3的方差分析结果表明,提取次数和提取时间对奇壬醇得率有非常显著的影响,随着提取次数的增加(从1次→3次),奇壬醇得率也明显增加(k1、k2、k3分别为0.570 2,0.620 6,0.823 1);提取时间的增加(从0.5→2.5 h),奇壬醇得率也明显增加(k1、k2、k3分别为0.558 8,0.706 2,0.748 9);溶媒用量对奇壬醇得率虽然也有影响,但影响不大,考虑到提取时药材浸润及药渣需要吸收损耗溶媒,故最后确定8倍量的溶媒用量;而乙醇浓度在70%~90%内对奇壬醇得率几乎没有影响。
根据上述分析结果,结合提取成本,初步确定乙醇浓度为70%,乙醇用量为8倍药材量,提取次数为3次,提取时间为2.5 h。
由于提取次数非常重要,对提取次数进行进一步研究。考虑到随着提取次数的增加,有效成分不断减少,提取时间可以适当缩短,因此,选择试验条件为:乙醇浓度为70%、乙醇用量为8倍药材量、第1次提取时间2.5 h、第2次开始提取时间1 h。试验结果见表4(表中的提取率以1.131 mg·g-1为100%计)。
表4 提取次数对试验结果的影响
Tab. 4 The influence of extraction time on the test results
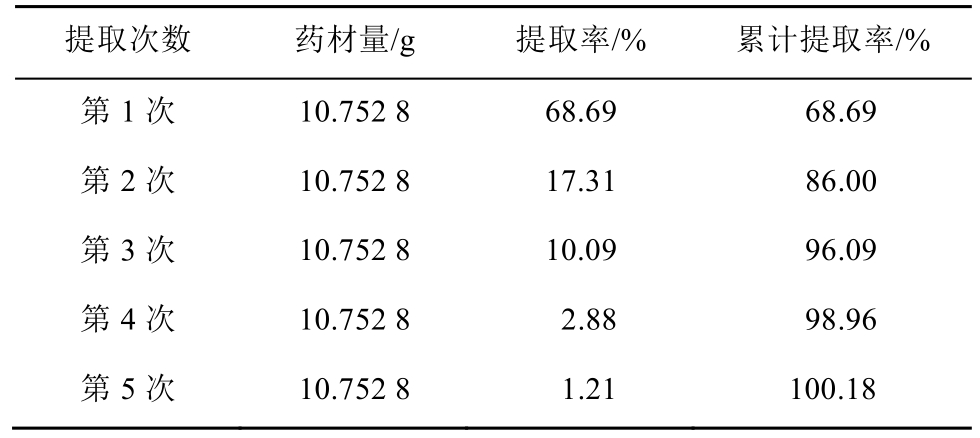
由于表4中的5次提取累计奇壬醇提取量之和为1.133 mg·g-1,与药典法测得的豨莶草药材中奇壬醇的含量1.131 mg·g-1非常接近,且第5次的提取率已经非常低,因此可以认为按上述提取条件进行5次提取后所剩药材残渣中的奇壬醇已经基本提取完全。
试验结果显示前3次豨莶草药材中奇壬醇累计提取率>96%,因此确定提取次数为3次。
2.4 工艺验证
根据正交试验结果,确定豨莶草乙醇提取条件为:用8倍药材量的70%乙醇提取3次(第1次2.5 h,第2次1 h,第3次1 h),并对该工艺进行验证。
称取豨莶草药材饮片2份,各约50 g,称定质量,加入70%乙醇400 mL,浸润2 h,再加热回流提取提取3次(2.5,1,1 h),合并3次提取液,定容至2 000 mL,HPLC测定奇壬醇含量。以药材中奇壬醇的含量为1.133 mg·g-1计算得到奇壬醇提取率分别为94.60%和93.67%。
验证试验结果显示该提取工艺得到的奇壬醇提取率>93%,重复性良好,工艺稳定可靠。
豨莶草其主要成分为二萜类化合物,奇壬醇是主要活性成分[9-13],中国药典2015年版将奇壬醇作为豨莶草的质量控制指标成分[1],因此,本实验亦将奇壬醇作为豨莶草提取工艺研究的指标考察成分。
由于水和乙醇具有价廉易得、环保等显著优点,是最常用的提取溶媒。试验结果表明乙醇比水更适合作为豨莶草的提取溶媒,这可能是奇壬醇分子结构中含有3个六元碳环而具有一定的脂溶性所致。进一步采用4因素3水平正交试验对乙醇浓度、乙醇用量、提取时间、提取次数等醇提条件进行了研究,发现提取次数和提取时间对奇壬醇提取率的影响非常显著,而乙醇浓度在70%~90%内对奇壬醇的提取率几乎没有影响。根据试验结果并结合考虑生产成本、时间成本以及工艺的可行性,最终确定豨莶草药材的提取工艺为:8倍量70%乙醇,浸润2 h,加热回流提取3次(第1次2.5 h,第2次1 h,第3次1 h)。经初步工艺验证,该工艺得到的奇壬醇提取率较高,稳定可行。
虽然之前有报道对于豨莶草提取工艺进行了研究,但本实验在工艺设计上更为合理,在针对正交试验无空列时本研究采取了重复性实验的方法,实验结果更为可靠,在提取时间的设计上也更为妥当,经过1次2.5 h和2次1 h的提取,豨莶草的累计提取率更高。故本实验以奇壬醇为指标,采用HPLC测定,利用更为合理的正交实验设计来考察与豨莶草提取率相关的因素水平,筛选最优工艺,为豨莶草的提取提供了更为合理可靠的理论依据。
REFERENCES
[1] 中国药典. 一部[S]. 2015: 368.
[2] WANG F H, FENG Q X, HUANG C W. Progress in pharmacdogical research of herba sigesbeckiae [J]. J Liaoning Univ Tradit Chin Med(辽宁中医药大学学报), 2011, 13(10):102-104.
[3] SONG Y P, YU Q H. The mechanism of therapeutic effect of herba sigesbeckiae on arthritis [J]. China Med Eng(中国医学工程), 2012, 20(11): 14-16.
[4] FU X C, JIANG F P, FAN J Z, et al. Extract of herba sigesbeckiae on mouse rheumatoid arthritis induced by anthrogen-CIA monoclonal antibody [J]. J Zhejiang Univ(Med Sci)(浙江大学学报: 医学版), 2013, 42(5): 556-560.
[5] 周卫惠. 豨莶草止痛散外敷治疗急性痛风性关节炎疗效观察[J]. 辽宁中医药大学学报, 2009, 11(9): 86-87.
[6] 孙贵才. 复方豨莶草胶囊对实验性大鼠急性痛风性关节炎细胞因子及COX-2表达影响的研究[D]. 哈尔滨: 黑龙江中医药大学, 2007.
[7] JIANG F P, FU X C, BAI H B. Mice acute toxitiy of sigesbeckiae and its effect on mouse acute couty arthritis [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2013, 30(12):1289-1291.
[8] 于雪峰, 李登宇, 孙贵才等. 复方豨莶草胶囊降血尿酸及对肾损害的保护作用[J]. 中医药学报, 2007, 35(2): 18-21.
[9] 王志. 干姜和中药豨莶草的化学成分研究[D]. 合肥: 安徽大学, 2012.
[10] KONG F Y, HU H H, TIAN Z H, et al. Study on index components and fingerprints of crude and processed Siegesbeckia Herbs [J]. China J Chin Mater Med(中国中药杂志), 2014, 39(15): 2907-2911.
[11] 王瑞. 三叶鬼针草和中药豨莶草的化学成分及生物活性研究[D]. 兰州: 兰州大学, 2010: 78-162.
[12] TENG T L, XU S F, CHEN F Y, et al. Research progress in chemical constituents and pharmacological activities of Herba Sigesbeckiae [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(2): 250-260.
[13] YIN Y, SUN Y, JIANG Z. Pharmacokinetics study of two active diterpenoids from herba sigesbeckiae in rat plasma [J]. Acta Pharm Sin(药学学报), 2016, 51(4): 631-636.
Study on the Extraction Process of Effective Fractions from Siegesbeckiae Herba
YE Aiqin1, WU Fan2, CAI Tiantian2, JIANG Fangping3, BAI Haibo3, FU Xuchun4
(1.Wenzhou Traditional Chinese Medical Hospital, Wenzhou 325000, China; 2.Zhejiang Traditional Chinese Medical Hospital, Hangzhou 310006, China; 3.Hangzhou Huadong Medicine Group Pharmaceutical Research Institute Co., Ltd., Hangzhou 310012, China; 4.Institute of Materia Medica, Zhejiang University City College, Hangzhou 310015, China)
ABSTRACT:OBJECTIVE To screen the optimum extraction process of effective fractions from Siegesbeckiae Herba.METHODSHPLC was used to determine the content of kirenol in Siegesbeckiae Herba extract. The ethanol extraction process was optimized by orthogonal test when kirenol content was selected as index.RESULTSThe kirenol yield obtained from Siegesbeckiae Herba was higher using ethanol solution as solvent than water. The optimum extraction process of Siegesbeckiae Herba was to extract three times (the first 2.5 h, the second 1 h, the third 1 h) using eightfold 70 % ethanol after infiltrating for 2 h.CONCLUSIONEthanol solution is better than water as solvent for extraction of kirenol. The optimised extraction process was reasonable and feasible.
KEY WORDS:Siegesbeckiae Herba; kirenol; extraction process; orthogonal test
中图分类号:R284.2
文献标志码:B
文章编号:1007-7693(2017)07-0988-04
DOI:10.13748/j.cnki.issn1007-7693.2017.07.012
引用本文:叶爱琴, 吴凡, 蔡田恬, 等. 豨莶草的提取工艺研究[J]. 中国现代应用药学, 2017, 34(7): 988-991.
收稿日期:2017-02-14
(本文责编:曹粤锋)
作者简介:叶爱琴,女,副主任药师 Tel: 13736796055 E-mail: yaq6055@sohu.com