克拉霉素对糖氧剥离大鼠皮质神经细胞的保护作用及其抑制凋亡的机制研究
顾爱明1,郭如雅2,翟昌林2(1.嘉兴市妇幼保健院,浙江 嘉兴 314000;2.嘉兴市第一医院,浙江 嘉兴 314000)
摘要:目的 研究克拉霉素对大鼠皮质神经细胞糖氧剥离(oxygen glucose deprivation,OGD)后的保护作用及其与抑制凋亡相关的作用机制。方法消化法提取原代大鼠皮质神经细胞,建立皮质神经细胞OGD模型,OGD前予以克拉霉素(clarithromycin,CAM)预处理;通过存活/凋亡检测试剂盒于荧光显微镜下观察各组细胞凋亡情况;试剂盒测定各组培养基LDH含量定量评估细胞凋亡情况;蛋白免疫印迹法测定各组细胞caspase-3,Bax,Bcl-2的表达情况。结果OGD处理后皮质神经细胞凋亡及乳酸释放含量较正常组明显增加(P<0.01),100 μmol·L-1CAM预处理可显著减少OGD造成的细胞凋亡及LDH释放(P<0.01);OGD处理后皮质神经细胞caspase-3,Bax/Bcl-2表达显著升高(P<0.01),而CAM预处理有效降低了caspase-3,Bax/Bcl-2表达。结论克拉霉素对糖氧剥离大鼠皮质神经细胞具有保护作用,其作用可能与抑制了凋亡相关通路有关。
关键词:克拉霉素;caspase-3;Bax;Bcl-2;糖氧剥离;皮质神经细胞
在过去的几十年里,研究人员已经开发了多种具有神经保护作用的化合物,如谷氨酸拮抗剂、钙通道阻滞剂、抗炎/抗氧化剂、GABA激动剂和生长因子等。遗憾的是,临床上缺乏有明确保护作用的神经保护剂于急性缺血性脑卒中后使用[1]。大环内酯类抗菌药物在减轻缺血再灌注损伤中的保护作用及糖氧剥离(oxygen glucose deprivation,OGD)后增加神经元细胞活性的研究早有报道[2],既往研究大环内酯类抗菌药物的脑缺血再灌注保护作用主要为调节免疫应答从而抑制了炎症对皮质神经元的破坏[3-6],本研究通过凋亡相关通路诠释了红霉素衍生物克拉霉素对OGD后的大鼠皮质神经细胞的保护作用。
1 材料与方法
1.1 材料与动物
克拉霉素(clarithromycin,CAM)原料药(湖北新银禾化工有限公司,纯度为99%,CAS编号:81103-11-9);一抗兔抗caspase-3(批号:8202S),Bax(批号:5023S)、Bcl-2(批号:15071S)、β-actin(批号:12620S)、二抗HRP标记的抗兔均购自CST;DMEM/F12培养基(Gibco,货号:11330057);LDH试剂盒(南京建成生物工程研究所,货号:A020-2);存活/凋亡试剂盒(美国Molecular Probes公司,货号:A10788)。
成年SD大鼠共40只,体质量230~260 g,购自浙江大学动物实验中心,动物合格证号为:11400700159023,使用许可证号为:SYXK(浙) 2012-0001,饲养于SPF动物房内,雌雄比例3∶1交配,选取出生后17 d龄的仔鼠,通过无菌操作取大鼠皮质原代神经细胞并进行培养。
1.2 原代大鼠皮质神经细胞的提取及培养
取17 d龄的SD大鼠,麻醉后酒精消毒,处死取脑,于超净台中移除嗅球、海马结构、基底神经节,通过显微剪剪碎皮质,于皮质中添加0.25%胰蛋白酶/EDTA并吹打1 min,于37 ℃培养箱中孵育30 min,加入10%胎牛血清(FBS)停止消化,将混悬液以80×g的转速离心5 min,弃上清液,将细胞沉淀再悬浮于含10%FBS培养基的离心管中,滴管吹打10~15次将细胞吹散均匀,将细胞培养于含DMEM/F12培养基中,将细胞转移至含聚赖氨酸/小鼠层黏连蛋白6孔板中,每孔3.2×106细胞,待细胞贴壁后更换培养基,培养基配置为:含DMEM/F12培养基中添加2 mmol·L-1谷氨酰胺、100 U·mL-1青霉素、100 mg·mL-1链霉素,每3 d更换1次。细胞培养于37 ℃培养箱,添加5%的CO2,从细胞培养第10天开始进行后续实验。
1.3 细胞LDH活性测定
对细胞进行分组,分别为对照组,对照+ 1 μmol·L-1CAM组,对照+10 μmol·L-1CAM组,对照+100 μmol·L-1CAM组,OGD组,OGD+ 1 μmol·L-1CAM组,OGD+10 μmol·L-1CAM组,OGD+100 μmol·L-1CAM组。各组弃去原培养基,分别更换为不含糖及血清的DMEM/F12培养基,分别于厌氧培养室(含95% N2,5% CO2)中预处理15 min,预处理后于超净工作台中对照组各组更换正常培养基,OGD各组分别更换为不含糖及血清的DMEM/F12培养基,各组分别添加不同浓度的CAM,对照组各组继续培养于正常培养箱,OGD各组于正常培养箱中培养30 min后转移至厌氧培养箱中37 ℃培养3 h,OGD结束后OGD各组更换为正常培养基,重新于正常培养箱中培养24 h,培养结束后,收集各组细胞培养基上清液,采用LDH试剂盒测定各组细胞上清液的LDH活性,同时胰酶消化,PBS清洗后收集各组培养的细胞,保存于-80 ℃,解冻后试剂盒测定细胞内LDH含量,LDH活性百分比为细胞外LDH含量与细胞内LDH含量的比值。
1.4 细胞存活/凋亡测定实验
对6孔板细胞进行分组,分别为对照组、OGD组、OGD+100 μmol·L-1CAM组。同前,对各组分别进行正常培养或糖氧剥离3 h,或于OGD前预先添加CAM等处理。待OGD后正常培养24 h,通过细胞存活/凋亡试剂盒测定各组细胞存活、凋亡情况,根据试剂盒说明,于各培养皿中添加2 mmol·L-1钙黄绿素和4 mmol·L-1溴化乙锭同型二聚体(EthD-1),于37 ℃避光孵育30~45 min。通过荧光显微镜观察细胞存活及凋亡情况,钙黄绿素将存活细胞内广泛存在的酯酶活性转化成绿色荧光,因此绿色荧光代表存活细胞。而EthD-1将凋亡细胞染为红色荧光。荧光图像放大倍率为200倍。1.5 Western blot测定细胞caspase-3、Bax、Bcl-2表达
对6孔板细胞进行分组,分别为对照组,OGD组,OGD+100 μmol·L-1CAM组,进行对应处理后正常培养24 h,弃去培养基,PBS润洗2次,于冰上添加RIPA裂解提取各组细胞蛋白,通过BCA法测定蛋白浓度,调节各组蛋白浓度相同后加上样缓冲液变性,制胶,每组20 μg蛋白加样电泳,100 V电压转膜2 h,根据标记蛋白进行剪膜,室温下20%牛奶封闭1 h,TBST洗膜3次,各PVDF膜条分别孵育对应1抗:caspase-3(1∶1 000),Bax(1∶1 000),Bcl-2(1∶1 000),β-actin(1∶1 000),4 ℃孵育过夜,TBST洗膜3次,对应二抗室温下孵育1 h,洗膜后加显影液化学显影,Quantity one软件分析。
1.6 统计学方法
所有实验重复3次,采用SPSS 18.0统计学软件进行分析,计量资料以x±s表示, 并进行正态性及方差齐性检验,组间比较采用t检验或方差分析(ANOVA),P<0.05认为差异具有统计学意义,P<0.01认为差异有显著统计学意义。
2 结果
2.1 糖氧剥离恢复24 h后细胞LDH的表达
和对照组相比,OGD组LDH的释放显著增加(P<0.01),经10 μmol·L-1和100 μmol·L-1的CAM预处理后LDH的释放较OGD+0 μmol·L-1CAM组显著降低(P<0.01),1 μmol·L-1的CAM预处理则无明显作用。

图1 OGD及CAM预处理对皮质神经细胞LDH释放的影响
与对照组相比,1)P<0.01;与OGD+0 μmol·L-1CAM组相比,2)P<0.01。
Fig. 1 Effect of OGD and CAM pretreatment on extracellular LDH content in cortex of each group
Compared with the control group,1)P<0.01; compared with OGD+ 0 μmol·L-1CAM group,2)P<0.01.
2.2 缺氧复氧及克拉霉素处理后细胞活力值表达分析
通路存活凋亡试剂盒可以直观发现糖氧剥离恢复24 h后,OGD组凋亡细胞较对照组明显增多,存活细胞明显减少,而OGD+100 μmol·L-1CAM则显著减少了OGD所造成的细胞凋亡及坏死数量,说明CAM在糖氧剥离中对细胞坏死凋亡起到了保护作用,见图2。
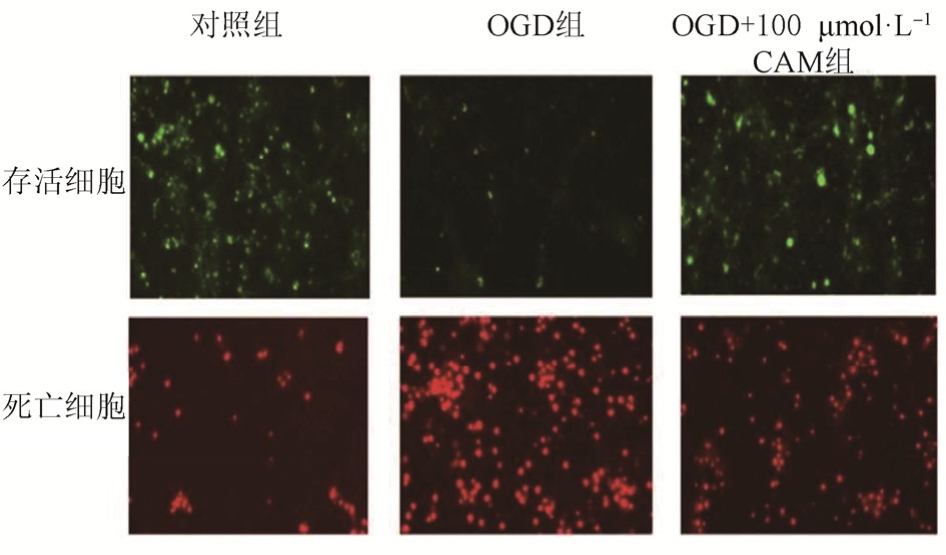
图2 OGD及CAM预处理后细胞存活及凋亡染色荧光分析
Fig. 2 Fluorescence analysis of cell survival and apoptosis after OGD and CAM pretreatment
2.3 缺氧复氧及克拉霉素处理对caspase-3、Bax、Bcl-2表达影响
通过Western blot测定,OGD组相较于对照组,caspase-3的相对表达量显著上升(P<0.01);而OGD+100 μmol·L-1CAM组与OGD组相比则显著减小了caspase-3的相对表达(P<0.05)。说明了OGD加重了皮质神经细胞的坏死凋亡,引起了caspase-3的表达增加,而应用CAM预处理可明显减少caspase-3的相对表达。
同时OGD组相较于对照组Bax/Bcl-2的比值明显上升(P<0.01);而OGD+100 μmol·L-1CAM组与OGD组相比则显著减小了Bax/Bcl-2的比值(P<0.01)。糖氧剥离加重了Bax的表达,减小了Bcl-2的表达,CAM预处理有效抑制了糖氧剥离所造成的Bax增高与Bcl-2降低。

图3 OGD及CAM预处理对caspase-3、Bax、Bcl-2表达的影响
与对照组比较,1)P<0.05,2)P<0.01;与OGD组比较,3)P<0.05,4)P<0.01。
Fig. 3 Effects of OGD and CAM pretreatment on the expression of caspase-3, Bax and Bcl-2
Compared with the control group,1)P<0.05,2)P<0.01; compared with OGD group,3)P<0.05,4)P<0.01.
3 讨论
通过提取原代大鼠皮质神经细胞,并通过更换无胎牛血清无糖培养基,于厌氧室处理建立细胞糖氧剥离损伤模型,可有效地模拟缺血性脑卒中神经元损害过程,目前已广泛应用于缺血性脑卒中的分子生物学探索[7]。本研究中,未予进行OGD造模的正常原代皮质神经细胞生长活跃,细胞体饱满,透光明显且轴突与树突边界清晰,细胞间呈交织状;当进行OGD处理后,培养皿中漂浮凋亡坏死细胞较前明显增多,细胞体固缩明显,贴壁不牢,胞体及突起拉长,骨架蛋白毁损严重,继续正常环境中培养24 h后,细胞转复改善并不明显。本研究于OGD前,给予OGD+CAM组预先使用CAM处理,相较于OGD组,CAM预处理明显减少了由OGD所带来的皮质神经细胞的坏死凋亡,大部分细胞的形态重新恢复饱满,由LDH的释放可知,10 μmol·L-1的CAM即可取得疗效,100 μmol·L-1的的CAM疗效显著且并未造成正常皮质神经元的损伤。
红霉素、CAM和其他大环内酯类抗菌药物在临床中应用已有较长的历史,引起的不良反应也较少。既往研究的大环内酯类药物的缺血再灌注神经保护作用很少涉及到抗凋亡机制,相关研究显示红霉素预处理可以介导缺血后的转录应答,增加了脑缺血区域及体外培养的神经细胞对缺氧的耐受性[8-10]。通过体外动物实验和临床研究发现大环内酯类抗菌药物也可以调解炎症机制[3-4,6,11]。在确定CAM对糖氧剥离的皮质神经元有保护作用后,本研究主要通过Western blot探索了CAM对于凋亡通路的影响。
缺血性脑卒中再灌注后会不可避免地造成皮质神经细胞的损伤,在该病理生理过程中,凋亡与坏死是最主要的两大机制。神经元凋亡是一个可逆的、细胞自身程序性的过程,多种基因参与了凋亡的调控,Bcl-2家族基因所表达的蛋白在这过程中发挥了显著的功能[12-13]。然而Bcl-2家族基因表达了2类不同功能的蛋白质,其中Bcl-w、Bcl-xl、Bcl-2蛋白是抑制凋亡进程的,而Bid、Bak、Bax蛋白则是加快凋亡进程的,本研究所涉及的Bcl-2、Bax蛋白是Bcl-2家族中调节凋亡进程功能最明显的蛋白[12]。缺血性脑卒中过程中,Bax依附至线粒体膜,线粒体膜通透性增高导致细胞质中细胞色素C含量上升,内源性凋亡途径由此激活[14]。同时Bcl-2的含量减少导致线粒体膜的稳定性下降,内质网释放Ca2+增多[15],氧化自由基及脂类过氧化物生成增多进一步加重了凋亡进程[16-17]。本研究中,通过western blot发现并验证OGD导致了皮质神经细胞的Bax表达上升,Bcl-2表达下降,而经过CAM预处理后再进行OGD则重新大幅度地抑制了Bax表达上升与Bcl-2的表达下降。
此外,本研究探索了CAM在皮质神经细胞OGD过程中与另一个凋亡相关蛋白caspase-3之间的联系。caspase-3作为凋亡执行蛋白酶,参与了caspases级联反应下行的重要过程,在凋亡程序中发挥后枢纽的功能[18]。caspase-3的激活也是受到Bcl-2家族基因所表达的蛋白调控的,缺血性脑卒中后Bax的上调及Bcl-2的下调均促进了caspase-3的活化。本研究也证实了OGD组caspase-3的表达较对照组明显升高,而经过CAM预处理后,caspase-3的表达上升得到了很好地抑制。
综上所述,大鼠皮质神经细胞OGD后的凋亡很可能是Bax、Bcl-2、caspase-3凋亡通路所介导的。CAM在OGD过程中可能抑制了Bax、caspase-3等促凋亡蛋白的表达及下调了抑凋亡蛋白Bcl-2的表达从而发挥保护皮质神经细胞的作用。本研究从凋亡方面探讨了CAM对OGD后皮质神经细胞的作用,为临床治疗提供了新的思路与依据。
REFERENCES
[1] MINNERUP J, SUTHERLAND B A, BUCHAN A M, et al. Neuroprotection for stroke: current status and future perspectives [J]. Int J Mol Sci, 2012, 13(9): 11753-11772.
[2] KATAYAMA Y, INABA T, NITO C, et al. Neuroprotective effects of erythromycin on cerebral ischemia reperfusion-injury and cell viability after oxygen-glucose deprivation in cultured neuronal cells [J]. Brain Res, 2014(1588): 159-167.
[3] AZUMA A, FURUTA T, ENOMOTO T, et al. Preventive effect of erythromycin on experimental bleomycin-induced acute lung injury in rats [J]. Thorax, 1998, 53(3): 186-189.
[4] LABRO M T, ABDELGHAFFAR H. Immunomodulation by macrolide antibiotics [J]. J Chemother, 2001, 13(1): 3-8.
[5] LI Y J, AZUMA A, TAKAHASHI S, et al. Fourteen-membered ring macrolides inhibit vascular cell adhesion molecule 1 messenger RNA induction and leukocyte migration: role in preventing lung injury and fibrosis in bleomycin-challenged mice [J]. Chest, 2002, 122(6):2137-2145.
[6] MORIKAWA K, ZHANG J, NONAKA M, et al. Modulatory effect of macrolide antibiotics on the Th1-and Th2-type cytokine production [J]. Int J Antimicrob Agents, 2002, 19(1):53-59.
[7] COBLE M D, HILL C R, BUTLER J M. Haplotype data for 23 Y-chromosome markers in four US population groups [J].Forensic Sci Int Genet, 2013, 7(3): e66-e68.
[8] BRAMBRINK A M, KOERNER I P, DIEHL K, et al. The antibiotic erythromycin induces tolerance against transient global cerebral ischemia in rats (pharmacologic preconditioning) [J]. Anesthesiology, 2006, 104(6):1208-1215.
[9] HUBER R, KASISCHKE K, LUDOLPH A C, et al. Increase of cellular hypoxic tolerance by erythromycin and other antibiotics [J]. Neuroreport, 1999, 10(7): 1543-1546.
[10] KOERNER I P, GATTING M, NOPPENS R, et al. Induction of cerebral ischemic tolerance by erythromycin preconditioning reprograms the transcriptional response to ischemia and suppresses inflammation [J]. Anesthesiology, 2007, 106(3): 538-547.
[11] KUDOH S, AZUMA A, YAMAMOTO M, et al. Improvement of survival in patients with diffuse panbronchiolitis treated with low-dose erythromycin [J]. Am J Respir Crit Care Med, 1998, 157(6 Pt 1): 1829-1832.
[12] LIU D, LU C, WAN R, et al. Activation of mitochondrial ATP-dependent potassium channels protects neurons against ischemia-induced death by a mechanism involving suppression of Bax translocation and cytochrome c release [J]. J Cereb Blood Flow Metab, 2002, 22(4): 431-443.
[13] ZHONG F F, WU C L, SUN X F, et al. Effects of Buyang Huanwu decoction combined with edaravone on the apoptosis of neuron and expression of Bcl-2 and Bax following cerebral ischemia-reperfusion in mice [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(11): 1392-1396.
[14] CROMPTON M. Bax, Bid and the permeabilization of the mitochondrial outer membrane in apoptosis [J]. Curr Opin Cell Biol, 2000, 12(4): 414-419.
[15] MATHAI J P, GERMAIN M, SHORE G C. BH3-only BIK regulates BAX, BAK-dependent release of Ca2+from endoplasmic reticulum stores and mitochondrial apoptosis during stress-induced cell death [J]. J Biol Chem, 2005, 280(25): 23829-23836.
[16] RANJAN P, BOSS J M. C/EBPbeta regulates TNF induced MnSOD expression and protection against apoptosis [J]. Apoptosis, 2006, 11(10): 1837-1849.
[17] MÉTRAILLER-RUCHONNET I, PAGANO A, CARNESECCHI S, et al. Bcl-2 protects against hyperoxia-induced apoptosis through inhibition of the mitochondria-dependent pathway [J]. Free Radic Biol Med, 2007, 42(7): 1062-1074.
[18] CHENG C Y, SU S Y, TANG N Y, et al. Ferulic acid inhibits nitric oxide-induced apoptosis by enhancing GABAB1 receptor expression in transient focal cerebral ischemia in rats [J]. Acta Pharmacol Sin, 2010, 31(8): 889-899.
Study on the Protective Effect of Clarithromycin on Cortical Neurons Deprived of Oxygen and Glucose in Rats and Its Mechanism of Inhibition of Apoptosis
GU Aiming1, GUO Ruya2, ZHAI Changlin2
(1.Jiaxing Maternity and Child Health Care Hospital, Jiaxing 314000, China; 2.Jiaxing First Hospital, Jiaxing 314000, China)
ABSTRACT:OBJECTIVE To research the protective effect of clarithromycin(CAM) on cortical neurons deprived of oxygen and glucose in rats and its related apoptosis mechanisms.METHODSExtraction of primary rat cortical neurons, to establish the oxygen glucose deprivation (OGD) model with CAM pretreatment; the survival/apoptosis detection kit was used to detect the cell apoptosis; LDH kit was used to measure the content of LDH in the medium of each group to evaluate the apoptosis. The expression of caspase-3, Bax and Bcl-2 in each group were detected by Western blot.RESULTSAfter treatment with OGD, compared with the control group, the apoptosis of cortical neurons and the content of lactic acid were significantly increased, the difference was significant (P<0.01); With 100 μmol·L-1CAM pretreatment the apoptosis and LDH release induced by OGD was significantly reduced (P<0.01). After treatment with OGD, the expression of caspase-3 and Bax/Bcl-2 in cortical neurons was significantly higher than that in control group (P<0.01), while CAM pretreatment effectively reduced the expression of caspase-3 and Bax/Bcl-2.CONCLUSIONCAM has protective effect on cortical neurons deprived of oxygen and glucose, which may be related to the promotion of caspase-3, upregulation of Bax, downregulation of Bcl-2 protein on apoptosis related pathways.
KEY WORDS:clarithromycin; caspase-3; Bax; Bcl-2; oxygen glucose deprivation; cortical neuron
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2017)07-0973-05
DOI:10.13748/j.cnki.issn1007-7693.2017.07.009
引用本文:顾爱明, 郭如雅, 翟昌林. 克拉霉素对糖氧剥离大鼠皮质神经细胞的保护作用及其抑制凋亡的机制研究[J]. 中国现代应用药学, 2017, 34(7): 973-977.
收稿日期:2017-02-07
(本文责编:李艳芳)
作者简介:顾爱明,男,硕士,副主任医师 Tel: (0573)82823055 E-mail: 709469028@qq.com


