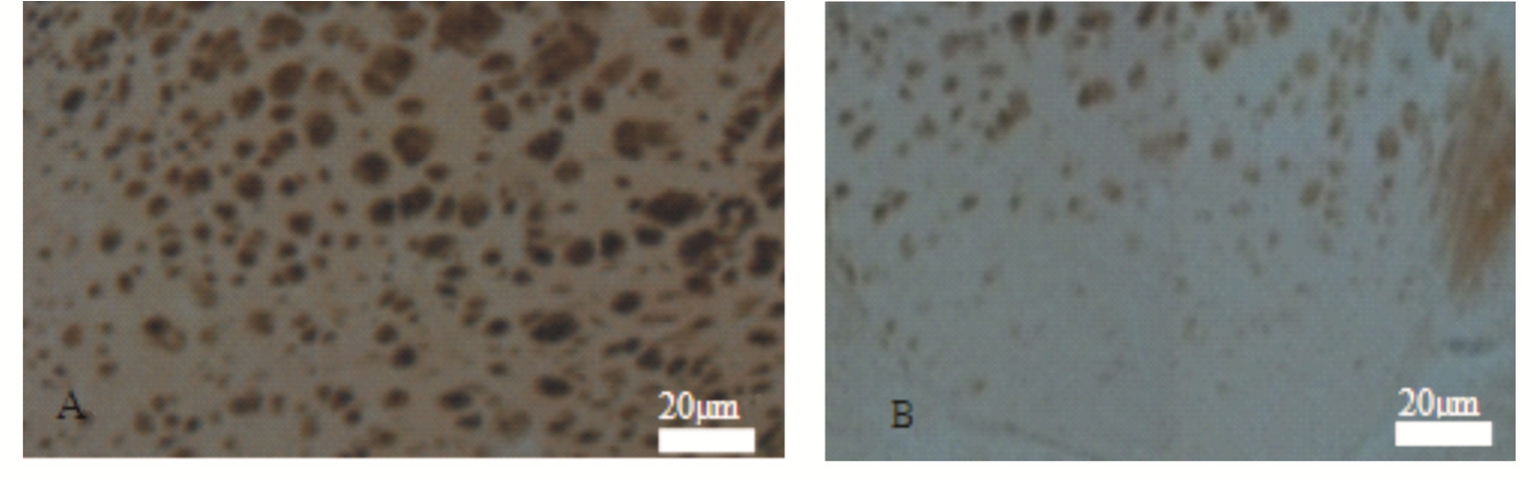
图1 正常组(A)和模型组(B)小鼠TH蛋白的免疫组化结果
Fig. 1 Immunohistochemical staining of TH protein in normal group(A) and model group(B)
杨毅,张晓玲,王琰萍,官俏兵,韩晨阳*(嘉兴市第二医院,浙江 嘉兴 314000)
摘要:目的 探索樟芝多糖对于6-OHDA诱导的的帕金森小鼠脑组织抗氧化/抗炎能力及行为学的影响。方法6-OHDA毁损内侧前脑束构建帕金森小鼠模型,小鼠分组为正常组、模型组、给药组(50,100,200 mg·kg-1)组,均为腹腔注射给药。游泳实验和水迷宫实验观察行为学变化,Elisa法检测纹状体GSH-Px、SOD、CAT、LDH、MDA含量和炎症因子IL-6、IL-1β表达。结果与模型组相比,给药组小鼠的GSH-Px、SOD、CAT、LDH显著上升,MDA、IL-6和IL-1β显著下降,小鼠的认知、行动能力得到明显的改善。结论樟芝多糖可以一定程度上改善帕金森小鼠行为,其原因可能与多糖具有抗氧化、抗炎的作用有关,多糖可以提高脑组织抗氧化能力,减少炎症因子表达。
关键词:樟芝多糖;6-OHDA;帕金森小鼠;抗氧化;抗炎
帕金森病的一个关键性致病因素是脑中黑质纹状体多巴胺神经元功能的丧失,而在不同的环境因素和遗传因素引起的帕金森病临床和病理的表现是不同的。研究表明脑部的氧化损伤对于帕金森的发生和进展有着直接的作用[1],所以抗氧化损伤一直是帕金森治疗的重点之一。近年来,多种植物多糖被证明有着很好的抗肿瘤、抗氧化以及免疫调节等生物活性[2-3]。樟芝是台湾独有的一种天然多孔菌类,由于其富含三萜、多糖、腺苷等多种天然物质,近年来逐渐成为研究的热门。有研究表明[4-6],樟芝三萜中多糖的成分高达30%以上,这成了樟芝多糖具有广泛应用前景的基础。目前鲜有文献报道樟芝多糖的抗氧化抗炎作用,亦鲜见文献报道樟芝多糖对于帕金森疾病的相关药理作用。本研究探讨樟芝多糖对于帕金森小鼠的行为学影响,以及相关氧化损伤因子和炎症因子的影响,为樟芝多糖在帕金森疾病中的应用和药理基础研究提供一定的支持。
1.1 动物
清洁级小鼠75只,体质量(20±5)g,购自浙江中医药大学动物实验中心,实验动物许可证号:SCXK(浙)2013-0184。小鼠分笼饲养,有9笼每笼8只,1笼3只,共10笼。动物实验室温度为20~25 ℃,湿度为(70±5)%,依据国家标准啮齿类动物干燥饲料喂养,小鼠活动、摄食自由。
1.2 试剂
6-OHDA(Sigma公司,批号:20160213);樟芝多糖(杭州众芝康公司,批号:20160110,纯度85%);GSH-Px、SOD、CAT、LDH、MDA、IL-6和IL-1β Elisa试剂盒(上海恒远生物有限公司,批号:20161712,20163125,20161314,20167181,20166112,20165716,20164331);酪氨酸羟化酶(TH)一抗和二抗均购于Sigma公司(批号:20160143,20162548)。
1.3 仪器
Multuskan Go 1510酶标仪(美国Thermo);Olympusix71显微镜(徕卡公司);CM1850UV切片机(Lecia)。
2.1 帕金森小鼠模型的构建及确定
将6-OHDA配制成2 μg·μL-1的0.2%维生素C-生理盐水溶液备用。小鼠麻醉后固定在立体定位仪上,根据文献[7]所述方法确定注射位置,每个点注射6-OHDA溶液5 μL,之后每日小鼠腹腔注射青霉素10 IU,连续1周。正常小鼠以0.9%的生理盐水代替6-OHDA溶液,在相同位置注射。正常小鼠和模型组小鼠在同一环境,同种饲料下饲养。在第7天断颈处死模型组小鼠和正常组小鼠,分离黑质-纹状体,进行TH的免疫组化实验,确定帕金森小鼠模型的黑质-纹状体病理状态。
术后每天观察小鼠的行为改变:有无行动迟缓,少动,震颤,竖毛以及嗅觉等异常,在术后第8天于帕金森小鼠皮下注射阿扑吗啡诱发旋转,记录注射后0.5 h内的旋转圈数,若每分钟>7圈则视为模型构建成功。
2.2 分组方法
设置正常组、模型组、给药组3组(多糖浓度为50,100,200 mg·kg-1),每组小鼠15只,♀♂各半。给药组在给药的第1~7天内每日腹腔注射多糖溶液(生理盐水溶解)1次,正常组和模型组同样注射等量的生理盐水,5组小鼠均在相同环境,相同饮食条件下饲养。
2.3 行为学观察项目
在小鼠术后确定成功造膜后,进行水迷宫实验的训练,为期1周,在训练1周后开始进行樟芝多糖给药和行为学实验,其中包括游泳实验和水迷宫实验,游泳实验在术后第2周进行,水迷宫实验在术后训练1周后进行,两种行为实验同步进行。
2.3.1 游泳实验 在药物干预中的第1,3,5,7天进行游泳实验,操作和评价如下:将小鼠放入20 cm×30 cm×20 cm的玻璃水箱中,水深为15 cm,水温为室温25 ℃。评分标准如下:1 min能连续游泳者为3分,大部分时间游泳偶尔漂浮为2.5分,50%时间为漂浮状态为2分,偶尔游泳大部分时间漂浮为1.5分,无法游泳偶尔后肢游动为1分。游泳实验在水迷宫实验2 h后进行。
2.3.2 水迷宫实验 小鼠术后1周开始进行水迷宫训练,训练时间1周,在药物干预中的第1,3,5,7天进行水迷宫实验,将小鼠放入终点处的水域,小鼠会登梯而上,提示小鼠避开水域。小鼠会借此避开水域达到终点,在水迷宫仪中传感系统会自动记录小鼠找到终点的用时。
2.4 TH蛋白免疫组化实验
取脑组织以4%的多聚甲醛固定后包埋、切片,以TH一抗1∶1 000染色,HRP二抗孵育,镜下观察TH蛋白的表达。
2.5 GSH-Px、SOD、CAT、LDH、MDA含量和炎症因子IL-6、IL-1β表达检测
在药物干预1周后将小鼠断头处死后迅速取大脑,在冰生理盐水中分离出所需的纹状体,以质量体积比的10倍加入冰生理盐水,剪碎后在研磨机中研磨、震荡、离心,得到匀浆上清液。根据Elisa试剂盒方法进行酶标仪的OD值检测,根据标准曲线得出各项指标。
2.6 统计分析
小鼠行为学数据结果和相关评分以x±s表示,所有数据采用SPSS 13.0统计软件进行t检验,以P<0.01为有显著性差异。
3.1 小鼠黑质-纹状体TH蛋白变化
正常组小鼠TH染色阳性细胞多,细胞质浓染,而模型组小鼠黑质阳性细胞数目显著减少,免疫活性低,着色浅。结果见图1。
3.2 游泳实验结果
模型组小鼠评分与正常组和给药组相比有显著性差异(P<0.01),而给药组小鼠评分显著高于模型组。结果见表1。
3.3 水迷宫实验结果
模型组小鼠抵达终点用时高于正常组,且具有显著性差异(P<0.01);而给药组小鼠用时明显低于模型组,具有显著性差异(P<0.01),结果见表2。
3.4 樟芝多糖相关氧化损伤及炎症因子指标的影响
模型组纹状体中的GSH-Px、SOD、CAT、LDH均明显低于正常组,而MDA、IL-6、IL-1β则高于正常组且均具有显著性差异(P<0.01)。经过樟芝多糖的干预7 d后GSH-Px、SOD、CAT、LDH显著增高,而MDA、IL-6、IL-1β则明显降低(P<0.01)。结果见表3。

图1 正常组(A)和模型组(B)小鼠TH蛋白的免疫组化结果
Fig. 1 Immunohistochemical staining of TH protein in normal group(A) and model group(B)
表1 小鼠游泳实验结果(n=15,x±s)
Tab. 1 Results of mice swimming test (n=15,x±s)
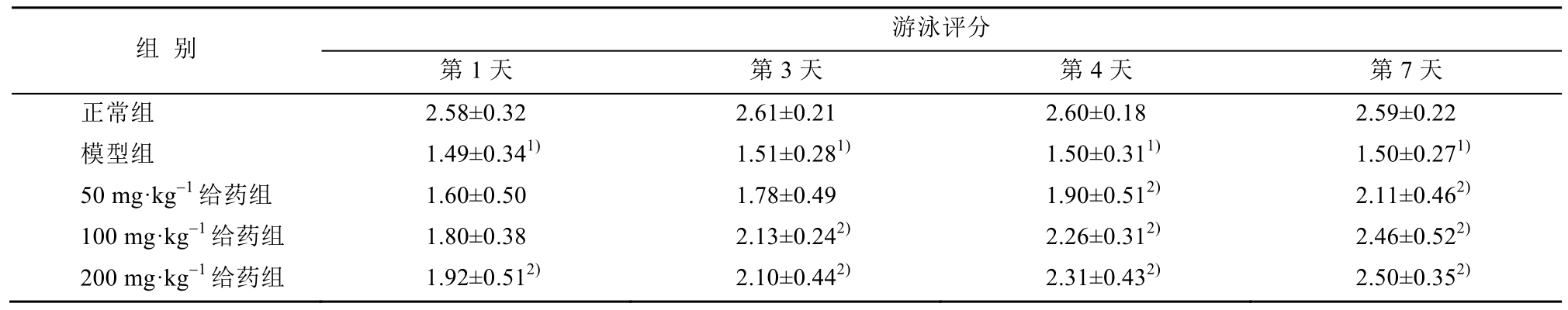
注:与正常组比较,1)P<0.01;与模型组比较,2)P<0.01。
Note: Compared with the normal group,1)P<0.01; compared with the model group,2)P<0.01.
表2 小鼠水迷宫实验结果(n=15,x±s)
Tab. 2 Results of mice water maze experiment(n=15,x±s)

注:与正常组比较,1)P<0.01;与模型组比较,2)P<0.01。
Note: Compared with the normal group,1)P<0.01; compared with the model group ,2)P<0.01.
表3 樟芝多糖对于氧化损伤指标和炎症因子的影响(n=15,x±s)
Tab. 3 Effects of Polysaccharides from Antrodia camphorata on oxidative damage and inflammatory factor(n=15,x±s)
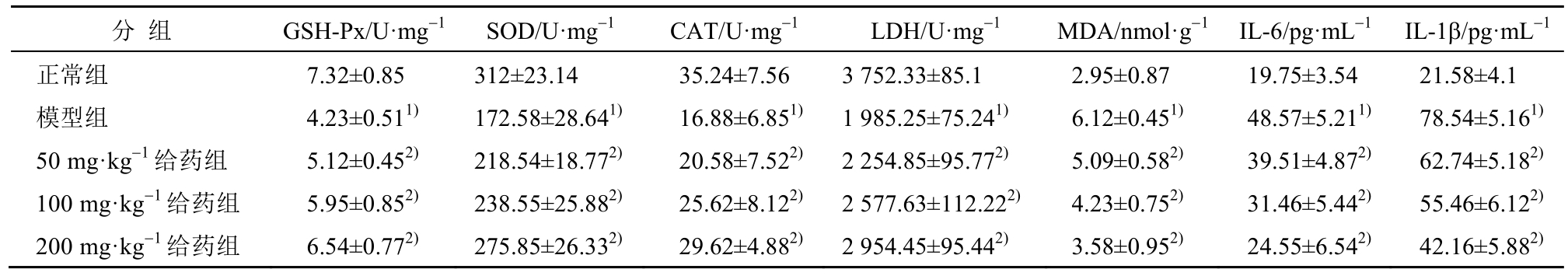
注:与正常组比较,1)P<0.01;与模型组比较,2)P<0.01。
Note: Compared with the normal group,1)P<0.01; compared with the model group,2)P<0.01.
樟芝为我国台湾的道地药材,仅见于台湾的桃园、南投、高雄等海拔450~2 000 m的深山中[8],目前从牛樟芝中分离得到的化学成分超过200多种,包括烷酸类、腺苷类、三萜类、多糖类以及超氧化歧化酶等[7]。目前对于樟芝多糖的研究较为广泛,樟芝中的多糖蛋白类可以抑制肿瘤细胞的转移,其作用可能与转化生长因子有关[9-10],多糖还具有抗内皮细胞血管新生的作用[11-12],硫酸类的多糖可以降低多柔比星导致的心脏毒性等作用[13]。在保肝作用的研究中发现[14],多糖可以减少肝细胞的氧化损伤,增加肝细胞的活性,其抗氧化的作用可能与肝细胞的DNA修复有关[15]。在抗炎及免疫调节的作用中发现,多糖可以降低肿瘤坏死因子,调节IL-6等炎症因子起到免疫调节的抗炎作用[16]。在神经保护作用的研究中发现多糖可以调节PC12细胞的活性,保护其免于β淀粉样蛋白的损伤[17],改善神经细胞的病变。总之樟芝多糖的活性是多样且强大的。6-OHDA是一种能选择性诱导多巴胺能神经元死亡的化合物,对于大鼠、小鼠等动物都是有效的神经毒素,可以产生帕金森性病变,它主要是通过细胞内外的氧化反应产生活性氧和苯醌类物质诱导产生氧化应激反应,引发黑质-纹状体的功能减退。脑是耗氧量较大的器官之一,实验证明许多中枢退行性疾病(尤其是帕金森和阿尔茨海默病等)都与氧化损伤和炎症反应有关。正常情况下机体对于氧化损伤有着自我调节的机制,其中抗氧化酶GSH-Px、SOD、CAT可以进行自由基水平的调节,而MDA和相关的活性氧物质可以反映出细胞受损的程度,从某种意义上说这些酶的表达水平可以反映出体内氧化损伤程度。而炎症因子IL-6、IL-1β经过证明在帕金森患者体内水平异常增高,可以反映出炎症反应对于发病及进程的相关性。
本实验针对樟芝多糖抗炎抗氧化的药理作用,以帕金森小鼠为研究对象发现,樟芝多糖可以明显改善帕金森小鼠的认知、运动行为,通过相关检测发现它可以显著提高GSH-Px、SOD、CAT、LDH等抗氧化酶的含量(P<0.01),且随着多糖浓度的变化,药理效果更加明显,它还可以降低MDA和炎症因子IL-6、IL-1β,且这些都与剂量正相关。
综上,樟芝多糖对于帕金森小鼠有着很好的治疗效果,为今后帕金森药物开发和研究提供了参考。
REFERENCES
[1] HIASSERINI D, PACIOTTI S, EUSEBI P, et al. Selective loss of glucocerebrosidase activity in sporadic Parkinson's disease and dementia with Lewy bodies [J]. Mol Neurodegener, 2015, 10(1): 15-19.
[2] LI J, LI P, CEHN K S. Advance in studies on anti-tumor activity of polysaccharides in latest five years[J]. China J Chin Mater Med(中国中药杂志), 2013, 38(8): 1116-1125.
[3] LI S S, JIN Y P, YAO C L, et al. Research achievements on structures and activities of polysaccharides from Panax ginseng [J]. China J Chin Mater Med(中国中药杂志), 2014, 39(24): 4709-4715.
[4] ZHAO C, LI Y S, JIANG M L, et al. Advance of the interaction between cytochrome P450 and xenobiotics [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2014, 31(8):1020-1024.
[5] CHIN-CHAN M, NAVARRO-YEPES J, UINTANILLAVEGA B. Environmental pollutants as risk factors for neurodegenerative disorders: Alzheimer and Parkinson diseases [J]. Front Cell Neurosci, 2015, 10(9): 124-128
[6] LU M, EL-SHAZLY M, WU T, et al. Recent research and development of Antrodia cinnamomea [J]. Pharmacol Ther, 2013, 139(2): 124-156.
[7] DU Y, WU T, CHANG F, et al. Chemical profiling of the
cytotoxic triterpenoid-concentrating fraction and characterization of ergostane stereo-isomer ingredients from Antrodia camphorata [J]. J Pharm Biomed Anal, 2012, 58(1): 182-192. [8] WANG L P, LU X L, ZHAO Z J. Overview of antrodia camphorata research [J]. Pharm Today(今日药学), 2017, 27(2):140-144.
[9] FA K, YANG C, CHEN P, et al. Anti-metastatic effects of ntrodan, the Antrodia cinnamomea mycelia glycoprotein, in lung carcinoma cells [J]. Int J Biol Macromol, 2015(74):476-482.
[10] CHIU C, PENG C, KER Y, et al. Physicochemical characteristics and anti-inflammatory activities of antrodan, a novel glycoprotein isolated from Antrodia cinnamomea Mycelia [J]. Molecules, 2014, 19(1): 22-40.
[11] YANG C M, ZHOU Y J, WANG R J, et al. Anti-angiogenic effects and mechanisms of polysaccharides from Antrodia cinnamomea with different molecular weights [J]. J Ethnopharmacol, 2009, 123(3): 407-412.
[12] CHENG J J, HUANG N K, LU H S, et al. Characterization and biological functions of sulfated polysaccharides from sulfated-salt treatment of Antrodia cinnamomea [J]. Process Biochem, 2009, 44(4): 453-459.
[13] SHEU M T, JHAN H J, HSIEH C M, et al. Efficacy of antioxidants as a complementary and alternative medicine (CAM) in combination with the chemotherapeutic agent doxorubicin [J]. Integr Cancer Ther, 2015, 14(2): 184-195.
[14] CHEN Y R, CHANG K T, TSAI M J, et al. Antrodia cinnamomea profoundly exalted the reversion of activated hepatic stellate cells by the alteration of cellular proteins [J]. Food Chem Toxicol, 2014(69): 150-162
[15] KER Y B, PENG C C, CHANG W L, et al. Hepatoprotective bioactivity of the glycoprotein, antrodan, isolated from Antrodia cinnamomea Mycelia [J]. PLoS One, 2014, 9(4):e93191.
[16] GOKILA VANI M, KUMAR K J, LIAO J W, et al. Antcin C from Antrodia cinnamomea protects liver cells against free radical-induced oxidative stress and apoptosis in vitro and in vivo through Nrf2-dependent mechanism [J]. Evid Based Complement Alternat Med, 2013: 296082. Doi: 10.1155/2013/ 296082.
[17] CHANG C H, WANG H E, LIAW P Y, et al. Antrodia cinnamomea exhibits a potent neuro-protective effect in the PC12 cell-Aβ 25-35 model-pharmacologically through adenosine receptors and mitochondrial pathway [J]. Planta Med, 2012, 78(17): 1813-1823.
Antioxidation and Anti-inflammatory Effects of Antrodia Camphorata Polysaccharide on Parkinsonian Mice Induced by 6-OHDA
YANG Yi, ZHANG Xiaoling, WANG Yanping, GUAN Qiaobing, HAN Chenyang*
(The Second Hospital of Jiaxing, Jiaxing 314000, China)
ABSTRACT:OBJECTIVE To study the antioxidation and anti-inflammatory effects of Antrodia camphorata polysaccharide on parkinsonian mice induced by 6-OHDA.METHODSThe Parkinsonian mice were induced by 6-OHDA destruction of MFB. The mice were divided into normal group, control group, and experimental group(50, 100, 200 mg·kg-1), were injected intraperitoneally. Behavioral changes were observed by swimming test and Morris water maze.RESULTSCompared with the model group, in the experimental groups, the mice GSH-Px, SOD, CAT and LDH significant increased, MDA, IL-6 and IL-1β significant declined. The cognitive ability and action ability of mice was improved significantly.CONCLUSIONThe Antrodia camphorata polysaccharide can improve Parkinson's behavior, the effect may be related to the antioxidant and anti-inflammatory, which can improve the antioxidant capacity of brain tissue and reduce the expression of inflammatory cytokines.
KEY WORDS:Antrodia camphorata polysaccharide; 6-OHDA; Parkinsonian mice; antioxidation; anti-inflammatory
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2017)07-0969-04
DOI:10.13748/j.cnki.issn1007-7693.2017.07.008
引用本文:杨毅, 张晓玲, 王琰萍, 等. 樟芝多糖对6-OHDA构建的帕金森小鼠模型的行为及抗氧化损伤/抗炎能力的影响[J]. 中国现代应用药学, 2017, 34(7): 969-972.
收稿日期:2017-01-24
(本文责编:曹粤锋)
作者简介:杨毅,男,副主任药师 Tel: 13967351048 E-mail: wasd911@126.com*
通信作者:韩晨阳,男,硕士,药师 Tel:13736496736 E-mail: 691513770@qq.com