
图1 CHMFL-FLT3-122化学结构式
Fig. 1 Chemical structure of CHMFL-FLT3-122
赵文婷,狄斌*(中国药科大学药学院,南京 211198)
摘要:目的 测定CHMFL-FLT3-122的2个解离常数。方法将CHMFL-FLT3-122溶于一系列的不同pH的缓冲溶液中,并在合适的波长处采用UV分别测定吸光度并计算其pKa1值;以不同比例的乙腈-水(30∶70、40∶60、50∶50、60∶40)为溶剂配制不同浓度(0.009,0.013,0.017 mol·L-1)的CHMFL-FLT3-122溶液,用盐酸溶液滴定,利用非对数滴定法(Benet法)经数学计算推算出其pKa2值。结果CHMFL-FLT3-122存在2个解离常数,其pKa1值为3.87±0.14,pKa2值为8.12。结论采用UV和非对数滴定法对CHMFL-FLT3-122的解离常数进行测定,方法简单快速,准确可靠,可为其制剂的处方设计、质量标准的研究提供参考。
关键词:CHMFL-FLT3-122;解离常数;紫外分光光度法;非对数滴定法
FMS样酪氨酸激酶3(FMS-like tyrosine kinase 3,FLT3)是一种Ⅲ型受体酪氨酸激酶,在造血细胞和淋巴细胞的增殖、分化、凋亡过程中发挥关键作用。FLT3的异常激活与一系列恶性血液疾病如急性髓性白血病(acute myeloid leukemia,AML)、急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和慢性髓性白血病(chronic myelogenous leukemia,CML)的发生发展以及预后密切相关,研究表明,超过1/3的AML患者伴随有FLT3的异常激活[1],其中FLT3蛋白的近膜结构域的内部串联重复序列突变(FLT3-ITD)是AML中最主要的突变之一。CHMFL-FLT3-122是一种新合成的FLT3激酶抑制剂,结构式见图1。该抑制剂对AML中的FLT3-ITD阳性的FLT3激酶自磷酸化及下游信号通路具有较好的抑制作用,并且能有效使细胞周期停滞,诱导此类细胞凋亡。在临床前动物实验中已证明该化合物可以有效地阻滞FLT3-ITD突变肿瘤在小鼠体内的增长[2]。
解离常数是关系到药物溶解度与pH值之间的重要理化常数,对药物的分离纯化、色谱分析处方工艺筛选及研究药物的体内代谢过程等具有重要的指导意义[3]。CHMFL-FLT3-122作为一种新型潜在治疗FLT3-ITD阳性AML的候选药物,其解离常数国内外均无报道,测定其解离常数可为其新制剂的处方设计开发、质量标准研究提供参考。一般测定药物解离常数的方法有电位滴定法、分光光度法、电导法、毛细管电泳法等[4]。CHMFL-FLT3-122结构中有2个含氮的碱性基团,一个为嘧啶环上的氨基,一个为脂肪叔胺,理论上有二级解离。嘧啶环上的氨基碱性很弱,无明显的滴定突跃,难以通过电位滴定法对其pKa1进行测定,但因为连有嘧啶环,且双离子型(CHMFL-FLT3-122的共轭酸)和一级解离离子型紫外吸收差异较大,因此可以通过UV对CHMFL-FLT3-122嘧啶环上的氨基的pKa1进行测定;脂肪叔胺几乎无紫外吸收,无法通过UV获得该基团的pKa2,而叔胺具有较强的碱性,虽CHMFL-FLT3-122难溶于水,但易溶于乙腈,因此可以通过电位滴定法测定其在不同比例的乙腈-水混合溶剂中的解离常数,再应用一定的数学方法来得到在纯水中的解离常数。本研究分别用UV和非对数滴定法(Benet法)对CHMFL-FLT3-122的pKa1和pKa2进行测定。

图1 CHMFL-FLT3-122化学结构式
Fig. 1 Chemical structure of CHMFL-FLT3-122
UV-2450紫外可见分光光度计(日本Shimadzu);FE-20型pH计、XS105DU电子天平购自瑞士Mettler Toledo。
CHMFL-FLT3-122对照品(自制,纯度99.42%,批号:122-20160401);磷酸二氢钾(国药集团,分析纯)、氯化钾(西陇化工,分析纯)用于配制缓冲溶液(称取KH2PO413.625 7 g,KCl 111.808 g加入超纯水溶解后定容至4 L,使之形成KH2PO4浓度为0.025 mol·L-1,μ=0.4的缓冲液);盐酸(国药集团,分析纯);氢氧化钠(西陇化工,分析纯);乙腈(TEDIA,色谱纯);实验用水为超纯水。
2.1 CHMFL-FLT3-122一级解离常数pKa1的测定
有机弱酸、弱碱性药物在介质中可发生电离,以一元有机弱酸为例,在水中达到电离平衡:HB⇋H++B-,在稀溶液中解离常数![]() 两边取负对数得:
两边取负对数得:
其中,HB为共轭酸,B-为共轭碱,如果HB和B-均有紫外吸收,紫外吸收光谱又有明显的差异,就可以用UV测定pKa值。测定时,可取待测药物,配制3种浓度相同的溶液,通过调节溶液pH值,使溶液①中的药物部分以HB,部分以B-的形式存在(部分解离);溶液②中的药物仅以HB的形式存在(未解离);溶液③中的药物仅以B-的形式存在(完全解离);设溶液①②③中药物的浓度分别为C,溶液①中HB的浓度为CHB,B-的浓度为CB。A、AHB、AB分别为在一定波长处溶液①②③的吸光度。如果HB与B-的紫外吸收均符合吸收定律,那么:
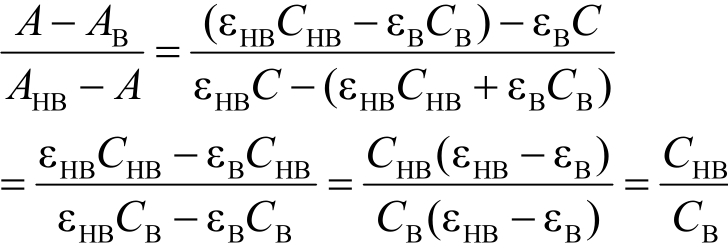
将其代入(1)中则可以得到:
即可计算出药物的pKa值。其中(2)式中pH值为溶液①的pH值[5]。
因此,根据上述原理,先配制一份CHMFL-FLT3-122储备液(0.04%HCl水溶液溶解,浓度0.1 mg·mL-1),准确移取CHMFL-FLT3-122储备液10 mL于一烧杯中,另加入缓冲液约85 mL,用稀HCl溶液或NaOH溶液调节溶液的pH,得到一系列不同pH的缓冲溶液,用FE-20型pH计测定溶液的pH后将其转移至100 mL量瓶,并用缓冲液稀释至刻度,摇匀,作待测液,同法配制各空白溶液。于1 cm比色皿中扫描其紫外吸收光谱,选择合适的波长测定其吸光度从而计算得到pKa1。
2.2 CHMFL-FLT3-122二级解离常数pKa2的测定
CHMFL-FLT3-122结构中有2个碱性含氮基团,嘧啶环上的氨基碱性很弱,叔胺的碱性较强,两者相差较大,因此可将CHMFL-FLT3-122看成是2个一元弱碱,用电位滴定法对其pKa2进行测定,Benet法的原理如下[6-8]:假设B为一元弱碱,向初始体积为V0(mL)、浓度为c0的B弱碱溶液中,用浓度为cT的标准盐酸滴定,得到平衡反应式:B+H+⇋HB+,电荷平衡:
令Z=[HB+],代入式(3)中得:
HB+的酸解离常数Ka为:
根据物料平衡:
将式(4)、(6)代入式(5)得:
其中Z=[OH-]+[Cl-]-[H+],[Cl-]=cTV/(V0+V),V为加入滴定液的体积。令y=Z,x=Z/[H+],则式(7)为y=c0-Kax。以y对x作图,斜率即为-Ka,从而得到pKa。
因此,根据上述Benet法原理,且CHMFL-FLT3-122难溶于水,但易溶于乙腈的性质,采用文献[9]的方法,分别以乙腈-水体积比为30∶70,40∶60,50∶50,60∶40作为溶剂,配制浓度为0.009,0.013,0.017 mol·L-1的CHMFL-FLT3-122溶液50 mL,用浓度为0.05 mol·L-1的盐酸滴定液(已标定)滴定,记录加入滴定液的体积V以及相应溶液的pH,计算y(Z)及x(Z/[H+]),以y对x作图,进行回归分析,由此求出不同浓度CHMFL-FLT3-122在不同比例的乙腈-水溶液中的pKa1。在同一浓度条件下,以求得的pKa1对乙腈-水比例作图,外推到水中即乙腈为0时(方程的截距),即为该浓度条件下CHMFL-FLT3-122在水中的pKa2。以求得的pKa2对CHMFL-FLT3-122的浓度作图,根据方程的截距得无限稀释溶液中的值即为CHMFL-FLT3-122的pKa2。
3.1 CHMFL-FLT3-122一级解离常数pKa1测定
3.1.1 解离过程的确定和测定波长的选择 按“2.1”项下方法进行初步测定,再根据分析,进一步实验。从一系列不同pH值缓冲液中CHMFL-FLT3-122的紫外吸收光谱可以看出CHMFL-FLT3-122在pH≤2.93的缓冲液中,紫外吸收光谱行为一致,可看作仅以双离子型(CHMFL-FLT3-122的共轭酸)存在;在pH 2.93~4.95之间的缓冲液中,产生不同的紫外吸收曲线,可看作部分以双离子型、部分以一级解离离子型存在;在pH≥4.95的缓冲液中,紫外吸收光谱行为基本一致,可看作一级解离完全,即使其存在二级解离,但由于发生二级解离的叔胺无紫外吸收,所以紫外吸收光谱基本无差异,见图2~4。
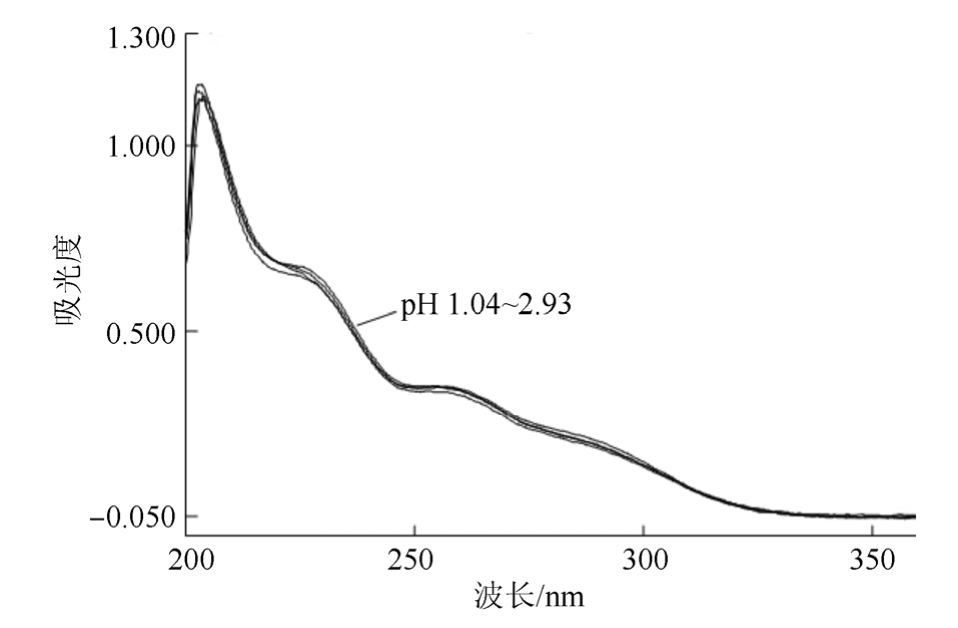
图2 CHMFL-FLT3-122在不同pH缓冲液中的紫外吸收光谱(pH 1.04~2.93)
Fig. 2 UV spectrum of CHMFL-FLT3-122 in different pH buffer (pH 1.04~2.93)
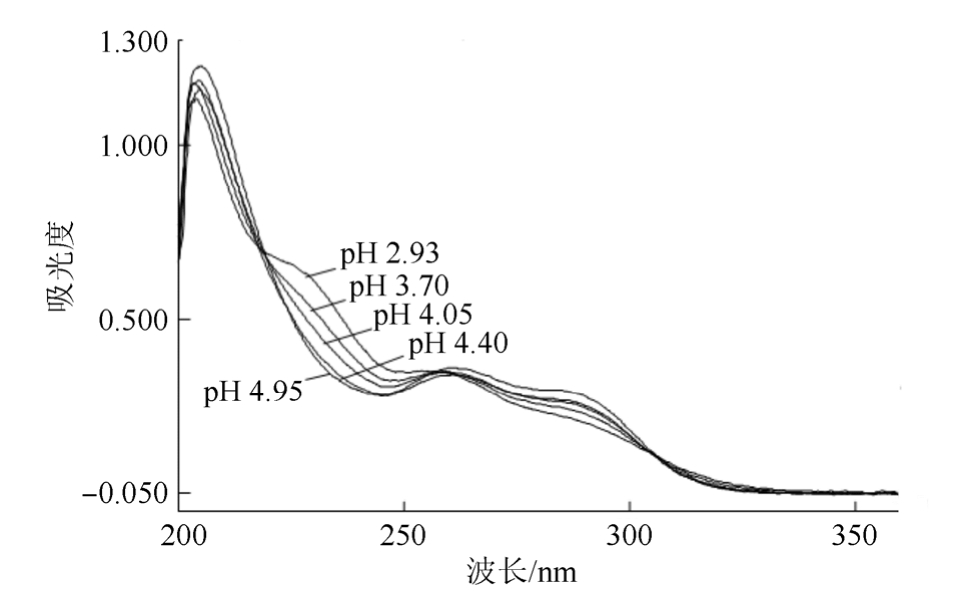
图3 CHMFL-FLT3-122在不同pH缓冲液中的紫外吸收光谱(pH 2.93~4.95)
Fig. 3 UV spectrum of CHMFL-FLT3-122 in different pH buffer (pH2.93~4.95)
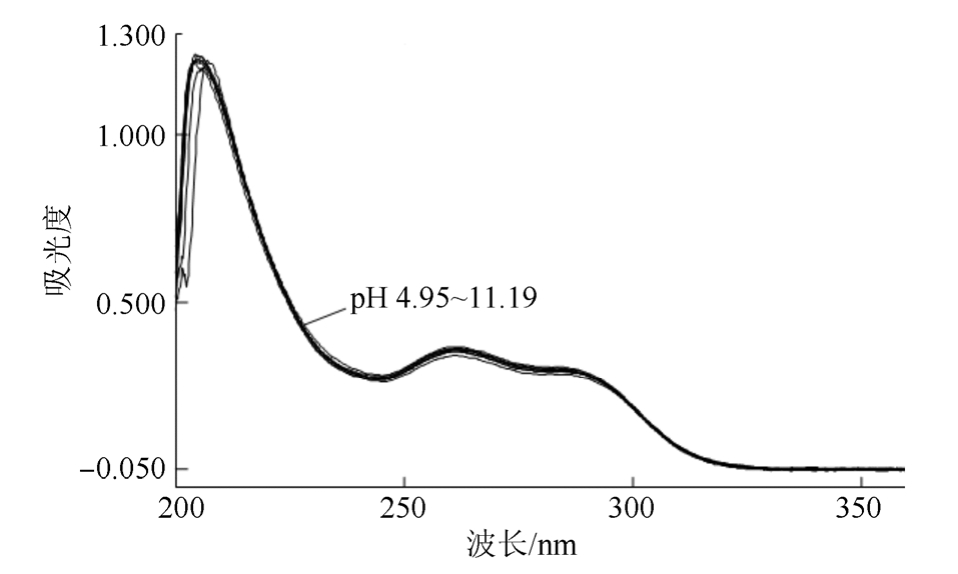
图4 CHMFL-FLT3-122在不同pH缓冲液中的紫外吸收光谱(pH 4.95~11.19)
Fig. 4 UV spectrum of CHMFL-FLT3-122 in different pH buffer (pH 4.95~11.19)
根据以上实验结果,选择紫外吸收系数差异大,吸收曲线较平坦的波长作为测定波长。本研究选择230和290 nm 2个波长作为测定波长,在测定波长处测定不同pH缓冲液中CHMFL-FLT3-122的吸光度用于解离过程中pKa1的研究。
3.1.2 吸光度的测定及pKa1的计算 在上述选定波长下,在pH 2.52~5.46之间,测定了CHMFLFLT3-122的吸光度(A)随pH值的变化情况,结果见表1。根据表1的吸光度值,按(2)式计算pKa1值,结果见表2。
表1 CHMFL-FLT3-122在不同pH缓冲液中的吸光度
Tab. 1 The absorbance of CHMFL-FLT3-122 in different pH buffer solutions
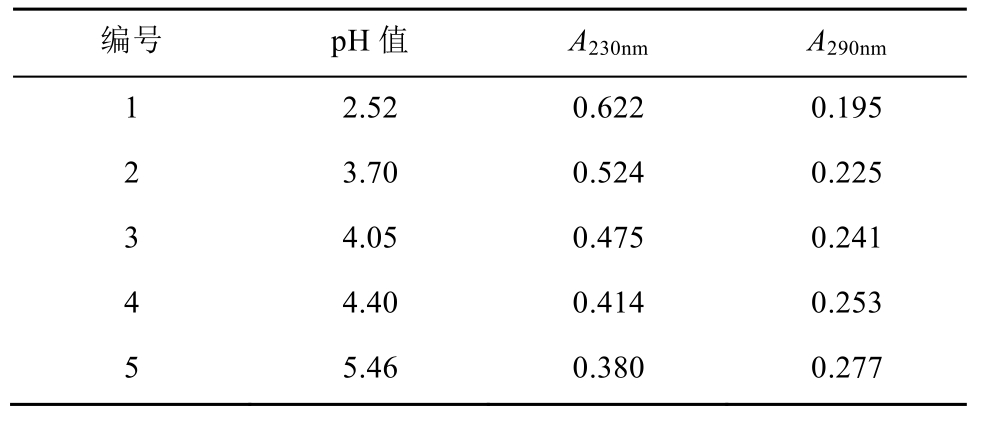
表2 CHMFL-FLT3-122的解离常数pKa1
Tab. 2 The dissociation constant pKa1of CHMFL-FLT3-122
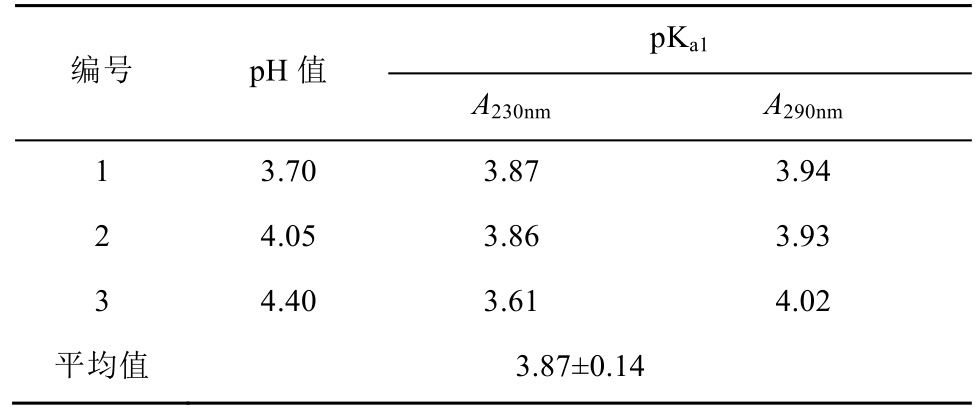
不同pH值的样品溶液在不同波长处测得的pKa值应是一致的,其差异由方法本身及测定误差引起。取平均值作为最后结果可减小误差,由本法测得CHMFL-FLT3-122的pKa1值为(3.87± 0.14)。
3.2 CHMFL-FLT3-122二级解离常数pKa2测定
3.2.1 CHMFL-FLT3-122溶液配制 按“2.2”项下方法,CHMFL- FLT3-122浓度分别为0.009,0.013,0.017 mol·L-1,各浓度均分别按照乙腈-水配比30∶70,40∶60,50∶50,60∶40进行实验。
3.2.2 pKa1测定结果 计算y(Z)及x(Z/[H+]),以y对x作图,进行回归分析,结果见表3。由此求出不同浓度CHMFL-FLT3-122在不同比例的乙腈-水溶液中的pKa1,结果见表4。
3.2.3 pKa2测定结果 在同一浓度条件下,以求得的pKa1对乙腈-水比例作图,外推到乙腈为0时(方程的截距),即为该浓度条件下CHMFLFLT3-122在水中的pKa2,结果见表5。
表3 不同浓度和不同乙腈-水比例下CHMFL-FLT3-122滴定曲线的线性回归方程
Tab. 3 The linear regression equations of the titration curve of different concentrations of CHMFL-FLT3-122 in different proportions of acetonitrile-water

表4 不同浓度CHMFL-FLT3-122在乙腈-水混合体系中的pKa1
Tab. 4 pKa1of different concentrations of CHMFL-FLT3-122 in different ratio of acetonitrile-water mixtures
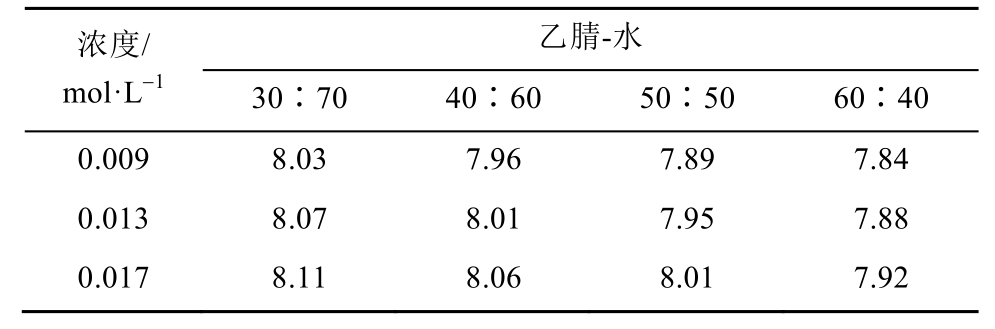
表5 不同浓度CHMFL-FLT3-122的pKa1与乙腈-水的线性回归方程及pKa2
Tab. 5 The pKa1/acetonitrile-water linear regression equations of different concentrations of CHMFL-FLT3-122 and pKa2

以求得的pKa1(b)对浓度(a)作图,得方程b=10.88a+8.12(r=0.992 6),根据方程的截距得无限稀释浓度的pKa2为8.12,即CHMFL-FLT3-122的pKa2为8.12。
3.3 讨论
本研究曾尝试仅使用UV或电位滴定法对CHMFL-FLT3-122的解离常数进行测定,但发现使用UV时,仅其双离子型(CHMFL-FLT3-122的共轭酸)和一级解离离子型的紫外吸收差异较大,而一级解离离子型和分子型的紫外吸收基本无差异,考虑到是由于叔胺无紫外吸收导致的,因而不能使用UV对其pKa2进行测定;而使用电位滴定法,由于CHMFL-FLT3-122嘧啶环上的氨基碱性太弱,无明显的滴定突跃,因而无法对其pKa1进行测定。所以最终选择使用UV和Benet法分别对其pKa1和pKa2进行测定。
CHMFL-FLT3-122在纯水中溶解度较差,为保证其pKa2测定的准确性,应进行预试验,选择合适的溶剂,使其既能溶解药物,又能与水混溶。预实验表明,乙腈是最佳溶剂,并在此基础上,选择合适的药物浓度、溶剂配比以及合适浓度的盐酸滴定液进行滴定。
UV测定化合物的解离常数是基于在不同pH值的条件下,不同状态的物质摩尔比不同,从而导致紫外吸收光谱的差异,因此,测定波长的选择对结果的准确性极为重要。在选定波长处,在不同pH值的溶液中,吸收差异必须明显,变化较大,否则误差较大[10]。因此,本研究选择230和290 nm 2个吸收差异较大处波长作为测定波长,此外,所选波长对应的吸收曲线最好较平坦,本研究中230 nm处吸收曲线不能完全达到这一要求,可能会对结果测定产生一定误差,取平均值作为最后结果则可减小误差。解离常数的测定容易受温度等因素的影响,所以本实验是均在恒温(25±1)℃的条件下配制样品并测定,以减少误差[5]。
CHMFL-FLT3-122作为一种新型潜在治疗FLT3-ITD阳性AML的候选药物,其解离常数国内外均无报道,本研究采用UV和Benet法分别对其pKa1和pKa2进行测定,得到CHMFL-FLT3-122的pKa1值为(3.87±0.14),pKa2值为8.12,方法简单快速,准确可靠,可为其制剂的处方设计、质量标准的研究提供参考。
REFERENCES
[1] GUO X X, LAN Q Y, RUAN C, et al. Advances in the study of inter action mode, structure activity relationship and clinical trials of FLT3 inhibitors [J]. Chin J New Drugs(中国新药杂志), 2016, 25(17): 1960-1966.
[2] LI X, WANG A L, YU K L, et al. Discovery of (R)-1-(3-(4-amino-3-(4-phenoxyphenyl)-1H-pyrazolo[3,4-d]pyrimidin -1-yl)piperidin-1-yl)-2-(dimethylamino)ethanone (CHMFLFLT3-122) as a potent and orally available FLT3 kinase inhibitor for FLT3-ITD positive acute myeloid leukemia [J]. J Med Chem, 2015(58): 9625-9638.
[3] HE J C, LI S, LUO Y. Determination of the dissociation constant of shikimic acid by UV spectrophotometry [J].J Mianyang Norm Univ(绵阳师范学院学报), 2006, 25(5):40-42.
[4] 李慧, 张起, 赵燕芳, 等. 抗痛风药SE-10平衡溶解度、表观油水分配系数及解离常数的测定[J]. 中国药剂学杂志(网络版), 2015(1): 27-34.
[5] SONG Y L, PU J X, ZHANG W, et al. Determination of dissociation constants of norathyriol by UV spectrophotometry [J].J Yunnan Univ Tradit Chin Med (云南中医学院学报), 2014, 37(5): 20-23.
[6] WANG C X, LIU Y L. Nonlogarithmic titration method for the determination of dissociation constant of loratadine [J].Chin Pharm J(中国药学杂志), 2003, 38(11): 44-45.
[7] LI Y G, CHEN H F, TU M Z , et al. Nonlogarithmic titration method for the determination of dissociation constant of auraptene [J]. Lishizhen Med Mater Med Res(时珍国医国药), 2011, 22(6): 1304-1305.
[8] YAN J W, YANG H, WANG J. Determination the dissociation constant and oil/water partition coefficient of dipfluzine [J]. Chin Pharm(中国药房), 2013, 24(41):3868-3870.
[9] BENET L Z, GOYAN J E. Nonlogarithmic titration curves for the determination of dissociation constants and purity[J]. J Pharm Sci, 1965(8): 1179-1182.
[10] LIU X J, YANG D J, LUO J Y, et al Determination of dissociation constants of puerarin and its derivative by UV-spectrophotometry [J]. Lishizhen Med Mater Med Res(时珍国医国药), 2006, 17(11): 2206-2207.
Determination of Dissociation Constants of FLT3 Inhibitor CHMFL-FLT3-122
ZHAO Wenting, DI Bin*
(College of Pharmacy, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT:OBJECTIVE To determine the two dissociation constants of CHMFL-FLT3-122.METHODSDissolve CHMFL-FLT3-122 in a series of different pH values buffer solutions and the absorbance was measured at appropriate wavelengths by UV to calculate the pKa1. Different proportions of acetonitrile-water mixtures(30∶70, 40∶60, 50∶50, 60∶40)were used to prepare different concentrations of CHMFL-FLT3-122 solutions(0.009, 0.013, 0.017 mol·L-1) which were titrated by hydrochloric acid solution and the pKa2was calculated by non-logarithmic titration method(Benet method).RESULTSThe pKa1of CHMFL-FLT3-122 was 3.87±0.14 and the pKa2of CHMFL-FLT3-122 was 8.12.CONCLUSIONThe determination of the dissociation constants of CHMFL-FLT3-122 by UV and Non-logarithmic titration method is simple, rapid, accurate and reliable. It can be a reference for the prescription design of preparations and the research of quality standard.
KEY WORDS:CHMFL-FLT3-122; dissociation constants; UV; non-logarithmic titration method
中图分类号:R917
文献标志码:B
文章编号:1007-7693(2017)07-1002-05
DOI:10.13748/j.cnki.issn1007-7693.2017.07.015
引用本文:赵文婷, 狄斌. FLT3抑制剂CHMFL-FLT3-122解离常数的测定[J].中国现代应用药学, 2017, 34(7): 1002-1006.
收稿日期:2017-02-09
(本文责编:蔡珊珊)
作者简介:赵文婷,女,硕士生 Tel: 18502548026 E-mail: lepolaris_zwt@163.com*
通信作者:狄斌,男,博士,教授,博导 Tel:(025)83271316 E-mail: dibin@cpu.edu.cn