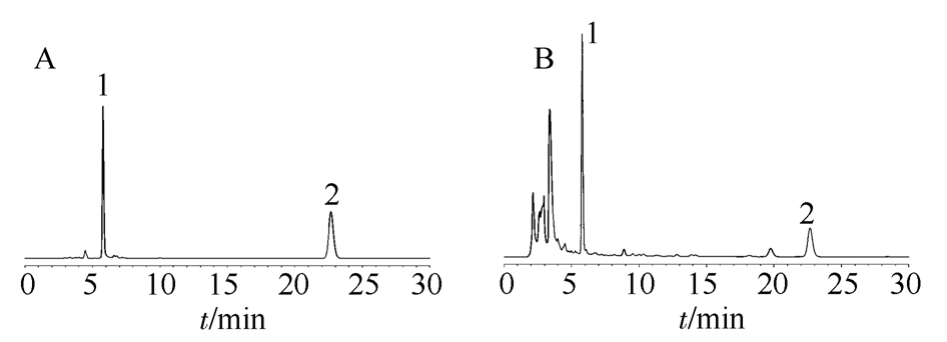
图1 高效液相色谱图
A-大叶茜草素和羟基茜草素对照品;B-茜草样品;1-大叶茜草素;2-羟基茜草素。
Fig. 1 HPLC chromatograms
A-rubimaillin and purpurin control; B-sample; 1-mollugin; 2-purpurin.
庄和思1,2,岳显可3,余露山1*(1.浙江大学药学院,杭州 310058;2.杭州市江干区人民医院,杭州 310021;3.浙江中医药大学药学院,杭州 310053)
摘要:目的 应用响应面法优化茜草中大叶茜草素提取的最佳工艺条件。方法在单因素试验的基础上,以大叶茜草素含量为响应值,选择盐酸浓度、加热温度和加热时间作为考察因素,采用Box-Behnken响应面设计法进行优化工艺研究。结果在盐酸浓度为10.5%,加热时间41.0 min,加热温度82.0 ℃条件下,茜草中大叶茜草素得率为2.53%,接近预测值2.51%。结论优化工艺简便稳定,重复性好,可用于茜草中大叶茜草素的水解提取的提取。
关键词:茜草;响应面法;大叶茜草素
茜草为茜草科植物Rubia cordifolia L.的干燥根及根茎,始载于《神农本草经》,具有凉血、化淤、止血、通经之功效,被广泛应用于治疗吐血、衄血、跌打损伤、经闭瘀阻等症[1]。主要化学成分有水溶性环己肽类[2],萘醌类,脂溶性蒽醌[3-5]和糖苷类,还有萜类、多糖类[6-8]、茜草素[9-10]、β-谷甾醇、茜草酸及微量元素等,其中大叶茜草素和羟基茜草素为2015版中国药典中评价茜草质量的指标性成分[1],具有抗肿瘤[11-12]、对抗毒激素、止血凝血[13-14]、增强免疫系统、抗炎[15-16]、抗氧化[17-18]、消除自由基和抗辐射[19]等作用。
茜草是中国药典收录的中药品种,经实验发现,茜草含量测定过程中,供试品溶液制备较为繁琐,且在不断的转移过程中容易产生误差[20]。本研究利用盐酸水解的作用,直接以一定浓度的盐酸甲醇为提取溶剂在相应的温度下进行水解,对茜草中大叶茜草素和羟基茜草素有很好的提取效果。本实验通过响应面法优化实验,筛选出最佳盐酸浓度、加热温度和加热水解时间。
1.1 仪器
U3000高效液相色谱仪(戴安科技有限公司),配置包括四元梯度泵、在线真空脱气机、自动进样器、恒温柱温箱、DAD检测器,变色龙色谱数据工作站(美国赛默飞世尔科技有限公司);XDB -C18色谱柱(4.6 mm×250 mm,5μm)(美国Agilent公司);R-201恒温水浴锅(上海申生科技有限公司);AL-204电子分析天平(梅特勒-托利多公司);TGL-16C高速台式离心机(飞鸽)。
1.2 试药
茜草(批号:QC-20150401,QC-20150428,QC-20150512,QC-20150518,QC-20150612),产地山西,购于温州华宇中药饮片有限公司;大叶茜草素(批号:110884-201405,含量99.0%)和羟基茜草素(批号:111898-201102,含量86.7%)购自中国食品药品检定研究院;甲醇、盐酸、磷酸为分析纯,水为重蒸水,液相用甲醇、乙腈为色谱醇。
2.1 色谱条件
Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm)色谱柱,以甲醇-乙腈-0.2%磷酸溶液(2∶50∶25)为流动相;流速1 mL·min-1,柱温25 ℃,检测波长250 nm;进样量为10 μL,大叶茜草素、羟基茜草素对照品及茜草样品色谱图见图1。

图1 高效液相色谱图
A-大叶茜草素和羟基茜草素对照品;B-茜草样品;1-大叶茜草素;2-羟基茜草素。
Fig. 1 HPLC chromatograms
A-rubimaillin and purpurin control; B-sample; 1-mollugin; 2-purpurin.
2.2 对照品溶液的制备
精密称取大叶茜草素对照品6.96 mg,羟基茜草素3.77 mg置于20 mL量瓶中,加甲醇至刻度,摇匀,制成制得浓度为0.348 mg·mL-1的大叶茜草素储备液和0.185 mg·mL-1的羟基茜草素储备液。根据试验要求,再将大叶茜草素和羟基茜草素储备液稀释,分别制成浓度为大叶茜草素:172.23,68.90,34.45,17.23,13.78 μg·mL-1;羟基茜草素:84.10,33.64,16.82,8.41,6.73 μg·mL-1,备用。
2.3 供试品溶液的制备
称取茜草粉末(过二号筛)约0.25 g置于具塞三角锥形瓶中,精密量取10%盐酸甲醇溶液25 mL,于80 ℃水浴锅中加热水解30 min,取出,待冷却,补重,取续滤液过膜纯化,进行HPLC分析。
2.4 线性关系考察
将稀释制成的浓度为大叶茜草素172.23, 68.90,34.45,17.23,13.78 μg·mL-1、羟基茜草素84.10,33.64,16.82,8.41,6.73 μg·mL-1的对照品溶液,分别精密吸取10 μL,注入液相色谱仪,测得峰面积积分值。以峰面积积分值为纵坐标(Y),大叶茜草素和羟基茜草素对照品进样量(μg)为横坐标(X),绘制标准曲线,回归方程为大叶茜草素Y=55.007X+0.231 09(R2=0.999 8)、羟基茜草素Y=118.82X+0.713 63(R2=0.999 7),由结果可知大叶茜草素在0.137 8~1.722 3 μg、羟基茜草素在0.067 3~0.841 μg内呈现良好的线性关系,符合试验要求。
2.5 仪器精密度考察
取浓度为大叶茜草素68.90 μg·mL-1、羟基茜草素33.64 μg·mL-1的对照品溶液,按“2.1”项下色谱条件,重复进样6次,测定峰面积,并计算RSD分别为大叶茜草素0.72%、羟基茜草素0.48%(n=6),表明精密度良好,符合试验要求。
2.6 加样回收率试验
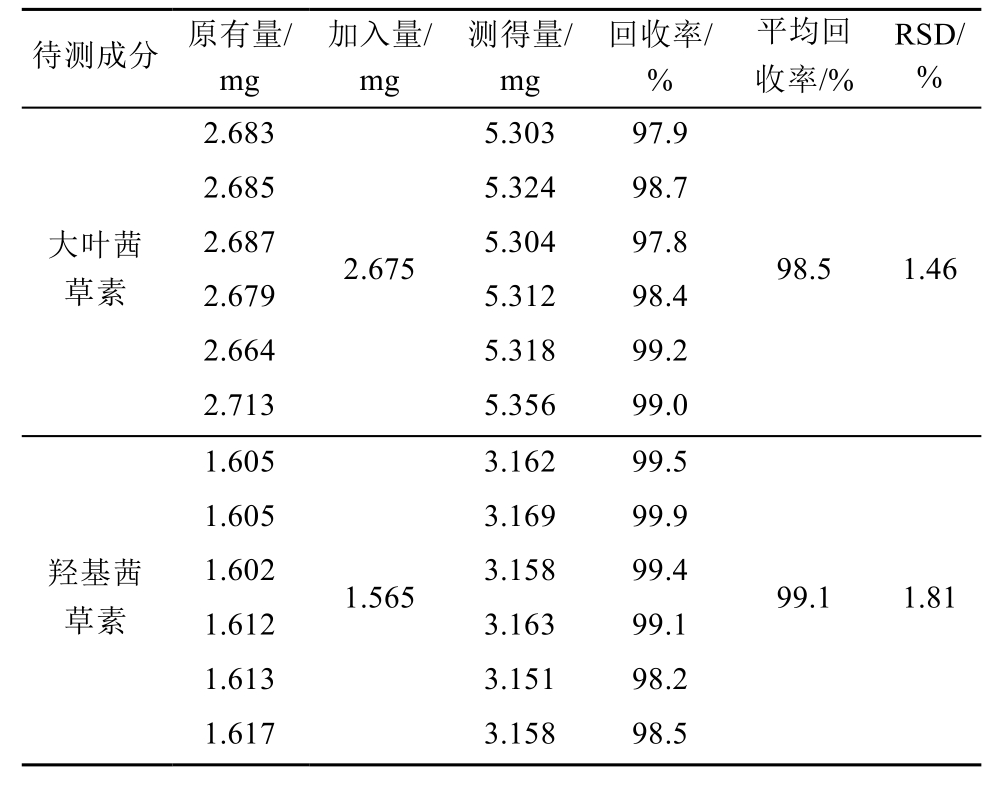
称取已知含量茜草粉末(过二号筛)0.25 g共6份,加入适量的大叶茜草素和羟基茜草素对照品,按“2.3”项下供试品制备方法及“2.1”项下色谱条件制样、测定,计算回收率和RSD值为大叶茜草素98.5%,1.46%,羟基茜草素99.1%,1.81%,见表1。结果表明,回收率符合试验要求。
表1 回收率考察结果(n=6)
Tab. 1 Recovery test results(n=6)
2.7 稳定性试验
取茜草供试品溶液分别于0,5,10,15,20,25,30 h进样,测定大叶茜草素和羟基茜草素峰面积值,计算峰面积的RSD值,大叶茜草素为1.57%、羟基茜草素为1.04%,表明供试品溶液在30 h内稳定。
2.8 重复性试验
称取茜草粉末(过二号筛)0.25 g共6份,按“2.3”项下供试品溶液制备方法进行制备,精密吸取供试品溶液10 μL,注入液相色谱仪,进行含量测定分析,得大叶茜草素和羟基茜草素含量平均值和RSD值分别为大叶茜草素2.17%、RSD值1.78%,羟基茜草素0.26%,RSD值为1.32%,重复性符合试验要求。
本试验主要研究盐酸在水解提取茜草中大叶茜草素和羟基茜草素过程中的作用,故盐酸浓度是试验首要考察的因素,而加热温度和加热时间与水解过程关系最为紧密,故本试验先对各因素进行单因素试验,再根据单因素的水平差异,设计响应面试验。
3.1 盐酸浓度的选择
称取茜草粉末(过二号筛)约0.25 g,共6份,分别加入盐酸浓度为2.0%,4.0%,6.0%,8.0%,10.0%,12.0%的盐酸甲醇溶液25 mL,在80 ℃水浴锅中加热水解40 min,考察盐酸浓度对茜草中大叶茜草素和羟基茜草素提取结果的影响。结果可知,随着盐酸浓度的增大,大叶茜草素含量逐渐增加,当盐酸浓度为10.0%时大叶茜草素含量最大,之后随着盐酸浓度的增大,大叶茜草素含量不再变化;然而,整个水解过程中盐酸浓度对羟基茜草素的含量无显著影响。故选择盐酸浓度8%,10%,12% 3个水平进行响应面工艺优化。见图2。
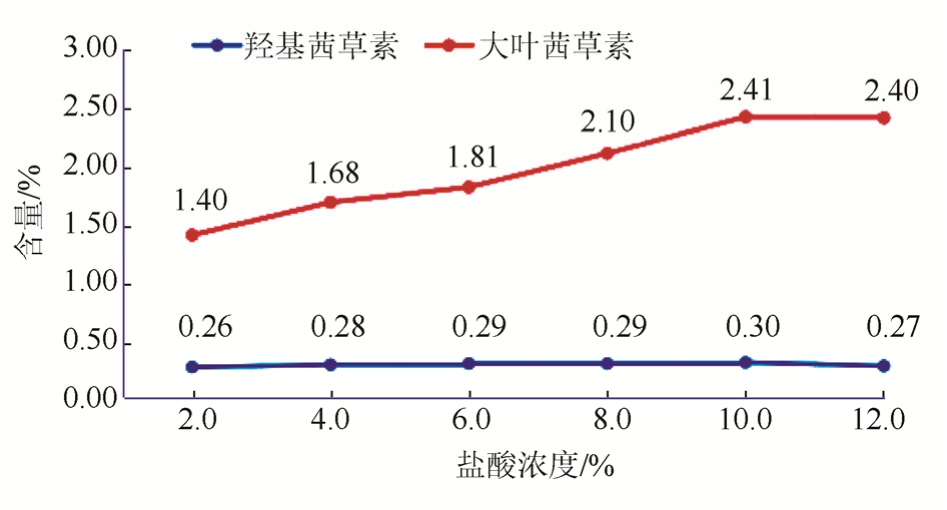
图2 盐酸浓度对水解提取茜草中大叶茜草素和羟基茜草素的影响
Fig. 2 Effect of hydrochloric acid concentration on the hydrolysis of mollugin and purpurin from Rubiae Radix et Rhizoma
3.2 加热温度的选择
称取茜草粉末(过二号筛)约0.25 g,共6份,加入含10%盐酸的盐酸甲醇溶液25 mL,分别于50,60,70,80,90 ℃水浴锅中加热水解40 min,考察温度对茜草中大叶茜草素和羟基茜草素提取结果的影响。结果可知,随着加热温度的增大,盐酸水解越充分,在温度为80 ℃时,大叶茜草素和羟基茜草素含量达到最大值,然而随着温度的继续增大,大叶茜草素和羟基茜草素含量却降低。故加热温度选择70,80,90 ℃ 3个水平进行响应面工艺优化。结果见图3。

图3 加热温度对水解提取茜草中大叶茜草素和羟基茜草素的影响
Fig. 3 Effect of heating temperature on the extraction of mollugin and purpurin from Rubiae Radix et Rhizoma
3.3 水解时间的选择
称取茜草粉末(过二号筛)约0.25 g,共6份,加入盐酸浓度为10%的盐酸甲醇溶液25 mL,于80 ℃水浴锅中加热水解20,30,40,50,60,70 min,考察水解时间对茜草中大叶茜草素和羟基茜草素提取结果的影响。结果可知,随着水解时间的增加,大叶茜草素的含量也相应增大,在水解40 min时,达到最大值,随着时间的继续增长,含量反而下降;羟基茜草素含量在前40 min逐渐增加,但之后未有明显变化。故水解时间选择30,40,50 min 3个水平进行响应面优化。见图4。
4.1 因素和水平的筛选
单因素试验表明,羟基茜草素在盐酸浓度、加热温度或水解时间变化的情况下,其含量变化不显著或与大叶茜草素呈现相同趋势变化,所以响应面实验中羟基茜草素不作为评价指标进行工艺优化。故选择盐酸浓度、加热温度和水解时间为考察因素,大叶茜草素为响应值,采用Design Expert 8.0.6b统计分析软件进行数据拟合,因素水平见表2。

图4 水解时间对水解提取茜草中大叶茜草素和羟基茜草素的影响
Fig. 4 Effect of hydrolysis time on the extraction of mollugin and purpurin from Rubiae Radix et Rhizoma
表2 响应曲面因素与水平表
Tab. 2 Factors and levels of response surface

4.2 Box-Behnken试验与结果
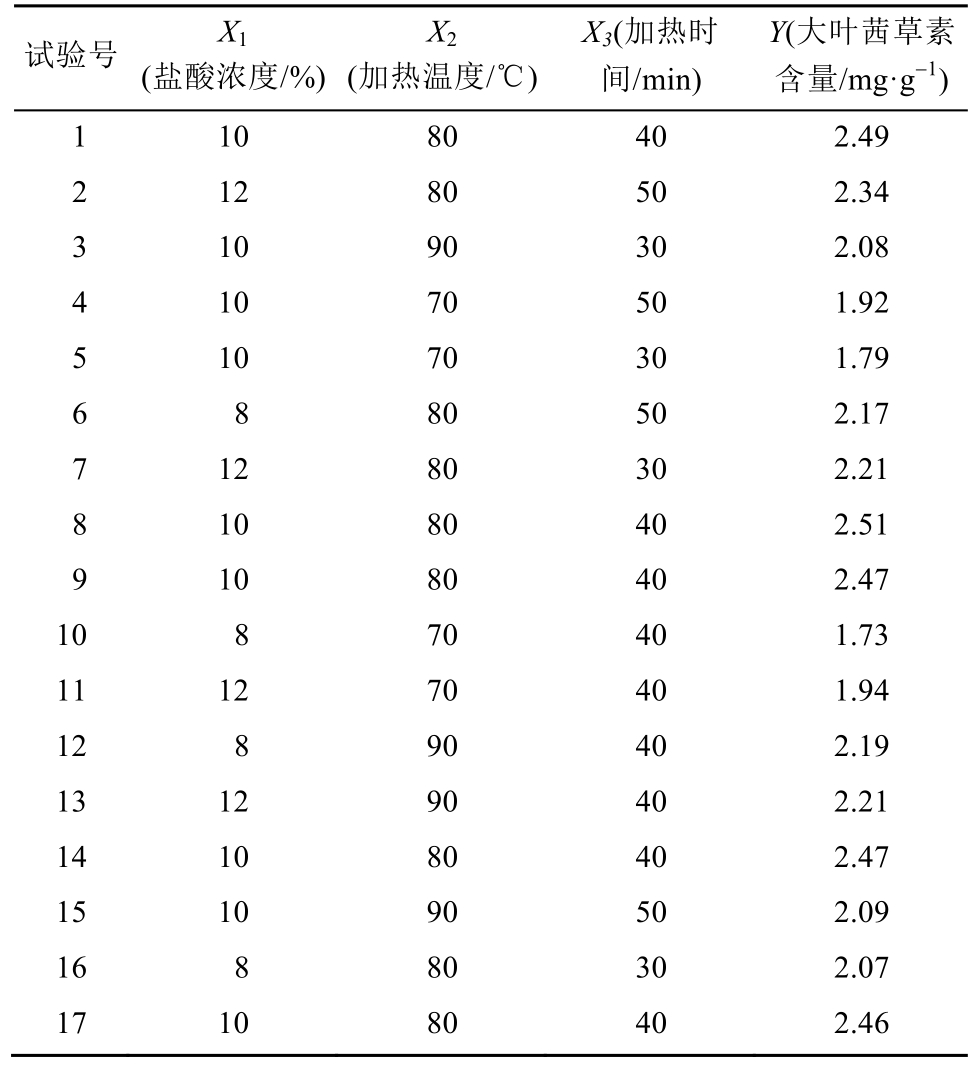
单因素试验确定了盐酸浓度、加热温度和加热时间3个因素,根据BBD试验设计原理,利用Design Expert 8.0.6设计了3因素3水平共17个试验点的响应面分析试验。按表2试验号进行供试品制备,测定茜草中大叶茜草素的含量,结果见表3。
表3 Box-Behnken试验设计以及响应值
Tab. 3 Box-Behnken experimental design and response value
响应值与各因素进行回归拟合后,得到回归方程如下:
Y=2.48+0.067 5X1+0.148 75X2+0.046 25X3-0.047 5X1X2+0.007 5X1X3-0.03X2X3-0.117 5X12-0.345X22-0.165X32(R2=0.987 3)。(X1:盐酸浓度;X2:加热温度;X3:加热时间;Y:大叶茜草素含量)。
回归决定系数R2=0.987 3,回归模型P<0.000 1,说明响应值拟合程度良好,能较好说明试验结果,但是失拟项P<0.1,P值小,说明失拟严重。从表4中各个P值可以看出盐酸浓度对茜草中大叶茜草素提取的影响具有显著性(P<0.01),加热温度对大叶茜草素提取的影响具有较高的显著性(P<0.001),盐酸浓度二次效应、加热温度二次效应、加热时间二次效应对大叶茜草素的含量也具有极其显著的影响(P<0.001)。
表4 Box-behnken试验结果分析
Tab. 4 Results of Box-behnken test
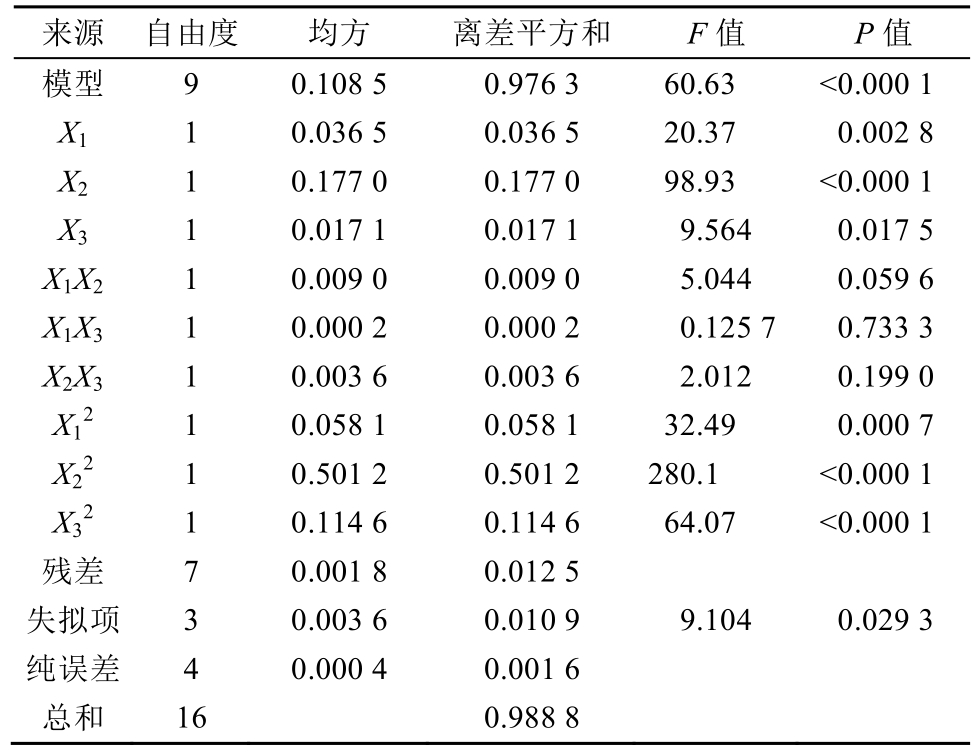
响应曲线面图是响应值对各试验因素盐酸浓度、加热温度、加热时间所构成的响应面图形,从响应分析图上可形象地看出各参数之间的相互作用,并获得最佳参数。本试验根据回归方程进行不同因素的响应面分析。结果见图5~6。
4.3 最优工艺的优化与验证
使用Design-Expert 8.0.6b软件得到最优盐酸水解提取工艺为:在盐酸浓度为10.50%,加热温度为81.93 ℃条件下,加热水解时间为41.29 min,茜草大叶茜草素预测值为2.51%。为试验方便,调整试验方案,即盐酸浓度为10.5%,加热温度为82.0 ℃,加热水解时间为41.0 min,在此条件下进行试验,大叶茜草素含量实测值为(2.53±0.12)% (n=6),接近预测值,说明该工艺稳定、可行。
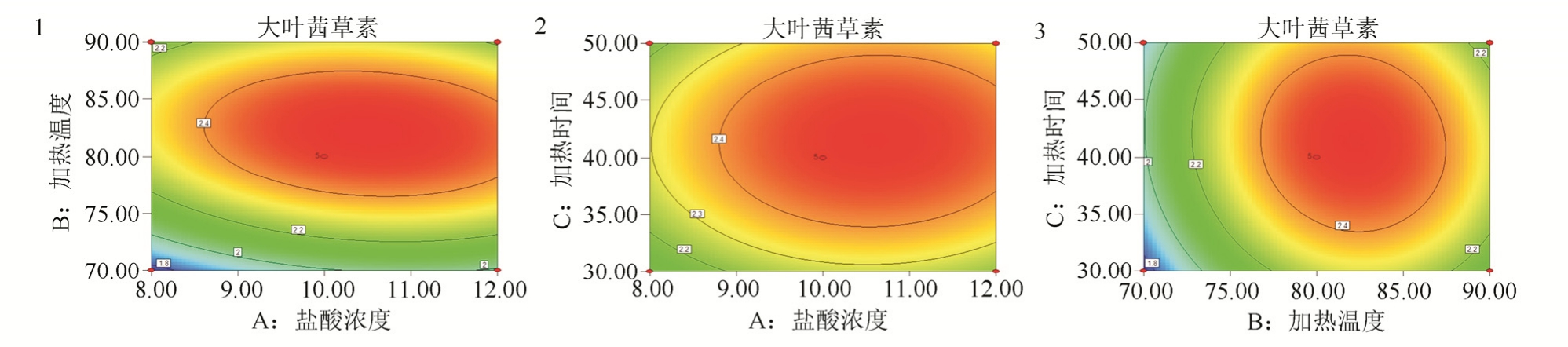
图5 响应面优化工艺模型的等高线叠加图
1-盐酸浓度与加热温度对大叶茜草素含量影响的等高线叠加图;2-盐酸浓度与加热时间对大叶茜草素含量影响的等高线叠加图;3-加热温度与加热时间对大叶茜草素含量影响的等高线叠加图。
Fig. 5 Contour map of response surface optimization process model
1-effects of hydrochloric acid concentration and heating temperature on the content of mollugin; 2-effects of hydrochloric acid concentration and heating time on the content of mollugin; 3-effects of heating temperature and time on the content of mollugin.
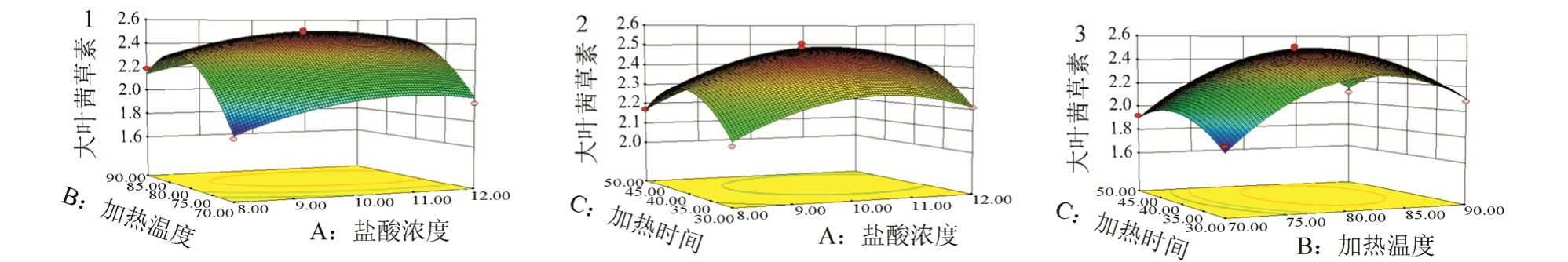
图6 响应面优化过程模型
1-盐酸浓度与加热温度对大叶茜草素含量影响的效应面图;2-盐酸浓度与加热时间对大叶茜草素含量影响的效应面图;3-加热温度与加热时间对大叶茜草素含量影响的效应面图。
Fig. 6 Response surface optimization process model
1-effects of hydrochloric acid concentration and heating temperature on the content of mollugin; 2-effects of hydrochloric acid concentration and heating time on the content of mollugin; 3-effects of heating temperature and time on the content of mollugin.
4.4 与药典方法的比较
中国药典2015年版方法:取5个批次本品粉末(过二号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇100 mL,密塞,称定质量,放置过夜,超声处理(功率250 W,频率40 kHz)30 min,放冷,再称定质量,用甲醇补充减失的质量,摇匀,滤过,精密量取续滤液50 mL,蒸干,残渣加甲醇-25%盐酸(4∶1)混合溶液20 mL溶解,置水浴中加热水解30 min,立即冷却,加入三乙胺3 mL,混匀,转移至25 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得5份样品。
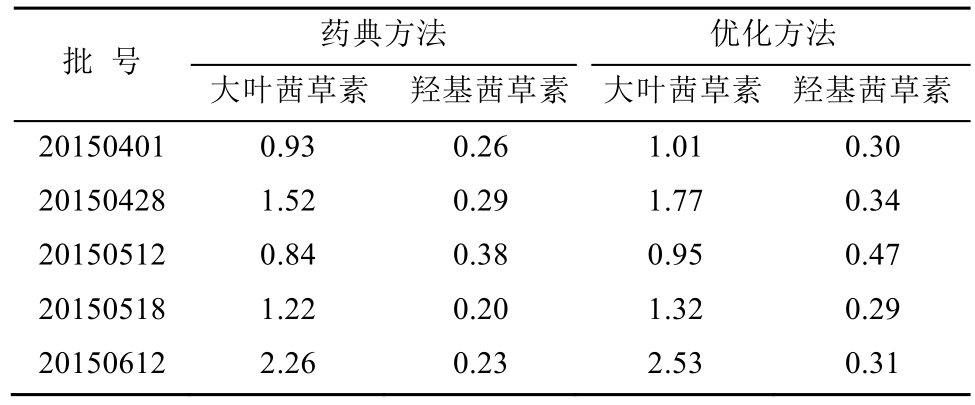
本实验方法:称取茜草粉末(过二号筛)约0.25 g置于具塞三角锥形瓶中,精密量取10.5%盐酸甲醇溶液25 mL,于82.0 ℃水浴锅中加热水解41.0 min,取出,待冷却,补重,取续滤液过膜纯化,进行HPLC分析。结果可知,本实验优化的实验方法,其提取所得的大叶茜草素和羟基茜草素含量均大于药典方法。比较结果见表5。
表5 茜草中大叶茜草素和羟基茜草素不同提取方法的比较
Tab. 5 Comparison of mollugin and purpurin with different extraction methods %
茜草中大叶茜草素和羟基茜草素为蒽醌类成分,一般羟基蒽醌类衍生物及其相应的苷类在植物体内多通过酚羟基或羧基结合成镁、钾、钠、钙盐形式存在,为充分提取出蒽醌类衍生物,必须预先加酸酸化使之全部游离后再行提取,故选用酸性溶剂作为提取溶剂[20]。
响应面分析设计系统本质上是将正交试验与回归分析相结合,以建立各因素对响应值的回归方程,除了可以分析各因素的变化对响应值的影响规律,同时可以得到相对精确的优化条件。本研究采用响应面法优化提取工艺。与正交试验法相比,正交试验法只能从试验的水平中筛选出最优水平,响应面法可以通过对回归方程和响应面等高线图的分析得到精确度更高的最佳工艺参数[21-24]。
尽管林文华等[9]也对茜草中大叶茜草素、羟基茜草素含量测定方法优化的实验研究,但其未对茜草的提取方法进行考察,简单参考药典或其他文献进行供试品的制备,重点在色谱条件的摸索,而本研究重点在茜草的提取工艺研究,采用响应面法优化茜草中大叶茜草素提取的最佳工艺条件,结果显示文献[9]中茜草中大叶茜草素的含量为0.57%~1.61%,平均含量为0.85%,而本研究最终检测的茜草中大叶茜草素含量为2.53%,效果远超过文献。
本研究在单因素试验的基础上,合理筛选出盐酸浓度、加热温度及加热水解时间3个因素的水平,将响应面法应用于茜草中大叶茜草素的提取。试验结果表明,盐酸甲醇溶液盐酸浓度为10.5%,加热温度为82.0 ℃,加热水解时间为41.0 min为最佳提取条件。同时,本试验所用的HPLC含量测定方法经方法学考察,精密度、稳定性及加样回收试验均符合规定,可作为茜草中大叶茜草素和羟基茜草素含量的测定方法。同时通过与药典方法进行比较,发现本实验优选的方法不仅方法简便,而且检测量还略大于药典方法。
REFERENCES
[1] 中国药典. 一部[S]. 2015: 234-235.
[2] LI P, HU Z H. Research progress in biology, chemical constituents, and biological activities of Rubia cordifolia [J]. Chin Tradit Herb Drugs(中草药), 2013, 44(14): 2009-2014.
[3] SHI J, LIU Z H, JIA T Z, et al. Determination of five active components in Morinda officinalis from different habitats by HPLC [J]. J Chin Med Mater(中药材), 2015, 38(2): 245-248.
[4] LIN S Q, GAO J F, WU L, et al. Study of anthraquinone component from rhizoma of Rubia cordifolia by preparative chromatogram of medium and low press [J]. Guihaia(广西植物), 2011, 31(6): 857-860.
[5] SHAN M Q, WANG K, DING A W, et al. Determination of 1, 3, 6-trihydroxy-2-methylanthraquinone in Rubiae Radix et Rhizoma before and after prepared by UPLC [J]. Mod Chin Med(中国现代中药), 2012, 14(12): 9-11.
[6] 张海容, 刘娟, 魏增云, 等. 响应面法优化超声提取中药茜草中多糖工艺[J]. 中成药, 2015, 37(10): 2321-2325.
[7] 孟宪元, 邢连宗. 茜草多糖的提取与分析[J]. 北京中医, 2005, 24(1): 35-36.
[8] TIAN C L, XIANG B. Microwave extraction and content determination of polysaccharides from Rubia cordifolia L. [J]. Food Sci(食品科学), 2009, 30(16): 135-136.
[9] LIN W H, ZHU X M, YAN P, et al. Experiment research on optimization of determination method for rubimaillin and purpurin in radix rubiae [J]. Tradit Chin Drug Res Clin Pharm(中药新药与临床药理), 2014, 25(3): 345-348.
[10] YANG H S, WANG J, GUO C, et al. Simultaneous determination of alizarin and rubimaillin in Rubia cordifolia by ultrasound-assisted ionic liquid-reversed phase liquid chromatography [J]. China J Chin Med Mater(中国中药杂志), 2015, 40(13): 2617-2623.
[11] 朱学研. 茜草提取物对人肝癌细胞抗肿瘤作用研究[D]. 吉林: 延边大学, 2014.
[12] PIAO C Z, SUN D Z, SONG J Y. Studies on anti-proliferation and inducing apoptosis of the extract of Rubia cordifolia L for MGC-803 cell line of gastric carcinoma [J]. J Med Sci Yanbian Univ(延边大学医学学报), 2008, 31(4): 261-264.
[13] OU L, HAN M, ZHANG Y Y, et al. Study on hemostatic mechanism of Rubiae Radix et Rhizoma in treating dysfunctional metrorrhagia [J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2015, 21(21): 152-155.
[14] SHAN M Q, CHEN X, LI J, et al. Comparative study on effects of Rubiae Radix et Rhizoma and carbonized Rubiae Radix et Rhizoma on acute blood stasis rat model [J]. China J Chin Med Mater(中国中药杂志), 2014, 39(3): 493-497.
[15] XU L Z, CHEN W N, ZHANG W, et al. The anti-inflammatory and immunologic effect of ethanol extract of Rubia cordifolia L. [J]. J Weifang Med Coll(潍坊医学院学报), 2002, 24(1): 1-3.
[16] ZHAO X H, YUAN M, MA Y H. Pharmacodynamic study on analgesic and anti-inflammatory effects of Tibetan medicine Qiancao capsules [J]. Lishizhen Med Mater Med Res(时珍国医国药), 2010, 21(2): 381-382.
[17] KANG W Y, ZANG X Y, LI L. Antioxidants from Rubia cordifolia [J]. J Henan Univ(Med Sci)(河南大学学报 医学版), 2006, 25(3): 6-8.
[18] JING L L, MA H P, FAN X F, et al. Study on the antioxidant activity of different extracts from Rubia tibetica Hook.F. [J]. Sci Tech Food Indust(食品工业科技), 2015, 36(1): 91-96.
[19] CHEN Y S, LI W Y. Experimental study on the decomposition, extract and antiradiation effects of Rubia polysaccharide [J]. J Henan Univ(Med Sci)(河南大学学报 医学科学版), 2004, 23(1): 32-34.
[20] 吴立军. 天然药物化学[M]. 北京: 人民卫生出版社, 1988:158.
[21] CHANG S P, YU X, LIANG Z Y, et al. Optimization of extraction technique of total flavonoids in polygonum Chinense by response surface methodoloy [J]. Pharm Today(今日药学), 2016, 26(1): 36-38, 50.
[22] SHI Z, WANG J P, JIANG J P. Optimizing the extraction process of the total saponin of Dioscoreae Nipponicae Rhizoma by response surface methodology [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(1): 68-71.
[23] HUANG H, ZENG L J, MO Y C, et al. Optimization of ultrasonic extraction of total flavonoids from Coreopsis tinctoria Nutt. using response surface methodology [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(8): 947-951.
[24] JIN L, ZHAO W S, GUO Q S, et al. Optimization of extraction technology from Paeoniae Radix Alba using response surface methodology [J]. China J Chin Mater Med(中国中药杂志), 2015, 40(15): 2988-2993.
Optimization of Hydrochloric Acid Hydrolysis Extracting Mollugin from Rubiae Radix et Rhizoma by Response Surface Methodology
ZHUANG Hesi1,2, YUE Xianke3, YU Lushan1*
(1.College of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058, China; 2.People’s Hospital of Jianggan District of Hangzhou, Hangzhou 310021, China; 3.College of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China)
ABSTRACT:OBJECTIVE To optimize the extraction process of mollugin from Rubiae Radix et Rhizoma.METHODSBased on single-factor experiment, the main factors hydrochloric acid concentration, extraction temperature and extraction time were determined by response surface methodology with the content of mollugin as the response value.RESULTSThe optimum extraction conditions were as follows: the hydrochloric acid concentration was 10.5%, extraction temperature was 82.0 ℃, and extraction time was 41.0min. Under these conditions, the yield rate of rubimaillin in Rubiae Radix et Rhizoma was 2.53%, which was well matched with the predicted content of 2.51%.CONCLUSIONThis optimal extraction process can be used for extracting the mollugin from Rubiae Radix et Rhizoma. It is simple, stable and reproducible.
KEY WORDS:Rubiae Radix et Rhizoma; response surface methodology; mollugin
中图分类号:R284.2
文献标志码:B
文章编号:1007-7693(2017)07-0982-06
DOI:10.13748/j.cnki.issn1007-7693.2017.07.011
引用本文:庄和思, 岳显可, 余露山. 响应面法优化盐酸水解提取茜草中大叶茜草素的工艺研究[J]. 中国现代应用药学, 2017, 34(7): 982-987.
收稿日期:2016-12-02
(本文责编:李艳芳)
作者简介:庄和思,男,硕士生,主管药师 Tel: (0571)86522076 E-mail: zhs9982@163.com*
通信作者:余露山,男,副教授,博导 Tel: (0571)88208407 E-mail: yuls@zju.edu.cn