表1 VP-16/TPGS胶束理化性质结果(n=3)
Tab. 1 Results of the physico-chemical properties of VP-16/TPGS micelles(n=3)

劳新南1,曹高忠2(1.桐乡市康复医院,浙江 桐乡 314500;2.温州医科大学附属第一医院,浙江 温州 325000)
摘要:目的 制备并表征装载依托泊苷(VP-16)的D-α-生育酚-聚乙二醇琥珀酸酯(TPGS)胶束(VP-16/TPGS)。方法采用薄膜水化法制备VP-16/TPGS,测定其粒径、Zeta电位,研究其体外药物释放行为,考察其细胞摄取和细胞毒性,评价其血液相容性。结果所制得的VP-16/TPGS胶束具有较小的粒径;具有较高的载药量和包封率;体外呈现良好的缓控释效果;可增强H446细胞对其的摄取,进而提高抗肿瘤活性;具有较高的血液相容性。结论VP-16/TPGS胶束是一种安全、有效的VP-16递送系统。
关键词:依托泊苷;D-α-生育酚-聚乙二醇琥珀酸酯;胶束
依托泊苷(etoposide,VP-16),化学名为4-去甲基表鬼臼毒素-9-(4,6-O-(R)亚乙基)-β-D-吡喃葡糖苷,鬼臼毒素的糖代谢产物,是一种半合成的抗肿瘤药物[1]。VP-16对小细胞肺癌具有良好的疗效,有效缓解率达40%~85%;对其他多种肿瘤,如急性白血病、卵巢癌、睾丸肿瘤、恶性淋巴瘤等也有效[2-5]。目前临床上常用为VP-16注射液,由于VP-16难溶于水,该注射液含有大量的无水乙醇、吐温80、聚乙二醇400作为药用辅料,易引起超敏反应、胃肠道刺激、高血压等不良反应,使得该注射液难以被患者耐受[2]。因而亟需开发一种安全、有效的VP-16注射液,以降低VP-16注射液的不良反应。
目前,纳米技术已被广泛应用到药物的传递和肿瘤治疗中。胶束制备方法简单且不使用有毒溶剂,可提高制剂的安全性;同时其特殊的“亲水-疏水”链段构成的“核-壳”结构,使其具有优异的装载疏水性药物的性能;而其纳米级别的尺寸(<100 nm)及亲水的外壳,使其具有长循环的特性,并被动靶向于肿瘤组织部位,进而提高疗效[6-9]。胶束已成为目前研究的热点[10-12]。
D-α-生育酚-聚乙二醇琥珀酸酯(tocopheryl polyethylene glycol succinate,TPGS)是一种水溶性的天然维生素E衍生物,由疏水性的维生素E链段和亲水性的聚乙二醇链段组成,可以自组装形成胶束,已被用作疏水性抗肿瘤药物紫杉醇、多烯紫杉醇、多柔比星等的传递载体[13-14]。维生素E是人体必需的一种维生素,而聚乙二醇已被美国FDA批准可用人体,因而TPGS是一种安全的材料;作为药物载体时,可避免其他辅料所引起的不良反应。
本实验以TPGS作为VP-16载体,通过薄膜水化法,制备装载VP-16的TPGS胶束(VP-16 loaded TPGS micelles,VP-16/TPGS),研究所制得制剂的性能,并对其体外抗肿瘤活性进行评价,为VP-16的新剂型的开发提供实验依据。
1.1 仪器
Agilent 1260高效液相色谱仪(美国Agilent公司);Nano-ZS90型激光粒度与Zeta电位分析仪(英国Malvern公司);KQ-3200B型超声波清洗器(江苏昆山仪器有限公司);BT-125D型电子分析天平(德国Sartorius公司);R-201型旋转蒸发仪(上海申顺生物科技有限公司);JEM-2100型透射电子显微镜(日本JEOL公司);Varioskan LUX全波长酶标仪(美国ThermoFisher公司);Lambda35型紫外分光光度计(美国PerkinElmer公司)。
1.2 材料
VP-16对照品和VP-16原料药均购自上海源叶生物技术有限公司;VP-16注射液(齐鲁制药有限公司,批号:WB1K12110008,规格:5 mL∶100 mg);乙腈(色谱纯)、TPGS均购自美国Sigma-Aldrich公司;CCK-8(上海碧云天生物技术有限公司);其他试剂均为分析纯。
2.1 VP-16/TPGS胶束的制备
采用薄膜水化法制备胶束。以10%载药量为例,将10 mg的VP-16和90 mg的TPGS分别溶于3 mL乙腈中,然后加入到25 mL单颈圆底烧瓶中,混合均匀;37 ℃下抽真空旋蒸除去乙腈,制得均一的含VP-16和TPGS的混合薄膜;加入10 mL超纯水,热水浴中振摇,制得澄清透明溶液,使用0.22 μm微孔滤膜趁热过滤溶液,除去游离的VP-16,即得装载VP-16的TPGS胶束溶液;真空冷冻干燥,得白色粉末状固体,密封保存于-20 ℃,以备后续使用。空白TPGS胶束的制备采用同法,不加VP-16。
2.2 VP-16/TPGS胶束的表征
2.2.1 粒径与Zeta电位 按“2.1”项下方法,制备理论载药量分别为0,5%,10%,15%,20%的VP-16/TPGS胶束溶液,0.22 μm微孔滤膜过滤后冷却至室温,使用激光粒度仪测定其粒径及其分散指数(polydispersity index,PDI)和表面电位,各样品平行测定3次取平均值。
2.2.2 形态观察 取“2.1”项下制得的VP-16/ TPGS胶束溶液,稀释至适宜浓度,滴于硝酸纤维覆盖的铜网上;磷钨酸负染色后,自然晾干,通过透射电子显微镜观察胶束形态。
2.3 载药量与包封率测定
2.3.1 色谱条件 色谱柱:HC-C18键合硅胶柱,(150 mm×4.6 mm,5 µm);流动相:水-乙腈(50∶50);流速:1 mL·min-1;检测波长:254 nm;进样量:20 µL;柱温:30 ℃。
2.3.2 标准曲线的建立 精密称量VP-16对照品10 mg,置于10 mL量瓶中,加入乙腈超声溶解并定容,得浓度为1 000 µg·mL-1的母液。将母液稀释得到100,50,25,12.5,6.25,3.12,1.56,0.78,0.39,0.19 µg·mL-1的系列对照品溶液。按“2.3.1”项下色谱条件进样,以峰面积(A)为纵坐标,VP-16浓度(C)为横坐标,进行线性回归,建立VP-16标准曲线。
2.3.3 载药量与包封率的测定 精密称取VP-16/TPGS胶束冻干品适量,乙腈溶解并稀释,按“2.3.1”项下条件进行测定,并通过“2.3.2”项中建立的标准曲线方程计算VP-16含量。按下列公式计算:载药量(drug loading capacity, DLC)(%)=(测得的药物量/胶束的取样量)×100%,包封率(encapsulated efficiency,EE)(%)=测得的药物含量/理论药物含量×100%。
2.4 体外释放研究
分别取胶束溶液和生理盐水稀释的市售VP-16注射液(对照)适量,加入到透析袋中,置于含0.5%吐温80的PBS (pH=7.4)缓冲液中;在(37±0.5)℃、100 r·min-1条件下恒温振荡,在预先设定的时间点取样,并更换新鲜释放介质。按“2.3”项下方法测定各时间点药物释放量,计算VP-16累积释放量,绘制药物释放曲线。本实验重复3次,所得结果为3次平均值。
2.5 细胞学评价
2.5.1 细胞摄取研究 采用HPLC测定不同时间点细胞内药物含量,考察人源小细胞肺癌细胞株(H446)对VP-16/TPGS胶束摄取行为。将处于对数生长期的H446细胞制备成细胞悬浮液,接种于6孔板中,每孔约1×106个细胞,在37 ℃、5% CO2培养箱中培养24 h。分别加入20 μg·mL-1的VP-16/TPGS胶束溶液和市售VP-16注射液,孵育1,2,4 h,胰酶消化并收集细胞,使用冷的PBS溶液洗涤3次;再加入100 μL纯化水,液氮冷冻-室温复溶,如此3次;再加入乙腈沉淀蛋白,萃取药物;所得乙腈溶液按“2.3”项下方法测定药物含量。
2.5.2 细胞毒性研究 采用CCK-8法考察VP-16/TPGS胶束对H446细胞的生长抑制作用。取处于对数生长期的H446细胞悬浮液,接种于96孔板中,每孔100 μL,细胞密度约为每孔5×103个,在37 ℃、5% CO2的培养箱中培养24 h。按100 μL每孔,加入不同浓度梯度的VP-16/TPGS胶束溶液和市售VP-16注射液,加完全培养基处理组作为空白对照,设6个复孔,继续培养24 h。每孔加CCK-8溶液20 μL,于37 ℃培养箱再孵育2 h,在酶标仪450 nm处测定OD值,取平均OD值分析并计算细胞存活率。
2.6 血液相容性
分别取新鲜制备的2%的兔血红细胞混悬液2.5 mL,加入到10 mL试管中,再分别加入2.5 mL纯化水(阳性对照)、生理盐水(阴性对照)、不同浓度的VP-16/TPGS胶束溶液或市售VP-16注射液,混合均匀,于37 ℃静置3 h,观察溶液状态;将各管于1 500 r·min-1离心10 min,取上清液在紫外可见分光光度计上545 nm处,以纯化水为空白读取各管OD值。溶血率计算公式如下:溶血率(%) = (样品吸光度-阴性对照吸光度)×100%/(阳性对照吸光度-阴性对照吸光度)
2.7 统计学分析
实验结果用x±s表示。采用SPSS 19.0统计软件处理实验数据,计量数据采用t检验,P<0.05认为有统计学差异。
3.1 VP-16/TPGS胶束的表征
3.1.1 粒径与Zeta电位 VP-16/TPGS胶束溶液的粒径和表面电位变化见表1。可以看出,同空白胶束溶液相比,装载VP-16的胶束的粒径略微增大,而且随VP-16的投料量增大也增大;但是所有胶束溶液的电位基本接近于电中性。
3.1.2 形态观察 VP-16/TPGS胶束的形态见图1。可以看出,胶束呈规则的单分散球形,粒径约为30 nm,与纳米粒度仪测定的结果相吻合。
表1 VP-16/TPGS胶束理化性质结果(n=3)
Tab. 1 Results of the physico-chemical properties of VP-16/TPGS micelles(n=3)


图1 VP-16/TPGS胶束的形态
Fig. 1 The morphology of VP-16/TPGS micelles
3.2 载药量与包封率
3.2.1 标准曲线的建立 在0.78~100 µg·mL-1内,浓度与峰面积呈现良好的线性关系,标准曲线方程为A=8.578C+1.484(r=0.999 8)。
3.2.2 载药量与包封率 VP-16/TPGS胶束的载药量与包封率结果见表1。可以看出,随VP-16的投料量增大也载药量增高,但包封率随之下降;当投料比达到20/80时,包封率<90%。因而,综合载药量与包封率考虑,选择15%的载药量组进行后续试验研究。
3.3 体外释放研究
VP-16制剂的体外释放曲线见图2。可以看出,市售VP-16注射液组药物快速释放,在前10 h,累积释放量达90%;而VP-16/TPGS组药物呈现缓慢释放的状态,前10 h累积释放量为65%,之后曲线趋于平稳,48 h时的累积释放量约为83%。
3.4 细胞学评价
3.4.1 细胞摄取研究 VP-16的细胞摄取量见图3。可以看出,细胞对VP-16的摄取呈现时间依赖性,随时间延长,细胞对VP-16的摄取量增多;同时,同市售VP-16注射液组相比,VP-16/TPGS胶束组细胞摄取了更多的VP-16[2 h,(0.68±0.09)μg vs (1.52±0.10)μg;4 h,(1.86±0.21)μg vs (3.53± 0.36)μg;P<0.05]。
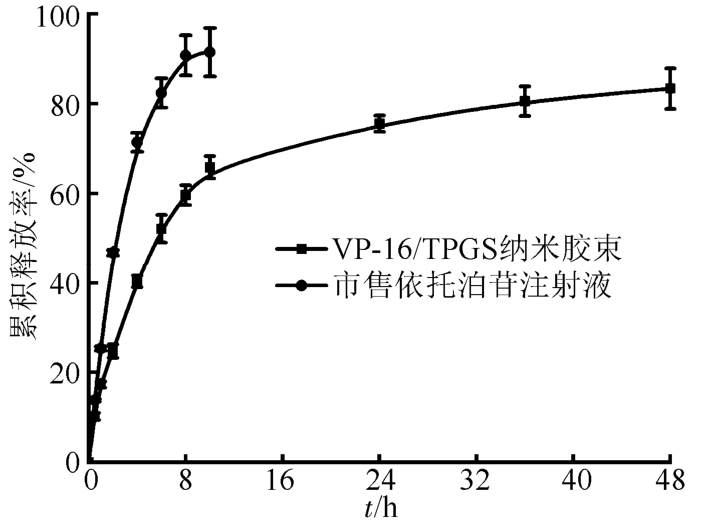
图2 体外药物释放曲线
Fig. 2 In vitro drug release behavior
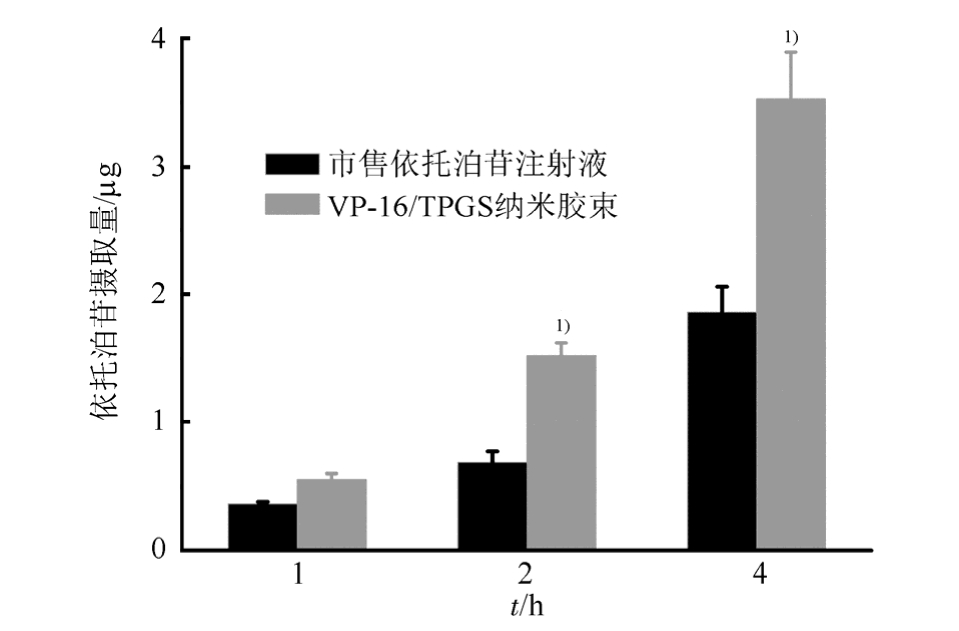
图3 H446细胞对VP-16的摄取
与市售VP-16注射液组相比,1)P<0.05。
Fig. 3 The cellular uptake of etoposide by H446 cells
Compared with VP-16 injection,1)P<0.05.
3.4.2 细胞毒性研究 VP-16对人小细胞肺癌H446细胞的生长抑制作用见图4。可以看出,VP-16的抑制作用呈现浓度依赖性,随浓度增高,H446细胞的生长受到明显抑制;并且VP-16/TPGS胶束组的抑制作用更明显,IC50(8.834 μg·mL-1)小于市售VP-16注射液组(IC50=14.017 μg·mL-1)。
3.5 血液相容性
市售VP-16注射液主要通过静脉注射给药,作为其改进剂型,VP-16/TPGS也主要通过静脉给药,因而应当考察其与血液的相容性,溶血率结果见图5。可以看出,在VP-16浓度增大到2.0 mg·mL-1时,VP-16/TPGS的溶血率仅为0.3%,<5%(溶血率>5%时,视为有溶血作用),可视为无溶血作用。
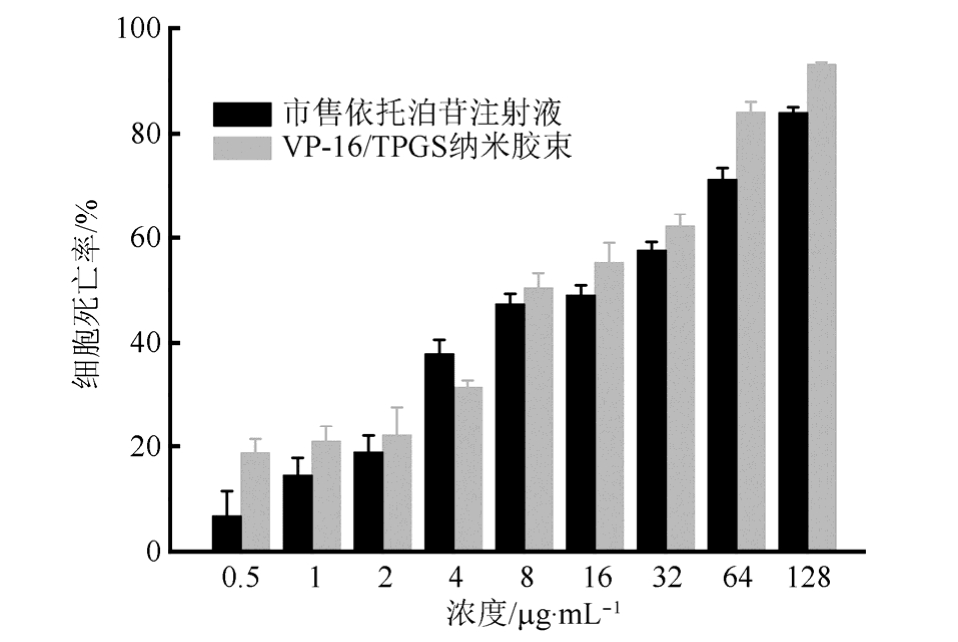
图4 VP-16制剂对H446细胞的毒性
Fig. 4 The cytotoxicity of etoposide formulation on H446 cells
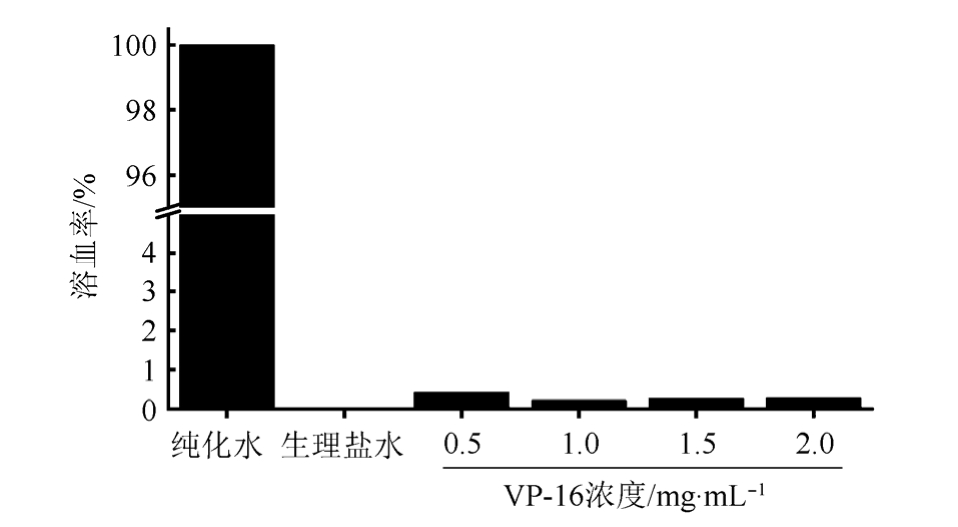
图5 VP-16/TPGS胶束的溶血率
Fig. 5 The hemolysis rate of VP-16/TPGS micelles
VP-16必须富集于肿瘤组织部位,才能有效地发挥抗肿瘤作用,但是目前临床使用的VP-16注射液缺乏靶向性,且所用辅料具有一定的不良反应。而聚合物胶束是一种优异的传递疏水性药物的载体,可通过肿瘤组织EPR效应(增强的渗透和滞留作用),而被动靶向富集于肿瘤组织,从而提高药物浓度。将VP-16胶束化能够优化VP-16的使用。
本实验中使用由生物安全性良好的维生素E和聚乙二醇组成的TPGS作为药物载体,采用薄膜水化法制备了装载VP-16的TPGS胶束。该制备方法未使用任何有毒表面活性剂,所制备的胶束具有较小的粒径,呈规则的单分散分布,且粒径为20~30 nm,可通过EPR效应被动靶向于肿瘤组织部位;而其表面基本不荷电,可减小体循环过程中的非特异吸附。该胶束具有较高的载药量和包封率,在载药量达15%时,包封率仍>90%,表明TPGS是一种有效的VP-16载体。体外释放研究表明,该载药胶束具有更慢的药物释放行为,表明VP-16胶束具有良好的缓控释效果,有助于延长体循环时间。体外抗肿瘤活性实验表明,VP-16胶束与市售VP-16注射液组均有明显抑制H446细胞的作用,但胶束组显示更强的抗肿瘤活性,结合细胞摄取结果,可以看出这是因为VP-16胶束化增强了H446细胞对药物摄取,使更多的药物富集于细胞,因而产生更强的杀伤作用。血液相容性研究表明,VP-16胶束没有溶血作用,因而VP-16/TPGS适于静脉注射给药,有利于体内应用。
因而,本研究所制备的VP-16/TPGS胶束是一种安全、有效的VP-16递送系统,值得进一步深入的研究。
REFERENCES
[1] HANDE K R. Etoposide: four decades of development of a topoisomerase II inhibitor [J]. Eur J Cancer, 1998, 34(10):1514-1521.
[2] BENJAMIN C, FU J, NEIL D. Enhanced efficacy of local etoposide delivery by poly (ether-anhydride) particles against small cell lung cancer in vivo [J]. Biomaterials, 2010, 31(2):339-344.
[3] DEANDELO D J, FATHI A T, WERNER L. A phase 1 study of lenalidomide in combination with mitoxantrone, etoposide, and Ara-C in patients with relapsed or refractory Acute Myeloid Leukemia [J]. Blood, 2015, 119(6): 126-2550.
[4] KUMAR A, LE N, SANTOS J. Chemotherapy is of value in second line and beyond, relapsed high-grade, serous epithelial ovarian cancer: An analysis of outcomes obtained with oral etoposide [J]. Am J Clin Oncol, 2016. Doi: 10.1097/coc. 0000000000000281.
[5] YOU B, SALLES G, BACHY E. Etoposide pharmacokinetics impact the outcomes of lymphoma patients treated with BEAM regimen and ASCT: a multicenter study of the LYmphoma Study Association (LYSA) [J]. Cancer Chemother Pharmacol, 2015, 76(5): 939-948.
[6] KATAOKAA K, HARADAA A, NAGASAKI Y. Block copolymer micelles for drug delivery: design, characterization and biological significance [J]. Adv Drug Deliv Rev, 2001, 47(1): 113-131.
[7] YOKOYAMA M. Polymeric micelles as a new drug carrier system and their required considerations for clinical trials [J]. Expert Opin Drug Deliv, 2010, 7(2): 145-158.
[8] LI Y P, XIAO K, LUO J T. A novel size-tunable nanocarrier system for targeted anticancer drug delivery [J]. J Control Release, 2010, 144(3): 314-323.
[9] FANG J, NAKAMURA H, MAEDA H. The EPR effect:unique features of tumor blood vessels for drug delivery, factors involved, and limitations and augmentation of the effect [J]. Adv Drug Deliv Rev, 2011, 63(3): 136-151.
[10] WANG G H, SHEN H P, JIN C S, et al. Antitumor activity of stearic acid grafted chitosan oligosaccharide polymeric micelles loading podophyllotoxin against human glioma cells [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(7):1248-1251.
[11] XU H Y, XIE L Y, CHANG D, et al. Preparation of MePEG-PLGA hydroxy camptothecin nanoparticles by improved dialysis method [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(6): 746-751.
[12] HOU J, LI J, SUN E, et al. Synergistic effect of Epimedii folium fried with suet oil for warming kidney and enhancing yang in dosage form of self-assembled micelles [J]. China J Chin Mater Med(中国中药杂志), 2016, 41(14): 2633-2637.
[13] MU L, FENG S S. Vitamin E TPGS used as emulsifier in the solvent evaporation/extraction technique for fabrication of polymeric nanospheres for controlled release of paclitaxel (taxol) [J]. J Control Release, 2002, 80(1-3): 129-144.
[14] PAN J, WANG Y T, FENG S S. Formulation, characterization, and in vitro evaluation of quantum dots loaded in poly(lactide)-vitamin E TPGS nanoparticles for cellular and molecular imaging [J]. Biotechnol Bioeng, 2008, 101(3):622-633.
Preparation and Characterization of Etoposide Micelles
LAO Xinnan1, CAO Gaozhong2
(1.The Rehabilitation Hospital of Tongxiang, Tongxiang 314500, China; 2.The First Affiliated Hosptial of Wenzhou Medical University, Wenzhou 325000, China)
ABSTRACT:OBJECTIVE To prepare and characterize the eptoposide(VP-16)-loaded D-α tocopheryl polyethylene glycol succinate(TPGS) micelles.METHODSThe VP-16/TPGS was prepared using thin-film hydration method. The particle size and Zeta potential were measured. The drug release behavior, cellular uptake and cytotoxicity were also studied. At last, the hemocompatibility was also evaluated.RESULTSThe prepared VP-16/TPGS micelles had small sizes, high drug loading capacity and encapsulated efficiency. The VP-16/TPGS micelles also exhibited a sustained and controllable in vitro release behavior. The enhanced cellular uptake of the VP-16/TPGS micelles by H446 celles improved the cytotoxicity. Besides, the VP-16/TPGS micelles showed a good hemocompatibility.CONCLUSIONVP-16/TPGS nanomicelle may be a safe and efficient drug delivery system for VP-16.
KEY WORDS:etoposide; D-α tocopheryl polyethylene glycol succinate(TPGS); micelles
中图分类号:R943
文献标志码:B
文章编号:1007-7693(2017)07-0992-05
DOI:10.13748/j.cnki.issn1007-7693.2017.07.013
引用本文:劳新南, 曹高忠. 依托泊苷胶束的制备与表征[J]. 中国现代应用药学, 2017, 34(7): 992-996.
收稿日期:2016-12-01
(本文责编:曹粤锋)
作者简介:劳新南,女,主管药师 Tel: 13600559416 E-mail: xn_lao@126.com