图1 联苯乙酸的化学结构式
Fig. 1 Chemical structure formula of felbinac
沈旭1,申屠建中2*(1.浙江工业大学,杭州 310014;2.浙江大学第一附属医院,杭州 310003)
摘要:本文综述了近几年国内外相关报道,将代谢后主要活性产物为联苯乙酸的药物分为一类,统称为联苯乙酸的前药,通过质谱联用技术论述了其在人体内的代谢过程与产物。联苯乙酸是发挥抗炎、镇痛作用的关键物质,但由于其水溶性差、口服给药常造成消化道障碍等缺点,除了制成外用制剂外,目前针对联苯乙酸的研究主要集中于其相关前药的合成、制剂、药理、药效等方面。联苯乙酸相关药物的研发成功可以较好地降低直接给联苯乙酸所带来的不良反应,为临床医师解除患者病痛提供有效的治疗手段,具有良好的开发前景,为苯胺洛芬的人体药动学研究提供思路。
关键词:联苯乙酸;代谢;液相色谱-质谱联用技术;苯胺洛芬
联苯乙酸(Felbinac,Biphenyl-4-ylacetic acid,结构式见图1)为白色结晶粉末状物质,几乎不溶于水,微溶于无水乙醇,易溶于二甲基甲酰胺,是有效的前列腺素合成酶抑制剂[1],是一种新型的非甾体抗炎药(NSAIDs)。当药物的活性代谢物为联苯乙酸时,常具有抗炎活性,外用可治疗关节炎和肌肉炎症。常用于变形性骨关节炎、腱鞘炎、肌肉痛、外伤和肿痛、疼痛的治疗。
图1 联苯乙酸的化学结构式
Fig. 1 Chemical structure formula of felbinac
联苯乙酸在大鼠体内经静脉注射给药,会延长联苯乙酸的肝代谢[1],并且联苯乙酸中的羧基可能会导致肝毒性[2],值得引起重视。当联苯乙酸与新喹诺酮类药物合用时抑制了GABA门控Cl电流,从而促使发生惊厥,并且随着联苯乙酸浓度的增大,惊厥发生率增大[3]。
临床常使用环糊精类、甘油、必需氨基酸等作为载体来设计联苯乙酸的前药,可以在保证消炎镇痛功效的前提下避免联苯乙酸上的游离羧基对胃肠道产生的消化道障碍。例如在联苯乙酸上引入2个非必要氨基酸(苯丙氨酸、甘氨酸)有利于降低溃疡发生率、延长镇痛时间、增强/延长抗炎活性,和优化抗关节炎作用。
1.1 联苯乙酸乙酯
将联苯乙酸进行乙酯化,再利用丙羟基-β-环糊精(HP-β-CyD)活化联苯乙酸乙酯。但是由于联苯乙酸乙酯脂溶性强难溶于水,故常加入大分子佐剂制成脂肪乳注射液进行给药,而大分子佐剂也使得联苯乙酸乙酯注射液的安全性差(导致过敏甚至休克)。
1.2 芬布芬
在联苯乙酸上引入一个γ-羰基丁酸基团,生成水溶性低、pH低[4]的芬布芬[3-(4-联苯羰基)丙酸,联苯丁酮酸],常通过口服、非肠道方式给药[5],用于抑制炎症、预防动物患上胶原关节炎、治疗人类类风湿性关节炎。芬布芬(非活性型)口服后经肝脏代谢为联苯乙酸(活性型)从而产生抗炎、镇痛作用,防止了直接引入活性代谢物联苯乙酸进入胃肠道,可以避免因胃肠刺激引起的胃肠溃疡等不良反应,有很好的耐受性,但是少数患者会出现转氨酶升高和碱性磷酸酶水平升高的现象[6]。由于药物在体内的生物转换可能会导致产生肝毒性,有些患者可能会出现肝炎和肝坏死现象[7]。芬布芬具有解偶联氧化磷酸化性能,芬布芬介导肝细胞毒性,导致线粒体功能紊乱(其中芬布芬对ATP的抑制是时间、浓度依赖型的[8];其代谢物对ATP的抑制是浓度依赖型的),从而造成ATP合成障碍。1.3 苯胺洛芬
苯胺洛芬(4-联苯乙酸-三羟甲基氨基甲烷,felbinac trometamol,结构式见图2)注射液[9]是我国自主研发的1.1类创新药,具有中国专利、国际专利,是(1,1’-二苯基)-4-乙酸(联苯乙酸)与氨基丁三醇所成的盐,为白色粉末,易溶于甲醇。苯胺洛芬属于NSAIDs中的芳基烷酸类。苯胺洛芬为高度水溶性的三羟基甲胺盐类,水溶性(1.93 mg·mL-1,25 ℃)优于联苯乙酸乙酯、联苯乙酸,是联苯乙酸的前药,可以在生物有机体内通过水解快速转换为联苯乙酸。苯胺洛芬的组成部分之一氨丁三醇是一个临床常用、安全性较高的碱基,可以穿过细胞膜而进入细胞内调节酸碱平衡、增大苯胺洛芬代谢物联苯乙酸的溶解度。
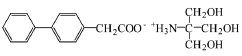
图2 苯胺洛芬的化学结构式
Fig. 2 Chemical structure formula of felbinac trometamol
目前正在进行临床评估该静脉注射药物用于治疗术后严重疼痛的可行性,但是还没有苯胺洛芬在人体内分布、代谢的相关报道。可以在联苯乙酸上引入基团来为研究其前药苯胺洛芬在人体内的代谢提供思路。常见的联苯乙酸的前药有:联苯乙酸乙脂、联苯乙酰吡啶、氨基葡萄糖联苯乙酸衍生物、联苯乙酸对乙酰氨基酚酯等。
给大鼠服用一相代谢产物为联苯乙酸的药物后,联苯乙酸可能经历了肝肠循环[9]。用LC-MS/MS可在大鼠的血浆中检测到4’-羟基联苯乙酸;在大鼠的尿液、粪便、胆汁中可发现4’-羟基联苯乙酸、联苯乙酸葡糖苷酸、4’-羟基联苯乙酸葡糖苷酸、4’-羟基联苯乙酸硫酸盐。但是由于葡糖苷酸类排泄物很少,很难确认4’-羟基联苯乙酸是发生在苯酚上还是羧酸基团上,见图3。
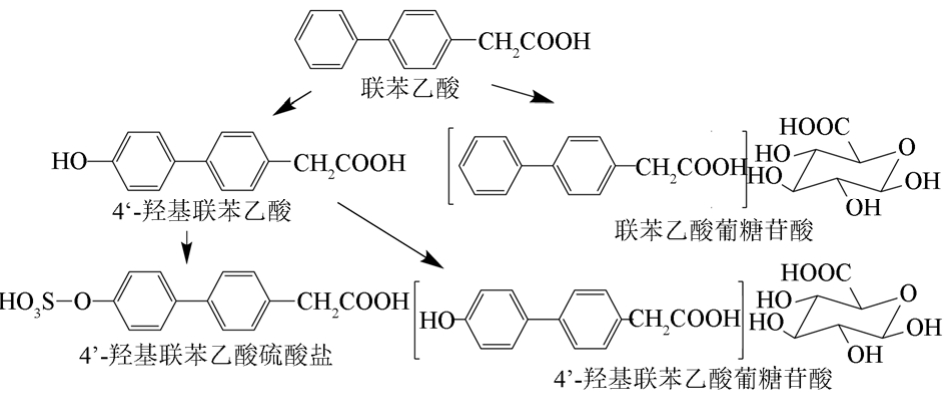
图3 联苯乙酸在大鼠体内的代谢过程[1]
Fig. 3 Metabolic processes of felbinac in rats
给人体服用一相代谢产物为联苯乙酸的药物后,用LC-MS/MS检测尿液,除了可检测出大鼠体内可以测到的物质外,还能检测到带有2个羟基的联苯乙酸、带有2个羟基的联苯乙酸葡糖苷酸、带有3个羟基的联苯乙酸、带有3个羟基的联苯乙酸葡糖苷酸(其葡糖苷酸的位置未知),可能的代谢途径见图4。
2.1 芬布芬的药动学研究[10]
除了以联苯乙酸为一相代谢物的药物以外,常见的联苯乙酸相关药物还有芬布芬,可能的代谢途径见图5。
芬布芬在人体中主要有4种代谢物,芬布芬与代谢物Ⅱ、Ⅲ在血浆中循环,发挥药理活性,显示抗炎活性;大量的代谢物Ⅳ、Ⅴ在尿液中排出,表现为药理惰性,从正常尿液中排出。肾功能不全会改变芬布芬的代谢模式,研究表明芬布芬与代谢物Ⅱ、Ⅲ在血浆中没有积累,但是随着肾功能损伤的增强,代谢物Ⅴ、Ⅳ在血浆中的积累增加了。在单一剂量试验中,代谢物血浆浓度的增加是安全的。值得注意的是,肾脏损伤不会影响芬布芬和第一相反应产物在血浆中的消除。

图4 联苯乙酸在体内的代谢途径[11]
Fig. 4 Metabolic processes of felbinac in the human body

图5 芬布芬的Ⅰ相代谢途径[8]
Fig. 5 Phase I metabolic pathway of fenbufen
芬布芬的Ⅱ相代谢途径见图6。根据IC50值的大小[11],可以发现F-NAC、F-GlcA、F-SG抑制ATP合成的能力强于芬布芬抑制ATP合成的能力;F-Gly、F-Carn、F-NAL抑制ATP合成的能力弱于芬布芬;而F-CoA抑制ATP合成的能力与芬布芬相当。线粒体的孵育会增强芬布芬的抑制作用。
通过干扰线粒体ATP生产,药物可能会导致细胞坏死或凋亡,最终导致器官衰竭[12]。研究表明,芬布芬以及其Ⅱ相代谢结合物(浓度不同,抑制效力不同)都会抑制ATP合成。故常认为芬布芬介导肝细胞毒性可能是由于ATP合成障碍导致线粒体功能障碍。芬布芬及其代谢产物可能是通过抑制ATP合成从而参与线粒体毒性。
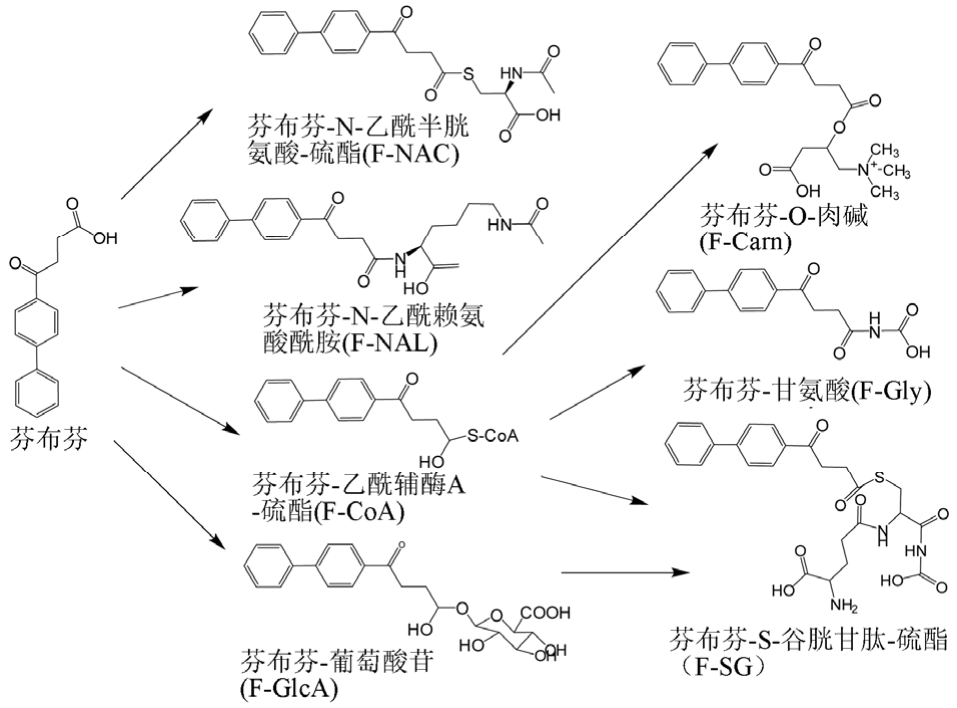
图6 芬布芬的Ⅱ相代谢途径[8]
Fig. 6 Phase Ⅱ metabolic pathway of fenbufen
2.2 苯胺洛芬的药动学研究[13]
目前正在进行临床评估该静脉注射药物用于治疗术后严重疼痛,但是还没有苯胺洛芬在人体内分布、代谢的相关报道。联苯乙酸的主要代谢途径是尿排泄,所以对于肾脏损伤的患者,苯胺洛芬也许是禁忌。
大鼠[1]、人体给药(苯胺洛芬)后,苯胺洛芬都是先代谢为联苯乙酸,然后再继续进行代谢,生成多种代谢物质,见图7。值得注意的是,静脉注射苯胺洛芬后,其代谢物联苯乙酸在大鼠与人体内代谢产生的物质不全相同[11]。
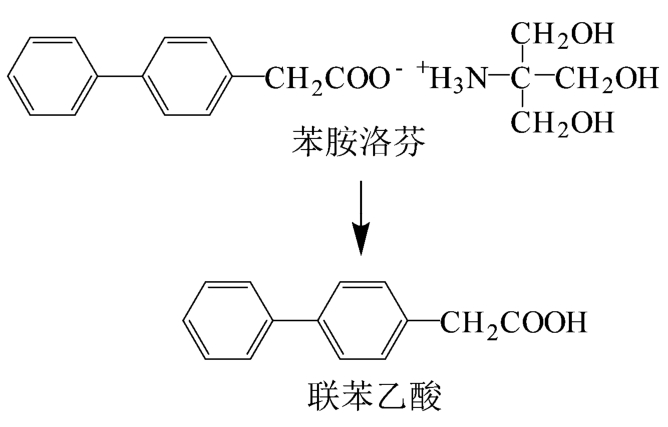
图7 苯胺洛芬在大鼠或人体内的代谢过程[1]
Fig. 7 Metabolic processes of felbinac trometamol in rats or in human body
向不同部位注射不同浓度的联苯乙酸[1],其吸收进入组织的时间与线性范围见表1。
表1 联苯乙酸吸收进入组织的时间与线性范围[2]
Tab. 1 The time of absorption into tissue and linear range of felbinac

给NIH小鼠、Beagle犬静脉注射苯胺洛芬或联苯乙酸乙酯,最大耐受量和LD50值见表2。
表2 最大耐受量和LD50[2]
Tab. 2 Maximum tolerated dose and LD50

给大鼠静脉注射苯胺洛芬注射液[1,13]后,消除半衰期t1/2大约为3 h;最大血浆浓度C0和AUC的值与剂量呈线性相关;联苯乙酸的消除半衰期t1/2大约为2~3 h,4’-羟基联苯乙酸达到最大血浆浓度需要大约6 h。
注射低(3.36 mg·kg-1)、中(8.4 mg·kg-1)、高(21 mg·kg-1)3种剂量的苯胺洛芬时,CL分别为2.82,2.57,2.17 mL·min-1·kg-1。且CL与Vdβ没有显著性差异,性别对其没影响。
联苯乙酸是最常见的NSAIDs之一,是广泛使用的带有羧基基团的天然荧光药物,临床主要是经皮给药。由于慢性或急性给药会导致不良反应(如胃肠道的侵蚀、出血,以及肾皮质、肾小管和乳头的病理变化),因此必须监测联苯乙酸在人体血浆内的浓度。常用的方法有LC-UC、LC-电子检测、LC-MS、LC-荧光[13-14]。
芬布芬、联苯乙酸乙酯、苯胺洛芬等联苯乙酸前药的基本结构是联苯乙酸,故常通过检测联苯乙酸的代谢途径来检测主要活性代谢物为联苯乙酸的前药代谢途径。
以前常用HPLC-UV、HPLC-荧光检测器、LC-MS、GC-MS来同时测定人体或者大鼠体内的联苯乙酸以及其他化合物[13]。缺点:灵敏度低、需要的体积样本[14](≥1 mL)、保留时间长(≥7 min)、且未检测联苯乙酸在人体内的代谢物、用复杂基质(如胆汁、粪便、组织)时选择性差、单调、样品预处理(柱前衍生物或液液萃取)费时、分析时间长等。
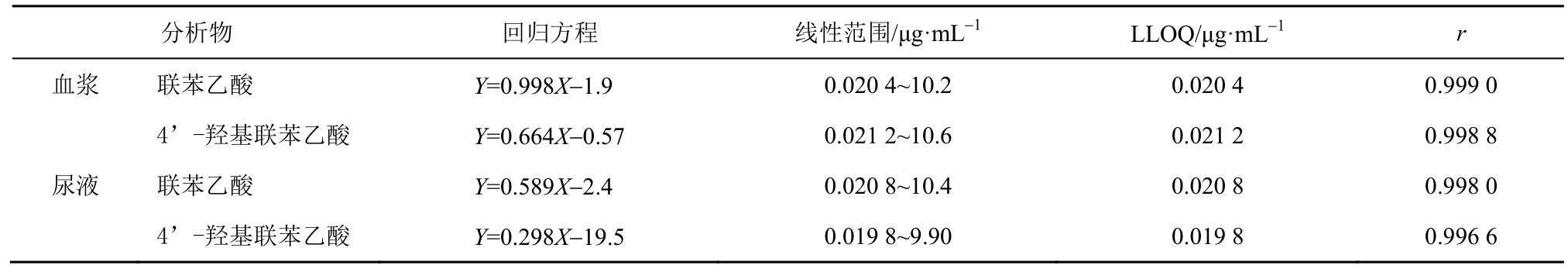
2015年郑运亮[11]等人通过LC-MS/MS技术检测静脉注射苯胺洛芬后人体血浆、尿液中的部分代谢物质,可获得相对较好的检测状况。其相关数据见表3。
表3 血浆与尿液中的联苯乙酸与4’-羟基联苯乙酸的线性回归数据、线性范围、最低定量下限(n=3)[11]
Tab. 3 Linear regression data, LLOD and LLOQ of felbinac and 4’-hydroxyfelbinac in human plasma and urine (n=3)
常用NSAIDs氟衍生与氟相分离测定联苯乙酸[15-17]来监测透皮吸收的联苯乙酸的浓度,具有在线性范围内重复性良好、简单、敏感、选择性强等优点。目前需要发展、验证用LC-Triple-TOF/MS和LC-MS/MS来迅速、敏感地识别人体血浆、尿液中的苯胺洛芬的代谢物的含量,从而应用于苯胺洛芬注射液在人体内的一期临床代谢、药动学、排泄的研究。具有低样本量、样品处理简单、灵敏度高、特异性好、流率大等优点。
软组织损伤与关节损伤中后期出现的局部酸胀疼痛,关节屈伸不利,是外科常见的较为顽固的疾患,严重地影响人们的健康和工作。我国许多地区潮湿寒冷、人口老龄化,患有各种关节性疾病的人群相当庞大。联苯乙酸的相关药物常用来治疗关节疾病。
联苯乙酸是芬布芬、苯胺洛芬等联苯乙酸前药的活性代谢产物,尽管直接利用联苯乙酸制成的药物其消炎镇痛作用强于代谢产生联苯乙酸的消炎镇痛作用,但易产生不良反应,故常在联苯乙酸上引入基团。联苯乙酸相关前药的研发成功,较好地弥补了口服NSAIDs不良反应大的不足,对风湿、类风湿性关节炎,骨关节炎等需长期用药的患者,是一个理想的治疗药物,加之联苯乙酸作为国内临床需求量比较大的品种而且尚未见国内有生产销售此药的报道,市场潜力巨大。因此研制开发本品在为临床医师解除患者病痛提供有效的治疗手段的同时,也必将带来一定的社会效益和经济效益。
通过研究联苯乙酸的一些相关前药的检测方法,可以为目前缺少的研究苯胺洛芬在人体内代谢过程提供依据。联苯乙酸相关药物的药物分析研究可以为苯胺洛芬在人体药动学研究提供建立检测代谢物方法的思路、药动学参数等,以及通过更全面了解苯胺洛芬在人体中的代谢途径来避免由于同时服用其他药物而可能产生的药物-药物相互作用。同时,也可以根据获得的信息制成不同剂型,优化给药方式、获得更好的疗效。
REFERENCES
[1] ZHANG C, CUI X Y, YANG Y, et al. Pharmacokinetics of felbinac after intravenous administration of felbinac trometamol in rats [J]. Xenobiotica, 2011, 41(4): 340-348.
[2] 雷夏凌, 肖百全, 杨威, 等. 一类创新药苯胺洛芬注射液急性毒性研究[J]. 今日药学, 2011, 21(7): 402-407.
[3] MARCHAND S, PARIAT C, BOUQUET S, et al. Pharmacokinetic-pharmacodynamic modelling of the convulsant interaction between norfloxacin and biphenyl acetic acid in rats [J]. Br J Pharmacol, 2000, 129(8): 1609-1616.
[4] HUQ F. Molecular modelling analysis of the metabolism of fenbufen [J]. Asian J Biochem, 2007, 2(1): 50-57.
[5] HUSAIN A, AHMAD A, ALAM M M, et al. Fenbufen based 3-[5-(substituted aryl)-1,3,4-oxadiazol-2-yl]-1-(biphenyl-4-yl)-propa n-1-ones as safer anti-inflammatory and analgesic agents [J]. Eur J Med Chem, 2009, 44(9): 3798-3804.
[6] SKONBERG C, OLSEN J, MADESEN K G, et al. Metabolic activation of carboxylic acids [J]. Expert Opin Drug Metab Toxicol, 2008, 4(4): 425-438.
[7] AGUNDEZ J A, LUCENA M I, MARTINEZ C, et al. Assessment of non-steroidal anti-inammatory drug-induced hepatotoxicity [J]. Expert Opin Drug Metab Toxicol, 2011, 7(7): 817-828.
[8] SYED M, SKONBERG C, HANSEN S H. Inhibition of ATP synthesis by fenbufen and its conjugated metabolites in rat liver mitochondria [J]. Toxicology In Vitro, 2016, 31: 23-29.
[9] XIAO B Q, LEI X L, YANG W, et al. Safety pharmacology research of class I new drug: felbinac trometamol injection [J]. Chin J New Drugs(中国新药杂志), 2011, 20(15): 1386-1391.
[10] SUNEELA D, MANISHA K, SUBHUSH B, et al. Carrier-linked mutual prodrugs of biphenylacetic acid as a promising alternative to bioprecursor fenbufen: design, kinetics, and pharmacological studies [J]. Inflammopharmacol, 2014, 22(4): 235-250.
[11] ZHENG Y L, HU X J, LIU J, et al. Qualitative and quantitative analysis of felbinac and its major metabolites in human plasma and urine by liquid chromatography tandem mass spectrometry and its application after intravenous administration of felbinac trometamol injection [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015(986-987): 60-68. Doi: 10.1016/j.jchromb.2015.01.042.
[12] LABBE G, PESSAYRE D, FROMENTY B. Drug-induced liver injury through mitochondrial dysfunction: mechanisms and detection during preclinical safety studies [J]. Fundam. Clin Pharmacol, 2008, 22(4): 335-353.
[13] ZHANG C, WANG L, YANG W, et al. Validated LC-MS/MS assay for the determination of felbinac: Application to a preclinical pharmacokinetics study of felbinac trometamol injection in rat [J]. J Pharm Biomed Anal, 2009, 50(1): 41-45.
[14] IBRAHIM H, BOYER A, BOUAJILA J, et al. Determination of non-steroidal anti-inflammatory drugs in pharmaceuticals and human serum by dual-mode gradient HPLC and fluorescence detection [J]. J Chromatogr B, 2007, 857(1):59-66.
[15] SAKAGUCHI Y, YOSHIDA H, TODOROKI K, et al. Separation-oriented derivatization of native fluorescent compounds through fluorous labeling followed by liquid chromatography with fluorous-phase [J]. Anal Chem, 2009, 81 (12): 5039-5045.
[16] HAYAMA T, SAKAGUCHI Y, YOSHIDA H, et al. Fluorous determination combined with liquid chromatography-tandem mass spectrometry: a method for the selective and sensitive determination of sialic acids in biological samples [J]. Rapid Commun Mass Spectrom, 2010, 24 (19): 2868-2874.
[17] SAKAGUCHI Y, YOSHIDA H, HAYMA T, et al. Fluorous derivatization and fluorous-phase separation for fluorometric determination of naproxen and felbinac in human plasma [J]. J Pharm Biomed Anal, 2011, 55(1): 176-180.
Metabolism of Felbinac and Its Pro-drug in Rats or Human Body
SHEN Xu1, SHENTU Jianzhong2*
(1.Zhejiang University of Technology, Hangzhou 310014, China; 2.First Affiliated Hospital, Zhejiang University, Hangzhou 310003, China)
ABSTRACT:According to the correlative reports in recent years, the main active products of metabolism which were felbianc are divided into a class of drugs, they are referred to as the former drug of the acetic acid. The metabolic processes and products in human body are discussed by LC-MS. Felbinac is the active metabolite of many non-steroidal anti-inflammatory drugs, and it is also the key material for its anti-inflammatory and analgesic effects. The shortcoming of low water solubility, gastrointestinal disorders by the oral administration and so on, in addition to the external reagent, felbinac research mainly concentrated in the prodrug synthesis, preparation, pharmacology and efficacy at present. The successful research and development of the related drugs of felbinac can reduce the side effects brought by the direct administration of felbianc, providing effective treatment for clinicians to relieve the pain of patients, and provide a way for human to study the pharmacokinetics of felbinac trometamol.
KEY WORDS:felbinac; metabolize; LC-MS; felbinac trometamol
中图分类号:R969.1
文献标志码:A
文章编号:1007-7693(2017)07-1068-05
DOI:10.13748/j.cnki.issn1007-7693.2017.07.031
引用本文:沈旭, 申屠建中. 联苯乙酸及其前药在大鼠或人体内的代谢[J]. 中国现代应用药学, 2017, 34(7): 1068-1072.
收稿日期:2016-11-01
(本文责编:李艳芳)
基金项目:“重大新药创制”国家科技重大专项(2013zx09401003-003)
作者简介:沈旭,女,硕士生 Tel: (0571)87236560 E-mail: shenxu0630@163.com*
通信作者:申屠建中,男,博士,主任药师 Tel:(0571)87236560 E-mail: stjz@zju.edu.cn