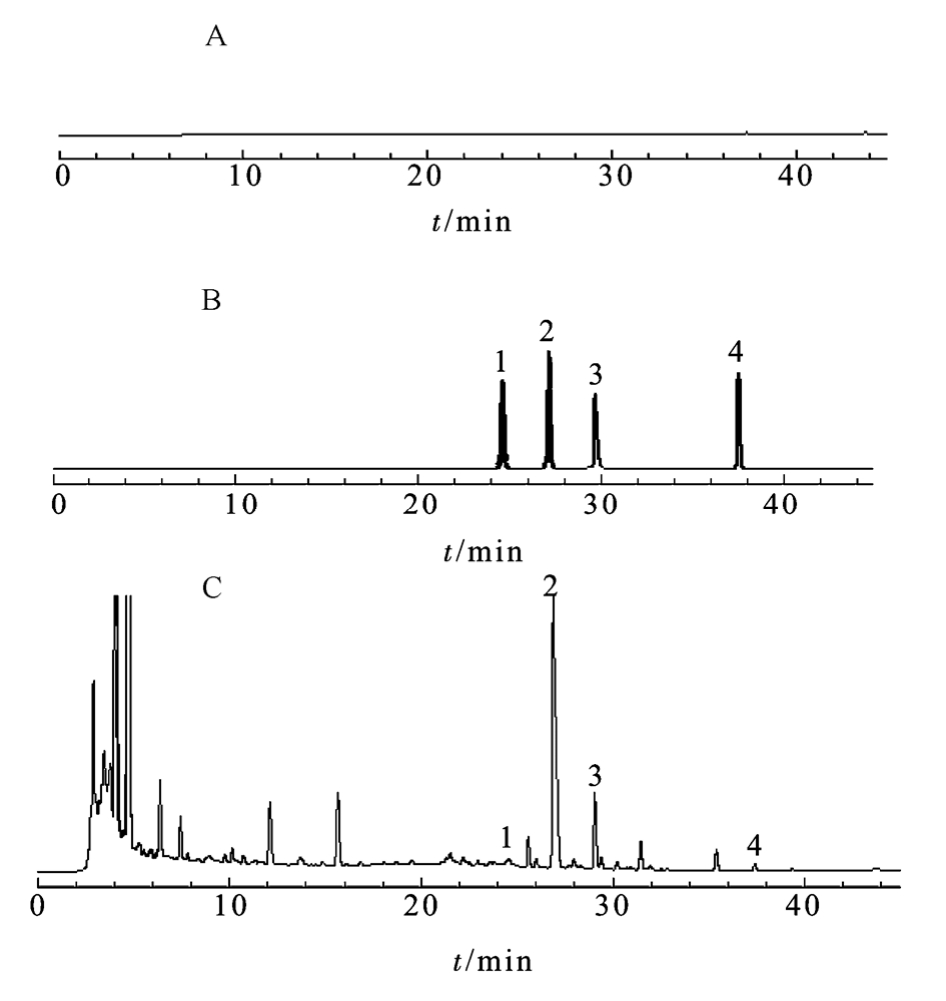
图1 高效液相色谱图
A-空白样品溶液;B-对照品溶液A1;C-乙酸乙酯提取物溶液;1-次乌头原碱;2-高乌甲素;3-苯甲酰乌头原碱;4-乌头碱。
Fig. 1 HPLC chromatograms
A-blank; B-reference substance solution A1; C-sample solution; 1-hypaconitine; 2-lappaconitine; 3-benzoylaconine; 4-aconitine.
·论 著·
魏莹1,刘姣1,2,雷军1,张帆1*,孙芸3*(1.川北医学院药学院,四川 南充 637007;2.成都市第五人民医院,成都 611130;3.新疆医科大学中药系,乌鲁木齐 830011)
摘要:目的 建立HPLC同时测定各生物碱含量的方法,并对准噶尔乌头的乙酸乙酯和乙醇提取部位进行分析。方法采用Agilent TC-C18(2)色谱柱(250 mm×4.6 mm,5 μm);流动相为0.3%磷酸水溶液(A)-乙腈(B),二元梯度洗脱(0~12 min,10%→16% B;12~30 min,16%→35% B;30~40 min,35%→45% B;40~45 min,45% B),流速1.0 mL·min-1,检测波长235 nm,柱温35 ℃,进样量20 μL。结果在45 min内生物碱成分均能完全分离,峰面积与进样量呈良好线性关系。乙酸乙酯提取物中含有次乌头原碱、高乌甲素、苯甲酰乌头原碱与乌头碱等,而乙醇提取物中含有宋果灵、苯甲酰乌头原碱、乌头碱、草乌甲素与3-脱氧乌头碱等,含量分别在1~130 mg·g-1之间,2个提取部位所含生物碱的种类与含量均有较大差异。结论该方法操作简便,结果可靠,重复性好,可用于准噶尔乌头药材的质量控制,并为其他乌头类药材中生物碱的定量分析提供参考。
关键词:准噶尔乌头;化学成分;生物碱;高效液相色谱法;毛茛科
准噶尔乌头(Aconitum soongaricum Stapf.)为毛茛科乌头属植物,是我国新疆天山地区特产民族药材,在西北地区常作为川乌与草乌的替代品使用,具祛风散寒、止痛消肿、通经活络等功效[1-4]。其酊剂外用为神经痛、牙痛、关节炎及其他各种疼痛时的镇痛剂,并被写入哈萨克药志与前苏联药典[5]。近年来笔者在研究与开发此类传统药物时已经探讨了准噶尔乌头的生物资源、物质基础、仪器分析、急性毒性与代谢毒性等多方面内容[6-10],但是在制备不同部位药物时,由于不同部位之间的化学成分的差异性不清楚,也就无法探讨该药材活性与毒性的来源与差异,更无法确定药材的开发方向、提高药材的利用度。因此,本实验采用HPLC对准噶尔乌头不同提取部位中生物碱成分进行定性与定量分析,建立针对性的分析方法[7,11],以发现不同提取部位之间的化学成分差异,为进一步阐明此类药材药理活性与毒性机制、开发创新药物提供科学依据。
Agilent-1220型高效液相色谱仪,包括两元泵、在线脱气机、手动进样器、紫外检测器;Millipore水纯化仪(美国Millipore公司);KQ-25E超声清洗机(昆山市超声仪器有限公司);AGB5型十万分之一电子天平(瑞士Mettler Toledo公司)。
准噶尔乌头于2013年7月采自新疆新源县那拉提草原,由川北医学院药学院张帆教授鉴定为准噶尔乌头(A. soongaricum Stapf.)全草。取根部适量清洁处理后粉碎,先分别用水与环己烷浸泡药材,提取并除去水溶性与油脂类杂质,再分别用乙酸乙酯与90%乙醇溶剂对其进行提取与浓缩,分别获得以上2个不同提取部位。对照品:乌头碱(批号:12081103,纯度:98%,供含量测定用)、次乌头碱(批号:14100908,纯度:98%,供含量测定用)、3-脱氧乌头碱(批号:20151112,纯度:98%,供含量测定用)、苯甲酰乌头原碱(批号:20151205,纯度:98%,供含量测定用)、草乌甲素(批号:14100913,纯度:98%,供含量测定用)和高乌甲素(批号:100547-200401,纯度:98%,供含量测定用)均购于宝鸡市辰光生物科技有限公司;宋果灵(自制,1H-和13C-NMR、ESI-MS鉴定,含量采用HPLC峰面积归一化法计算92%);甲醇(HPLC级,批号:126273,上海星可生化有限公司);乙腈(HPLC级,批号:152833,赛默飞世尔科技有限公司);水为纯水(Millipore水纯化仪自制);其他试剂均为分析纯。
2.1 溶液制备
2.1.1 混合对照品溶液 分别精密称取减压干燥至恒重的对照品乌头碱、次乌头碱、3-脱氧乌头碱、苯甲酰乌头原碱、草乌甲素、高乌甲素和宋果灵适量,分别置10 mL量瓶中,加乙腈溶解并定容,摇匀得对照品母液。分别取母液适量配制混合对照品溶液A1(含次乌头原碱0.38 mg·mL-1、高乌甲素0.22 mg·mL-1、苯甲酰乌头原碱0.07 mg·mL-1与乌头碱0.08 mg·mL-1)和混合对照品溶液B1(含宋果灵0.99 mg·mL-1、苯甲酰乌头原碱0.04 mg·mL-1、乌头碱0.31 mg·mL-1、草乌甲素0.08 mg·mL-1与3-脱氧乌头碱0.23 mg·mL-1)。
2.1.2 供试品溶液 分别精密称取乙酸乙酯提取物113.15 mg与乙醇提取物114.48 mg,置于5 mL量瓶中,用乙腈溶解并定容,配制成浓度为22.63 mg·mL-1的乙酸乙酯提取物溶液与22.90 mg·mL-1的乙醇提取物溶液,摇匀后过0.45 μm滤膜得供试品溶液。
2.2 样品分析方法的建立
2.2.1 色谱条件 色谱柱为Agilent TC-C18(2) (250 mm×4.6 mm,5 μm);流动相为0.3%磷酸水溶液(A)-乙腈(B),二元梯度洗脱:0~12 min,10%→16%B;12~30 min,16%→35%B;30~40 min,35%→45%B;40~45 min,45%B。检测波长为235 nm,流速1.0 mL·min-1,柱温35 ℃,进样量20 μL。乙酸乙酯与乙醇提取部位及各自对照品的HPLC色谱图分别见图1~2。

图1 高效液相色谱图
A-空白样品溶液;B-对照品溶液A1;C-乙酸乙酯提取物溶液;1-次乌头原碱;2-高乌甲素;3-苯甲酰乌头原碱;4-乌头碱。
Fig. 1 HPLC chromatograms
A-blank; B-reference substance solution A1; C-sample solution; 1-hypaconitine; 2-lappaconitine; 3-benzoylaconine; 4-aconitine.
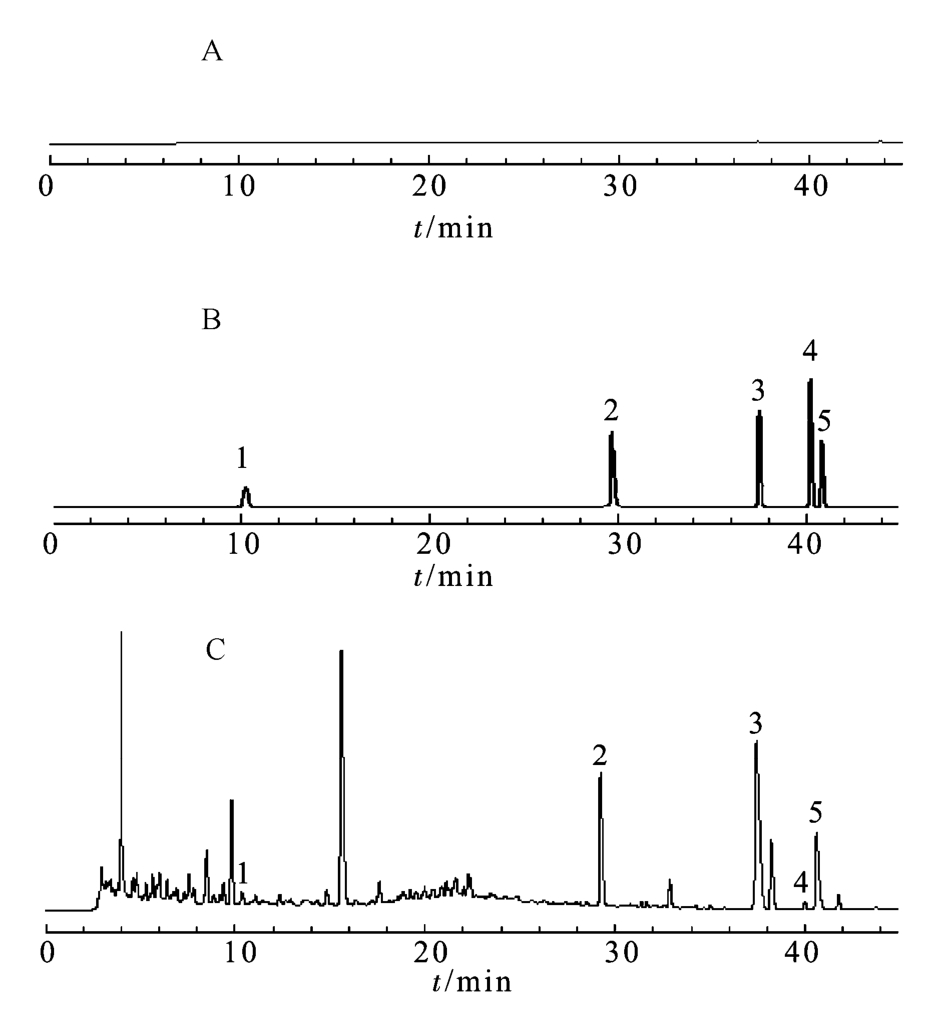
图2 高效液相色谱图
A-空白样品溶液;B-对照品溶液B1;C-乙醇提取物溶液;1-宋果灵;2-苯甲酰乌头原碱;3-乌头碱;4-草乌甲素;5-3-脱氧乌头碱。
Fig. 2 HPLC chromatograms
A-blank; B-reference substance solution B1; C-sample solution; 1-songorine; 2-benzoylaconine; 3-aconitine; 4-bulleyaconitine A; 5-3-deoxyaconitine.
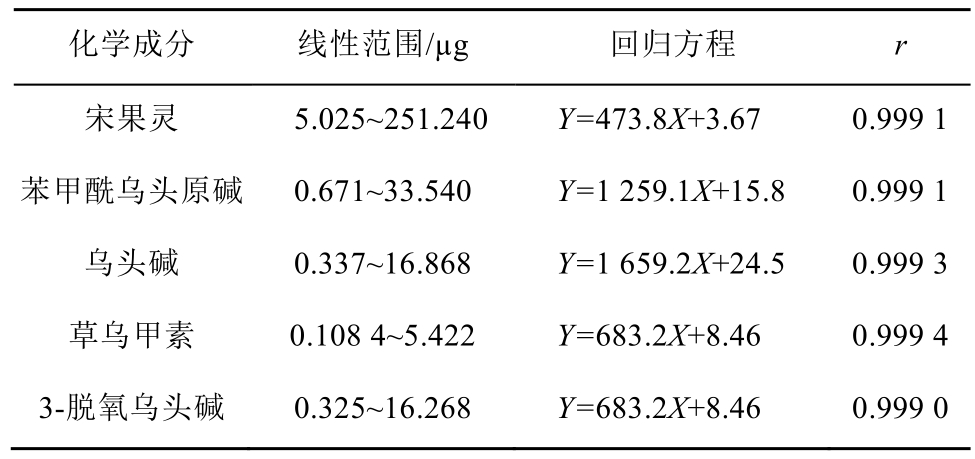
2.2.2 线性关系考察 分别称取对照品适量,乙腈溶解,制备混合对照品溶液A2(含次乌头原碱29.61 mg·mL-1、高乌甲素11.589 mg·mL-1、苯甲酰乌头原碱1.677和乌头碱0.843 4 mg·mL-1)和混合对照品溶液B2(含宋果灵12.562 mg·mL-1、苯甲酰乌头原碱1.677 mg·mL-1、乌头碱0.843 4 mg·mL-1、草乌甲素0.2711 mg·mL-1和3-脱氧乌头碱0.813 4 mg·mL-1);将混合对照品溶液分别稀释5,10,15,20,50倍制成系列混合对照品溶液;精密吸取对照品溶液各20 μL,按“2.2.1”项下色谱条件测定,以进样量(μg)为横坐标(X),色谱峰峰面积为纵坐标(Y),绘制标准曲线,得回归方程。其线性范围、标准曲线和相关系数(n=6)结果见表1~2。
表1 乙酸乙酯提取部位中各生物碱成分的线性范围、回归方程、相关系数(n=6)
Tab. 1 Linear range, regression equation and correlation coefficient of components in ethyl acetate extract (n=6)
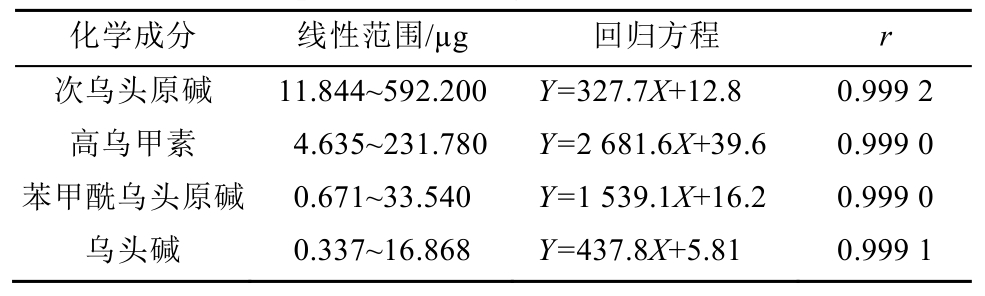
表2 乙醇提取部位中各生物碱成分的线性范围、回归方程、相关系数
Tab. 2 Linear range, regression equation and correlation coefficient of components in ethanol extract
2.2.3 仪器精密度试验 乙酸乙酯提取物溶液中次乌头碱、高乌甲素、苯甲酰乌头原碱和乌头碱的峰面积的RSD值分别为2.50%,2.31%,1.26%,2.62%;乙醇提取物溶液中宋果灵,苯甲酰乌头原碱,乌头碱,草乌甲素和3-脱氧乌头碱的峰面积的RSD值分别为2.20%,0.48%,0.52%,2.16%,0.72%,结果表明仪器精密度良好。
2.2.4 重复性实验 结果乙酸乙酯提取物溶液中次乌头碱、高乌甲素、苯甲酰乌头原碱和乌头碱的平均含量的RSD值分别为2.18%,2.03%,1.23%,1.16%;乙醇提取物溶液中宋果灵,苯甲酰乌头原碱,乌头碱,草乌甲素和3-脱氧乌头碱的平均含量的RSD值分别为:1.86%,1.67%,1.51%,2.17%,1.82%,表明重复性良好。
2.2.5 稳定性实验 乙酸乙酯提取物溶液中次乌头碱,高乌甲素,苯甲酰乌头原碱和乌头碱的的峰面积的RSD分别为2.80%,2.51%,1.94%,1.57%;乙醇提取物溶液中宋果灵、苯甲酰乌头原碱、乌头碱、草乌甲素和3-脱氧乌头碱的峰面积的RSD分别为1.39%,1.19%,1.19%,1.82%,1.17%,表明供试品溶液在室温下24 h内稳定。
2.2.6 加样回收率试验 乙酸乙酯提取部位的加样回收率试验:精密称取已测含量的乙酸乙酯提取物(次乌头原碱、高乌甲素、苯甲酰乌头原碱和乌头碱的含量分别为14.809,5.795,0.829和0.417 mg)样品共6份,每份约113 mg,分别精密加入混合对照品溶液(各对照品浓度分别为14.809,5.795,0.829与0.417 mg·mL-1)1 mL,按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定含量,计算回收率,结果见表3。
表3 乙酸乙酯提取部位加样回收率试验结果(n=6)
Tab. 3 Results of recovery tests of components in ethyl acetate extract(n=6)
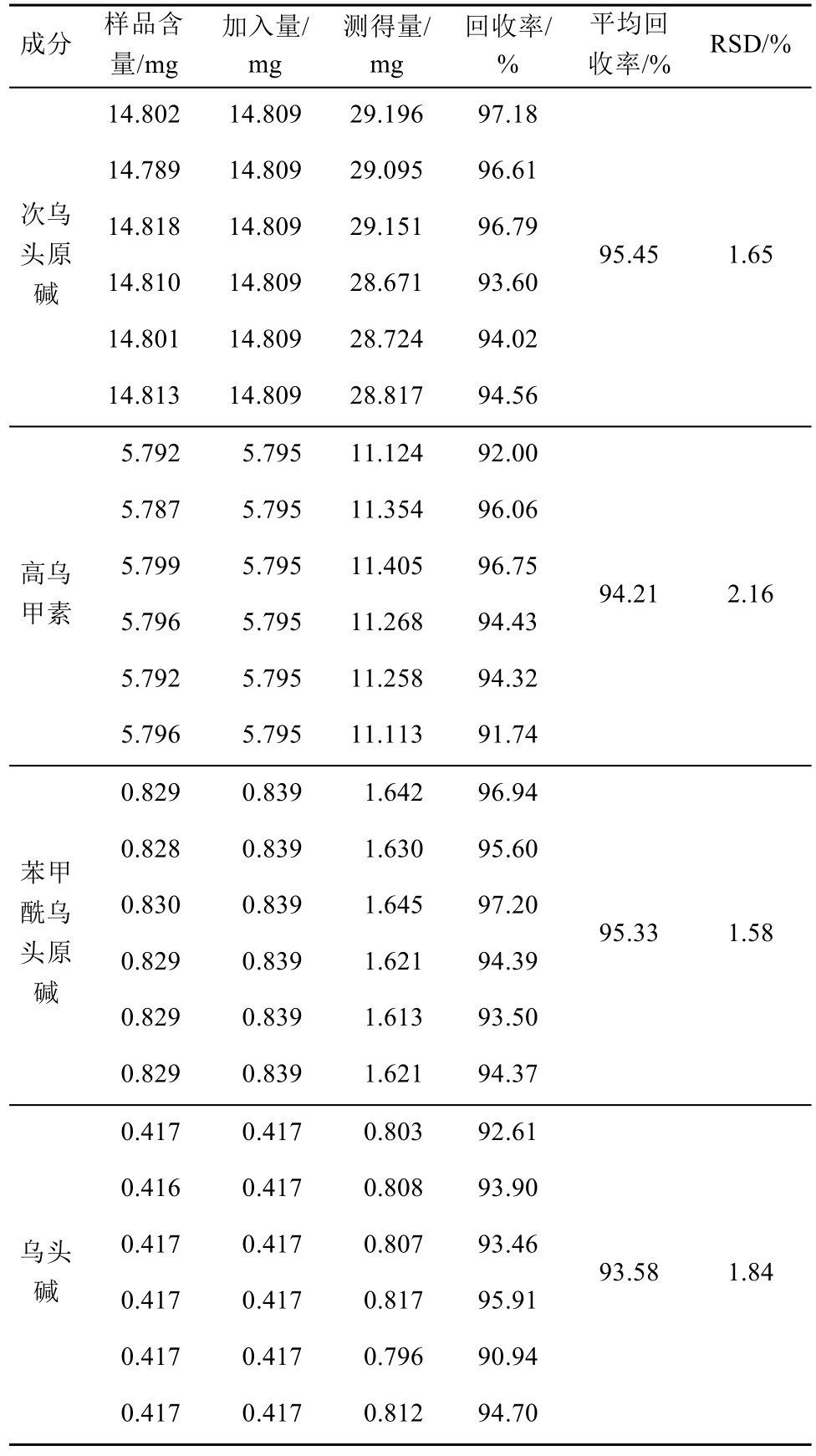
乙醇提取部位的加样回收率试验:精密称取已测含量的乙醇提取物(宋果灵、苯甲酰乌头原碱、乌头碱、草乌甲素和3-脱氧乌头碱的含量分别为6.255,0.835,0.420,0.135和0.511 mg)样品共6份,每份约114 mg,分别精密加入混合对照品溶液(各对照品浓度分别为6.255,0.835,0.420,0.135和0.511 mg·mL-1)1 mL,按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定含量,计算回收率,结果见表4。
2.3 样品含量测定
称取乙酸乙酯提取物和乙醇提取物各110 mg,精密称定,按“2.1.2”项下方法制备供试品溶液,于波长235 nm处测定,计算含量,结果见表5。
表4 乙醇提取部位加样回收率试验结果(n=6)
Tab. 4 Results of recovery tests of components in ethanol extract(n=6)
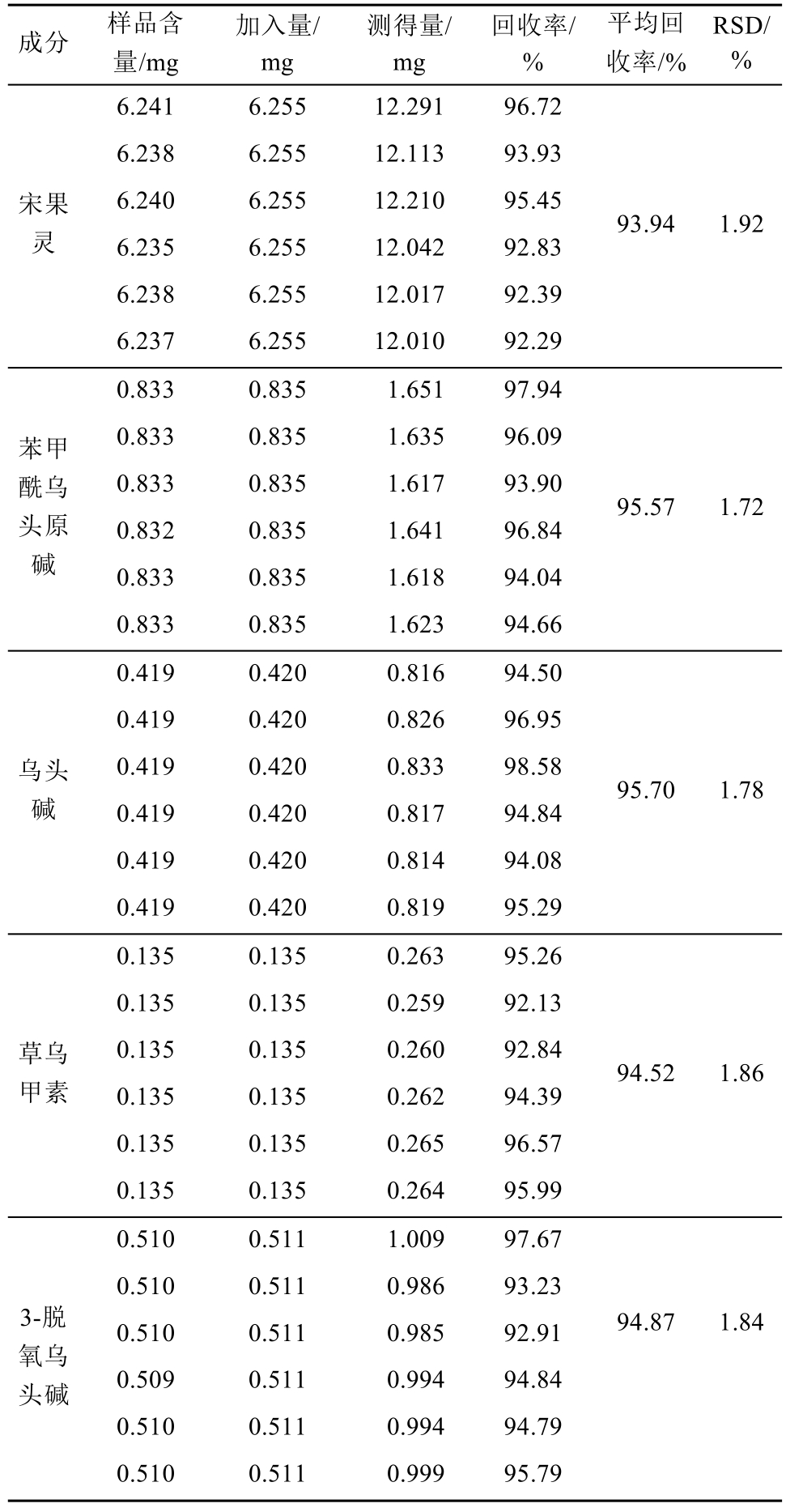
表5 准噶尔乌头的不同提取部位中主要生物碱的含量(n=3)
Tab. 5 The contents of alkaloids from different extracts in A. soongaricum(n=3) mg·g-1
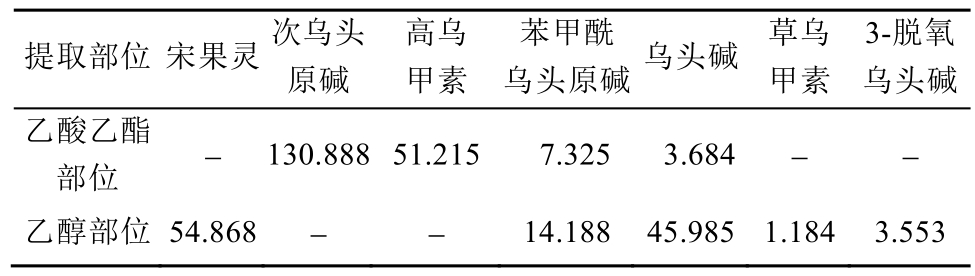
注:“-”表示含量低于定量限。
Note: the symbol “-” showed that the contents were below quantification limit.
实验结果表明,准噶尔乌头乙酸乙酯提取部位与乙醇提取部位相比,均含有苯甲酰乌头原碱与乌头碱,但乙醇部位的含量远高于乙酸乙酯部位;而乙酸乙酯部位中含有次乌头原碱与高乌甲素,乙醇部位中含有宋果灵、草乌甲素与3-脱氧乌头碱,各个成分的含量也相差很大。此外,对于极性相差较大的提取部位,本研究尝试在HPLC中选择使用甲醇-水、甲醇-水-十二烷基硫酸钠、甲醇-水-三乙胺、乙腈-水、乙腈-磷酸水等多个流动相体系,试验证明在235 nm处,乙腈-0.3%磷酸水溶液梯度洗脱能够将各生物碱成分进行较好地分离,且具有良好的峰形,此方法可用于准噶尔乌头中化学物质基础的检测和质量标准的建立,并为其他乌头属药材的成分分析提供借鉴。
准噶尔乌头在新疆天山地区分布集中、蕴藏量大,作为民族民间药材疗效显著、使用历史悠久,具有确切的临床疗效。但是由于经济和地理原因,该药材一直未被重视、更没有被充分利用,反而被作为草原毒害草而除去,造成了资源的极大浪费。本研究旨在研究准噶尔乌头不同提取部位的物质基础的差异,在此基础上将进一步确定活性部位、提高活性组分纯度,为开发创新药物奠定基础。
REFERENCES
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 第27卷. 北京: 科学出版社, 1979: 308.
[2] 蔡冬梅, 刘悦, 张帆. 新疆特产乌头属植物的研究概况[J].新疆中医药, 2011, 29(2): 74-75.
[3] ZHANG F, YANG J, CAI D M, et al. Resource survey of Aconitum L. plant in Xinjiang province [J]. J Xinjiang Med Univ(新疆医科大学学报), 2011, 34(12): 1399-1401.
[4] ZHAO F C, LI J, WU C, et al. Research on Aconitum Soongaricum and its processed products treatment for CIA rats [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2012, 29(12): 1061-1066.
[5] 徐新, 巴哈尔古丽·黄尔汗. 哈萨克药志[M]. 第1卷. 北京:民族出版社, 2009: 447-449.
[6] LIU Y, CAI D M, WUFUER H, et al. Morphological and histological identification of Aconitum soongaricum Stapf [J]. J Chin Med Mater(中药材), 2011, 34(6): 876-878.
[7] ZHANG F, YANG L J, CAI D M, et al. Analysis of the diterpenoid alkaloids in Aconitum soongaricum Stapf by HPLC and TLC [J]. Nat Prod Res Dev(天然产物研究与开发), 2012, 24(7): 924-927.
[8] YANG L J, ZHANG F, CAI D M, et al. Analysis on the acute toxicity of Aconitum soongaricum Stapf in mice [J]. Lishizhen Med Mater Med Res(时珍国医国药), 2012, 23(10):2542-2543.
[9] ZHOU Q, GAO F C, MA H M, et al. Analysis on ISSR characteristics of Aconitum L. ethnic medicine in Xinjiang [J]. J Xinjiang Med Univ(新疆医科大学学报), 2014, 37(12):1614-1618.
[10] ZHANG F, LIU J, LEI J, et al. Serum metabolomic profiling of rats by intervention of Aconitum soongaricum [J]. Nat Prod Commun, 2015, 10(12): 2165-2167.
[11] ZHAO F C, HE Q, LI J. Assay of diester diterpenoid alkaloids in Aconitum soongaricum by HPLC [J]. Chin Trad Pat Med(中成药), 2012, 34(8): 1552-1555.
[12] DENG M J, YU J J, WANG X Y, et al. Simultaneous determination of chlorogenic acid, mignonette glycosides and 3, 5-O-dicaffeoylquinic acid of Yinju extract by HPLC [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(4):403-407.
Variance Analysis on the Chemical Constitutes of Different Extracts from Aconitum Soongaricum Stapf.
WEI Ying1, LIU Jiao1,2, LEI Jun1, ZHANG Fan1*, SUN Yun3*
(1.School of Pharmacy, North Sichuan Medical College, Nanchong 637007, China; 2.Chengdu Fifth People’s Hospital, Chengdu 611130, China; 3.Traditional Chinese Medicine Department, Xinjiang Medical University, Urumqi 830011, China)
ABSTRACT:OBJECTIVE To establish an HPLC method for simultaneously analyzing the alkaloids in Aconitum soongaricum Stapf, and study the chemical differences between ethyl acetate extract and ethanol extract.METHODSThe separation was performed on an Agilent TC-C18(2) column (250 mm×4.6 mm, 5 μm), and the mobile phase consisted of 0.3% phosphoric acid water (A)-acetonitrile (B) in gradient mode (0-12 min, 10%→16% B; 12-30 min, 16%→35% B; 30-40 min, 35%→45% B; 40-45 min, 45% B) at the flow rate of 1.0 mL·min-1. The detection wavelength was 235 nm, while the column temperature was 35 ℃ and the injection volume was 20 μL.RESULTSAll the alkaloids could be separated completely within 45 min, and the regression equation showed good liner relationship between the peak area and the content of each compound. The ethyl acetate extract contained four alkaloids including hypaconitine, lappaconitine, benzoylaconine and aconitine, while ethanol extract contained five alkaloids including songorine, benzoylaconine, aconitine, bulleyaconitine A and 3-deoxy-aconitine, and the contents of above alkaloids were 1-130 mg·g-1. Results showed that there were significant differences between the two parts.CONCLUSIONThis method is simple, accurate, and reproducible, and is suitable for the quality control of Aconitum soongaricum, and can be used for quantitative analysis of other Aconitum crude medicines.
KEY WORDS:Aconitum soongaricum Stapf; chemical constitute; alkaloid; HPLC; Ranunculaceae
中图分类号:R284.1
文献标志码:B
文章编号:1007-7693(2017)07-0933-05
DOI:10.13748/j.cnki.issn1007-7693.2017.07.001
引用本文:魏莹, 刘姣, 雷军, 等. 民族药准噶尔乌头不同提取部位化学成分的差异性分析[J]. 中国现代应用药学, 2017, 34(7): 933-937.
收稿日期:2016-09-14
(本文责编:李艳芳)
基金项目:国家自然科学基金(81460637);川北医学院博士启动基金(201402)
作者简介:魏莹,女,硕士,讲师 Tel: (0817)3300337 E-mail: 414697669@qq.com*
通信作者:张帆,男,博士,教授 Tel:15775830757 E-mail: zhangfan596@163.com 孙芸,女,硕士,副教授 Tel: 18699123803 E-mail: sunyun330@163.com