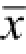 ±s表示,并采用SPSS 16.0软件进行单因素方差分析(one way ANOVA)检验。P<0.05表示具有显著性差异。
±s表示,并采用SPSS 16.0软件进行单因素方差分析(one way ANOVA)检验。P<0.05表示具有显著性差异。
·论 著·
李文畅 1,马晓倩 1,李玉璟 1,张丽志 2,李蒙蒙 1,方 瑞 1,温 克 1*(1.天津医科大学基础医学院药理学系,天津 300070;2.天津市第一中心医院妇产科,天津 300192)
摘要:目的 研究 1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)对心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury,MIRI)所致细胞凋亡的影响及其与PI3K/Akt/GSK3β信号通路的相关性。方法 缺血30 min后,进行再灌注损伤120 min,建立大鼠MIRI模型。采用TTC染色方法测定心肌梗死面积,采用TUNEL染色方法观察心肌凋亡指数,采用酶联免疫方法测定血浆CK-MB活性。采用Western blot方法测定Akt、GSK3β磷酸化情况以及cleaved caspase-3水平,并测定细胞色素C释放情况。结果 S1P可明显减少心肌梗死面积、降低细胞凋亡指数。同时增加Akt、GSK3β磷酸化程度,降低cleaved caspase-3水平,减少胞浆细胞色素C易位。S1P的保护作用可被PI3K抑制剂LY294002所阻断。结论 S1P可通过抑制线粒体蛋白细胞色素C释放、减少caspase激活,减弱MIRI所致心肌细胞凋亡以及心肌梗死,该作用与PI3K/Akt/GSK3β信号通路活化有关。
关键词:1-磷酸鞘氨醇;缺血再灌注损伤;凋亡;PI3K/Akt
心肌缺血再灌注损伤(myocardial ischemia/ reperfusion injury,MIRI)是指缺血心肌在恢复血液供应后,心肌损伤加重的情况,可导致梗死面积增大、细胞凋亡、心律失常等。缺血性或药理性预适应或后适应可在一定程度上增加心肌细胞抗MIRI的能力 [1],实验研究表明,部分药物(如吸入麻醉药、他汀类和阿片类药物)可诱导药理性后适应发挥心肌保护作用 [2-3]。
1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)是位于细胞膜上的鞘磷脂的代谢产物 [4],本实验室前期研究表明,S1P具有保护微血管内皮细胞,抑制炎症诱导的微血管通透性增加 [5];抵抗心肌细胞缺氧/复氧损伤等作用 [6]。但其对心肌缺血再灌注损伤的影响及其机制尚不完全清楚。目前研究发现,再灌注损伤挽救激酶(reperfusion injury salvage kinase,RISK)通路介导了部分药物后适应诱导的心肌保护作用,该通路主要包括磷脂酰肌醇3-激酶(phosphatidylinositol-3-OH kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)、细胞外信号调节激酶1/2(extracellular signal-regulated kinases 1/2,Erk1/2)以及糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β) [7]。而GSK3β活性的抑制可增加心肌对MIRI的耐受力。S1P是否对PI3K/Akt/ GSK3β通路有影响目前尚不清楚,因此本研究应用大鼠MIRI模型观察了S1P对心肌细胞损伤的影响,同时进一步观察了S1P对PI3K/Akt/GSK3β通路以及凋亡通路主要蛋白细胞色素C(cytochrome C,Cyt-C)以及caspase-3的影响,以明确S1P心肌保护作用的机制。
1.1 动物
清洁级Wistar大鼠,7周龄,体质量(250±10)g,♂,56只,由北京维通利华实验动物技术有限公司动物公司提供,实验动物生产许可证号:SCXK(京) 2007-0001。
1.2 主要试剂与仪器
S1P(美国Sigma公司,批号:113M4720V);PI3K抑制剂LY294002(美国Sigma公司,批号:092M4616V);2,3,5-三苯基氯化四氮唑(TTC,美国Sigma公司,批号:T17770);CK-MB Elisa试剂盒(南京建成生物工程研究所,批号:E1112060);磷酸化-Akt(Ser473)、cleaved caspase-3、β-actin抗体购自美国Santa Cruz科技公司;Akt、Cyt-C、VDAC、磷酸化-GSK3β(Ser 9)以及GSK3β抗体购自美国CST公司;辣根过氧化物酶标记二抗(北京中杉金桥生物技术有限公司,批号:20140709);ECL发光试剂盒(江苏碧云天生物技术研究所,批号:109525)。
Powerpac HC型电泳仪(美国BIO-RAD公司);Tanon-5200型凝胶成像仪(北京原平皓生物技术有限公司)。
1.3 分组
Wistar大鼠随机分为4组,每组14只。假手术组:大鼠行开胸手术,但不进行MIRI损伤操作;MIRI组:大鼠开胸后,接受心肌30 min缺血随后120 min再灌注损伤操作;S1P组:大鼠接受MIRI损伤操作,再灌注初期股静脉注射 1.0 mg·kg -1S1P;LY+S1P组:大鼠缺血后15 min 股静脉注射0.3 mg·kg -1LY294002,其余同S1P组。每组动物其中8只用于梗死面积及CK-MB测定,剩余6只用于凋亡及蛋白检测。
1.4 MIRI模型制备
大鼠通过腹腔注射乌拉坦(1.0 g·kg -1)进行麻醉。行气管插管,连接小动物呼吸机。开胸后暴露心脏,用3-0缝合线结扎冠状动脉左前降支进行缺血损伤,缺血30 min后,去除缝合线,恢复血液供应,进行再灌注损伤120 min。
1.5 心肌梗死面积测定
每组选取8只动物心脏用于梗死面积测定。再灌注120 min后,结扎左前降支,股静脉注射0.5%台盼蓝溶液2 mL,随后立即取出心脏。沿矢状轴将心脏切成1 mm厚的切片。蓝染组织为正常组织,而未染色组织为缺血组织,即危险区(AAR)。分离AAR并用0.03 mol·L -1TTC溶液于37 ℃水域孵育20 min。正常心肌经TTC染色后为砖红色,而梗死心肌(IS)表现为灰白色。分离梗死组织及正常组织并称重,计算IS/AAR比值以反应心肌梗死面积。
1.6 血浆CK-MB活性测定
动物心肌缺血再灌注损伤120 min后,经腹主动脉取血3 mL,300×g离心10 min分离血浆。采用ELISA方法测定血浆CK-MB活性。
1.7 心肌细胞TUNEL检测
心肌再灌注损伤120 min后,取左心室近心尖部组织,常规固定、脱水、包埋、切片。采用TUNEL染色的方法观察心肌凋亡情况。胞核棕染的细胞为TUNEL阳性、凋亡细胞。计算5个视野下凋亡阳性细胞的百分率即为凋亡指数。
1.8 Western blot实验
取心脏左心室组织制备匀浆,并提取全细胞、线粒体、胞浆蛋白样品,BCA法蛋白定量。全细胞蛋白样品用于Akt、GSK3β以及caspase-3检测,线粒体及胞浆蛋白样品用于Cyt-C测定。BCA法蛋白定量,将蛋白样品进行SDS-PAGE凝胶电泳,并转至PVDF膜。封闭液室温封闭1 h后,加入p-Akt、Akt、p-GSK3β、GSK3β、cleaved caspase-3、β-actin、Cyt-C、VDAC等一抗4 ℃孵育过夜,二抗室温孵育1 h。采用ECL法观察特异蛋白条带光密度变化。并计算磷酸化蛋白与总蛋白的比值或目的蛋白与内参蛋白(VDAC:线粒体内参;β-actin:全细胞蛋白内参)比值。
1.9 统计学方法
所有数据以
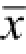 ±s表示,并采用SPSS 16.0软件进行单因素方差分析(one way ANOVA)检验。P<0.05表示具有显著性差异。
±s表示,并采用SPSS 16.0软件进行单因素方差分析(one way ANOVA)检验。P<0.05表示具有显著性差异。
2.1 S1P对心肌缺血再灌注损伤模型大鼠心肌梗死面积及血浆CK-MB活性的影响
假手术组无梗死心肌存在,而MIRI组可见大范围梗死组织与假手术组比较,具有显著性差异(P<0.01)。S1P可明显减少IS/AAR,与MIRI组比较,具有显著性差异(P<0.01)。此外,LY294002预处理组可减弱S1P减少心肌梗死面积的作用,与MIRI组比较无显著性差异。血浆CK-MB检测发现,MIRI组CK-MB水平明显高于假手术组(P<0.01)。与心肌梗死面积结果相似,S1P可显著降低MIRI损伤引起的CK-MB增高(P<0.01),而LY294002可抑制S1P对CK-MB的影响。结果见表1。
表1 S1P对缺血再灌注损伤大鼠心肌IS/AAR和血浆CK-MB的影响(n=8,
 ±s)
±s)
Tab.1 Effect of S1P on IS/AAR and serum creatine kinase-MB(CK-MB) after ischemia-reperfusion injury(n=8,
 ±s)
±s)
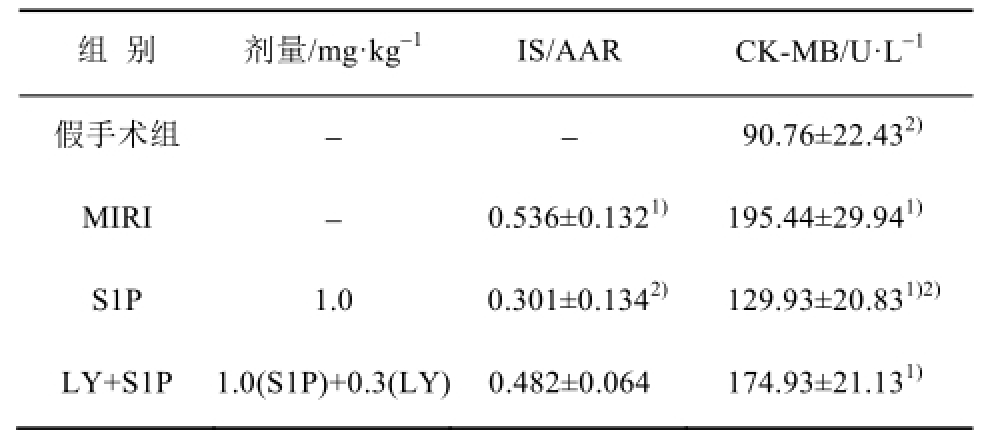
注:与假手术组比较,
1)P<0.01;与MIRI组比较,
2)P<0.01。
Note: Compared with control group,
1)P<0.01; compared with MIRI group,
2)P<0.01.
2.2 S1P对心肌细胞凋亡的影响
与假手术组比较,MIRI组凋亡细胞数量明显增加(P<0.01);而S1P可降低心肌细胞凋亡指数,与MIRI组比较具有显著性差异(P<0.01)。LY294002预处理可抑制S1P降低凋亡细胞的作用,与MIRI组比较,无显著性差异。结果见图1。

图1 S1P对心肌缺血再灌注损伤大鼠心肌凋亡的影响(400×)
与假手术组比较,
1)P<0.01;与MIRI组比较,
2)P<0.01。
Fig.1 Effect of S1P on apoptosis of myocardium after ischemia-reperfusion injury (400×)
Compared with control group,
1)P<0.01; compared with MIRI group,
2)P<0.01.
2.3 S1P对心肌细胞Akt、GSK3β磷酸化以及cleaved capase-3水平的影响
各组间总Akt以及总GSK3β水平无显著性差异。与假手术组比较,MIRI组磷酸化Akt水平无显著性差异。而S1P可明显增加p-Akt,与假手术组比较,具有显著性差异(P<0.01)。此外LY294002可减弱S1P引起的Akt磷酸化的增加,与S1P组及MIRI组比较,具有显著性差异(P<0.01)。
GSK3β磷酸化水平检测显示,与假手术组比较,MIRI组p-GSK3β水平明显增高(P<0.05)。S1P可明显增加p-GSK3β水平,与假手术组比较,具有显著性差异(P<0.01),而LY294002可部分抑制S1P对p-GSK3β的作用,与S1P组及MIRI组比较,差异有统计学意义(P<0.01)。结果见图2。

图2 S1P对心肌Akt和GSK3β磷酸化的影响(n=6,
 ±s)
±s)
与假手术组比较,
1)P<0.01,
2)P<0.05;与MIRI组比较,
3)P<0.01;与S1P组比较,
4)P<0.01。
Fig.2 Effects of S1P on Akt and GSK3β phosphorylation in rat hearts(n=6,
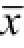 ±s)
±s)
Compared with control group,
1)P<0.01,
2)P<0.05; compared with MIRI group,
3)P<0.01; compared with S1P group,
4)P<0.01.
与假手术组比较,MIRI组cleaved caspase-3水平明显增加(P<0.01),S1P可阻断MIRI所致的cleaved caspase-3增加,与MIRI组比较,具有显著性差异(P<0.01)。此外,LY294002预处理可抑制S1P对caspase-3的作用,与S1P组比较,具有显著性差异(P<0.05)。结果见图3。
2.4 S1P对心肌细胞线粒体Cyt-C释放的影响
与假手术组比较,MIRI组心肌细胞胞浆Cyt-C水平明显增加(P<0.01),而线粒体Cyt-C水平显著下降(P<0.01)。S1P可抑制Cyt-C由线粒体至胞浆的释放,可降低胞浆Cyt-C,增加线粒体Cyt-C水平,与MIRI组比较,具有显著性差异(P<0.01),而该作用可为LY294002所逆转,结果见图3。
心肌缺血再灌注损伤过程中,细胞死亡形式主要包括2种:细胞凋亡和坏死 [8]。有其他实验研究证实,S1P对内皮细胞放射损伤具有抗凋亡作用 [9]。本研究在证实S1P具有缩小心肌梗死面积、降低CK-MB活性的前提下,主要观察了S1P对细胞凋亡的影响,并进一步探索了其抗细胞凋亡机制。TUNEL检测证实,S1P可明显降低MIRI诱导的细胞凋亡,具有一定的抗凋亡作用。

图3 S1P对心肌Cleaved caspase 3及Cyt-C易位的影响(n=6,
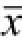 ±s)
±s)
与假手术组比较,
1)P<0.05,
2)P<0.01;与MIRI组比较,
3)P<0.05,
4)P<0.01;与S1P组比较,
5)P<0.05,
6)P<0.01。
Fig.3 Effects of S1P on caspase-3 cleavage and Cyt-C translocation in rat hearts(n=6,
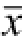 ±s)
±s)
Compared with control group,
1)P<0.05,
2)P<0.01; compared with MIRI group,
3)P<0.05,
4)P<0.01; compared with S1P group,
5)P<0.05,
6)P<0.01.
多数研究认为RISK信号通路和生存活化因子增强通路(survivor activating factor enhancement pathway,SAFE)可能在药物抗MIRI损伤作用中发挥一定的作用 [10]。本实验室前期研究已证实SAFE通路与S1P抗心肌缺氧复氧损伤作用有关 [6]。本次研究主要观察RISK通路在S1P心肌保护作用中的影响。实验结果显示S1P可明显增加p-Akt,提示S1P可活化RISK通路。为进一步证实RISK通路活化与S1P心肌保护作用有关,采用了PI3K抑制剂LY294002,研究显示LY294002可抑制S1P引起的Akt磷酸化增加,并减弱S1P诱导的心肌保护作用。提示RISK信号通路活化在S1P抗MIRI损伤中发挥重要作用。
GSK3β是RISK信号通路下游的关键靶点,有研究报道,白藜芦醇、舒芬太尼等药物可增加GSK3β磷酸化进而减少心肌梗死范围 [11],提示GSK3β磷酸化与心肌保护作用有关。与其他实验室研究结果相似,本研究证实S1P亦可增加GSK3β磷酸化,且此作用可为LY294002所阻断,提示S1P可通过PI3K/Akt/GSK3β通路发挥心肌保护作用。
线粒体为细胞氧化磷酸化的主要位点,在MIRI损伤引起的细胞坏死和凋亡过程中发挥着关键作用。在生理状态,线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)处于关闭状态,再灌注损伤早期,钙超负荷、氧化应激等因素可刺激mPTP开放 [12-13]。mPTP开放可进一步导致线粒体肿胀,线粒体破坏,Cyt-C由线粒体释放入胞浆,进而激活caspase家族,诱导细胞凋亡 [14]。本实验研究结果显示S1P可抑制MIRI诱导的Cyt-C释放以及caspase-3活化,该作用亦可为LY294002所阻断。
综上所述,本研究结果提示S1P可通过抑制线粒体Cyt-C释放、减少caspase激活,减弱MIRI所致心肌细胞凋亡以及心肌梗死,该作用与PI3K/Akt/GSK3β信号通路活化有关。
REFERENCES
[1] HEUSCH G. Cardioprotection: chances and challenges of its translation to the clinic [J]. Lancet, 2013, 381(9861): 166-175.
[2] XIA J G, XU F F, QU Y, et al. Atorvastatin post-conditioning attenuates myocardial ischemia reperfusion injury via inhibiting endoplasmic reticulum stress-related apoptosis [J]. Shock, 2014, 42(4): 365-371.
[3] CHEN D, CHENG B, ZHOU H Y, et al. The effect of sevoflurane postconditioning on cardioprotection against ischemia-reperfusion injury in rabbits [J]. Mol Biol Rep, 2012, 39(5): 6049-6057.
[4] YATOMI Y, OHMORI T, RILE G, et al. Sphingosine 1-phosphate as a major bioactive lysophospholipid that is released from platelets and interacts with endothelial cells [J]. Blood, 2000, 96(10): 3431-3438.
[5] ZHANG G, XU S, QIAN Y, et al. Sphingosine-1-phosphate prevents permeability increases via activation of endothelial sphingosine-1-phosphate receptor 1 in rat venules [J]. Am J Physiol Heart Circ Physiol, 2010, 299(5): H1494-H1504.
[6] WANG Y, WANG D, ZHANG L, et al. Role of JAK-STAT pathway in reducing cardiomyocytes hypoxia/reoxygenation injury induced by S1P postconditioning [J]. Eur J Pharmacol, 2016(784): 129-136.
[7] HAUSENLOY D J, YELLON D M. New directions for protecting the heart against ischemia-reperfusion injury: targeting the reperfusion injury salvage kinase (RISK)-pathway [J]. Cardiovasc Res, 2004, 61(3): 448-460.
[8] GOTTLIEB R A, BURLESON K O, KLONER R A, et al. Reperfusion injury induces apoptosis in rabbit cardiomyocytes [J]. J Clin Invest, 1994, 94(4): 1621-1628.
[9] BONNAUD S, NIAUDET C, LEGOUX F, et al. Sphingosine-1-phosphate activates the AKT pathway to protect small intestines from radiation-induced endothelial apoptosis [J]. Cancer Res, 2010, 70(23): 9905-9915.
[10] KALAKECH H, HIBERT P, PRUNIER-MIREBEAU D, et al. RISK and SAFE signaling pathway involvement in apolipoprotein A-I-induced cardioprotection [J]. PLoS One, 2014, 9(9): e107950. Doi: 10.1371/journal.pone.0107950.
[11] WU Q L, SHEN T, MA H, et al. Sufentanil postconditioning protects the myocardium from ischemia-reperfusion via PI3K/Akt-GSK-3β pathway [J]. J Surg Res, 2012, 178(2): 563-570.
[12] ONG S B, SAMANGOUEI P, KALKHORAN S B, et al. The mitochondrial permeability transition pore and its role in myocardial ischemia reperfusion injury [J]. J Mol Cell Cardiol, 2015(78): 23-34.
[13] ERTRACHT O, MALKA A, ATAR S, et al. The mitochondria as a target for cardioprotection in acute myocardial ischemia [J]. Pharmacol Ther, 2014, 142(1): 33-40.
[14] PARK S S, ZHAO H, MUELLER R A, et al. Bradykinin prevents reperfusion injury by targeting mitochondrial permeability transition pore through glycogen synthase kinase 3beta [J]. J Mol Cell Cardiol, 2006, 40(5): 708-716.
Effects of Sphingosine-1-phosphate on Apoptosis Induced by Myocardial Ischemia-reperfusion Injury and Its Correction with PI3K/Akt/GSK3β Pathway
LI Wenchang 1, MA Xiaoqian 1, LI Yujing 1, ZHANG Lizhi 2, LI Mengmeng 1, FANG Rui 1, WEN Ke 1*(1.Department of Pharmacology, School of Basic Medical Sciences, Tianjin Medical University, Tianjin 300070, China; 2.Department of Obstertrics and Gynecology, Tianjin First Center Hospital, Tianjin 300192, China)
ABSTRACT:OBJECTIVE To investigate the effect of sphingosine 1-phosphate (S1P) on cell apoptosis induced by myocardial ischemia/reperfusion injury(MIRI), and its correlation with PI3K/Akt/GSK3β pathway. METHODS Rats were subjected to MIRI, consisting of 30 min of ischemia followed by 120 min of reperfusion. Myocardial infarct size and apoptotic index were measured by triphenyltetrazolium (TTC) and terminal deoxynucleotide transferase dUTP nick-end labeling (TUNEL) assays, respectively. Plasma CK-MB activity was measured by enzyme linked immunosorbent assay. Akt and GSK3β phosphorylation, caspase-3 cleavage, and cytochrome C translocation were assessed by western blot. RESULTS S1P significantly decreased myocardial infarct size and apoptosis, as well as enhanced Akt and GSK3β phosphorylation, attenuated caspase-3 cleavage and cytosolic cytochrome C translocation. Moreover, the protective effects of S1P treatment were blocked by cotreatment with a PI3K inhibitor, LY294002. CONCLUSION S1P can inhibit the release of mitochondrial cytochrome C, block activation of caspase-3, relieve cellular apoptosis and myocardial infarction. And these effects are mediated by activation of PI3K/Akt/GSK3β pathway.
KEY WORDS:sphingosine 1-phosphate; myocardial ischemia/reperfusion injury; apoptosis; PI3K/Akt
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2017)02-0151-05
DOI:10.13748/j.cnki.issn1007-7693.2017.02.001
收稿日期:2016-09-11
基金项目:国家自然科学基金项目(81173058,81502419),天津市大学生创新创业训练计划项目(201610062021)
作者简介:李文畅,女,硕士生,研究实习员 Tel: 15222152061 E-mail: lanyu_ziqi@163.com *
通信作者:温克,男,博士,副教授 Tel: (022)83336835 E-mail: kewencn@163.com