表1 甲磺酸多沙唑嗪2种晶型粉末特征衍射峰值表
Tab.1 XRPD peak values of 2 forms of doxazosin mesylate

胡 帆,李 煜,陈 悦 *(浙江省食品药品检验研究院,杭州 310052)
摘要:目的 研究甲磺酸多沙唑嗪晶型特征,为多晶型研究提供实验依据。方法 采用X射线粉末衍射法(XRPD)、差示扫描量热法(DSC)、热重法(TG)、红外光谱分析(IR)、拉曼光谱分析及溶解性试验对甲磺酸多沙唑嗪晶A型与晶H型进行多晶型研究。结果 获得甲磺酸多沙唑嗪晶A型与晶H型的表征图谱。结论 X射线粉末衍射法、差示扫描量热法与热重法可用于定性区分甲磺酸多沙唑嗪晶A型与晶H型,晶H型溶解度性质优于晶A型。
关键词:甲磺酸多沙唑嗪;晶型表征;粉末X射线衍射;热分析;红外光谱;拉曼光谱;溶解性试验
多晶型(polymorphism)是指由于分子的排列形式及对称规律不同,化合物存在2种或2种以上的不同晶型物质状态。以固体形式存在的医药产品大约占总量的85%以上,普遍存在多晶型现象 [1]。药物的不同晶型可能在理化性质如外观、密度、熔点、溶解度和生理活性等多方面存在显著差异,从而进一步影响药物的安全性、稳定性和有效性。通过多晶型研究,可以保证药物在制备、贮存过程中的晶型和化学稳定性;选择药用优势晶型制备药物,可以改善药物的溶出速度和生物利用度,提高药物的治疗效果,也可能减小毒性 [2-4];根据晶型的特点确定制剂工艺,改善药物粉末的压片性能等,可有效保证生产的药物不同批次间的等效性;通过选择在临床治疗上效果可靠且稳定可控的晶型,可以制备高效、低毒、安全、优质的固体制剂 [5-6]。药物多晶型检测分析技术是指能把因晶型不同而带来的理化性质差异显现出来并结合到多晶型研究中的技术。目前常用的药物多晶型检测分析技术主要用于以下几个方面:①晶型物质鉴别,②晶型纯度评价,③晶型质量控制,通过药物多晶型检测分析技术最终达到正确认识晶型物质状态,建立对应的评价方法与标准 [7]。
甲磺酸多沙唑嗪是目前常用于治疗原发性高血压的α 1-肾上腺受体阻滞剂,对于单独用药难以控制血压的患者,与利尿剂、钙拮抗剂或血管紧张素转化酶抑制剂(ACEI)合用可有较好的治疗效果。欧洲药典8.8与英国药典2015版中均明确提出甲磺酸多沙唑嗪有多晶型现象,国内外文献与专利报道 [8-9]表明,甲磺酸多沙唑嗪存在7种晶态晶型及1种无定型,晶态晶型分别命名为晶A、D、E、F、G、H和I型。
D8 Advance X射线粉末衍射仪(德国BRUKER公司);Q5000型热重分析仪(美国TA公司);DSC1型热重分析仪(瑞士Mettler Toledo公司);Nicolet 6700红外分光光度计(美国Thermo公司);MS2000型激光粒度仪(英国马尔文公司);inVia Reflex型激光显微拉曼光谱仪(英国雷尼绍公司)。
甲磺酸多沙唑嗪(中国食品药品检定研究院,批号:100566-200401);甲磺酸多沙唑嗪原料药(新东港药业股份有限公司,批号:20130201);甲磺酸多沙唑嗪原料药(康恩贝制药有限公司,批号:20130201);甲磺酸多沙唑嗪原料药(河南天方药业股份有限公司,批号:20130206);甲磺酸多沙唑嗪原料药(康美药业股份有限公司,批号:20130206)。
2.1 粉末X射线衍射(X-ray powder diffraction,XRPD)分析
2.1.1 扫描条件 采用CuKα辐射配制石墨单色器;扫描管压40 kV;扫描电流40 mA。扫描范围3~40°,扫描速度每步0.2 s,步长0.02°,扫描时间0.1 s。所测定的甲磺酸多沙唑嗪原料药外观均为白色结晶性粉末。取上述厂家的原料药,研磨过100目筛,分别精密称取100 mg样品用于粉末X射线衍射检测分析。
2.1.2 扫描结果 粉末图谱与文献报道数据进行比对后发现:○1河南天方、康恩贝与康美的原料药晶型主成分基本一致,康恩贝原料药为晶A型,其余2个厂家的原料药在相同称样量的条件下,衍射峰强度偏低且峰形弥散,表明含有不同程度的无定型,是以晶A型为主成分含有部分无定型态的混晶。○2新东港及中检院的原料药晶型主成分基本一致,中检院原料药为晶H型,新东港原料药是以晶H型为主成分含有部分无定型态的混晶 [10-11]。2种晶型的粉末衍射特征峰值表见表1,2种晶型的粉末衍射图谱见图1。以下DSC、TG、IR、拉曼及溶解度试验均采用康恩贝高纯原料药作为晶A型样品,中检院高纯原料药作为晶H型样品用于检测。
2.2 差示扫描量热法(differential scanning calorimeter,DSC)
2.2.1 检测条件 仪器采用标准铝与镍进行校正合格,Al 2O 3坩埚称量,实验环境采用氮气保护,升温范围40~300 ℃,升温速率为10 ℃·min -1。
表1 甲磺酸多沙唑嗪2种晶型粉末特征衍射峰值表
Tab.1 XRPD peak values of 2 forms of doxazosin mesylate

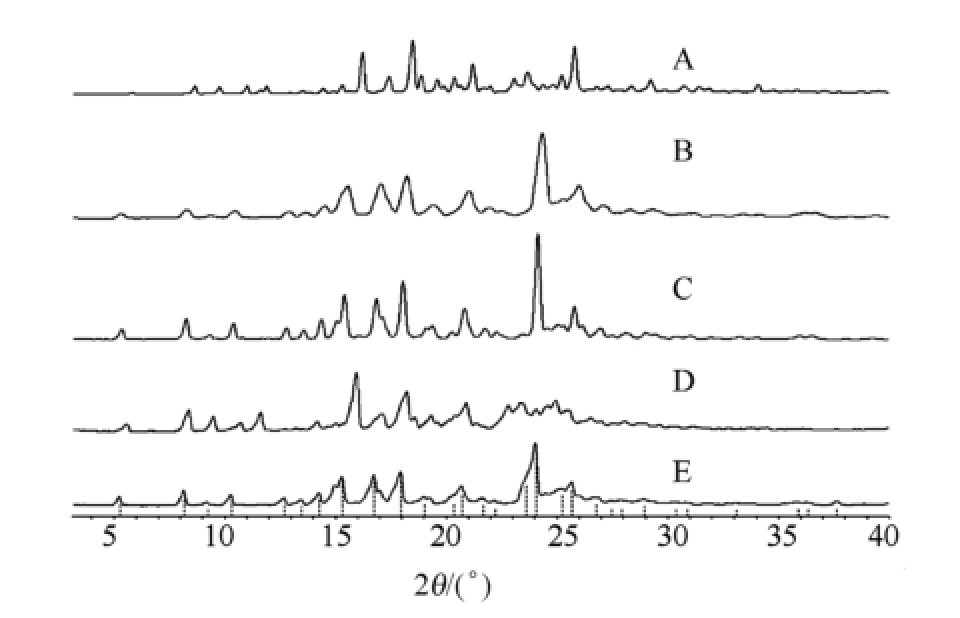
图1 甲磺酸多沙唑嗪原料药粉末衍射图谱
厂家:A-中国食品药品检定研究院;B-河南天方药业股份有限公司;C-康恩贝制药有限公司;D-新东港药业股份有限公司;E-康美药业股份有限公司。
Fig.1 The XRPD patterns of doxazosin mesylate raw material
Manufactor: A-National Institutes for Food and Drug Control; B-Topfond Pharmaceutical Company Limited; C-CONBA Pharmaceutical Company Limited; D-Neo-Dankong Pharmaceutical Company Limited; E-Kangmei Pharmaceutical Company Limited.
2.2.2 检测结果 前期研究表明厂家采用甲醇为重结晶溶剂,残留溶剂未检出,因此可以排除有机溶剂的干扰,确定样品的吸热过程来源于吸附或结晶水的影响。DSC实验结果表明,甲磺酸多沙唑嗪2种晶型在热力学性质上存在差异,晶A型在83.21 ℃存在峰形延展的吸附水峰,273.88 ℃为峰形尖锐的吸热熔融峰;晶H型仅在128.98 ℃存在1个吸热峰,提示该温度下可能发生晶型的转变。2种晶型的DSC图谱见图2。

图2 甲磺酸多沙唑嗪2种晶型DSC图谱
A-晶A型;H-晶H型。
Fig.2 The DSC figures of 2 forms of doxazosin mesylate
A-form A; H-form H.
2.3 热重分析(thermo-gravimetric analysis,TG)
2.3.1 检测条件 仪器采用标准铝与镍进行校正合格,Al 2O 3坩埚称量,平铺坩埚底部1/3高度,升温范围30~260 ℃,升温速率为10 ℃·min -1。
2.3.2 检测结果 实验温度设置为40~260 ℃,未到达甲磺酸多沙唑嗪的熔融分解温度,因此该温度下的失重台阶来源于样品中的吸附或结晶水。热重实验结果表明,不同晶型结合的水分含量与形式差异较大,晶A型样品约含有0.5分子结晶水,晶H型约含有1分子水,2种晶型的失重台阶温度分别为83.34 ℃、92.31 ℃,结合DSC实验结果进一步证明晶A型中所含水分为吸附水,晶H型中所含水分为结晶水,2种晶型的热重分析结果见表2,2种晶型的TG图谱见图3。
表2 甲磺酸多沙唑嗪2种晶型TG热分析结果
Tab.2 TG results of 2 forms of doxazosin mesylate
2.4 红外光谱分析(infrared radiation,IR)
2.4.1 检测条件 采用溴化钾压片法;光谱扫描范围4 000~650 cm -1;分辨率4.000 cm -1;扫描次数32次。

图3 甲磺酸多沙唑嗪2种晶型热重图谱
A-晶A型;H-晶H型。
Fig.3 The TGA curves of 2 forms of doxazosin mesylate
A-form A; H-form H.
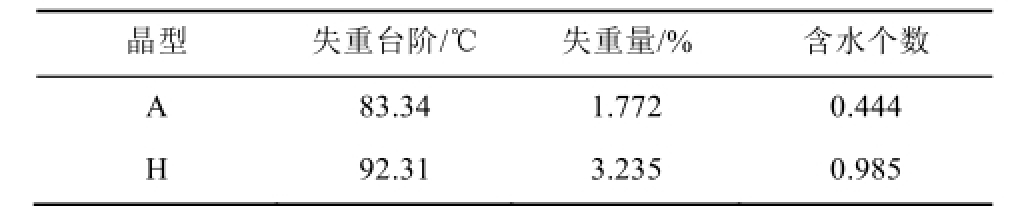
2.4.2 检测结果 由多晶型引起的化合物红外图谱差异主要是由于结晶溶剂或结晶水数量、连接方式及作用强弱的影响。实验结果表明甲磺酸多沙唑嗪晶A型与晶H型在红外光谱图上无显著差异,因此采用红外光谱无法定型鉴别上述2种晶型。2种晶型的红外图谱如图4所示。
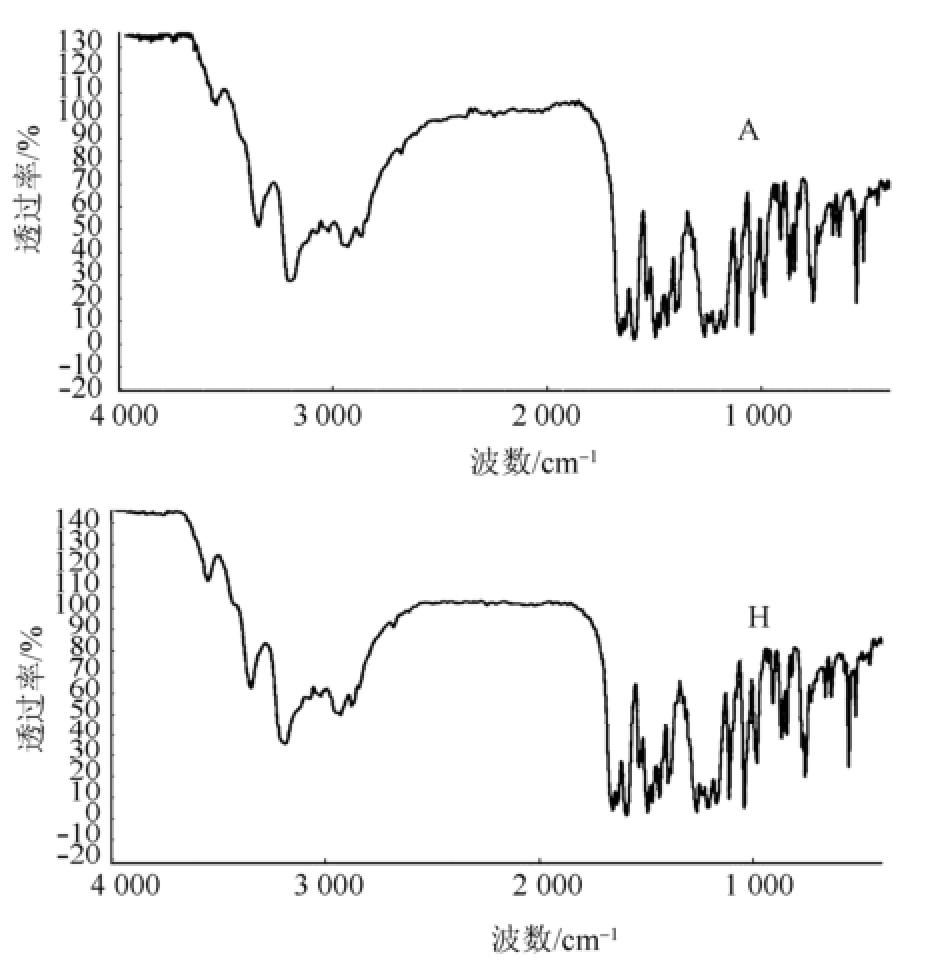
图4 甲磺酸多沙唑嗪2种晶型红外图谱
A-晶A型;H-晶H型。
Fig.4 The IR spectra of 2 forms of doxazosin mesylate
A-form A; H-form H.
2.5 拉曼光谱分析
2.5.1 检测条件 配有半导体致冷型CCD检测器,横向空间分辨率为1 cm -1,纵向空间分辨率为2 cm -1,光谱范围100~4 000 cm -1,光谱分辨率为1 cm -1。以532 nm激光光源,每毫米1 800刻线光栅,激光功率10%,曝光时间1 s,连续扫描1次,20×物镜,扫描范围100~3 200 cm -1分别测定甲磺酸多沙唑嗪晶A型与晶H型的拉曼光谱,各测6次,取平均光谱作为分析对象。
2.5.2 检测结果 拉曼光谱对于分子晶格的低频振动可有效检测,且具有非破坏的特点,近年来逐渐应用于晶型研究中 [12]。甲磺酸多沙唑嗪2种晶型的拉曼光谱显示,晶A型与晶H型在激光拉曼中吸收位置和相对强度均基本一致,主要吸收带在1 400~1 500 cm -1处,在激光拉曼光谱中2种晶型未显示出区别,因此无法采用拉曼光谱法对甲磺酸多沙唑嗪2种晶型进行定性鉴别。2种晶型的拉曼图谱见图5。
图5 甲磺酸多沙唑嗪2种晶型拉曼图谱
A-晶A型;H-晶H型。
Fig.5 The Raman spectra of 2 forms of doxazosin mesylate
A-form A; H-form H.
2.6 溶解性试验
2.6.1 溶酶系统 0.1 mol·L -1盐酸溶液、pH为4.5的醋酸缓冲液、pH为6.5的磷酸缓冲液、水、0.2% SDS溶液及0.5%SDS溶液。
2.6.2 检测条件 精密称取甲磺酸多沙唑嗪的2种晶型样品各5 mg,置于100 mL三角锥形瓶中,定量加入75 mL溶媒,于(37±2)℃下在振荡器里强力振摇,分别于10,20,30,60,120,180,240 min取样,过滤,取续滤液,按照紫外-可见分光光度法,在246 nm的波长处测定吸光度 [13]。
2.6.3 检测结果 6种溶媒系统在240 min内吸光度最大处为100%,其余点各自转换为百分比,以时间为横坐标,吸光度为纵坐标分别绘制溶解度曲线,进行不同晶型样品的溶解性质比较。甲磺酸多沙唑嗪2种晶型在6种溶剂系统中表现出不同溶解效率,其中以0.5%SDS溶液中的溶解百分率最高。在上述6种溶媒系统中,晶H型溶解含量百分比均高于晶A型,甲磺酸多沙唑嗪2种晶型的溶解速率曲线见图6。
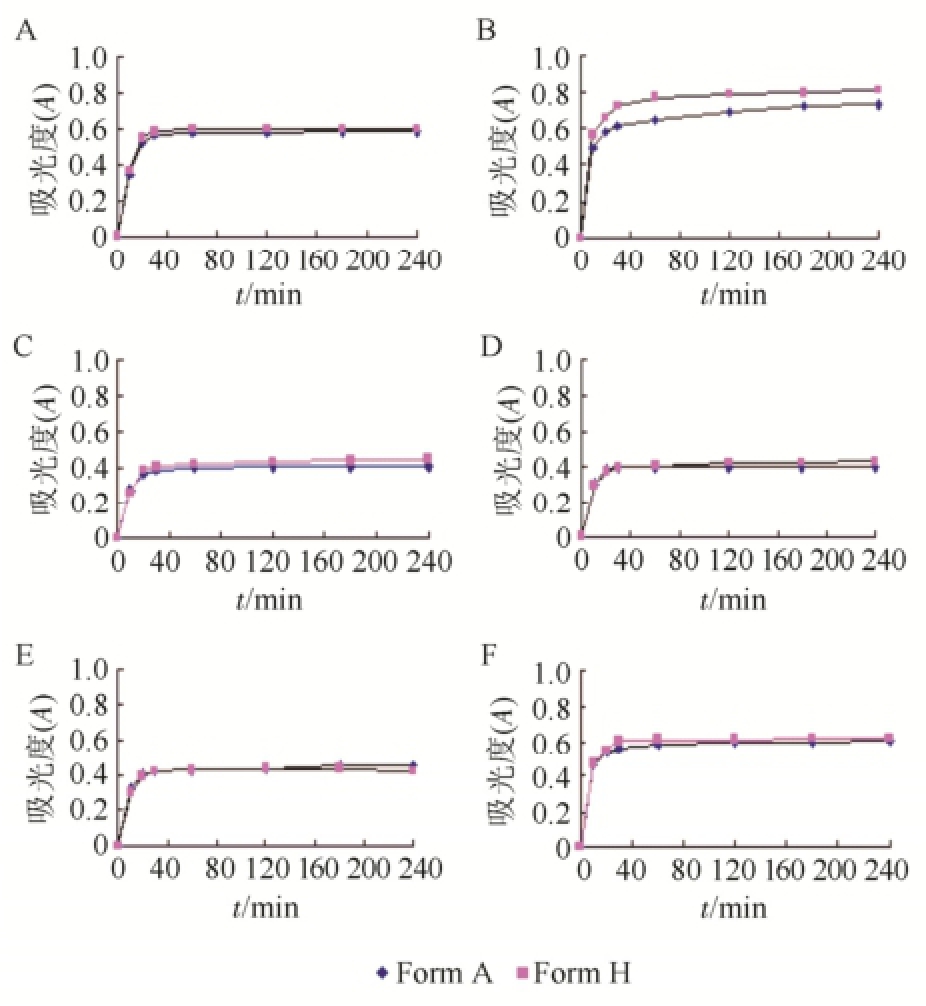
图6 甲磺酸多沙唑嗪2种晶型溶解度图
A-0.1 mol·L
-1HCl;B-pH 4.5醋酸缓冲液;C-pH 6.5磷酸缓冲液;D-水;E-0.2% SDS溶液;F-0.5% SDS溶液。
Fig.6 The dissolution test curves of two forms of doxazosin mesylate
A-0.1 mol·L
-1HCl solution; B-pH 4.5 buffer; C-pH 6.5 buffer; D-water; E-0.2% SDS solution; F-0.5% SDS solution.
药物的质量控制除了包含一般化学药物的质量控制要求外,还应增加对晶型物质种类与晶型物质含量的控制指标。具体来说,晶型药物的质量控制应包括:①原料药晶型种类与含量的质量控制;②制剂中原料药晶型种类与含量的质量控制;③固体制剂中辅料的质量控制。本研究结果显示,2种晶型在体外模拟实验中表现出明显差异,表明甲磺酸多沙唑嗪的多晶型现象对其生物利用度存在影响。选择溶解性质更好的晶H型作为优势药用晶型,可以提高难溶性药物的药效。目前检测到的常用晶型为晶A型与晶H型,根据本研究结果,可从2种晶型的粉末图谱中选择易于识别的,特征性强的,不受到辅料组分峰强度干扰的衍射峰用于甲磺酸多沙唑嗪原料药与制剂中晶型含量的定量检测 [14],达到有效控制药物的晶型质量,保障药品质量稳定性和用药安全,实现最佳的药物临床治疗效果的目的。
REFERENCES
[1] 吕扬, 杜冠华. 固体化学药物的优势药物晶型[J]. 中国药学杂志, 2010, 45(1): 5-10.
[2] SUN L L, ZOU Q G, ZHANG Z J. Study on polymorphism of Agomelatine [J]. West Chin J Pharm Sci(华西药学杂志), 2012, 27(5): 533-536.
[3] CHEN G L, LI J C, PENG X S, et al. Drug polymorphism and related quality control [J]. Chin J Pharm Anal(药物分析杂志), 2012, 32(8): 1503-1508.
[4] 吕扬, 杜冠华. 晶型药物[M].北京: 人民卫生出版社, 2009: 49-50.
[5] MAO L, ZHENG Q T, LV YANG. Progress on the study of solid drug polymorphism [J]. Nat Prod Res Dev(天然产物研究与开发), 2005, 117(3): 371-375.
[6] CHIENG N, RADES T, AALTONEN J. An overview of recent studies on the analysis of pharmaceutical polymorphs [J]. J Pharm Biomed Anal, 2011, 55(4): 618-644.
[7] SHAH B, KAKUMANU V K, BANSAL A K. Analytical techniques for quantification of amorphous/crystalline phases in pharmaceutical solids [J]. J Pharm Sci, 2006, 95(8): 1641-1665.
[8] RAJENDRA N K, DHARMARAJ R R, MANISH G G. Crystalline polymorph of doxazosin mesylate (form IV) and process for preparation thereof: United States, US 8383627 [P]. 2013-2-26
[9] YOUNG T S, YOON H L. Polymorphism of doxazosin mesylate [J]. Arch Pharm Res, 2005, 28(6): 730-735.
[10] THOTA G, REGURI B R, CHAKKA R. Methods for the preparation of polymorphs of doxazosin mesylate: United States , US 6399775 [P]. 2012-06-04.
[11] PETER K, MACRO T, DIETER H. Conversion of modification D to modification A of doxazosin mesylate: United States , US 6500830 [P]. 2002-12-31
[12] LIN L, LI X D, DING L X, et al. Polymorphism analysis of Fluconazole by Raman Spectroscopy [J]. Chin Pharm J(中国药学杂志), 2012, 47(11): 915-919.
[13] 中国药典. 四部[S]. 2015: 38-40.
[14] LI Y, HU F, CHEN Y, et al. Quantitative analysis of crystal type content in doxazosinmesylate tablets by powder x-ray diffraction [J]. PTCA(Part B: Chem Anal)(理化检验-化学分册), 2015(51): 22-24.
Characterization Study of Polymorphism of Doxazosin Mesylate
HU Fan, LI Yu, CHEN Yue *(Zhejiang Institute for Food and Drug Control, Hangzhou 310052, China)
ABSTRACT:OBJECTIVE To study the characterization of doxazosin mesylate forms and provide polymorphic research material. METHODS Characterization spectrum of form A and form H of doxazosin mesylate were detected by X-ray powder diffraction(XRPD), differential scanning calorimeter(DSC), thermo-gravimetric analysis(TG), infrared radiation(IR), Raman spectra analysis and dissolution test. RESULTS Characterization figures of form A and form H were obtained. CONCLUSION Form A and form H show difference in XRPD, DSC and TG patterns, form H has better performance in dissolution test.
KEY WORDS:doxazosin mesylate; polymorphic characterization; X-ray powder diffraction; thermal analysis; infrared radiation; Raman spectra; dissolution test
中图分类号:R914.1
文献标志码:B
文章编号:1007-7693(2017)02-0242-05
DOI:10.13748/j.cnki.issn1007-7693.2017.02.019
收稿日期:2016-8-31
作者简介:胡帆,女,博士,主管药师 Tel: (0571)87180322 E-mail: hufan@zjyj.org.cn *
通信作者:陈悦,男,硕士,主任药师 Tel: (0571)86459458 E-mail: chenyue@zjyj.org.cn