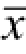 ±s表示,P<0.05为差异具有统计学意义。
±s表示,P<0.05为差异具有统计学意义。
邵益丹,史婷婷,赵艳梅,潘旭旺,琚立萍,张 晶,庄让笑 *(杭州市西溪医院,杭州 310023)
摘要:目的 研究乙酰半胱氨酸(N-acetylcysteine,NAC)对游离脂肪酸(free fatty acid,FFA)诱导的L02细胞的非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)模型的炎症反应和胰岛素抵抗的活性。方法 用FFA处理L02细胞,建立NASH细胞模型;MTT法检测NAC对细胞生长抑制率的影响,并依此优选3个安全给药浓度;油红染色法观察细胞内的脂质沉积情况;Elisa法检测细胞的IL-8、TNF-α和葡萄糖转运蛋白-4(glucose transporter,GLUT-4)含量;Western blot及Elisa法检测细胞的胰岛素受体(insulin receptor,IR)含量。结果 NAC在10 600.0 μg·mL -1的最大给药浓度时其细胞生长抑制率仅为34.10%,因此设定100,150和250 μg·mL -13个给药浓度;NAC各给药组较模型组82.45%的细胞脂变率,分别下降至61.77%,68.08%和79.28%,差异具有统计学意义(P<0.01)且呈浓度依赖性;NAC各给药组的GLUT-4和IR含量较模型组均显著提高(P<0.01);NAC各给药组的TNF-α和IL-8含量较模型组均显著下降(P<0.01)。结论 NAC的细胞毒性极小,可不同程度地降低NASH细胞的脂变率,尤其可改善模型细胞的胰岛素抵抗及炎症反应水平,表现出在治疗NASH方面的潜在价值。
关键词:乙酰半胱氨酸;非酒精性脂肪性肝炎;胰岛素抵抗;炎症反应
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种代谢综合症相关的肝脏疾病,其中的非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)的患病率逐渐超过酒精性肝病和病毒性肝炎而受到研究者的重视。NASH病例中可切除性胆管癌的比例高达20%,而儿童患NAFLD的比例亦高达2.6%~9.6% [1-2]。NASH的病理变化包括肝细胞脂肪变及炎性反应 [3],且后者可导致不可逆的肝损伤。因此,炎性反应的触发作为非酒精性脂肪性肝病进展过程中的关键点,对整个疾病的进程起到至关重要的作用。“二次打击”学说认为,过量脂质沉积导致的肝脂肪变和氧化应激/脂质过氧化损伤是NASH发生发展的主要机制 [4]。有研究表明,氧化应激可引起胰岛β细胞功能衰退及胰岛素抵抗 [5]。肝细胞过量脂质沉积和脂质过氧化与产生胰岛素抵抗密切相关 [4],而抗氧化治疗可以改善这一过程 [6]。
乙酰半胱氨酸(N-acetylcysteine,NAC)为人体内合成谷胱甘肽(GSH)的前体物质,具有很强的清除氧自由基作用,对肝脏的脂质过氧化损伤和炎症反应具有保护作用,进而减缓肝纤维化过程 [7-8];有研究显示,NAC能够对活性氧(ROS)产生应答反应,间接通过增加细胞内GSH水平和(或)作为-SH还原剂阻止人胰淀素诱发的细胞凋亡来调控细胞氧化还原反应 [9]。上述结果提示NAC具有较好的抗炎和抗氧化应激作用,在治疗NASH方面具有潜在价值。
NASH的发生和发展过程中伴随着胰岛素抵抗、炎症因子上调等现象,致使肝实质细胞脂肪变性、炎症细胞浸润和肝细胞坏死等 [10-12]。目前多数有关NAC治疗NASH的研究建立于大鼠体内模型之上,给药时NAC在消化道和肝脏中易受首过效应和复杂的体内环境干扰,从而降低其生物利用度和药理活性;而利用NASH细胞模型观察NAC在炎症和胰岛素抵抗方面的体外活性,仍鲜有报道。本研究利用FFA诱导的人体正常肝脏L-02细胞的NASH模型 [13]来研究NAC对该模型脂质沉积、葡萄糖转运蛋白-4(glucose transporter,GLUT-4)、TNF-α、IL-8和胰岛素受体(insulin receptor,IR)含量的影响,探讨其在抗NASH方面的作用,可为该领域的研究提供一定的基础。
1.1 试剂
NAC(武汉远大弘元药业股份有限公司,批号:20141001);DMEM培养基(Hyclone公司);胎牛血清(FBS)(BI公司);二甲基亚砜(DMSO) (Invitrogen公司);十二烷基磺酸钠(SDS)(Biosharp公司);噻唑蓝(MTT)、油红、棕榈油、油酸(Sigma公司);BCA蛋白定量试剂盒(批号:4A500150)、RIPA裂解液、PMSF (北京鼎国生物技术有限公司);L02细胞系(上海诺辰生物技术有限公司);胰岛素受体试剂盒(E-EL-H0452,批号:AK0014AUG01001)、葡萄糖转运蛋白-4试剂盒(E-EL-H1825,批号:AK00140EC27006)、TNF-α试剂盒(E-EL-H0109,批号:AK0014JUL21010)、IL-8试剂盒(E-EL-H0048,批号:AK0014JUL21003)(Elabscience公司);IR抗体(ab137747)(Abcam公司)。
1.2 仪器
Thermo Scientific 8000细胞培养箱(美国Thermo公司)、MK3型酶标检测仪(Thermo Scientific公司)、BOXUN X-25超净工作台(上海博迅实业有限公司)、TDZ4B-WS低速离心机(上海卢湘仪)、XDS-1A光学显微镜(上海精密科学仪器有限公司)、DMI3000B倒置拍照显微镜(莱卡)、垂直电泳仪(上海天能科技有限公司)。
2.1 细胞培养
取冻存的L02细胞株37 ℃快速解冻,1 000 r·min -1离心5 min,用DMEM培养液清洗2次,加入DMEM基础培养基重悬、离心后加入DMEM完全培养基,于37 ℃,5%CO 2条件下进行培养并观察细胞模型生长状况,备用。
2.2 NASH模型
细胞浓度1×10 5·mL -1,每孔100 μL接种于96孔板,37 ℃,5%CO 2条件培养24 h,待80%细胞黏连,加入FFA(按棕榈酸︰油酸=1︰2制成500 μmol·L -1的浓度)作用24 h,建立NASH细胞模型。
2.3 MTT法测试化合物对细胞生长抑制率的影响
设空白组、模型组(FFA组)和给药组(10 600,3 533.3,1 177.8,392.6,130.9,43.6,14.5 μg·mL -1,每孔200 μL的NAC溶液,DMSO︰DMEM=0.1︰9.9),空白组、模型组和给药组每个浓度设3个复孔;给药48 h后,每孔加入15 μL MTT,于37 ℃,5%CO 2条件避光孵育3 h;离心后吸净孔内液体,每孔加200 μL DMSO,摇床室温震荡10 min,用酶标仪测定492 nm处吸光度(OD值),据此计算细胞生长抑制率。
2.4 油红染色法测试化合物对细胞脂变率的影响
建立模型,按3个浓度给药,每个浓度3个复孔;72 h后进行油红染色:PBS溶液清洗细胞3次,4%多聚甲醛固定10 min;再用PBS溶液清洗细胞2次,60%异丙醇漂洗1 min;室温下油红染色10 min,加入蒸馏水终止;光镜下可见细胞内红色中性脂滴。
2.5 Elisa法测试细胞上清液GLUT-4、TNF-α和IL-8含量
给药方法同上,NAC分别作用24和48 h后,3 000 r·min -1低温离心培养液,取上清液,检测GLUT-4、TNF-α和IL-8含量。
2.6 Western-blot和Elisa法测试细胞IR含量
给药方法同上,NAC作用48 h后,3 000 r·min -1低温离心细胞裂解液,取上清液,检测IR含量。
2.7 数据处理
用Image J软件处理油红染色结果并计算细胞脂变率;用Curve Expert1.34软件处理MTT和Elisa结果;用SPSS 19.0的“配对样本t检验”对数据进行统计分析,以
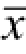 ±s表示,P<0.05为差异具有统计学意义。
±s表示,P<0.05为差异具有统计学意义。
3.1 NAC对细胞生长抑制率的影响
结果显示,NAC作用48 h后,最高给药浓度下的细胞生长抑制率为34.10%。为使受试化合物发挥较为显著的疗效,并最大限度避免细胞毒性对实验结果的影响,本文选择250,150,100 μg·mL -13个给药浓度进行后续试验。结果见图1。

图1 细胞生长抑制率
Fig.1 Ratio of cell growth inhibition
3.2 NAC对NASH细胞模型脂质沉积情况的影响
结果显示,各给药组细胞脂变率均较模型组低,且差异具有统计学意义(P<0.01);高、中浓度组之间差异具有统计学意义(P<0.05);中、低浓度组之间,高、低浓度组之间脂变率的差异同样具有统计学意义(P<0.01)。结果见图2。
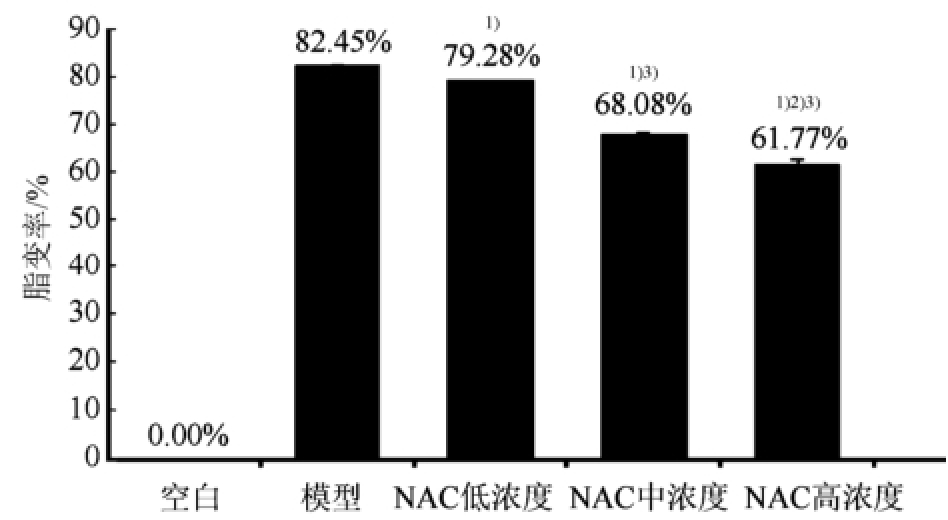
图2 细胞脂变率
与模型组相比,
1)P<0.01;与中浓度组比较,
2)P<0.05;与低浓度组比较,
3)P<0.01。
Fig.2 Ratio of steatosis
Compared with model group,
1)P<0.01; compared with medium concentration group,
2)P<0.05; compared with low concentration group,
3)P<0.01.
3.3 NAC对NASH细胞模型GLUT-4、TNF-α和IL-8含量的影响
结果显示,模型组与空白组的GLUT-4、TNF-α和IL-8含量差异明显,具有统计学意义(P<0.01);与模型组相比,各浓度组对各指标的改善较明显,差异具有统计学意义(P<0.01)。
24 h时,与模型组比较,高、中、低浓度组GLUT-4、TNF-α、IL-8均有统计学差异(P<0.01);高浓度组GLUT-4和IL-8的含量相比中浓度组差异具有统计学意义(P<0.05);高、中浓度组GLUT-4、TNF-α和IL-8的含量与低浓度组比较差异有统计学意义(P<0.01)。
48 h时,与模型组比较,高、中、低浓度组GLUT-4、TNF-α、IL-8均有统计学差异(P<0.01);NAC对IL-8含量的影响在高、中浓度组之间差异具有统计学意义(P<0.05);高、中浓度组GLUT-4、TNF-α和IL-8的含量与低浓度组比较差异有统计学意义(P<0.01)。结果见表1~2。
表1 Elisa法检测GLUT-4、TNF-α和IL-8含量(n=3,
 ±s, 24 h)
±s, 24 h)
Tab.1 Content of GLUT-4、TNF-α and IL-8 measured by Elisa(n=3,
 ±s, 24 h)
±s, 24 h)

注:与空白组比较,
1)P<0.01;与模型组比较,
2)P<0.01;与中浓度组比较,
3)P<0.05;与低浓度组比较,
4)P<0.01。
Note: Compared with control group,
1)P<0.01; compared with model group,
2)P<0.01; compared with medium concentration group,
3)P<0.05; compared with low concentration group,
4)P<0.01.
表2 Elisa法检测GLUT-4、TNF-α和IL-8含量(n=3,
 ±s, 48 h)
±s, 48 h)
Tab.2 Content of GLUT-4, TNF-α and IL-8 measured by Elisa(n=3,
 ±s, 48 h)
±s, 48 h)
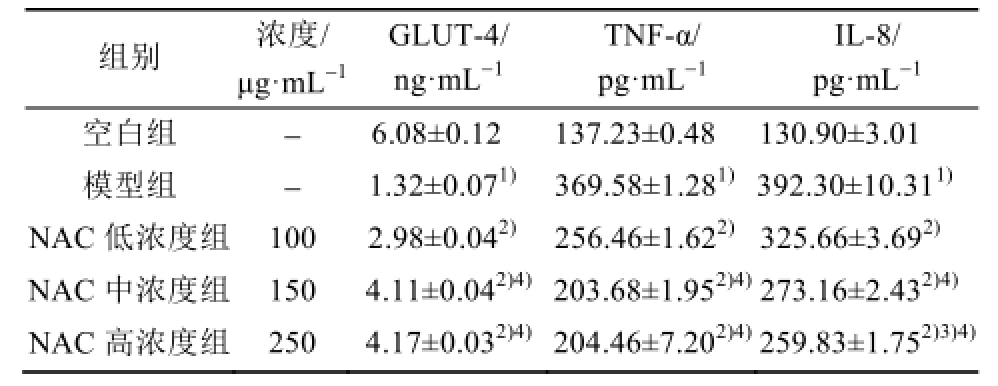
注:与空白组比较,
1)P<0.01;与模型组比较,
2)P<0.01;与中浓度组比较,
3)P<0.05;与低浓度组比较,
4)P<0.01。
Note: Compared with control group,
1)P<0.01; compared with model group,
2)P<0.01; compared with medium concentration group,
3)P<0.05; compared with low concentration group,
4)P<0.01.
3.4 NAC对NASH细胞模型IR含量的影响
IR的Western blot检测结果见图3,由于其组间差异不明显,故进一步开展了Elisa检测。结果显示,模型组与空白组的IR含量差异明显,具有统计学意义(P<0.01);各浓度组对IR含量的改善均较为明显,相比模型组的差异具有统计学意义(P<0.01);高、中浓度组之间差异具有统计学意义(P<0.05);高、中浓度组相比低浓度组差异较明显(P<0.01)。结果见表3。
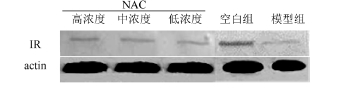
图3 Western blot检测IR结果
Fig.3 Content of IR measured by Western blot
表3 Elisa法测定IR含量(n=3,
 ±s)
±s)
Tab.3 Content of IR measured by Elisa(n=3,
 ±s)
±s)

注:与空白组比较,
1)P<0.01;与模型组比较,
2)P<0.01;与中浓度组比较,
3)P<0.05;与低浓度组比较,
4)P<0.01。
Note: Compared with control group,
1)P<0.01; compared with model group,
2)P<0.01; compared with medium concentration group,
3)P<0.05; compared with low concentration group,
4)P<0.01.
MTT试验结果显示,NAC对L02 NASH细胞模型的生长抑制率较低,即使在接近饱和浓度10 600.0 μg·mL -1时也仅为34.0%,且呈浓度依赖性,提示该化合物细胞毒性较小。为确保该化合物的给药浓度产生较为显著的疗效和较小的细胞毒性,本研究选择100,150和250 μg·mL -13个安全给药浓度进行后续试验。
NAC对细胞内脂质沉积影响试验结果表明,该化合物对NASH细胞模型显著升高的脂变率具有一定程度的改善作用,且呈浓度依赖性。
ELISA和Western blot检测结果显示,模型组细胞的GLUT-4和IR含量下降,TNF-α和IL-8的含量显著升高,提示在FFA诱导下细胞出现了胰岛素抵抗和炎症水平升高现象;而模型细胞在NAC的作用下,上述症状得到了不同程度的改善,表现为GLUT-4和IR含量的增加,以及TNF-α和IL-8含量的下降;同时,通过不同浓度给药组之间的比较发现,化合物对以上指标的改善作用呈一定程度的浓度依赖性,且化合物对TNF-α和IR的改善作用尤为明显。
综上所述,NAC可在一定程度上改善FFA诱导的L02细胞NASH模型的脂肪变和胰岛素抵抗状况,减轻模型细胞的炎症反应水平,保护细胞免受进一步的氧化应激和炎症损伤,从而发挥其在抗NASH方面的潜在作用。该研究结果可能对发挥NAC在治疗NAFLD和NASH方面的价值提供参考。
REFERENCES
[1] REDDY S K, HYDER O, MARSH J W, et al. Prevalence of nonalcoholic steatohepatitis among patients with resectable intrahepatic cholangiocarcinoma [J]. J Gastrointest Surg, 2013, 17(4): 748-755.
[2] TAKAHASHI Y, FUKUSATO T, INUI A, et al. Pediatric nonalcoholic fatty liver disease/nonalcoholic steatohepatitis [J]. Nihon Rinsho, 2012, 70(10): 1827-1834.
[3] BIEGHS V, WOUTERS K, PATRICK J, et al. Role of scavenger receptor A and CD36 in diet-induced nonalcoholic stestohepatitis in hyperlipidemic mice [J]. Gastroenterology, 2010, 138(7): 2477-2486.
[4] TSOCHATZIS E A, MANOLAKOPOULOS S, PAPATHEODORIDIS G V, et al. Insulin resistance and metabolic syndrome in chronic liver diseases: old entities with new implications [J]. Scand J Gastroenterol, 2009, 44(1): 6-14.
[5] LEAHY J L. Pathogenesis of type 2 diabetes mellitus [J]. Arch Med Res, 2005, 36(3): 197-209.
[6] DREWS G, KRIPPEIT-DREWS P, DÜFER M. Oxidative stress and beta-cell dysfunction [J]. Pflugers Arch, 2010, 460(4) : 703-718.
[7] GALICIA M M, RODRÍGUEZ R A, REYES G K, et al. N-acetylcysteine prevents carbon tetrachloride- induced liver cirrhosis: role of liver transforming growth factor -beta and oxidative stress [J]. Eur J Gastroenterol Hepatol, 2009, 21(80): 908-914.
[8] ZHOU T, CHEN Y, LIU C H, et al. Effects of N-acetylcysteine on liver fibrosis and lipid peroxidation in cirrhotic rats [J]. Chin J New Drugs Clin Rem(中国新药与临床杂志), 2007, 4(26): 259-263.
[9] KONARKOWSKA B, AITKEN J F, KISTLER J, et al. Thiol reducing compounds prevent human amylin-evoked cytotoxicity [J]. FEBS J, 2005, 272(19) : 4949-4959.
[10] POLYZOS S A, KOUNTOURAS J, ZAVOS C. Nonalcoholic fatty liver disease: the pathogenetic roles of insulin resistance and adipocytokines [J]. Curr Mol Med, 2009, 9(3): 299-314.
[11] SERVIDDIO G, BELLANTI F, TAMBORRA R, et al. Uncoupling protein-2 (UCP2)induces mitochondrial proton leak and increases susceptibility of non-alcoholic steatohepatitis ( NASH) liver to ischaemia -reperfusion injury [J]. Gut, 2008, 57(7): 957-965.
[12] TSOCHATZIS E A, PAPATHEODORIDIS G V, ARCHIMANDRITIS A J. Adipokines in nonalcoholic steatohepatitis: from pathogenesis to implications in diagnosis and therapy [J]. Mediators Inflamm, 2009, 2009: 831670. Doi: 10.1155/2009/831670.
[13] PAN X F, WEN C X, XU J H. Comparison of two cell lines for cell model of hepatocytic steatosis in vitro [J]. J Guangdong Pharm Coll(广东药学院学报), 2010, 26(1): 85-89.
Study of N-acetylcysteine’s Anti-Nonalcoholic Steatohepatitis Activity in Vitro
SHAO Yidan, SHI Tingting, ZHAO Yanmei, PAN Xuwang, JU Liping, ZHANG Jing, ZHUANG Rangxiao *(Hangzhou Xixi Hospital, Hangzhou 310023, China)
ABSTRACT:OBJECTIVE To investigate the effects of N-acetylcysteine(NAC) on the inflammatory response and insulin resistance in the model of nonalcoholic steatohepatitis(NASH) induced by free fatty acid(FFA) in L02 cells. METHODS L02 cells were treated with FFA to establish NASH cell model; The growth inhibition ratio of NAC was measured by MTT to select the safe drug concentration. The fat deposition in cells was observed by oil-red staining method. The content of IL-8, TNF-α and glucose transporter-4(GLUT-4) were tested by Elisa; And the content of cells’ insulin receptor(IR) were tested by Western blot and Elisa. RESULTS The growth inhibition ratio was only 34.10% under the NAC’s maximum concentration of 10 600.0 μg·mL -1, so 3 treatment groups were seted with the NAC concentration of 100, 150 and 250 μg·mL -1. The steatosis ratio of the model group was up to 82.45%, but the treatment groups’ ratio felled to 61.77%, 68.08% and 79.28% significantly(P<0.01) with a concentration dependence; The treatment groups’ concentration of GLUT-4 and IR was increased significantly(P<0.01) compared with the model group, but significant concentration decreases of IL-8 and TNF-α were observed(P<0.01). CONCLUSION NAC has a tinny cytotoxicity. It can decrease NASH cells’ steatosis ratio and especially improve their insulin resistant and inflammatory response level, showing potential value on NASH treatment.
KEY WORDS:N-acetylcysteine; nonalcoholic steatohepatitis; insulin resistance; inflammatory response
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2017)02-0200-04
DOI:10.13748/j.cnki.issn1007-7693.2017.02.011
收稿日期:2016-07-26
基金项目:杭州市科技发展计划项目(20130633B10,20142013A60)
作者简介:邵益丹,男,硕士生 Tel: (0571)86481960 E-mail: 40773425@qq.com *通信作者:庄让笑,男,主任药师 Tel: (0571)86481960 E-mail: zhuangrangxiao@sina.com