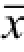 ±s表示,并用SPSS 15.0统计分析软件进行处理,P值计算采用非配对双边t检验进行分析,P<0.05认为有显著性差异。
±s表示,并用SPSS 15.0统计分析软件进行处理,P值计算采用非配对双边t检验进行分析,P<0.05认为有显著性差异。
王 倩,郑海雅,周 颖,钟益芳(丽水市人民医院,浙江 丽水 323000)
摘要:目的 探讨蛇床子素联合肿瘤坏死因子诱导凋亡配体[tumor necrosis factor (TNF)-related apoptosis inducing ligand,TRAIL]对乳腺癌干细胞的杀伤效应及机制。方法 用TRAIL及蛇床子素体外处理MCF-7乳腺癌非干细胞及MCF-7乳腺癌干细胞,MTT法检测乳腺癌细胞的细胞活力;流式细胞术检测乳腺癌细胞的凋亡;Western blot试验检测caspase-9和caspase-3的活化,凋亡酶激活因子(apoptotic protease activating facter-1,Apaf-1)的表达水平,细胞色素C的释放;免疫共沉淀法检测Apaf-1和caspase-9前体的相互作用。结果 MCF-7肿瘤干细胞对TRAIL的敏感性显著低于MCF-7非干细胞。在MCF-7肿瘤干细胞的培养体系中加入蛇床子素能显著提高TRAIL对MCF-7肿瘤干细胞的细胞活力抑制率。Western blot实验结果表明,蛇床子素能显著上调MCF-7肿瘤干细胞中Apaf-1的表达水平,但不影响细胞色素C的释放。在MCF-7肿瘤干细胞中转染Apaf-1 siRNA后,蛇床子素联合TRAIL对MCF-7肿瘤干细胞的协同杀伤活性受到显著抑制。另外,免疫共沉淀实验结果表明,蛇床子素联合TRAIL能显著诱导MCF-7肿瘤干细胞中Apaf-1与caspase-9前体的相互作用,并使之发生活化。结论 蛇床子素通过上调Apaf-1的表达促进TRAIL对乳腺癌干细胞caspase-9的活化,从而增强TRAIL对乳腺癌干细胞的凋亡诱导效应。
关键词:蛇床子素;肿瘤坏死因子诱导凋亡配体;乳腺癌干细胞;Apaf-1;caspase-9;凋亡
有报道表明,乳腺癌是女性群体中发病率和致死率最高的恶性肿瘤,是严重危害女性健康的世界性难题 [1]。尽管对于乳腺癌的研究已经取得了一些进展,肿瘤的发生及转移的内在分子机制正逐步被揭示,关于乳腺癌对药物治疗的耐药性及分子机制目前仍不十分清楚 [2]。近期的研究表明,癌症可以被认为是一种干细胞失调性疾病,肿瘤可能是由一种具有“干细胞样”的恶性细胞增殖形成的,这种具有高度自我更新能力的肿瘤细胞被称为“肿瘤干细胞” [3-4]。肿瘤坏死因子诱导凋亡配体[tumor necrosis factor (TNF)-related apoptosis inducing ligand,TRAIL]是一种属于TNF超家族的细胞因子 [5],它能选择性诱导肿瘤细胞发生凋亡,却不影响正常组织细胞的功能,因此TRAIL是一种有良好前景的新型低毒肿瘤治疗药物 [6-7]。然而,一些肿瘤细胞(特别是肿瘤干细胞)对TRAIL的治疗不敏感,并且分子机制也不十分清楚 [8]。因此,研究肿瘤干细胞如何产生对TRAIL抵抗的分子机制并采取辅助治疗手段提高肿瘤干细胞对TRAIL的敏感性有十分重要的意义。
1.1 细胞培养
人乳腺癌细胞系MCF-7购于美国ATCC。CD24-FITC和CD44-PE荧光抗体用于MCF-7肿瘤干细胞的分选,简要步骤如下:将MCF-7细胞系用CD24-FITC和CD44-PE荧光抗体在暗处冰上孵育40 min,之后用生理盐水将细胞洗涤3遍后,用流式细胞仪进行细胞分选,CD44阳性且CD24阴性的MCF-7细胞即为MCF-7乳腺癌干细胞,剩余细胞则为MCF-7非干细胞 [9]。MCF-7肿瘤干细胞及MCF-7非干细胞均培养在含10%胎牛血清的DMEM培养基中,在37 ℃恒温培养箱中培养,通入5% CO 2。
1.2 试剂与仪器
噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT,货号:M2128)、蛇床子素(osthole,批号:O9265)、Annexin V/PI凋亡检测试剂盒(批号:APOAF)均购于美国Sigma-Aldrich;TRAIL(美国R&D Systems);CD24-FITC和CD44-PE荧光抗体均购于美国BD公司;DMEM培养基、胎牛血清购于美国Gibco;细胞蛋白提取液、cleaved caspase-9、cleaved caspase-3、caspase-9前体(pro-caspase-9)、凋亡酶激活因子(apoptotic protease activating facter-1,Apaf-1)、细胞色素C和β-actin抗人抗体均购于美国Cell Signaling;蛋白G免疫共沉淀琼脂糖珠(美国Santa Cruz);Apaf-1 siRNA购于上海吉玛生物,序列正向:5’-UGCUCUACUACAUGAAGGA UU-3’,反向:5’-UCCUUCAUGUAGUAGAGCA UU-3’; Lipofectamine 2000(美国Invitrogen);ECL试剂盒(美国Pierce,批号:32106)。
TECAN Sunrise Microplate Reader酶标仪(瑞士TECAN公司);BD FACSAria II流式细胞分选仪(美国BD Biosciences公司);Mini-PROTEAN Tetra电泳仪(美国Bio-Rad公司)。
2.1 Apaf-1基因沉默
为了抑制MCF-7肿瘤干细胞中Apaf-1的蛋白表达,作者设计了Apaf-1 siRNA。将MCF-7肿瘤干细胞接种在培养板上,孵育过夜后将Apaf-1 siRNA(终浓度为50 pmol·mL -1)用Lipofectamine 2000转染入肿瘤细胞中,培养24 h。
2.2 线粒体分离
为了检测MCF-7肿瘤干细胞中细胞色素C的释放,按文献所述方法使用0.015%地高辛蔗糖溶液分离MCF-7肿瘤干细胞中的细胞质,用Western blot方法检测从线粒体释放到细胞质中的细胞色素C [10]。
2.3 细胞活力检测
将MCF-7肿瘤干细胞或MCF-7非干细胞按每孔5×10 3接种在96孔板上,孵育过夜使细胞完全贴壁。将Apaf-1 siRNA(终浓度为50 pmol·mL -1)用0.5 μL的Lipofectamine 2000进行转染并用100 μL无血清培养基孵育6 h,之后将无血清培养基更换为100 μL有血清DMEM继续培养24 h。然后按实验设计将蛇床子素(终浓度为20 μmol·L -1)及TRAIL(终浓度为5 ng·mL -1)加入到培养体系中,培养48 h。之后加入20 μL MTT (5 mg·mL -1)培养4 h,移除孔内培养基,加入100 μL二甲亚砜,570 nm波长下测定OD值。相对细胞活力结果用实验组与对照组的OD值比值表示。TRAIL的半数有效浓度(IC 50)根据细胞活力曲线进行计算。实验分为对照组、蛇床子素组、TRAIL组、蛇床子素+TRAIL组、蛇床子素+TRAIL+Apaf-1 siRNA组,每组3个复孔。
2.4 细胞凋亡试验
将MCF-7肿瘤干细胞或MCF-7非干细胞按每孔5×10 5接种在6孔板上,孵育过夜使细胞完全贴壁。将TRAIL(终浓度为5 ng·mL -1)加入到培养体系中,培养48 h。之后将细胞用生理盐水洗涤2次,按照凋亡试剂盒说明书步骤将PI(碘化丙啶)和Annexin-V加入细胞中孵育20 min,采用流式细胞术检测肿瘤细胞的凋亡。实验分为对照组及TRAIL治疗组,每组采用3个复孔。
2.5 Western blot试验
将MCF-7肿瘤干细胞或MCF-7非干细胞按每孔5×10 5接种在6孔板上,孵育过夜使细胞完全贴壁。将Apaf-1 siRNA(终浓度为50 pmol·mL -1)用0.5 μL的Lipofectamine 2000进行转染并用100 μL无血清培养基孵育6 h,之后将无血清培养基更换为100 μL有血清DMEM继续培养24 h。然后按实验设计将蛇床子素(终浓度为20 μmol·mL -1)及TRAIL(终浓度为5 ng·mL -1)加入到培养体系中,培养48 h。之后将细胞用蛋白提取液进行裂解,裂解后的样品用12.5% SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用cleaved caspase-9、cleaved caspase-3、caspase-9前体、Apaf-1、细胞色素C和β-actin抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2 h,蛋白条带用ECL试剂盒显色发光。目的蛋白的相对表达用目标蛋白灰度值与β-actin灰度值的比值表示,蛋白灰度值分析用Image J软件处理。实验分为对照组、蛇床子素组、TRAIL组、蛇床子素+TRAIL组、蛇床子素+TRAIL+Apaf-1 siRNA组,每组采用3个复孔。
2.6 免疫共沉淀
将MCF-7肿瘤干细胞按每孔5×10 5接种在6孔板上,孵育过夜使细胞完全贴壁。将Apaf-1 siRNA(终浓度为50 pmol·mL -1)用0.5 μL的Lipofectamine 2000进行转染并用100 μL无血清培养基孵育6 h,之后将无血清培养基更换为100 μL有血清DMEM继续培养24 h。然后按照实验设计将蛇床子素(终浓度为20 μmol·mL -1)及TRAIL(终浓度为5 ng·mL -1)加入到培养体系中,培养48 h。之后裂解细胞并将细胞在12 000 r·min -1离心10 min,收取上清液分成等量2份,一份直接进行Western blot试验检测β-actin的表达作为对照,另外一份加入Apaf-1抗体孵育过夜。Apaf-1抗体孵育完毕后加入蛋白G琼脂糖珠孵育2 h。经过2 h免疫沉淀反应后进行Western blot试验,检测与Apaf-1结合的pro-caspase-9蛋白。结合pro-caspase-9蛋白的相对表达用目标蛋白灰度值与β-actin灰度值的比值表示。实验分为对照组、蛇床子素组、TRAIL组、蛇床子素+TRAIL组、蛇床子素+TRAIL+Apaf-1 siRNA组,每组3个复孔。
2.7 统计学方法
实验重复3次,实验数据用
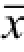 ±s表示,并用SPSS 15.0统计分析软件进行处理,P值计算采用非配对双边t检验进行分析,P<0.05认为有显著性差异。
±s表示,并用SPSS 15.0统计分析软件进行处理,P值计算采用非配对双边t检验进行分析,P<0.05认为有显著性差异。
3.1 MCF-7肿瘤干细胞对TRAIL的敏感性显著低于MCF-7非干细胞
MTT细胞活力试验显示,TRAIL(0~20 ng·mL -1)对MCF-7肿瘤干细胞的杀伤活性显著低于MCF-7非干细胞(P<0.05),同时TRAIL对MCF-7肿瘤干细胞的IC 50显著高于MCF-7非干细胞(P<0.05),表明乳腺癌干细胞对TRAIL有耐药性,结果见图1。
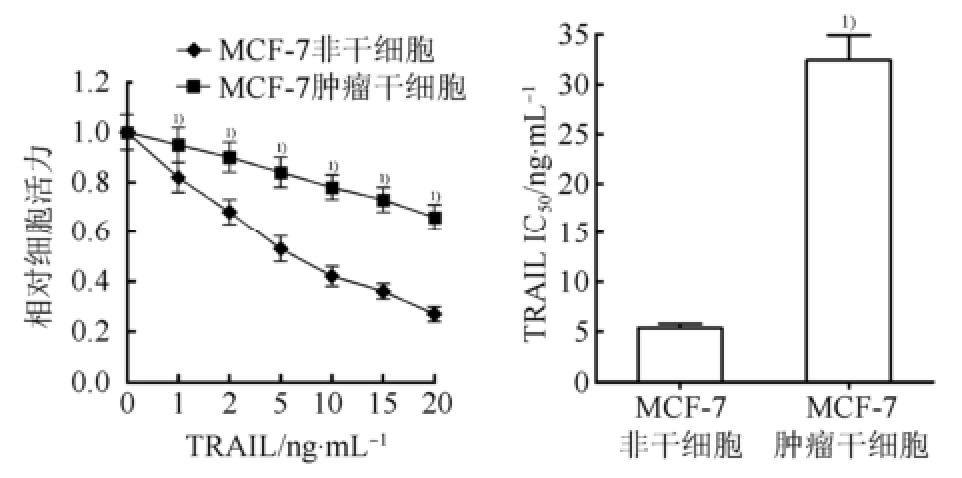
图1 TRAIL对MCF-7肿瘤干细胞和非干细胞的杀伤活性及IC
50影响的比较(n=3,
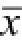 ±s)
±s)
与MCF-7非干细胞相比,
1)P<0.05。
Fig.1 Comparison of cytotoxic activity and IC
50of TRAIL on MCF-7 tumor stem cells and non-stem cells(n=3,
 ±s)
±s)
Compared with the MCF-7 non-stem cells,
1)P<0.05.
流式细胞试验结果显示,在TRAIL处理下,MCF-7肿瘤干细胞的凋亡率显著低于MCF-7非干细胞(P<0.05),MCF-7肿瘤干细胞caspase-9和caspase-3的活化程度显著低于MCF-7非干细胞(P<0.05),结果见图2。以上结果表明,乳腺癌干细胞对TRAIL诱导的凋亡信号不敏感。
3.2 蛇床子素通过上调Apaf-1的表达提高MCF-7肿瘤干细胞对TRAIL的敏感性
MTT细胞活力试验结果显示,TRAIL (5 ng·mL -1)单独处理对MCF-7肿瘤干细胞的抑制作用较弱,然而联合蛇床子素后,TRAIL对MCF-7肿瘤干细胞的杀伤活性显著提高(P<0.05),表明蛇床子素辅助治疗能提高乳腺癌干细胞对TRAIL的敏感性,结果见图3。

图2 TRAIL对MCF-7肿瘤干细胞和非干细胞的细胞凋亡率、caspase-9和caspase-3活化程度影响的比较(n=3,
 ±s)
±s)
A-对细胞凋亡率的影响;B-对caspase-9和caspase-3活化程度的影响;与MCF-7非干细胞对照组相比,
1)P<0.05;与MCF-7肿瘤干细胞对照组相比,
2)P<0.05;与MCF-7非干细胞TRAIL组相比,
3)P<0.05。
Fig.2 Comparison of apoptotic rate and activation of caspase-9 and caspase-3 of TRAIL on MCF-7 tumor stem cells and non-stem cells(n=3,
 ±s)
±s)
A-apoptotic rate; B-activation of caspase-9 and caspase-3; compared with the MCF-7 non-stem cells control group,
1)P<0.05; compared with the MCF-7 cancer stem cells control group,
2)P<0.05; compared with the TRAIL-treated MCF-7 non-stem cells group,
3)P<0.05.
Western blot试验结果显示,MCF-7肿瘤干细胞中的Apaf-1蛋白表达水平明显低于MCF-7非干细胞(P<0.05),提示乳腺癌干细胞可能通过Apaf-1途径抵抗TRAIL的抗肿瘤活性,结果见图4。
蛇床子素能显著上调MCF-7肿瘤干细胞中Apaf-1的表达水平(P<0.05),提示蛇床子素在MCF-7肿瘤干细胞中对TRAIL的增效作用可能和Apaf-1的上调有关,结果见图5。
进一步实验结果显示,在MCF-7肿瘤干细胞中转染Apaf-1 siRNA沉默Apaf-1的表达后,蛇床子素联合TRAIL对MCF-7肿瘤干细胞的杀伤活性受到显著抑制(P<0.05),证实了蛇床子素通过上调Apaf-1的表达提高MCF-7肿瘤干细胞对TRAIL的敏感性,结果见图6。
3.3 蛇床子素通过上调Apaf-1的表达促进caspase-9的活化
研究表明,只有在细胞色素C的存在下,caspase-9前体才能通过与Apaf-1的结合而发生活化 [11]。实验结果显示,TRAIL能显著诱导细胞色素C从线粒体中释放到细胞质中(P<0.05),而与蛇床子素无关(图7A)。另外,蛇床子素单独处理虽能上调MCF-7肿瘤干细胞中Apaf-1的表达却不能直接诱导Apaf-1与caspase-9的相互作用,而蛇床子素联合TRAIL不仅能上调MCF-7肿瘤干细胞中Apaf-1的表达,同时也能诱导Apaf-1与caspase-9的相互作用(图7B)。以上结果表明,TRAIL通过诱导细胞色素C的释放介导细胞的凋亡,而蛇床子素通过上调Apaf-1的表达促进TRAIL诱导的Apaf-1和caspase-9前体的相互作用。
Western blot实验结果显示蛇床子素联合TRAIL能显著活化caspase-9及其下游效应分子caspase-3。沉默Apaf-1的表达后,蛇床子素则不能促进TRAIL对caspase-9的活化(图7C),表明蛇床子素通过上调Apaf-1的表达促进TRAIL对caspase-9及其下游效应分子caspase-3的活化。

图3 蛇床子素联合TRAIL对MCF-7肿瘤干细胞杀伤活性的影响(n=3,
 ±s)
±s)
与对照组相比,
1)P<0.05;与TRAIL组相比,
2)P<0.05。
Fig.3 Effect of osthole combined with TRAIL on cytotoxicity of MCF-7 tumor stem cells(n=3,
 ±s)
±s)
Compared with the control group,
1)P<0.05; compared with the TRAIL group,
2)P<0.05.
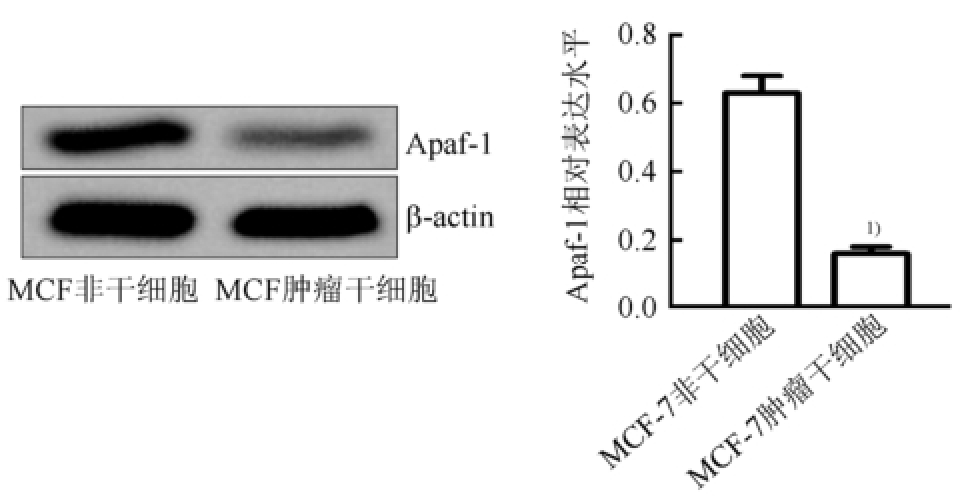
图4 MCF-7肿瘤干细胞和非干细胞的Apaf-1表达水平的比较(n=3,
 ±s)
±s)
与MCF-7非干细胞相比,
1)P<0.05。
Fig.4 Comparison of expression of Apaf-1 on MCF-7 tumor stem cells and non-stem cells(n=3,
 ±s)
±s)
Compared with the MCF-7 non-stem cells,
1)P<0.05.

图5 蛇床子素联合TRAIL对MCF-7肿瘤干细胞Apaf-1表达水平的影响(n=3,
 ±s)
±s)
与对照组相比,
1)P<0.05;与TRAIL组相比,
2)P<0.05。
Fig.5 Effect of osthole combined with TRAIL on expression of MCF-7 tumor stem cells(n=3,
 ±s)
±s)
Compared with the control group,
1)P<0.05; compared with the TRAIL group,
2)P<0.05.
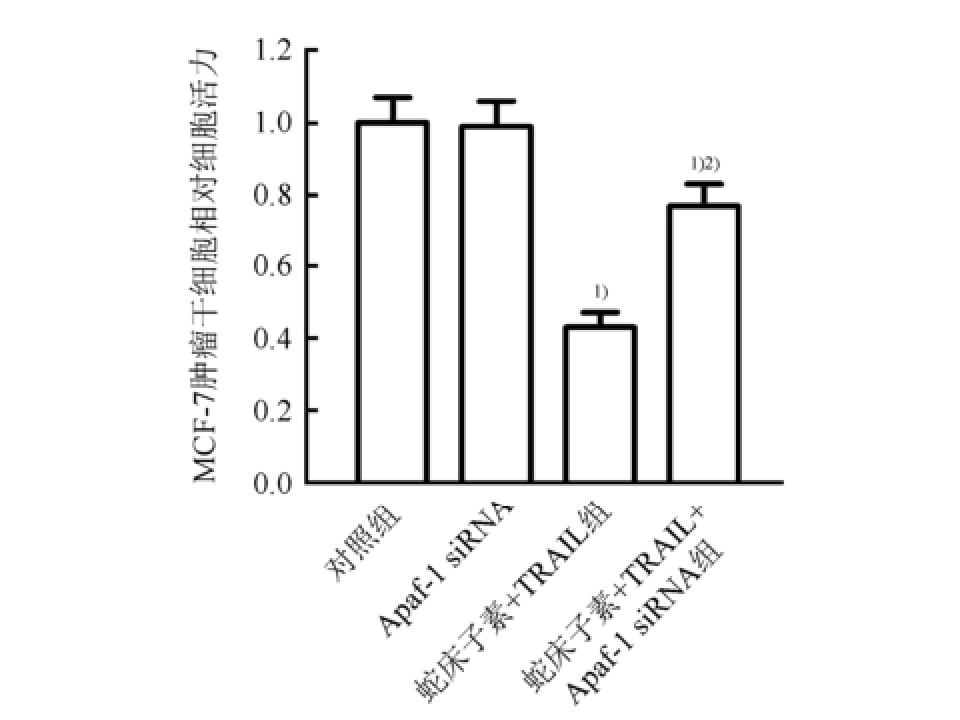
图6 Apaf-1 siRNA对蛇床子素联合TRAIL杀伤MCF-7肿瘤干细胞的抑制作用(n=3,
 ±s)
±s)
与对照组相比,
1)P<0.05;与蛇床子素+TRAIL组相比,
2)P<0.05。
Fig.6 Inhibitory effect of the cytotoxicity of the co-treatment with TRAIL and osthole in the MCF-7 cancer stem cells(n=3,
 ±s)
±s)
Compared with the control group,
1)P<0.05; compared with the osthole +TRAIL group,
2)P<0.05.
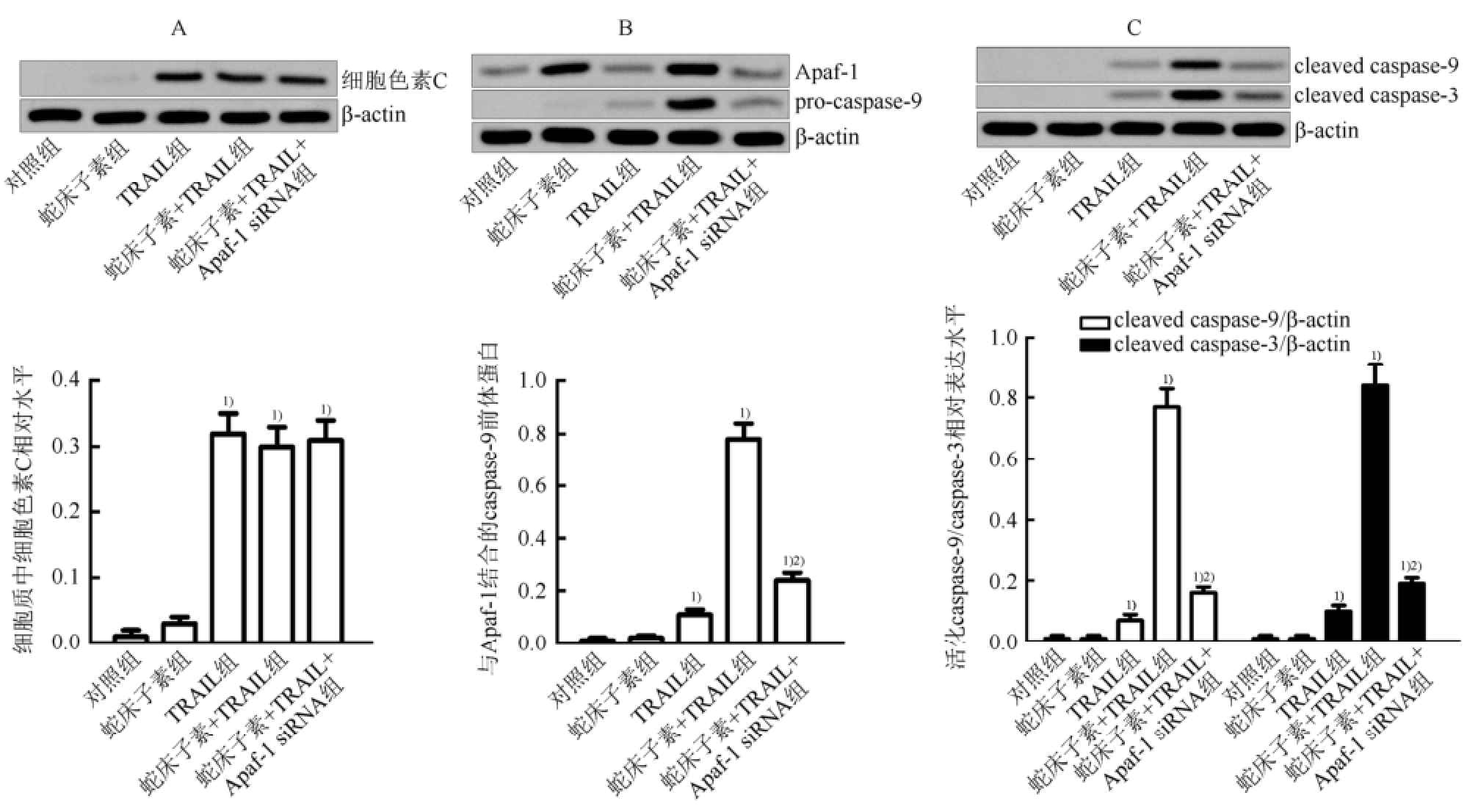
图7 蛇床子素通过上调Apaf-1的表达促进caspase-9的活化
A-TRAIL诱导MCF-7肿瘤干细胞中细胞色素C的释放;B-蛇床子素通过上调Apaf-1的表达促进TRAIL诱导的Apaf-1和pro-caspase-9的相互作用;C-蛇床子素联合TRAIL显著活化MCF-7肿瘤干细胞中的caspase-9及其下游效应分子caspase-3;与对照组相比,
1)P<0.05;与蛇床子素+ TRAIL组相比,
2)P<0.05。
Fig.7 Osthole promoted the activation of caspase-9 through upregulating the expression of Apaf-1
A-TRAIL induced the release of cytochrome C in the MCF-7 cancer stem cells; B-Osthole promoted the TRAIL-induced interaction with Apaf-1 and pro-caspase-9 through upregulating the expression of Apaf-1 in the MCF-7 cancer stem cells; C-Co-treatment with osthole and TRAIL significantly triggered the caspase-9 and the downstream of caspase-3 in the MCF-7 cancer stem cells; Compared with the control group,
1)P<0.05; compared with the osthole+TRAIL group,
2)P<0.05.
有文献指出,乳腺癌组织中肿瘤干细胞的存在是造成药物抵抗的重要因素 [12],因此提高乳腺癌干细胞对TRAIL治疗的敏感性可能是克服TRAIL抵抗的有效策略 [13]。在本研究中,实验结果表明乳腺癌干细胞对TRAIL的敏感性显著低于非干细胞,TRAIL单独处理对乳腺癌干细胞的凋亡诱导能力较弱,这些实验结果与文献报道一致。
蛇床子素是从中药蛇床子中提取的活性物质,在现代中医治疗中有广泛的用途 [14]。近些年来的研究发现,蛇床子素还具有一定的抗肿瘤作用 [15],然而蛇床子素对乳腺癌干细胞的辅助治疗作用至今还很少报道。在本研究中,实验结果表明蛇床子素单独处理虽不能显著杀伤乳腺癌干细胞,但却能显著提高TRAIL对乳腺癌干细胞的杀伤能力,两者联合存在治疗乳腺癌干细胞的药物协同效应。
研究表明,TRAIL能诱导肿瘤细胞发生凋亡,它主要通过激活caspase-8/tBid信号通路损伤肿瘤细胞的线粒体膜电位,使细胞色素C等凋亡诱导因子释放到细胞质中,从而激活细胞的凋亡通路 [16-17]。在细胞色素C依赖的凋亡信号通路中,下游分子caspase-9的活化至关重要,活化的caspase-9能直接激活caspase-3这一效应分子,进而使肿瘤细胞的DNA发生片段化,从而发生凋亡 [18-19]。研究表明在细胞色素C活化caspase-9的过程中,Apaf-1蛋白的参与至关重要。Apaf-1是1个分子量为130 kDa的凋亡相关蛋白,有多个caspase结合位点。细胞质中的Apaf-1在细胞色素C的活化下能与caspase-9前体结合,从而激活caspase-9并诱导细胞发生caspases依赖的凋亡 [20-21]。在本研究中,实验结果表明蛇床子素增强TRAIL对乳腺癌干细胞杀伤活性的机制和其能上调Apaf-1的表达有关。TRAIL能引起乳腺癌干细胞细胞色素C的释放,而蛇床子素可能通过上调Apaf-1的表达增加其与caspase-9的结合,从而增强caspase-9的活化和凋亡,因此TRAIL和蛇床子素存在协同抗肿瘤作用。
综上所述,本研究证明了蛇床子素能显著提高乳腺癌干细胞对TRAIL的敏感性。通过机制研究发现,蛇床子素能通过上调Apaf-1的表达使乳腺癌干细胞中的caspase-9在细胞色素C的作用下与Apaf-1结合而发生活化,进而使乳腺癌干细胞进入凋亡程序。这些研究为逆转TRAIL对乳腺癌的耐药性提供了新的思路和理论依据。
REFERENCES
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2013 [J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[2] ZANARDI E, BREGNI G, DI COSIMO S, et al. Better together: Targeted combination therapies in breast cancer [J]. Semin Oncol, 2015, 42(6): 887-895.
[3] DE SOUSA E, MELO F, VERMEULEN L. Wnt signaling in cancer stem cell biology [J]. Cancers (Basel), 2016, 8(7): 60.
[4] HONG M, TAN H Y, FENG Y, et al. Cancer stem cells: the potential targets of chinese medicines and their active compounds [J]. Int J Mol Sci, 2016, 17(6): 893.
[5] OSHI P, JEON Y J, CROCE C M, et al. MicroRNA-148a reduces tumorigenesis and increases TRAIL-induced apoptosis in NSCLC [J]. Proc Natl Acad Sci U S A, 2015, 112(28): 8650-8655.
[6] HARI Y, HARASHIMA N, HARADA M, et al. Bcl-xL inhibition by molecular-targeting drugs sensitizes human pancreatic cancer cells to TRAIL [J]. Oncotarget, 2015, 6(39): 41902-41915.
[7] AMARANTE-MENDES G P, GRIFFITH T S. Therapeutic applications of TRAIL receptor agonists in cancer and beyond [J]. Pharmacol Ther, 2015(155): 117-131.
[8] RECIO-BOILES A, ILMER M, ALT E, et al. JNK pathway inhibition selectively primes pancreatic cancer stem cells to TRAIL-induced apoptosis without affecting the physiology of normal tissue resident stem cells [J]. Oncotarget, 2016, 7(9): 9890-9906.
[9] NANDY S B, ARUMUGAM A, LAKSHMANASWAMY R, et al. MicroRNA-125a influences breast cancer stem cells by targeting leukemia inhibitory factor receptor which regulates the Hippo signaling pathway [J]. Oncotarget, 2015, 6(19): 17366-17378.
[10] XU Y, CUI J H, DU Z J, et al. Antisensenucleic acids of miR-24 promoted the doxorubicin-induced apoptosis via BIM-Smac/DIABLO pathway in colon cancer [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(2): 175-181.
[11] MCSTAY G P, GREEN D R. Preparation of cytosolic extracts and activation of caspases by cytochrome C [J]. Cold Spring Harb Protoc, 2014, 2014(7): 778-782.
[12] YANG Z X, SUN Y H, JIANG G Q, et al. Increased activity of CHK enhances the radioresistance of MCF-7 breast cancer stem cells [J]. Oncol Lett, 2015, 10(6): 3443-3449.
[13] PIGGOTT L, OMIDVAR N, CLARKSON R W, et al. Suppression of apoptosis inhibitor c-FLIP selectively eliminates breast cancer stem cell activity in response to the anti-cancer agent TRAIL [J]. Breast Cancer Res, 2011, 13(5): R88.
[14] BALAYSSAC S, GILARD V, MALET-MARTINO M, et al. Analysis of herbal dietary supplements for sexual performance enhancement: first characterization of propoxyphenylthiohydroxyhomosildenafil and identification of sildenafil, thiosildenafil, phentolamine and tetrahydropalmatine as adulterants [J]. J Pharm Biomed Anal, 2012, 63(7): 135-150.
[15] LIN K, GAO Z, FU Q, et al. Osthole suppresses the proliferation and accelerates the apoptosis of human glioma cells via the upregulation of microRNA-16 and downregulation of MMP-9 [J]. Mol Med Rep, 2015, 12(3): 4592-4597.
[16] HAN M A, WOO S M, KWON T K, et al. 6-Shogaol enhances renal carcinoma Caki cells to TRAIL-induced apoptosis through reactive oxygen species-mediated cytochrome c release and down-regulation of c-FLIP(L) expression [J]. Chem Biol Interact, 2015(228): 69-78.
[17] LI G, FU D, CHENG B, et al. CYC1 silencing sensitizes osteosarcoma cells to TRAIL-induced apoptosis [J]. Cell Physiol Biochem, 2014, 34(6): 2070-2080.
[18] WEN Q, ZHANG X, YANG P H, et al. A novel strategy for real-time and in situ detection of cytochrome C and caspase-9 in Hela cells during apoptosis [J]. Analyst, 2014, 139(10): 2499-2506.
[19] LIU J, QIN CK, QIN C Y, et al. OSU-03012, a non-Cox inhibiting celecoxib derivative, induces apoptosis of human esophageal carcinoma cells through a p53/Bax/cytochrome c/caspase-9-dependent pathway [J]. Anticancer Drugs, 2013, 24(7): 690-698.
[20] HU Q, WU D, SHI Y, et al. Molecular determinants of caspase-9 activation by the Apaf-1 apoptosome [J]. Proc Natl Acad Sci U S A, 2014, 111(46): 16254-16261.
[21] SHANG J, YANG F, SUN S, et al. MicroRNA-23a antisense enhances 5-fluorouracil chemosensitivity through APAF-1/ caspase-9 apoptotic pathway in colorectal cancer cells [J]. J Cell Biochem, 2014, 115(4): 772-784.
Anti-tumor Effect of Osthol Combined with Tumor Necrosis Factor-Related Apoptosis Inducing Ligand on Breast Cancer Stem Cells
WANG Qian, ZHENG Haiya, ZHOU Ying, ZHONG Yifang(People’s Hospital of Lishui City, Lishui 323000, China)
ABSTRACT:OBJECTIVE To investigate the synergistic effect and mechanism of osthole and tumor necrosis factor (TNF)-related apoptosis inducing ligand (TRAIL) in breast cancer stem cells. METHODS After treatment of osthole and TRAIL in the MCF-7 cancer stem cells (MCF-7-CSCs) as well as the MCF-7-non-cancer stem cells (MCF-7-non-CSCs), MTT assay was performed to detect the cell viability; flow cytometry analysis was performed to measure the cell apoptosis; Western blot analysis was performed to evaluate the activation of caspase-9 and caspase-3, expression of Apaf-1, and release of cytochrome C; co-immunoprecipitation was performed to detect the interaction with Apaf-1 and pro-caspase-9, respectively. RESULTS The sensitivity of MCF-7-CSCs to TRAIL was significantly lower than the MCF-7-non-CSCs. Addition of osthole significantly increased the inhibitory rate of MCF-7-CSCs treated with TRAIL. The results of Western blot indicated that the treatment of osthole could significantly upregulate the expression of Apaf-1 without changing the release of cytochrome C. Transfection with Apaf-1 siRNA abolished the synergistic effect of osthole and TRAIL in MCF-7-CSCs. In addition, the results of co-immunoprecipitation indicated that the combination of osthole and TRAIL significantly induced the interaction with Apaf-1 and pro-caspase-9, which led to the activation of caspase-9 in MCF-7-CSCs. CONCLUSION Osthole promotes the TRAIL-induced activation of caspase-9 and apoptosis by upregulating the expression of Apaf-1 in the breast cancer stem cells.
KEY WORDS:osthole; tumor necrosis factor (TNF)-related apoptosis inducing ligand (TRAIL); breast cancer stem cells; Apaf-1; caspase-9; apoptosis
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2017)02-0225-07
DOI:10.13748/j.cnki.issn1007-7693.2017.02.016
收稿日期:2016-07-21
作者简介:王倩,女,硕士,主管技师 Tel: 18957092550 E-mail: lishuiwangqian@163.com