 ±s表示,多组间分析采用单因素(one-way ANOVA)方差分析,多组两两比较采用t检验。以P<0.05为差别有统计学意义。
±s表示,多组间分析采用单因素(one-way ANOVA)方差分析,多组两两比较采用t检验。以P<0.05为差别有统计学意义。
曼 琼 1,邓 毅 1,2*,杨志军 1,王 勇 1,赵 妮 1,刘 靓 1(1.甘肃中医药大学,兰州 730000;2.甘肃省中药药理与毒理学重点实验室,兰州 730000)
摘要:目的 观察甘草内生菌有效菌株与宿主甘草对痰浊阻肺型大鼠的干预作用,筛选甘草内生菌有效菌株。方法 Wistar大鼠130只,♀♂各半,随机分为正常组、模型组、阳性组、水煎液组及不同甘草内生菌有效菌株组。模型组及干预组采用SO 2烟熏和冷风刺激10 d诱导痰浊阻肺模型,干预组在造模6 d起灌胃干预7 d。观察大鼠一般情况,进行清醒无创状态肺功能检测,分光光度法测定气管酚红排泌量,HE染色后光学显微镜下观察肺组织病理形态学变化,ELISA法检测大鼠肺泡灌洗液白介素IL-17、IL-23的含量。结果 与模型组相比,JTZB005、JTZB006、JTZB058、JTZB063组大鼠的肺功能检测各项指标均显著升高(P<0.05);与宿主甘草水煎液组相比,JTZB005、JTZB058与其作用相当。这4株有效菌株可显著降低大鼠酚红排泌量及肺泡灌洗液中IL-17、IL-23的含量(P<0.05),并与水煎液作用相当。结论 筛选出4株对痰浊阻肺大鼠具有治疗作用的甘草内生菌有效菌株,且与其宿主有相似的生理活性。
关键词:甘草;内生菌;痰浊阻肺
甘草为气管炎、咽喉炎、支气管哮喘等呼吸系统疾病常用药。目前,在我国栽培甘草储积量并不能满足日益增长的社会需求,需找寻相关对策弥补巨大的市场缺口。研究表明,甘草内生菌可产生与其宿主甘草相同或相似的药理活性及活性物质 [1-2],然而甘草内生菌对呼吸系统疾病的治疗作用却鲜有报道。本实验通过选取栽培乌拉尔甘草(Glycyrrhiza uralensis Fisch.)分离纯化内生菌,经体内外抑菌实验筛选9株有效菌株,对痰浊阻肺模型大鼠进行干预,比较有效菌株与其宿主甘草水煎液的干预作用,筛选出对呼吸系统疾病具有治疗作用的甘草内生菌有效菌株。
1.1 材料
1.1.1 动物 SPF级Wistar大鼠,130只,♀♂各半,体质量(180~220)g,购自甘肃中医药大学动物实验中心,实验动物许可证号:SCXK(甘)2015-0002。所有大鼠饲养于甘肃中医药大学动物实验室,20~25 ℃,相对湿度60%~70%,普通饲料喂养,自由饮水。
1.1.2 仪器与试药 野生乌拉尔甘草采于甘肃酒泉市金塔县,经甘肃中医药大学生药实验中心林丽高级实验师鉴定为正品,将实验所用甘草破碎至1~3 mm,加10倍量纯化水,浸泡30 min,武火加热,文火煎煮60 min,纱布滤过,滤液水浴浓缩至含生药量45 mg·mL -1,4 ℃冰箱保存备用。复方贝母氯化铵片(西安利君君制药有限责任公司,批号:1506390);艾条(南阳市卧龙汉医艾绒厂,批号:20151101)。
生理盐水(西安京西双鹤药业有限公司,批号:1503217B;无水乙醇(批号:20160103),碳酸氢钠(批号:20151012)均购自天津市大茂化学试剂厂;升华硫(天津市凯信化学工业有限公司,批号:20150524);酚红(上海中泰化学试剂有限公司,批号:20160123);NA营养琼脂培养基(批号:20150122),营养肉汤培养基(批号:20140826),均来自青岛高科园海博生物技术有限公司;IL-23 ELISA试剂盒(批号:CSB-E08462r),IL-17 ELISA试剂盒(批号:AK0016MAY05004),均购自武汉伊莱瑞特生物科技有限公司。
LDZX-30FB立体压力蒸汽灭菌锅(上海申安医疗器械厂);DHP-927电热恒温培养箱(上海一恒科学仪器有限公司);UV Blue Star B型紫外-可见分光光度计(北京来佰泰科技有限公司);HJ-CJ-2D双人净化工作台(上海苏静实业有限公司);自制熏蒸箱(大小:120×100×80 cm);RXZ型智能人工气候培养箱(宁波江南仪器厂);WPB PLT-UNR-持续时间-2型动物肺功能检测系统(法国EMKA公司);MODEL680-酶标仪(美国伯乐公司)。
1.1.3 甘草内生菌有效菌株 [3]本试验所用的9株有效菌株均为将前期甘草分离、纯化得到的内生菌再采用体外菌饼法、体内小鼠腹腔感染造模后,筛选出对金黄色葡萄球菌、肺炎链球菌、大肠杆菌均具有抑菌作用的菌株,即JTZB002、JTZB005、JTZB006、JTZB014、JTZB020、JTZB043、JTZB058、JTZB060、JTZB063。
1.2 方法
1.2.1 有效菌株发酵液的制备 [4]营养肉汤培养基按每瓶300 mL分装于500 mL锥形瓶中,121 ℃灭菌20 min,将已活化的内生细菌有效菌株于无菌操作台上用接种环挑取5环菌种,接种于已灭菌的液体培养基中,于摇床28 ℃,200 r·min -1条件下培养4 d,将发酵液于3 000 r·min -1离心15 min,取上清液过滤,60 ℃烘干。给药时称取各菌株粉末,用已灭菌的纯水稀释至含菌株粉末量45 mg·mL -1。
1.2.2 分组造模与给药 Wistar大鼠130只,随机数字表法分为13组,即正常组、模型组、阳性组、水煎液组、各有效菌株组(JTZB002、JTZB005、JTZB006、JTZB014、JTZB020、JTZB043、JTZB058、JTZB060、JTZB063)。参考文献 [5-6]并根据预实验建立痰浊阻肺大鼠模型,将模型组和各药物组大鼠SO 2烟薰(3 g硫磺粉均匀洒布于清艾条中点燃)30 min后,人工气候箱于10 ℃、冷风刺激10 min,每天2次,持续10 d。以大鼠具有明显气道痰鸣音,鼻部潮湿,咳嗽,食少,拱背倦睡,消瘦为造模成功。正常组则置于正常环境中饲养。自造模第6天起,各组分别给予相应药物干预,正常组与模型组给予生理盐水0.1 mL·(10g) -1;阳性组给予复方贝母氯化铵片0.08 g·kg -1,水煎液组给予栽培甘草水煎液0.95 g·kg -1,各有效菌株组给予不同甘草内生菌发酵液0.95 g·kg -1,各组药物稀释后与空白组等容积灌胃,每天1次,连续7 d。
1.3 检测指标
1.3.1 一般情况观察 实验期间,观察各组大鼠的一般情况变化,包括活动状况、毛发、体质量、咳嗽、气喘及口鼻分泌物等特异性症状、体征。
1.3.2 肺功能检测 [7]实验第11天给药2 h后,打开动物肺功能检测系统,运行IOX数据采集系统软件,实验将大鼠分批放入动物描记箱中,每箱1只,每次4箱,做清醒无创状态下肺功能测试。带动物安静后记录实验数据,每只动物保证安静状态下至少测定3 min。测试指标有吸气时间、呼气时间、潮气量、肺泡通气量。
1.3.3 酚红排泌法 精密称取酚红100 mg,5 g·dL -1NaHCO 3溶解,溶液转至100 mL量瓶,NaHCO 3洗涤烧杯,洗涤液转移至量瓶中,重复3次,定容。从溶液中分别精密量取0.2,0.4,0.6,0.8,1.0,1.2 mL于10 mL量瓶,NaHCO 3定容。选3个不同浓度的酚红标准溶液,200~600 nm的波长范围内扫描得出最佳吸收波长。以酚红浓度X(mg·mL -1)为横坐标,以吸光度Y为纵坐标建立回归方程。最后一日给药30 min后,腹腔注射7.05 mmol·L -1酚红溶液0.5 mL。30 min后,放血处死大鼠,分离气管,用5% NaHCO 3溶液冲洗气管3次,每次0.5 mL。721分光光度计测吸收值,根据回归方程得出酚红浓度 [8]。
1.3.4 病理切片 断颈处死大鼠,结扎右主支管处,取右肺上叶部分肺组织,4%戊二醛固定,HE染色,光学显微镜下进行观察组织形态学改变。1.3.5 生化指标 用穿刺针插入气管上端,用PBS反复冲洗左肺3次,每次2 mL,将回收的肺泡灌洗液于4 ℃,1 500 r·min -1离心10 min,取上清液,ELISA法检测IL-17、IL-23含量,所有操作按试剂盒说明书进行。
1.4 统计学处理
采用SPSS 19.0统计分析软件处理数据,各项指标均以
 ±s表示,多组间分析采用单因素(one-way ANOVA)方差分析,多组两两比较采用t检验。以P<0.05为差别有统计学意义。
±s表示,多组间分析采用单因素(one-way ANOVA)方差分析,多组两两比较采用t检验。以P<0.05为差别有统计学意义。
2.1 一般情况观察
正常组大鼠身强体壮,毛发有光泽,好动,食欲旺盛,体质量持续上升。模型组大鼠普遍可明显听到痰鸣音,口鼻分泌物增多,逆毛并毛发枯槁,拱背倦睡,食少,消瘦。阳性组、甘草水煎液组、JTZB005、JTZB006、JTZB058、JTZB063组大鼠可见不同程度皮毛恢复光泽,痰鸣音逐渐减轻,偶可听到咳嗽,饮食基本正常,体质量逐渐回升。JTZB002、JTZB014、JTZB020、JTZB043、JTZB060组大鼠状态与模型组相似。
2.2 清醒大鼠肺功能检测
与正常组比较,痰浊阻肺模型组大鼠吸气时间、呼气时间、潮气量及静息每分钟肺泡通气量均明显降低,差异具有统计学意义(P<0.01)。与模型组比较,阳性组,水煎液组,JTZB005、JTZB006、JTZB058、JTZB063组的吸气时间、呼气时间、潮气量及肺泡通气量4项指标均有所上升,差异具有统计学意义(P<0.05或P<0.01)。各有效菌株与宿主水煎液比较,JTZB005、JTZB058有效菌株各项肺功能检测指标与其宿主水煎液相当,差异不具有统计学意义。JTZB006、JTZB063组大鼠吸气时间高于模型组,差异具有统计学意义(P<0.05)。结果见表1。
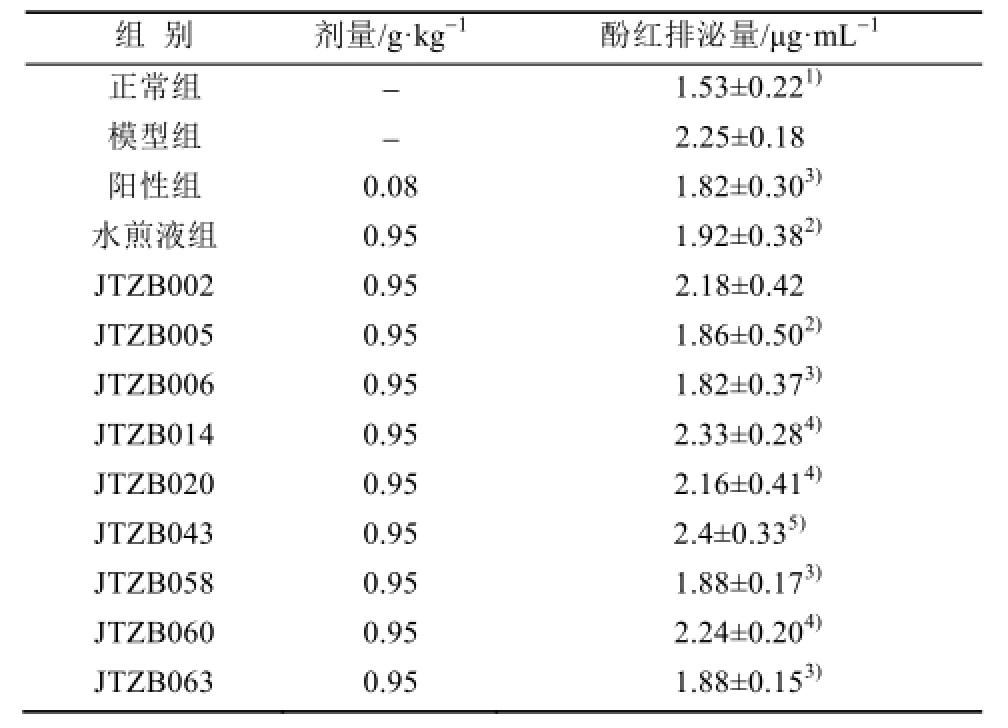
2.3 痰浊阻肺大鼠酚红排泌量分析
与正常组比较,模型组大鼠酚红排泌量显著增加(P<0.01)。与模型组相比,阳性组,水煎液组,JTZB005、JTZB006、JTZB058、JTZB063组的酚红排泌量降低,差异具有统计学意义(P<0.05或P<0.01)。各有效菌株组与宿主水煎液组比较,JTZB005、JTZB006、JTZB058、JTZB063与宿主水煎液作用相似,差异无统计学意义。结果见表2。
表1 各组大鼠肺功能检测比较(n=10,
 ±s)
±s)
Tab.1 Comparison of pulmonary function tests in rats(n=10,
 ±s)
±s)
注:与正常组比较,
1)P<0.01;与模型组比较,
2)P<0.05,
3)P<0.01;与水煎液组比较,
4)P<0.05,
5)P<0.01。
Note: Compared with the control group,
1)P<0.01; compared with the model group,
2)P<0.05,
3)P<0.01; compared with the decoction of Glycyrrhiza group,
4)P<0.05,
5)P<0.01.
表2 大鼠呼吸道酚红排泌量( n=10,
 ±s)
±s)
Tab.2 The amount of phenolred excretion in rats(n=10,
 ±s)
±s)
注:与正常组比较,
1)P<0.01;与模型组比较,
2)P<0.05,
3)P<0.01;与水煎液组比较,
4)P<0.05,
5)P<0.01。
Note: Compared with the control group,
1)P<0.01; compared with the model group,
2)P<0.05,
3)P<0.01; compared with the decoction of Glycyrrhiza group,
4)P<0.05,
5)P<0.01.
2.4 肺组织病理变化
正常组大鼠可见支气管黏膜上皮完整,管壁正常,纤毛排列整齐,无明显的炎性细胞渗出,肺泡结构完整,无显扩张。模型组大鼠支气管黏膜上皮脱落,纤毛缺失,支气管管壁可见明显增厚,杯状细胞增多,黏膜层有大量炎细胞浸润,肺泡壁部分断裂,肺泡腔增大,个别肺泡融合成肺大泡,肺间质可见明显大量炎细胞。阳性组,水煎液组,JTZB005、JTZB006、JTZB058、JTZB063组可见支气管上皮较模型组完整,纤毛增多,支气管管壁略有增厚,黏膜下炎细胞浸润较模型组有所改善,肺泡腔轻度扩大,肺间质炎细胞浸润减轻。JTZB014、JTZB060组大鼠支气管、肺泡及肺间质结构较模型组略有改善,JTZB002、JTZB020、JTZB043组大鼠病理表现与模型组相当。结果见图1。
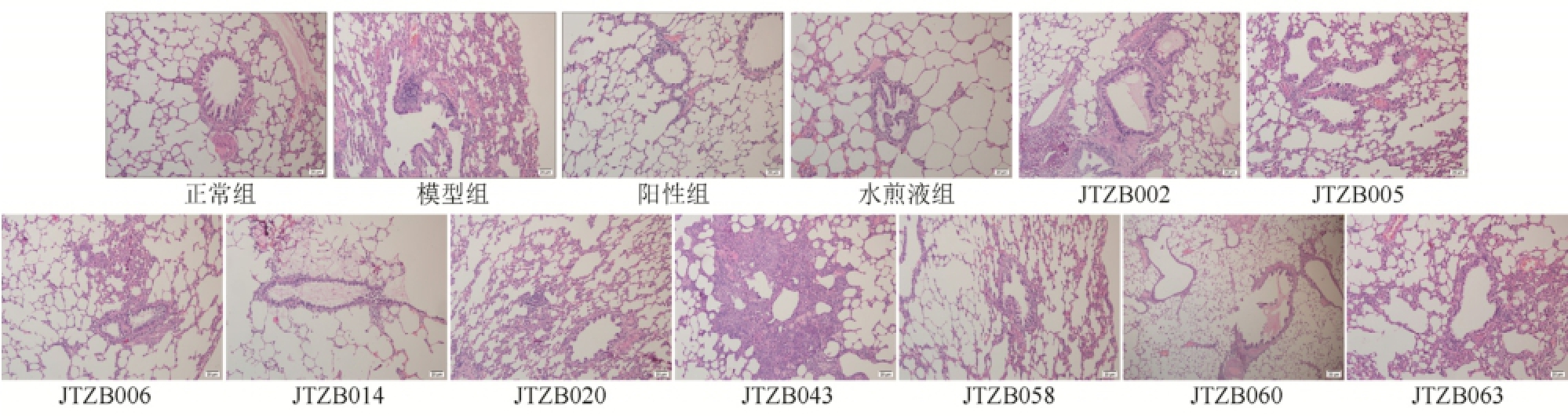
图1 各组大鼠肺组织病理变化(HE染色,100×)
Fig.1 The lungs tissue pathological changes in rats (HE staining, 100×)
2.5 大鼠肺泡灌洗液IL-17、IL-23含量分析
与正常组相比,模型组大鼠肺泡灌洗液中IL-17、IL-23的含量显著高于正常组,差异有统计学意义(P<0.01)。与模型组相比,阳性组,水煎液组,JTZB005、JTZB006、JTZB058、JTZB063组均能有效降低痰浊阻肺大鼠肺泡灌洗液IL-17、IL-23含量,差异有统计学意义(P<0.05或P<0.01);JTZB060可降低肺泡灌洗液中IL-17含量。与水煎液组比较,甘草内生菌有效菌株JTZB005、JTZB006、JTZB058、JTZB063与宿主水煎液IL-17、IL-23含量相当,差异无统计学意义。结果见表3。
表3 大鼠肺泡灌洗液白介素IL-17、IL-23水平比较(n=10,
 ±s)
±s)
Tab.3 Comparison of the level of interleukin IL-17, IL-23 in rat alveolar lavage lotion(n=10,
 ±s)
±s)
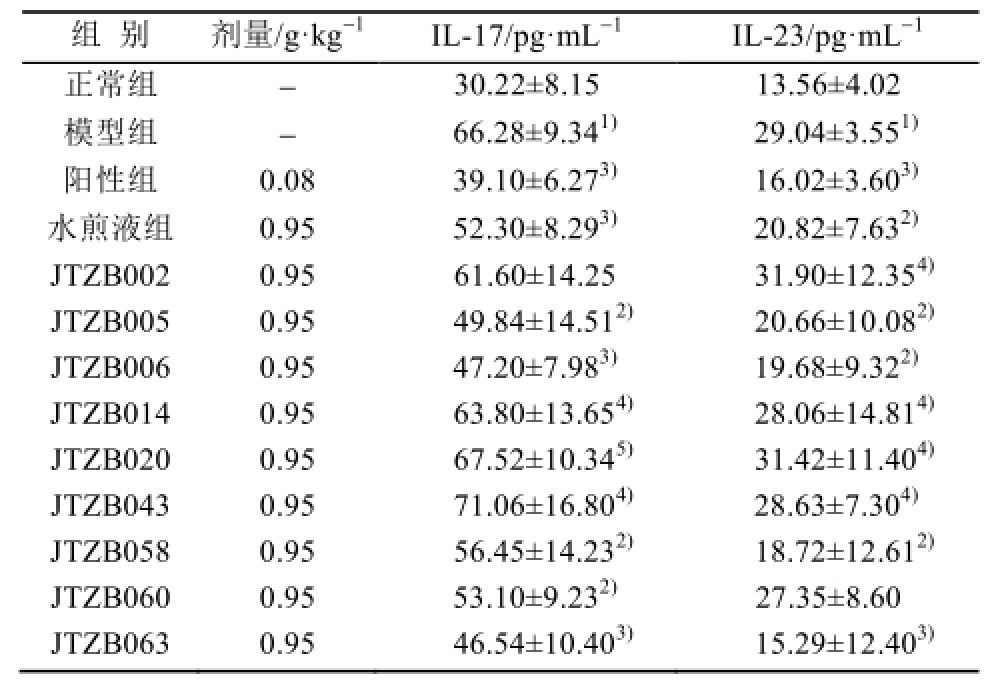
注:与正常组比较,
1)P<0.01;与模型组比较,
2)P<0.05,
3)P<0.01;与水煎液组比较,
4)P<0.05,
5)P<0.01。
Note: Compared with the control group,
1)P<0.01; compared with the model group,
2)P<0.05,
3)P<0.01; compared with the decoction of Glycyrrhiza group,
4)P<0.05,
5)P<0.01.
内生菌是指在其生活史的一定或全部阶段生活于健康植物的各种组织和气管内部的微生物。利用微生物对传统中药进行开发和研究是一种新的方式。甘草内生菌的提取分离,可对甘草资源的保护提供新的研究思路。对甘草内生菌与其宿主进行药效学比较可更深入地为甘草内生菌与其宿主提供的内在联系,从而寻求甘草药材资源的替代品。甘草性平、味甘、质润,归心、脾、肺、胃经,因其归肺经可以治疗肺系疾病,或使药物抵达肺部使药之功用,保持呼吸道之洁净。现代研究证实,甘草口服可缓和炎症对咽喉及肺部的刺激,使炎症的血管反应和细胞的反应降低 [9]。目前,甘草内生菌与宿主甘草之间的药效学研究鲜有报道,因此本实验通过对痰浊阻肺大鼠进行干预,筛选出与宿主甘草具有相似或相同药理活性的甘草内生菌有效菌株。
痰浊阻肺证的形成主要是因为外邪袭肺,引发咳喘,继而伤肺,肺气耗伤,导致肺宣肃无力,不能输布津液而水液停滞,聚而成痰,因此本实验通过SO 2烟熏及冷风刺激诱导痰浊阻肺模型,从而对比研究甘草内生菌有效菌株与宿主甘草对呼吸系统疾病大鼠的影响。酚红排泌量是检测支气管排痰的1个常用指标,其利用酚红腹腔注射后可部分从气管排出的特点,将大鼠酚红排泌量作为筛选衡量痰液的客观指标。肺功能检测可表现肺部疾病气道通畅性、肺组织弹性、通气和储存能力的状态,是呼吸系统疾病的重要指标之一,潮气量反应呼吸的容积量,肺泡通气量反应有效进行气体交换的量。现代研究表明,“痰证”即为肺部炎症的表现,与机体细胞因子的表达密切相关。白介素IL-17与IL-23大量存在于肺泡中,IL-17是Th17细胞主要分泌的促炎性因子,是它的主效应细胞因子,可激活T细胞,刺激气道上皮细胞及平滑肌细胞释放趋化因子,参与诱导中性粒细胞的活化与聚集,从而导致炎症的产生。IL-23对可促进多种细胞因子的分泌,缓解调节性T细胞(Treg细胞)对Th17细胞的抑制作用,诱导Th17分化,并且能促进记忆T细胞分泌IL-17 [10]。
本实验结果表明,模型组大鼠可见咳嗽、气促,明显痰鸣音,口鼻分泌物增多,毛发枯槁,体质量减少等痰浊阻肺症状,且其肺功能各项指标、分红排泌量及肺泡灌洗液中IL-17、IL-23含量与正常组存在显著差异,说明该造模方法较成功。JTZB005、JTZB006、JTZB058、JTZB063组大鼠的肺功能检测各项指标显著升高,大鼠酚红排泌量及肺泡灌洗液中IL-17、IL-23的含量显著降低,且与宿主甘草水煎液组作用相当。JTZB002、JTZB014、JTZB020、JTZB043、JTZB060组有效菌株各项指标与模型组无显著差异,表明这5株有效菌株对痰浊阻肺型大鼠无治疗作用。
内生菌发酵液的处理主要以乙醇或乙酸乙酯提取为主,然而甘草内生菌的药效学研究鲜有报道,内生菌活性部位不明确,为减少活性部位的丢失,本实验选用甘草内生菌发酵液进行动物体内实验。已有研究显示 [11-12],可从甘草内生菌发酵液的内生代谢产物中测定出与甘草相似的黄酮、皂苷类成分。JTZB005、JTZB006、JTZB058、JTZB063组与宿主甘草有相似的生理活性推测与其含有和甘草相似的黄酮、皂苷类成分有关。
综上所述,筛选出4株甘草内生菌有效菌株JTZB005、JTZB006、JTZB058、JTZB063与宿主有着相似的生理活性,并对痰浊阻肺模型大鼠具有较好的治疗作用。
REFERENCES
[1] LI W J, ZHEN S H, MAO P H, et al. Isolation of endophyte from Glycyrrhiza inflata Batalin of Xinjiang uygur autonomous region and screening of glycyrrhizic acid-producing strain [J]. Biotechnology(生物技术), 2008, 18(5): 28-31.
[2] DENG Y, WANG Y, DING R W, et al. The preliminary study on antibacterial activity of endophyte secondary metabolites from Glycyrrhiza in Gansu [J]. J Chin Med Mater(中药材), 2013, 36(2): 181-184.
[3] 赵妮, 邓毅, 刘靓, 等. 甘草内生菌20株有效菌株发酵物与宿主水煎液、总黄酮、总皂苷体外抑菌活性对比研究[J]. 中医研究, 2016, 29(5): 66-70.
[4] LIU X, DANG F F, HE X L, et al. Isolation of endophyte from wild liquorice in north Shaanxi and screening of their antifungal activity [J]. Acta Bot Bor-Occid Sin(西北植物学报), 2010, 30(10): 2110-2115.
[5] WANG P, WU X Y, ZHANG M L, et al. Expression of NF-κB and COX-2 mRNA in rats with phlegm obstruction due to lung-deficiency [J]. J Chin Integ Med(中西医结合学报), 2005, 3(2): 119-122.
[6] 王九林, 姜惟, 卞慧敏, 等. 肺虚痰阻病理模型的研制[J].中国中医基础医学杂志, 1996(04): 44-45.
[7] 蔺兴遥, 张毅, 李娟, 等. 黄芪黄酮与红芪黄酮对肺间质纤维化模型大鼠肺功能影响的对比研究[J]. 中成药, 2013, 35(8): 1770-1773.
[8] YE Y G, LI S Y, CHEN Y F, et al. Comparative study of different extracts of loquat leaf in antitussive and antiaststhmatic effects [J]. Pharmacol Clin Chin Mater Med(中药药理与临床), 2013(2): 100-102.
[9] ZHANG M F, SHEN Y Q. Eeffects of licorice and its extracts on respiratory system [J]. Drug & Clin(现代药物与临床), 2010, 25(4): 262-267.
[10] WILSON N J, BONIFACE K, CHAN J R, et al. Development, cytokine profile and function of human interleukin 17-producing helper T cells [J]. Nat Immunol, 2007, 8(9): 950-957.
[11] LI B Y, ZHANG Q. Isolation of licorice endophytic fungi and screening of flavones-producing strains [J]. Tianjin Agri Sci (天津农业科学), 2012, 18(5): 15-18.
[12] SONG S Q, FANG S J, GU M Y, et al. Preliminary studies on its glycyrrhizinic acid metabolites of endophytic bacteria from Glycyrrhiza inflata Bat. of Xinjiang [J]. Microbiology(微生物学通报), 2008, 35(9): 1439-1442.
Comparative Study on the Intervention Effects of Endophytic Bacteria Isolated from Glycyrrhizae Radix Et Rhizoma on Rats with Phlegm Turbidity Obstructing in the Lung
MAN Qiong 1, DENG Yi 1,2*, YANG Zhijun 1, WANG Yong 1, ZHAO Ni 1, LIU Liang 1(1.Gansu University of Chinese Medicine, Lanzhou 730000, China; 2.Key Laboratory of Pharmacology and Toxicology for Traditional Chinese Medicines of Gansu Province, Lanzhou 730000, China)
ABSTRACT:OBJECTIVE To investigate the intervention effect of effective strains of endophytic and Glycyrrhizae Radix et Rhizome(Glycyrrhiza) on rats with turbid phlegm obstructing in the lung, and filtrate effective strains. METHODS One hundred and thirty Wistar rats were randomly divided into normal group, model group, positive group, decoction of Glycyrrhiza group and different effective strains of endophytic of Glycyrrhiza groups. The rat model of phlegm blocking in the lung was established by inhaleing SO 2and clod wind for 10 d in model and intervention groups. Since sixth day, drug intervention group were given corresponding drugs for 7 d. The expectorant effects were studied by observing the changes of rats’ general activities, detection of lung function in conscious non-invasive state, tracheal excretion of phenol red and pathological of lung tissues. In addition,the contents of IL-17 and IL-23 were detected. RESULTS Compared with the model group, the index of lung function tests of JTZB005, JTZB006, JTZB058 and JTZB063 were rised significiantly (P<0.05). Compared with the decoction of Glycyrrhiza group, the effects of JTZB005 and JTZB058 were similar. The tracheal excretion of phenol red and the content of IL-17 and IL-23 of rats were decreased significiantly(P<0.05), and their effects were similar with decoction of Glycyrrhiza group. CONCLUSION By filtrating, 4 effective strains of endophytic of Glycyrrhiza have effects in turbid phlegm obstructing, and the physiological activity of them are similar with their host Glycyrrhiza.
KEY WORDS:Glycyrrhizae Radix et Rhizoma; endophytic; turbid phlegm obstructing in the lung
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2017)02-0161-05
DOI:10.13748/j.cnki.issn1007-7693.2017.02.003
收稿日期:2016-07-13
基金项目:国家自然科学基金(81360633)
作者简介:曼琼,女,硕士生 Tel: 18152094636 E-mail: gretam@163.com *
通信作者:邓毅,男,教授,博导 Tel: 13919289773,(0931)8765350 E-mail: dengyi@gszy.edu.cn