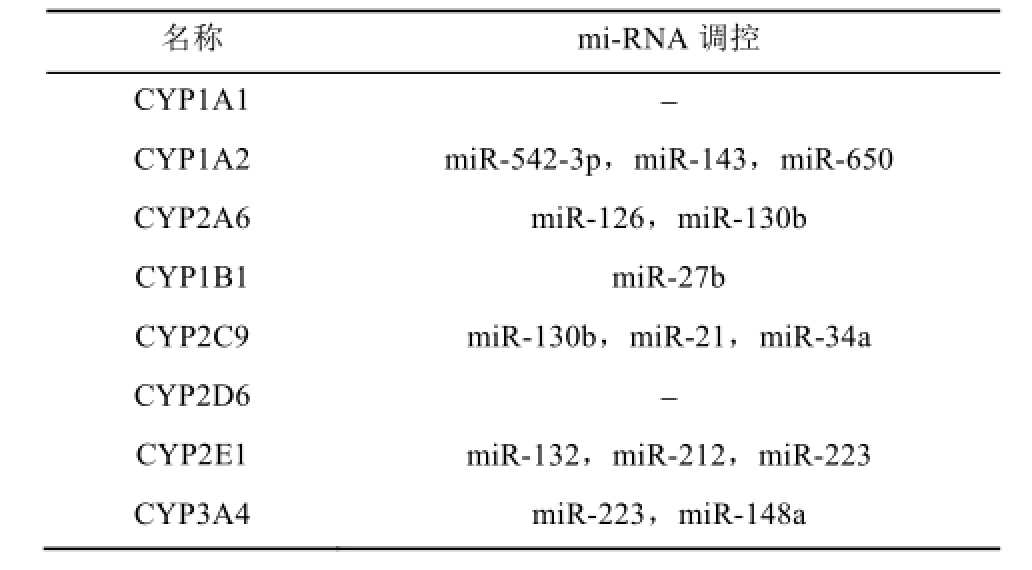
表1 CYP450酶调控相关mi-RNA
Tab.1 Regulate related miRNAs of CYP450 enzymes
张轶雯 1,方 罗 1,郑小卫 1,李清林 1,童莹慧 1,鲍美华 2,黄 萍 1*(1.浙江省肿瘤医院药剂科,杭州 310022;2.长沙医学院,长沙 410219)
摘要:细胞色素P450(CYPs)家族是体内重要的药物代谢酶,其功能主要是代谢临床药物及外源性物质。长期以来,CYP450酶的个体间功能活性差异往往被认为是由基因多态性所导致。然而随着研究的日益深入,人们发现基因序列的改变并不能完全解释CYP450酶的个体间活性差异。表观遗传学作为研究DNA序列未发生变化而基因表达发生可遗传变异的学科,可作为重要研究手段进一步解释CYP450酶的个体差异。该学科主要研究内容包括DNA甲基化、组蛋白翻译后修饰和RNA编辑等。本文就各主要CYP450酶的表观遗传学调控研究进行综述并讨论其在药物代谢和临床应用中的意义。
关键词:细胞色素P450酶;表观遗传学;调控;代谢
细胞色素P450(cytochrome P450,CYP450)是体内重要的Ⅰ相代谢酶,主要分布于肝脏、肠道及肾脏等组织器官。其功能主要是将外源性毒物或内源性物质转化为极性衍生物,使其可与Ⅱ相代谢酶或药物转运体结合进行下一步代谢,从而更易于排出体外 [1]。根据各CYP450酶的氨基酸序列的相似性,人体内CYP450酶家族主要被分为CYP 1A,2A,2B,2C,2D,2E和3A等亚家族。各亚家族在药物代谢中起着不同的作用,包括底物的羟化、磺化和去甲基化等反应。CYP450酶的数量和活性直接影响药物在体内的代谢活化与外排 [2]。
表观遗传学是研究DNA序列未发生变化而基因表达发生可遗传改变的学科,是遗传学的重要分支学科。其研究内容主要包括DNA甲基化、组蛋白翻译后修饰和RNA编辑等 [3]。DNA甲基化主要通过DNA甲基化转移酶(DNA methyltransferase,DNMT)将基因序列CpG岛上的胞嘧啶5’位甲基化为5-甲基胞嘧啶,从而影响基因表达。染色体的多级折叠需要DNA与组蛋白(H2A、H2B、H3和H4)相结合,组蛋白在进化中是保守的,但其翻译后会发生一系列修饰,包括乙酰化、甲基化、泛素化和磷酸化等。此修饰作用为其他蛋白与DNA结合产生协同或拮抗效应,从而发挥转录调控作用。RNA编辑是指在mRNA水平上改变遗传信息的过程,其中功能性非编码RNA在该过程中发挥重要的作用,包括长链非编码RNA(long noncoding RNA,lncRNA)和短链非编码RNA(microRNA,miRNA) [4]。近年来,表观遗传学在疾病进展与治疗中的意义逐渐成为研究热点,CYP450作为主要的代谢酶,其活性受到表观遗传调控,将对药物与内源性物质的代谢与活化产生影响。本文将分别对各主要CYP450酶的表观遗传学调控进行综述,并讨论其在药物代谢和临床应用中的意义。
CYP1A1主要分布在肝外,其生物学功能是参与多环芳烃致突变中间体的生物激活及解毒代谢。研究表明,CYP1A1的表观遗传变化在前列腺癌中具有重要意义 [5]。DNA甲基化抑制剂5-氮杂胞苷(5-aza-CdR)可增加人前列腺癌LNCaP细胞系中由TCDD所诱导的CYP1A1转录水平表达,而在人前列腺正常细胞系PWR-1E和RWPE-1中则无此现象。进一步研究其机制发现,LNCaP细胞系中CYP1A1基因启动子区呈高甲基化,可以阻止芳香烃受体复合物与二噁英反应元件(dioxin response element,DRE)的结合从而抑制TCDD对CYP1A1的诱导作用。同时,在组织水平观察到CYP1A1的高甲基化仅发生在前列腺癌组织的DNA中。上述结果提示,CYP1A1的高甲基化水平与前列腺癌风险相关,且当机体暴露于如二噁英等致癌物质时,高甲基化水平的CYP1A1更难将其代谢,从而导致毒性蓄积。另一项研究表明,烟草可显著升高胎盘中CYP1A1的表达水平,为解释这一现象,研究者对CYP1A1启动子区CpG位点的甲基化水平进行检测,发现吸烟者较不吸烟者显著降低 [6]。同时,有报道在小鼠体内证实CYP1A1的甲基化与性别相关 [7],检测不同性别小鼠CYP1A1启动子区-873~ -566位发现CpG岛甲基化数目与位置存在区别,从而使CYP1A1表达量存在差异。这一结果可部分解释性别所造成疾病易感性以及药效的差异,为流行病学及药物的开发提供一定的依据。
CYP1A2是CYP1亚家族主要的代谢酶,约占肝脏中CYP450酶总量的18%,代谢包括咖啡因、氯氮平、丙咪嗪和茶碱在内的多种药物,负责多种前诱变剂、环境或饮食来源中致癌物的代谢活化,并可由配体与芳香烃受体结合所诱导 [8]。Park等 [9]发现,肝细胞在从干细胞发育的过程中甲基转移酶会被抑制,使CYP1A2的CpG岛去甲基化,从而上调其表达。进一步研究证实,CYP1A2肝内的表达上调与其第二外显子中的17个CpG岛甲基化程度密切相关。除甲基化调控外,Swart等 [10]对CYP1A2的3'-UTR区进行miRNA结合位点预测,发现其可被miR-542-3p、miR-143、miR-650等在肝脏中具有功能性表达的miRNA调控。此外,组蛋白去乙酰化也被证实是CYP1A2调控的重要机制之一。最初在大鼠肝细胞中发现组蛋白乙酰化可增加TCDD诱导的CYP1A2表达 [11]。随后,Nakajima等 [12]在MCF-7和HELA细胞中,加入组蛋白去乙酰化抑制剂后发现CYP1A2的mRNA水平明显升高。上述结果证实,CYP1A2除了基因型具有多样性外,还可被表观遗传学广泛调控,为其功能具有较大个体化差异这一现象提供了理论依据。
CYP2A6主要表达于肝脏,约占肝脏CYP450酶总量的5%~10%,参与香豆素和尼古丁等化合物的代谢,与吸烟的致癌风险相关 [13-14]。该基因个体间活性差异较大,最初认为是基因型不同所引起的。然而,即使在基因型相同的野生型人群中,CYP2A6活性也存在较大的变异,提示CYP2A6活性差异除基因型外仍存在其他影响因素 [15-16]。Nakano等 [17]在HEK293细胞中通过荧光报告基因实验发现,CYP2A6基因3'-UTR区存在miR-126结合位点,过表达miR-126后可显著抑制其mRNA和蛋白表达水平。同时,其催化经典底物香豆素7’-位羟化活性也被抑制。此外,miR-130b也可以抑制CYP2A6的表达与活性 [18]。同时,在人肝细胞中证实组蛋白乙酰化可上调CYP2A6表达,通过Hsp-70相互作用蛋白(Hsp70-interacting protein,CHIP)实验证明,CYP2A6近端启动子的染色质组蛋白H4乙酰化增加了HNF4α与HNF4-RE结合,从而增加地塞米松诱导的CYP2A6表达上调 [19]。提示CYP2A6的转录后翻译对其功能活性具有重要影响。
CYP1B1主要表达于肝外组织,主要参与类固醇类物质的代谢,如视黄醇、褪黑激素以及4’-羟基雌二醇等,且该基因被证明与青光眼、子宫内膜癌和前列腺癌等疾病的发生率相关,并在肿瘤组织中高表达 [20-21]。目前研究发现,CYP1B1表观遗传学调控较为复杂,在不同肿瘤组织中存在差异。CYP1B1在乳腺癌细胞MCF-7细胞中可被二噁英诱导,但肝癌细胞HepG2中则无此现象。该现象被证实与CYP1B1启动子区甲基化相关,MCF-7细胞中二噁英可结合到芳香烃受体,而HepG2细胞中此段区域CpG岛高度甲基化使得芳香烃受体不能被结合,下游的CYP1B1不能被转录激活。如使用甲基化抑制剂5-氮杂胞苷处理HepG2细胞后,则二噁英对CYP1B1的诱导作用恢复 [22]。此外,CYP1B1的3’-非翻译区存在miR-27b的调控靶点,在miR-27b表达水平不同的细胞系中,CYP1B1表达与miR-27b水平呈负相关 [23]。同时,在乳腺癌组织中观察到miR-27b的表达水平下降可伴随CYP1B1表达水平升高 [24]。在结直肠癌组织中,炎症因子IL-6可显著诱导CYP1B1表达,其机制与miR-27b调控甲基化转移酶DNMT1的磷酸化从而改变CYP1B1的甲基化程度有关 [25]。此外,组蛋白H3、H4的乙酰化也是CYP1B1表观遗传学调控途径之一。
CYP2C9是肝内主要的代谢酶之一,涉及多种治疗指数狭窄药物的代谢,如苯妥英钠和华法林。CYP2C9的表达及活性与此类药物的疗效和不良反应的发生密切相关,在临床实践中具有重要意义。表观遗传学研究显示,miRNA对CYP2C9表达和活性具有重要影响,该基因3’-非翻译区存在miRNA的调控靶点,可与多个miRNA结合。在miR-130b阴性的细胞中,CYP2C9功能活性可升高近30%,且高表达miR-130b可显著降低CYP2C9的表达 [18]。同时,miR-21与miR-34a也可影响CYP2C9表达。此外,翻译后磷酸化修饰也是调节CYP2C9功能活性的重要表观遗传学途径之一 [26]。
CYP2D6在肝中表达水平较低,仅占肝中CYP酶蛋白总量的2%~4%,但其在药物代谢中具有重要意义,参与了临床约25%~30%药物的代谢,如β-受体阻断剂、抗抑郁药物和抗肿瘤药物等。其中,已被证实CYP2D6可将他莫昔芬代谢为活性代谢产物4’-羟基他莫昔芬,其活性与抗肿瘤疗效相关。已有研究证实除性别、年龄外,吸烟可显著影响CYP2D6的甲基化水平,且各个基因型的甲基化程度也存在差异,弱代谢型的甲基化程度高于强代谢型 [27]。该研究结果提示吸烟可改变甲基化水平,从而影响抗肿瘤药物的活性与疗效。进一步研究发现 [28],CYP2D6启动子区存在大量CpG岛,同时其组蛋白H3K27me3也可发生甲基化改变。此外,有研究对CYP2D6可能存在的mi-RNA结合位点进行预测,并观察mi-RNA对其表达的调控作用。结果显示,暂未发现CYP2D6的表达与mi-RNA调控相关。甲基化调控可能是CYP2D6基因最为重要的表观遗传学调控途径。
CYP2E1约占肝CYP总量的7%,主要参与多种前体毒性物质和致癌物质的代谢与生物激活。已有研究显示,在胰岛素介导的CYP2E1调节通路中,miR-132、miR-212可直接与CYP2E1的3'-UTR区结合降低其mRNA水平的表达,也通过参与PI3-K、Akt和mTOR信号通路调控CYP2E1表达,此类调节作用可能与肝脏代谢和疾病的发生发展相关 [29]。除了表达水平的调控,一些miRNA可在功能活性水平对CYP2E1进行调节,miR-223可通过调节细胞色素b5进而影响CYP2E1对经典底物氯唑沙宗的6位羟化代谢活性 [30]。
CYP3A4主要表达于肝脏与肠道,约占人肝脏CYP酶总量的30%,参与代谢临床50%的药物,是体内最重要的药物代谢酶。其个体间活性差异可导致某些药物清除率相差20倍,因此,明确CYP3A4的遗传学与表观遗传学在临床实践中具有重要意义。目前对CYP3A4相关的表观遗传学研究相对较多,已发现甲基化、miRNA、组蛋白乙酰化和翻译后修饰均可直接或间接调控CYP3A4的表达。miR-223可通过显著降低CYP3A4对睾酮6β位羟化的催化活性 [30]。同时,已证实CYP3A4上游调控基因PXR(如3'-UTR区存在rs1054190T等位基因)突变将会影响miR-148a结合,从而增加CYP3A4的表达 [31]。且PXR启动子区的甲基化也可影响CYP3A4的mRNA表达水平 [32]。此外,组蛋白甲基转移酶PRMT1参与了PXR基因的H4R3甲基化与组蛋白H4乙酰化调控,进而使CYP3A4转录激活。泛素化作为翻译后修饰手段也在CYP3A4蛋白表达中起到了关键作用,其中糖蛋白-78(glycoprotein-78,gp-78)和CHIP在E3连接酶介导的CYP3A4泛素化过程中具有重要意义 [33]。当gp-78和Hsp-70相互作用蛋白表达增高时,CYP3A4蛋白含量减少,提示可能引起CYP3A4活性改变进而引起临床药物的疗效或毒性改变。
CYP450酶家族作为重要的药物代谢酶,其个体间活性差异直接影响了治疗药物的疗效与毒性,因而受到了广泛关注。长期以来,基因序列的改变被认为是CYP450酶个体间活性差异的关键因素。然而,随着研究的日益深入,人们发现基因序列的改变并不能完全解释CYP450酶的个体间活性差异,甚至某些相同基因型的人群对药物代谢的能力也不尽相同。因此,表观遗传学的观点逐渐受到了重视。本文总结了CYP450家族中主要亚型的表观遗传学研究进展,目前研究相对集中于miRNA调控(表1)与启动子区CpG岛甲基化对CYP450酶表达及活性的改变,其他表观遗传学调控途径有待进一步研究阐明。
表1 CYP450酶调控相关mi-RNA
Tab.1 Regulate related miRNAs of CYP450 enzymes

综上所述,CYP450酶的表观遗传学调控研究已覆盖了其家族内的多个重要亚家族,但仍有大量的CYP450酶暂未见报道,或仅研究了部分表观遗传学调控机制。同时,由于CYP450家族多受核受体调控,且其功能与CYP450唯一的电子供体CYP450氧化还原酶(cytochrome P450 oxidoreductase,POR)密切相关。因此,在研究CYP450表观遗传学变化的同时对上述基因也需进行更深入的研究,以期更好地阐明CYP450酶活性变化。随着生物信息学与分子生物技术的发展,表观遗传学将作为CYP450酶研究的重要分支,从药物代谢角度对临床实践提供理论依据和支持。
REFERENCES
[1] TOLSON A H, WANG H. Regulation of drug-metabolizing enzymes by xenobiotic receptors: PXR and CAR [J]. Adv Drug Deliv Rev, 2010, 62(13): 1238-1249.
[2] 张轶雯, 鲍美华, 周丽华, 等. 孕甾烷X受体在药物代谢中的作用及研究进展[J]. 中国临床药理学与治疗学, 2013, 18(10): 1169-1174.
[3] WOLFFE A P, MATZKE M A. Epigenetics: regulation through repression [J]. Science, 1999, 286(5439): 481-486.
[4] EGGER G, LIANG G, APARICIO A, et al. Epigenetics in human disease and prospects for epigenetic therapy [J]. Nature, 2004, 429(6990): 457-463.
[5] OKINO S T, POOKOT D, LI L C, et al. Epigenetic inactivation of the dioxin-responsive cytochrome P4501A1 gene in human prostate cancer [J]. Cancer Res, 2006, 66(15): 7420-7428.
[6] SUTER M, ABRAMOVICI A, SHOWALTER L, et al. In utero tobacco exposure epigenetically modifies placental CYP1A1 expression [J]. Metabolism, 2010, 59(10): 1481-1490.
[7] PENALOZA C G, ESTEVEZ B, HAN D M, et al. Sex-dependent regulation of cytochrome P450 family members Cyp1a1, Cyp2e1, and Cyp7b1 by methylation of DNA [J]. FASEB J, 2014, 28(2): 966-977.
[8] BROWN C M, REISFELD B, MAYENO A N. Cytochromes P450: a structure-based summary of biotransformations using representative substrates [J]. Drug Metab Rev, 2008, 40(1): 1-100.
[9] PARK H J, CHOI Y J, KIM J W, et al. Differences in the epigenetic regulation of cytochrome P450 genes between human embryonic stem cell-derived hepatocytes and primary hepatocytes [J]. PLOS One, 2015, 10(7): e0132992.
[10] SWART M, DANDARA C. Genetic variation in the 3'-UTR of CYP1A2, CYP2B6, CYP2D6, CYP3A4, NR1I2, and UGT2B7: potential effects on regulation by microRNA and pharmacogenomics relevance [J]. Front Genet, 2014(5): 167.
[11] XU L, RUH T S, RUH M F. Effect of the histone deacetylase inhibitor trichostatin A on the responsiveness of rat hepatocytes to dioxin [J]. Biochem Pharmacol, 1997, 53(7): 951-957.
[12] NAKAJIMA M, IWANARI M, YOKOI T. Effects of histone deacetylation and DNA methylation on the constitutive andTCDD-inducible expressions of the human CYP1 family in MCF-7 and HeLa cells [J]. Toxicol Lett, 2003, 144(2): 247-256.
[13] MWENIFUMBO J C, TYNDALE R F. Genetic variability in CYP2A6 and the pharmacokinetics of nicotine [J]. Pharmacogenomics, 2007, 8(10): 1385-402.
[14] ROSSINI A, DE ALMEIDA SIMAO T, ALBANO R M, et al. CYP2A6 polymorphisms and risk for tobacco-related cancers [J]. Pharmacogenomics, 2008, 9(11): 1737-1752.
[15] STRASSER A A, MALAIYANDI V, HOFFMANN E, et al. An association of CYP2A6 genotype and smoking topography [J]. Nicotine Tob Res, 2007, 9(4): 511-518.
[16] NAKAJIMA M. Smoking behavior and related cancers: the role of CYP2A6 polymorphisms [J]. Curr Opin Mol Ther, 2007, 9(6): 538-544.
[17] NAKANO M, FUKUSHIMA Y, YOKOTA S, et al. CYP2A7 pseudogene transcript affects CYP2A6 expression in human liver by acting as a decoy for miR-126 [J]. Drug Metab Dispos, 2015, 43(5): 703-712.
[18] RIEGER J K, REUTTER S, HOFMANN U, et al. Inflammation-associated microRNA-130b down-regulates cytochrome P450 activities and directly targets CYP2C9 [J]. Drug Metab Dispos, 2015, 43(6): 884-888.
[19] ONICA T, NICHOLS K, LARIN M, et al. Dexamethasonemediated up-regulation of human CYP2A6 involves the glucocorticoid receptor and increased binding of hepatic nuclear factor 4 alpha to the proximal promoter [J]. Mol Pharmacol, 2008, 73(2): 451-460.
[20] RODRIGUEZ-ANTONA C, INGELMAN-SUNDBERG M. Cytochrome P450 pharmacogenetics and cancer [J]. Oncogene, 2006, 25(11): 1679-1691.
[21] VASILIOU V, GONZALEZ F J. Role of CYP1B1 in glaucoma [J]. Annu Rev Pharmacol Toxicol, 2008, 48(1): 333-358.
[22] BEEDANAGARI S R, TAYLOR R T, BUI P, et al. Role of epigenetic mechanisms in differential regulation of the dioxin-inducible human CYP1A1 and CYP1B1 genes [J]. Mol Pharmacol, 2010, 78(4): 608-616.
[23] TSUCHIYA Y, NAKAJIMA M, TAKAGI S, et al. MicroRNA regulates the expression of human cytochrome P450 1B1 [J]. Cancer Res, 2006, 66(18): 9090-9098.
[24] HABANO W, GAMO T, SUGAI T, et al. CYP1B1, but not CYP1A1, is downregulated by promoter methylation in colorectal cancers [J]. Int J Oncol, 2009, 34(4): 1085-1091.
[25] PATEL S A, BHAMBRA U, CHARALAMBOUS M P, et al. Interleukin-6 mediated upregulation of CYP1B1 and CYP2E1 in colorectal cancer involves DNA methylation, miR27b and STAT3 [J]. Br J Cancer, 2014, 111(12): 2287-2296.
[26] REDLICH G, ZANGER U M, RIEDMAIER S, et al. Distinction between human cytochrome P450 (CYP) isoforms and identification of new phosphorylation sites by mass spectrometry [J]. J Proteome Res, 2008, 7(11): 4678-4688.
[27] TIILI E M, ANTIKAINEN M S, MITIUSHKINA N V, et al. Effect of genotype and methylation of CYP2D6 on smoking behavior [J]. Pharmacogenet Genomics, 2015, 25(11): 531-540.
[28] PARK H J, CHOI Y J, KIM J W, et al. Differences in the epigenetic regulation of cytochrome P450 genes between human embryonic stem cell-derived hepatocytes and primary hepatocytes [J]. PLOS One. 2015, 10(7): e0132992.
[29] SHUKLA U, TUMMA N, GRATSCH T, et al. Insights into insulin-mediated regulation of CYP2E1: miR-132/-212 targeting of CYP2E1 and role of phosphatidylinositol 3-kinase, Akt (protein kinase B), mammalian target of rapamycin signaling in regulating miR-132/-212 and miR-122/-181a expression in primary cultured rat hepatocytes [J]. Drug Metab Dispos, 2013, 41(10): 1769-1777.
[30] TAKAHASHI K, ODA Y, TOYODA Y, et al. Regulation of cytochrome b5 expression by miR-223 in human liver: effects on cytochrome P450 activities [J]. Pharm Res, 2014, 31(3): 780-794.
[31] TAKAGI S, NAKAJIMA M, MOHRI T, et al. Posttranscriptional regulation of human pregnane X receptor by micro-RNA affects the expression of cytochrome P450 3A4 [J]. J Biol Chem, 2008, 283(15): 9674-9680.
[32] XIE Y, KE S, OUYANG N, et al. Epigenetic regulation of transcriptional activity of pregnane X receptor by protein arginine methyltransferase 1 [J]. J Biol Chem, 2009, 284(14): 9199-9205.
[33] PEER C J, SISSUNG T M, FIGG W D. CHIP and gp78-mediated ubiquitination of CYP3A4: Implications for the pharmacology of anticancer agents [J]. Cancer Biol Ther, 2011, 11(6): 549-551.
Study Advance on Epigenetic Regulation of Cytochrome P450 Enzymes
ZHANG Yiwen 1, FANG Luo 1, ZHENG Xiaowei 1, LI Qinglin 1, TONG Yinghui 1, BAO Meihua 2, HUANG Ping 1*(1.Department of Pharmacy, Zhejiang Cancer Hospital, Hangzhou 310022, China; 2.Changsha Medical University, Changsha 410219, China)
ABSTRACT:The cytochromes P450 (CYPs) are a family of drug-metabolizing enzymes, which are responsible for the major part of metabolism of clinically important drugs and xenobiotic substances. The high interindividual variability in CYP450 expression and activity is used attributed to gene polymorphism, while it can not explain all the variability. Epigenetics is the study of cellular and physiological phenotypic trait variations that are due to external factors that switch genes on and off and affect how cells read genes. Unlike genetics based on changes to the DNA sequence (the genotype), the changes in gene expression or cellular phenotype, these changes include histone proteins post-translational modification, DNA methylation and miRNAs. In this review, we summary the epigenetic studies on human CYP450, illusion the regulation of epigenetic on expression of these drug-metabolizing enzymes, discuss its significance in drug metabolism and clinical applications clinical practice.
KEY WORDS:CYP450; epigenetics; regulation; metabolism
中图分类号:R284.1
文献标志码:A
文章编号:1007-7693(2017)02-0293-05
DOI:10.13748/j.cnki.issn1007-7693.2017.02.031
收稿日期:2016-06-29
基金项目:国家自然科学基金(81503165);浙江省中医药科技计划项目(2015ZA038)
作者简介:张轶雯,女,博士,主管药师 Tel: (0571)88122440 E-mail: zjzyw2003@163.com *
通信作者:黄萍,女,博士,主任药师 Tel: (0571)88122438 E-mail: huangpwly@sina.com