万古霉素和利奈唑胺治疗儿童中枢神经系统感染研究进展
王法琴,杨 飞
*(兰州大学第二医院药学部临床药学科,兰州 730030)
摘要:儿童发生中枢神经系统感染时,尤其是多重耐药革兰氏阳性菌株感染时,万古霉素常常作为一线选择药物。糖肽类在正常脑脊液(cerebrospinal fluid,CSF)中药物浓度低,而在脑膜炎症时,万古霉素透入血脑屏障的药物增多,但CSF/血浆的AUC比值个体差异很大,常常导致治疗失败。利奈唑胺常用于治疗严重的革兰氏阳性菌株中枢神经系统感染,其在CSF中药物浓度与血浆中游离的药物浓度接近,透入血脑屏障基本不受脑膜炎症的影响。但利奈唑胺未批准用于中枢神经系统感染。因此,评估万古霉素和利奈唑胺治疗儿童多重耐药革兰氏阳性菌中枢神经系统感染的临床效果和不良反应仍然是重要的研究方面。
关键词:万古霉素;利奈唑胺;中枢神经系统;感染;儿童
近年来,尽管新型抗菌药物在临床广泛应用,但发生多重耐药菌株的情况却越来越严峻。中枢神经系统感染时,抗菌药物在脑脊液(cerebrospinal fluid,CSF)中快速达到杀菌浓度是临床和微生物学治疗能否成功的关键。药物的选择受其在脑脊液中的分布、清除及药物本身物理化学性质的影响。在治疗多重耐药革兰氏阳性菌株中枢神经系统感染时,可能发生由于万古霉素较难在脑脊液中达到有效治疗浓度而导致临床效果不理想或失败的案例。在这种情况下,临床常会倾向于选用利奈唑胺,但利奈唑胺说明书中无中枢神经系统感染的适应证,属于超说明书用药。因此,在抗菌药物的剂量和时间依赖性或浓度依赖杀菌模式的理论基础上,评估万古霉素和利奈唑胺在儿童脑脊液中的药动学和药效学参数,研究他们在治疗儿童中枢神经系统感染时的有效性和安全性,仍然是临床研究和药物实践的重要方面
[1]。
1 药物透过BBB屏障的影响因素
药物的物理化学性质影响药物透过血脑屏障(Blood-brain barrier,BBB)的程度。小分子药物,蛋白结合率低的药物和亲脂性化合物易进入CSF。蛋白结合率高的药物则需要从蛋白结合中解离出来,以维持循环中的药物浓度。其次,BBB炎症反应时,炎症介质的释放打破BBB细胞间的紧密连接出现漏洞。另外,CSF流出阻力增加,CSF生成和流出量比例减少,以及在促炎症释放因子作用下,流出转运蛋白,如P-糖蛋白减少,药物自BBB流出减少,导致脑脊液中药物浓度和滞留时间增加。此外,年龄也是影响药物透过BBB的重要因素,新生儿和老年患者的CSF流量较大,因此CSF/血清白蛋白比增加,使药物在CSF中的浓度增加了
[1]。
2 万古霉素和利奈唑胺的特点
万古霉素通过抑制革兰氏阳性菌细胞壁的合成发挥作用,用于治疗革兰氏阳性球菌感染,特别是耐甲氧西林金黄色葡萄球菌的感染。利奈唑胺是第一个恶唑烷酮类抗菌药物,被FDA批准用于治疗甲氧西林敏感的或耐甲氧西林葡萄球菌引起的皮肤软组织感染,或者万古霉素耐药的肠球菌和其他敏感微生物引起的感染。利奈唑胺选择性地与50S核糖体单位结合,并抑制复杂蛋白质合成的起始阶段,阻止细菌的生长和繁殖。与万古霉素相比,利奈唑胺的优势之一是其口服生物利用度高,接近100%。因此,接受静脉注射利奈唑胺的患者可以改用口服利奈唑胺,而万古霉素只能静脉给药
[2]。万古霉素和利奈唑胺特点比较见表1。
3 利奈唑胺儿科患者中的药动学研究
美国FDA批准在儿科患者中利奈唑胺的适应证包括肺炎、皮肤和软组织感染、万古霉素耐药的屎肠球菌感染。FDA未批准利奈唑胺用于导管相关血流感染和导管部位的感染,仅用于确定或高度怀疑革兰氏阳性敏感菌的治疗,以减少耐药菌。说明书提到在经脑室腹膜分流术的儿童患者给予单剂或多剂利奈唑胺后,CSF中利奈唑胺的药物浓度个体差异大,不能获得或维持一致的治疗浓度。因此,不推荐利奈唑胺经验性用于儿科中枢神经系统感染。然而,当万古霉素治疗儿科中枢神经系统感染失败后,临床常选择利奈唑胺作为二线药物治疗该类感染。因此,药品超说明书用法的发生率和药物不良反应事件的发生率均较高
[3]。
3.1 利奈唑胺可以很好地进入CSF中
由于利奈唑胺的分子量小,带中性电荷,以及是两性化合物等原因,脑膜炎症的存在对利奈唑胺渗透入CSF没有重要影响。利奈唑胺的治疗浓度较宽,在CSF中浓度和血浆中游离浓度相似。当利奈唑胺的AUC/MIC值为80~120时和T>MIC
90值>80%或Cmin值/MIC值为4~5倍时可获得最大(杀菌)治疗效果
[1]。
在无炎症的脑膜,利奈唑胺在CSF中的浓度约为血浆浓度的70%。Dotis等
[4]通过对文献的分析评价,发现儿科患者中,利奈唑胺在CSF中谷浓度为1.5~7.0 mg·L
-1,而利奈唑胺的CSF/血浆浓度比为0.8~17.0。通常,利奈唑胺对于MRSA的抑菌浓度为2 mg·L
-1,因此认为标准剂量的利奈唑胺就可以在CSF达到足够的治疗浓度和抗菌活性。而且,由于利奈唑胺的脑脊液渗透性高,因此临床效果可能比理论上的抗菌活性更明显。许多儿科患者病例报道已经证明利奈唑胺成功地治疗了革兰氏阳性菌中枢神经系统感染。即使在早产儿,也有报道利奈唑胺单药治疗或与其他抗菌药物联合使用成功地治疗脑室引流相关的CSF感染
[5]。
3.2 儿童和青少年脑脊液中利奈唑胺药动学
患儿年龄越小,利奈唑胺的清除率越高,随着年龄的增长清除率下降。利奈唑胺在脑积水患儿的脑室内药物浓度经证实与成人是相似的,但较小的儿童需要更高的给药频次。Yogev等
[6]研究了利奈唑胺不同给药方法在儿科患者脑脊液中的药动学。给药方案为利奈唑胺10 mg·kg
-1,q12h,3 d或10 mg·kg
-1,q8h,2 d,静脉滴注。结果显示,2个实验组利奈唑胺渗透进入脑室CSF的量分别为CSF/血浆总AUC
12=0.98和CSF/血浆总AUC
8=0.95,结果相似,平均C
min分别为1.26 mg·L
-1(q12h) vs 1.94 mg·L
-1(q8h)。作者认为,如果一线治疗失败,如致病菌株对利奈唑胺敏感,可选用利奈唑胺治疗儿童的中枢神经系统感染。
表1 万古霉素和利奈唑胺的特点比较
Tab.1 Comparison features of vancomycin and linezolid
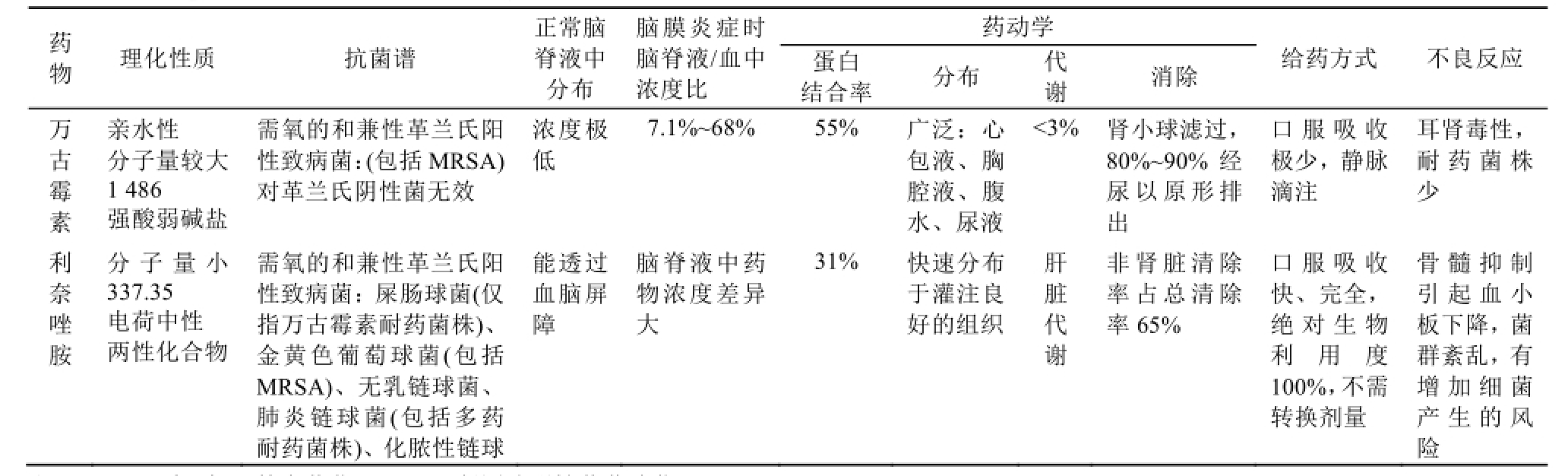
注:MRSA-耐甲氧西林金葡菌;MRSE-凝固酶阴性葡萄球菌。
Note: MRSA-Methicillin-resistant Staphylococcus aureus; MRSE-coagulase negative staphylococci.
药物 理化性质 抗菌谱正常脑脊液中分布脑膜炎症时脑脊液/血中浓度比药动学结合率分布 代谢消除蛋白给药方式 不良反应万古霉素亲水性分子量较大1 486强酸弱碱盐需氧的和兼性革兰氏阳性致病菌:(包括MRSA)对革兰氏阴性菌无效浓度极低7.1%~68%55% 广泛:心包液、胸腔液、腹水、尿液<3%肾小球滤过,80%~90%经尿以原形排出口服吸收极少,静脉滴注耳肾毒性,耐药菌株少利奈唑胺分子量小337.35电荷中性两性化合物需氧的和兼性革兰氏阳性致病菌:屎肠球菌(仅指万古霉素耐药菌株)、金黄色葡萄球菌(包括MRSA)、无乳链球菌、肺炎链球菌(包括多药耐药菌株)、化脓性链球能透过血脑屏障脑脊液中药物浓度差异大31% 快速分布于灌注良好的组织肝脏代谢非肾脏清除率占总清除率65%口服吸收快、完全,绝对生物利用度100%,不需转换剂量骨髓抑制引起血小板下降,菌群紊乱,有增加细菌产生的风险
在一项利奈唑胺在婴儿、儿童感染患者中的应用-前瞻性多中心研究中,其中包括12例中枢神经系统感染儿童,其中肺炎链球菌感染2例,其他链球菌感染1例,表皮葡萄球菌感染2例,病原菌不明感染7例。该研究将受试者分为<2岁组和≥2岁组,0~11岁给予利奈唑胺10 mg·kg
-1,q8h;>11岁给予利奈唑胺600 mg,q12h。结果显示,12例中枢神经系统感染患儿中,11例治愈,1例好转。笔者认为利奈唑胺通常是安全的,在儿童包括新生儿患者中耐受好。不良反应是可逆和已知的,然而,潜在的血液学和神经系统毒性虽然较成人发生更少,但也需要密切监测
[7]。
Chiappini等
[8]进行了利奈唑胺在儿科患者中的有效性和安全性的系统评价,其中包括中枢神经系统感染儿童16例,治愈率100%,15例未发生不良反应,1例未报道不良反应。利奈唑胺说明书中,一项研究纳入215例出生至11岁和248例5~17岁的儿童患者中评价了利奈唑胺的安全性,最长用药28 d,按不良反应发生的严重程度,利奈唑胺组报告的不良反应中轻至中度的分别为83%和99%。因此,有必要明确利奈唑胺的有效性和耐受性,并密切监测利奈唑胺的不良反应和耐药性的发生。
4 万古霉素在儿科患者中的药动学研究
脑室分流感染是导致脑室分流失败的1个常见原因。由于抗菌药物在脑脊液中的渗透性和分流管周围生物膜的形成,造成抗感染困难。脑室分流管感染以表皮葡萄球菌、金黄色葡萄球菌和肠球菌感染为主。因此万古霉素常作为抗菌药物治疗脑室分流感染,尽管使用广泛,但是万古霉素在脑室分流术患儿脑脊液中的药动学研究却很少。
Autmizguin等
[9]研究了8例脑室腹膜分流术儿科患者CSF中万古霉素药动学:平均剂量每次19 mg·kg
-1(11~30),q8h(7~13),治疗时间17 d (4~27),平均万古霉素CSF浓度为1.07 mg·L
-1(0.06~9.13),平均CSF/血浆浓度0.08(0~0.66),2例感染MRSA的脑膜炎儿童,给药间隔末的C
CSF浓度(1.15和9.13 mg·L
-1)远大于最低抑菌浓度MIC(0.75和1 mg·L
-1)。1例表皮葡萄糖球菌感染患儿给药5 h后万古霉素的C
CSF浓度(0.06 mg·L
-1)低于MIC (2 mg·L
-1)。笔者认为,在纳入儿童中,万古霉素在CSF中的浓度虽然低,但是可被检测到,渗透率不同可能是由于万古霉素在CSF中的清除率与血清中的清除率较低所致。
万古霉素进入脑脊液的渗透性依靠BBB的完整性和脑膜炎炎症的状态,要保证给予足量的剂量以便更多的药物进入CSF。神经外科手术和BBB破坏的患者,万古霉素在CSF中的浓度可能达到治疗水平。Jorgenson等
[10]在儿科患者单次静脉给药后(15~20 mg·kg
-1),超过40%的CSF样品未检测到万古霉素药物浓度。对确诊和怀疑脑室分流感染的患儿,静脉给予万古霉素10~20 mg·kg
-1,q6~12h,平均的CSF中万古霉素浓度为(2.48± 0.52)mg·L
-1(0~6.58 mg·L
-1),脑脊液/血浆的AUC比为(0.77%~18%)。笔者认为,万古霉素在脑脊液的渗透率与CNS炎症指数无相关性。尽管万古霉素在分流感染患儿的CFS中浓度较低,但不影响感染的根除。直接脑室内给药可能可以提高万古霉素在CNS中的渗透性。Sullins等
[11]观察到脑膜炎患者CSF万古霉素浓度高于无脑膜炎的患者。CSF的渗透性在早产儿较高。在分流管置入之前,预防性地给予万古霉素却在CSF中没有检测到万古霉素(7/8)。
目前,对于儿科患者万古霉素的给药剂量比较保守,大多数患者血药谷浓度均在治疗窗以下,但对于是否应用大剂量万古霉素的效益和风险常难以决策。Durham等
[12]评估了儿科复杂感染,包括脑膜炎、肺炎、骨髓炎、脓毒症、心内膜炎患者中万古霉素的剂量,研究纳入1月~18岁儿童75例,平均年龄(4.2±3.9)岁,体质量(17.0± 11.2)kg,万古霉素每次15 mg·kg
-1,q6h。结果发现仅有5例(6%)患儿初始谷浓度达到15~20 mg·L
-1,1.0~5.9岁组与其他年龄组相比,更不太可能达到(P=0.041)。34例未达到治疗谷浓度的患儿,接受了更高剂量的万古霉素(80 mg·kg
-1·d
-1)后,15例(44.1%)达到了15~20 mg·L
-1。因此认为在儿科复杂感染患者中,包括中枢神经系统感染,万古霉素每次15 mg·kg
-1,ivgtt,q6h,谷浓度不太可能达到15~20 mg·L
-1。而在这些患者(80 mg·kg
-1·d
-1)中,可能谷浓度更易达到15~20 mg·L
-1。
5 万古霉素和利奈唑胺在CNS感染中的比较研究
笔者未检索到有关比较万古霉素和利奈唑胺在儿童CNS感染中的疗效和不良反应的临床研究,仅检索到2篇体外研究。Calik等
[13]研究比较了万古霉素和利奈唑胺治疗兔子MRSA感染脑膜炎模型的抗菌效果。方法:在兔子脑室内接种ATCC43300菌株诱导脑膜炎发生,培养16 h脑膜炎形成后,万古霉素组予每次20 mg·kg
-1,q12h,利奈唑胺分为每次10和20 mg·kg
-1,q12h 2组,以及不接受任何抗菌药物的对照组,在培养结束16 h末和治疗24 h末测定CSF细菌计数。结果显示,培养16 h末细菌计数在所有组是相似的,在治疗结束24 h末万古霉素组的细菌计数下降大约是利奈唑胺20 mg·kg
-1组的2logs(P>0.05),大约是利奈唑胺10 mg·kg
-1组的4logs(P=0.037)(万古霉素组:-2.860±4.495,利奈唑胺20 mg·kg
-1组:-0.724±4.360,利奈唑胺10 mg·kg
-1组:1.39± 3.37)。全部和部分的细菌学响应方面万古霉素组高于利奈唑胺10 mg·kg
-1组(P=0.01),但是万古霉素组与利奈唑胺20 mg·kg
-1组或利奈唑胺10 mg·kg
-1组与利奈唑胺20 mg·kg
-1组相比却无统计学意义。结果表明利奈唑胺在治疗兔子MRSA感染脑膜炎模型方面并不优于万古霉素(每次20 mg·kg
-1,q12h)。而利奈唑胺10 mg·kg
-1组更是处于劣势。
对于表皮葡萄糖球菌和金黄色葡萄糖球菌引起的中枢神经系统感染,抗感染的困难在于静脉给药在CSF中难以获得足够高的药物浓度,以及分流管周围生物膜的形成。Bayston等
[14]对万古霉素和利奈唑胺体外抗脑室腹膜分流管被覆生物膜感染的活性进行了研究。试验方法,第1~7天,制备模拟脑脊液中生物膜被覆导管,第8~21天,予万古霉素50 mg·L
-1(脑室内注射)或利奈唑胺5 mg·L
-1(静脉注射),第22~28天为再生复发阶段(无抗菌药物)。结果表明,屎肠球菌引起的生物膜,不论使用万古霉素还是利奈唑胺均未被根除,葡萄糖球菌生物膜在使用2种抗菌药物2 d后均被根除并无再生,没有观察到耐药性。利奈唑胺通过静脉或口服给药均可获得有效浓度能够根除MRSE和MRSA生物膜,无论是万古霉素鞘内注射还是利奈唑胺均不能根除肠球菌生物膜,希望该体外研究结果能为利奈唑胺进一步的临床试验带来启示,以避免外科手术移除脑室腹膜分流管。
6 结论
脑膜炎症的存在对利奈唑胺渗透入CSF无重要影响,治疗浓度较宽,CSF中浓度和血浆中游离浓度相似。儿童剂量为10 mg·kg
-1,ivgtt,q8h时,C
min更高。万古霉素进入脑脊液的渗透性依靠BBB的完整性和脑膜炎炎症的状态;神经外科手术和BBB破坏的患者,CSF中万古霉素的浓度可能达到治疗水平。万古霉素血浆谷浓度15~20 mg·L
-1时,CSF和CSF/血浆AUC比变异很大,也足够达到治疗浓度,有待确证。是否可以通过提高剂量来提高CSF浓度有待进一步研究。
由于缺乏大样本随机对照研究,因此万古霉素和利奈唑胺用于中枢神经系统感染的安全性和有效性尚无明确定论。在监测血药浓度的基础上,给予足够的剂量以保证万古霉素透入CFS的量足以根除耐药革兰氏阳性菌株,但要注意监测肾毒性、听力损害等不良反应。由于利奈唑胺无中枢神经系统感染的适应症,在万古霉素治疗失败时,可选用利奈唑胺作为二线治疗药物,使用期间应注意监测骨髓抑制、二重感染、耐药性增加等不良反应。
REFERENCES
[1] DI P A, GORI G, TASCINI C, et al. Clinical pharmacokinetics of antibacterials in cerebrospinal fluid [J]. Clin Pharmacokinet, 2013, 52(7): 511-542.
[2] YUE J, DONG B R, YANG M, et al. Linezolid versus vancomycin for skin and soft tissue infections [J]. Evid Based Child Health, 2014, 9(1): 103-166.
[3] YANG X Y, ZHAO J, SHI J, et al. Visualized analysis on studies of off-label drug use in children [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(5): 620-625.
[4] DOTIS J, IOSIFIDIS E, IOANNIDOU M, et al. Use of linezolid in pediatrics: a critical review [J]. Int J Infect Dis, 2010, 14(8): e638-e648.
[5] LANGGARTNER M, MUTENTHALER A, HAIDEN N, et al. Linezolid for treatment of catheter-related cerebrospinal fluid infections in preterm infants [J]. BMJ Case Reports, 2009, 2009: doi: 10.1136/bcr.11.2008.
[6] YOGEV R, DAMLE B, LEVEY G, et al. Pharmacokinetics and distribution of linezolid in cerebrospinal fluid in children and adolescents [J]. Pediatr Infect Dis J, 2010, 29(3): 827-830.
[7] GARAZZINO S, KRZYSZTOFIAK A, ESPOSITO S, et al. Use of linezolid in infants and children: a retrospective multicenter study of the Italian Society for Paediatric Infectious Diseases [J]. J Antimicrob Chemother, 2011, 66(10): 2393-2397.
[8] CHIAPPINI E, CONTI C, GALLI L, et al. Clinical efficacy and tolerability of linezolid in pediatric patients: a systematic review [J]. Clin Ther, 2010, 32(1): 66-88.
[9] AUTMIZGUIN J, MORAN C, GONZALEZ D. Vancomycin cerebrospinal fluid pharmacokinetics in children with cerebral ventricular shunt infections [J]. Pediatr Infect Dis J, 2014, 33(10): e270-e272.
[10] JORGENSON L, REITER P D, FREEMAN J E, et al. Vancomycin disposition and penetration into ventricular fluid of the central nervous sy stem following intravenous therapy in patients with cerebrospinal devices [J]. Pediatr Neurosurg, 2007, 43(6): 449-455.
[11] SULLINS A K, ABDEL-RAHMAN S M. Pharmacokinetics of antibacterial agents in the CSF of children and adolescents [J]. Pediatr Drugs, 2013, 15(2): 93-117.
[12] DURHAM S H, SIMMONS M L, MULHERIN D W, et al. An evaluation of vancomycin dosing for complicated infections in pediatric patients [J]. Hosp Pediatr, 2015, 5(5): 276-281
[13] CALIK S, TURHAN T, TASKIN Y, et al. Vancomycin versus linezolid in the treatment of methicillin resistant Staphylococcus aureus meningitis in an experimental rabbit model [J]. Med Sci Monit, 2012, 18(11): SC5-8.
[14] BAYSTON R, ULLAS G, ASHRAF W. Action of linezolid or vancomycin on biofilms in ventriculoperitoneal shunts in vitro [J]. Antimicrob Agents Chemother, 2012, 56(6): 2842-2845.
Research Progress of Vancomycin and Linezolid on the Treatment of Central Nervous System Infections in Children
WANG Faqin, YANG Fei
*(Department of Clinical Pharmacy, Lanzhou University Second Hospital, Lanzhou 730030, China)
ABSTRACT:Vancomycin is usually selected as first-line antibacterial drugs in treatment of central nervous system(CNS) infection especialy in multidrug-resistant gram-positive strains. Glycopeptides achieve relatively low cerebrospinal fluid(CSF concentrations). However, inflamed meninges enhance the distribution of vancomycin into CSF, but the AUC ratio(CSF∶serum) of vancomycin varies from person to person, which usually lead to treatment failure. Linezolid is often used to treat severe Gram-positive infections at the CNS level. CSF linezolid concentrations have been found similar to those of the free fraction in plasma, whereas the presence of inflammation seems not to influence linezolid penetration into CSF. But, it is not licenced using linezolid in CNS infections treatment. It is important to reseach the clinical effect and adverse drug reaction of vancomycin and linezolid in the treatment of multidrug-resistant gram-positive strains of CNS infections in children.
KEY WORDS:vancomycin; linezolid; central nervous system; infection; children
中图分类号:R971
文献标志码:A
文章编号:1007-7693(2017)02-0301-04
DOI:10.13748/j.cnki.issn1007-7693.2017.02.033
收稿日期:2016-06-29
作者简介:王法琴,女,硕士,副主任药师 Tel: (0931)8942753 E-mail: wangfqpure@163.com
*
通信作者:杨飞,男,硕士,主管药师 Tel: (0931)8942753 E-mail: frankyangfei@126.com
