 ±s表示,并用SPSS 15.0统计分析软件进行处理,P值计算采用非配对双边t检验进行分析,P<0.05认为有显著性差异。
±s表示,并用SPSS 15.0统计分析软件进行处理,P值计算采用非配对双边t检验进行分析,P<0.05认为有显著性差异。
潘海强,沈 锋,崔焌辉,蔡 珂,都志军(浙江省立同德医院肛肠科,杭州 310012)
摘要:目的 探讨miR-19反义核酸与CD133 +HT29细胞亚群对多柔比星敏感性的关系并研究其机制。方法 用RT-qPCR方法检测miR-19在结直肠癌细胞中的表达水平。流式细胞术检测miR-19反义核酸和多柔比星对HT29细胞系的CD133 +细胞亚群种群比例的影响。MTT法检测miR-19反义核酸对多柔比星杀伤CD133 +HT29细胞亚群能力的影响。利用生物信息学及Western blot法验证miR-19是否调节CD133 +HT29细胞亚群中PTEN的表达。运用Western blot、免疫共沉淀、流式细胞术研究miR-19反义核酸影响多柔比星疗效的信号通路。结果 结直肠癌细胞系的miR-19表达水平显著高于正常结直肠上皮细胞系,并且CD133 +细胞中的miR-19表达水平显著高于常规结直肠癌细胞。多柔比星体外单独治疗能提高HT29细胞系中CD133 +细胞亚群的比例,然而联用miR-19反义核酸后CD133 +HT29细胞亚群的种群比例显著下降。MTT结果表明miR-19反义核酸可显著增强多柔比星对CD133 +HT29细胞亚群的杀伤活性。Western blot实验表明miR-19的靶基因可能为PTEN。MiR-19反义核酸可显著抑制CD133 +HT29细胞亚群PI3K、AKT和Bad的磷酸化,增强Bad与Bcl-2和Bcl-xl的结合,从而提高CD133 +HT29细胞亚群对多柔比星依赖的凋亡信号的敏感性,促进caspase-9和caspase-3的活化。结论 MiR-19反义核酸通过PTEN/PI3K/AKT/Bad途径提高CD133 +HT29细胞亚群对多柔比星的敏感性。
关键词:miR-19;PTEN;多柔比星;结直肠癌干细胞;Bad
肿瘤干细胞,又称为肿瘤起始细胞或干细胞样肿瘤细胞,是肿瘤组织细胞群体中一群有干细胞特征的特殊肿瘤细胞,表达CD133、Bmi-1和Oct4等干细胞表面标志。近期的文献报道这群肿瘤干细胞对化疗有较强的抵抗性,这些有很强自我更新能力的肿瘤干细胞是造成肿瘤化疗失败和复发的重要因素 [1-2]。结直肠癌是严重威胁人类健康的恶性肿瘤,由于结直肠癌较易发生肝转移,其致死率居于所有恶性肿瘤前列 [3]。对于不适宜进行手术治疗的晚期结直肠癌患者而言,化疗是一项重要的治疗手段。多柔比星又称为阿霉素,是一种抗肿瘤抗生素,它能嵌入到肿瘤细胞的DNA中,从而抑制RNA和DNA的合成并诱导细胞进入凋亡程序 [4]。多柔比星是治疗结直肠癌的有效药物,然而结直肠癌干细胞对多柔比星的高度抵抗性往往造成化疗的失败 [5],因此靶向于结直肠癌干细胞的辅助治疗是提高多柔比星的抗肿瘤活性的有效方法。
研究表明microRNA(miRNA)与肿瘤的发生和肿瘤的药物抵抗密切相关。miRNAs是一种由19~25个核苷酸组成的内源性的非编码单链RNA,它们能与目标mRNA的3’UTR(3’非编码区)发生互补配对,从而抑制mRNA的转录并使之降解,调节相应基因的表达 [6]。研究表明,miRNA在肿瘤细胞中调节各种生理活动,影响细胞的增殖、分化、凋亡等功能 [7]。本研究的目的在于探讨miR-19反义核酸是否能调节结直肠癌干细胞对多柔比星治疗的敏感性。
1.1 细胞培养
人正常结直肠上皮细胞系FHC [8],人结直肠癌细胞系HT29,SW480,SW620购于美国ATCC。CD133 +HT29细胞亚群用流式细胞仪进行分选,CD133阳性的HT29细胞即为HT29肿瘤干细胞 [9]。各细胞系培养在含10%胎牛血清的DMEM培养基中,在37 ℃恒温培养箱中培养,通入5% CO 2。
1.2 试剂和仪器
多柔比星(批号:D1515)、噻唑蓝(MTT)、凋亡检测试剂盒(批号:APOAF)购于美国Sigma-Aldrich。DMEM培养基购于美国Gibco;蛋白提取液、PTEN、磷酸化PI3K、磷酸化AKT、磷酸化Bad、活化caspase-9、活化caspase-3、Bad、Bcl-2、Bcl-xl和β-actin兔抗人抗体购于美国Cell Signaling。CD133-FITC荧光抗体购于美国BD公司。MiR-19反义核酸(ACACGUUUAGGUACGU UUUGACU),阴性对照寡核苷酸(NCO,UUGUUACUUACACUGUAGACGGU),PTEN siRNA (sense:GCACAAGAGGCCCUAGAUUTT,antisense:AAUCUAGGGCCUCUUGUGCTT)购于上海吉玛生物;Trizol试剂、Lipofectamine 2000购于美国Invitrogen。SYBR Green试剂(大连TaKaRa);PCR引物由上海生工生物工程有限公司合成;ECL试剂盒(美国Pierce,批号:34079);蛋白G免疫共沉淀琼脂糖珠(美国Santa Cruz);TECAN Sunrise Microplate Reader型酶标仪(瑞士TECAN公司)。BD FACSAria II型流式细胞分选仪(美国BD Biosciences公司)。Mini-PROTEAN Tetra型电泳仪号(美国Bio-Rad公司)。
2.1 HT29肿瘤干细胞的分选
CD133阳性的HT29细胞被认为是HT29肿瘤干细胞 [9]。分选步骤如下:将HT29细胞系用FITC标记的CD133抗体在冰上暗处孵育40 min。孵育完毕后用冰预冷的生理盐水将细胞在1 200 r·min -1下离心清洗2次后用流式细胞仪进行细胞分选。CD133阳性的HT29细胞即为HT29肿瘤干细胞。
2.2 荧光定量PCR检测miR-19的表达
将培养细胞的总RNA用Trizol试剂按操作说明书进行提取,以提取的总RNA为模板,采用茎环法用miR-19特异性引物进行逆转录。miR-19的逆转录引物序列:5′-CTCAACTGGTGTCGTGG AGTCGGCAATTCAGTTGAGACACGUUU-3′。之后以逆转录产物为模板,用SYBR Green试剂按其试剂说明书操作步骤进行定量PCR扩增,以U6 snRNA作为内参。
2.3 MTT法检测多柔比星对CD133 +HT29细胞亚群和常规HT29细胞的杀伤活性
将CD133 +HT29细胞亚群和常规HT29细胞按每孔5×10 3接种在96孔板上孵育过夜,用(0~2 μg·mL -1)多柔比星处理肿瘤细胞48 h,之后加入20 mL MTT (5 mg·mL -1)培养4 h,移除孔内培养基,加入100 μL二甲亚砜,570 nm波长下测定OD值。细胞活力结果用多柔比星处理组与对照组的OD值比值表示。
2.4 MTT法检测miR-19反义核酸和多柔比星对CD133 +HT29细胞亚群细胞活力的影响
将CD133 +HT29细胞亚群按每孔5×10 3接种在96孔板上,分为对照组、多柔比星组、miR-19反义核酸组和多柔比星+miR-19反义核酸组。对照组为CD133 +HT29细胞亚群用Lipofectamine 2000转染NCO培养24 h,之后更换新鲜培养基不加药物继续培养48 h。多柔比星组为CD133 +HT29细胞亚群用Lipofectamine 2000转染NCO培养24 h,之后更换新鲜培养基加入1 μg·mL -1多柔比星继续培养48 h。miR-19反义核酸组为CD133 +HT29细胞亚群用Lipofectamine 2000转染miR-19反义核酸培养24 h,之后更换新鲜培养基不加药物继续培养48 h。多柔比星+miR-19反义核酸组为CD133 +HT29细胞亚群用Lipofectamine 2000转染miR-19反义核酸培养24 h,之后更换新鲜培养基加入1 μg·mL -1多柔比星继续培养48 h。处理完毕后在细胞培养基中加入20 mL MTT (5 mg·mL -1)培养4 h,移除孔内培养基,加入100 μL二甲亚砜,570 nm波长下用酶标仪测定OD值。细胞活力结果用实验组与对照组的OD值比值表示。
2.5 CD133 +HT29细胞亚群所占比例的测定
按“2.4”项下方法处理HT29细胞系,之后在细胞培养基中加入CD133抗体在暗处孵育20 min后将细胞用流式细胞仪进行分析,计算CD133阳性的HT29细胞所占总HT29细胞的比例。
2.6 免疫共沉淀
按“2.4”项下方法处理CD133 +HT29细胞亚群,之后对细胞进行计数,取2×10 6的各组细胞用免疫沉淀缓冲液进行裂解,缓冲液的成分如下:50 mmol·L -1Tris-HCl (pH 7.4),1% NP-40细胞裂解液,150 mmol·L -1NaCl,1 mmol·L -1EDTA,1%混合蛋白酶抑制剂(Sigma-Aldrich)。CD133 +HT29细胞亚群在裂解液下处理15 min后,将其在12 000 r·min -1下离心10 min,收取上清液并在其中加入Bad抗体孵育过夜,之后加入蛋白G琼脂糖珠孵育2 h。孵育完成后将其在1 200 r·min -1速度下离心5 min,将琼脂糖珠离心至管底,之后将上清小心吸去,琼脂糖珠用免疫沉淀缓冲液洗涤2次后加入Western blot上样缓冲液,沸水浴煮5 min后备用,用于检测与Bad结合的Bcl-2和Bcl-xl蛋白。
2.7 Western blot试验
按“2.4”项下方法处理CD133 +HT29细胞亚群,之后用蛋白提取液提取总蛋白质。将总蛋白质或从“2.5”所述步骤中得到的免疫共沉淀蛋白用12.5% SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用PTEN、磷酸化PI3K、磷酸化AKT、磷酸化Bad、活化caspase-9、活化caspase-3、Bad、Bcl-2、Bcl-xl或β-actin兔抗人抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2 h,蛋白条带用ECL试剂盒显色发光。
2.8 细胞凋亡试验
按“2.4”项下方法处理CD133 +HT29细胞亚群,之后按照凋亡试剂盒说明书步骤将PI(碘化丙啶)和Annexin-V加入细胞中孵育20 min,采用流式细胞术检测肿瘤细胞的凋亡,Annexin-V阳性细胞即为凋亡细胞。
2.9 统计学方法
实验重复3次,实验数据用
 ±s表示,并用SPSS 15.0统计分析软件进行处理,P值计算采用非配对双边t检验进行分析,P<0.05认为有显著性差异。
±s表示,并用SPSS 15.0统计分析软件进行处理,P值计算采用非配对双边t检验进行分析,P<0.05认为有显著性差异。
3.1 结直肠癌CD133 +细胞亚群过表达miR-19
荧光定量PCR结果显示,结直肠癌细胞的miR-19表达水平显著高于正常结直肠上皮细胞FHC(图1A)。将3种结直肠癌细胞系的CD133 +细胞亚群分离出来后进行PCR检测,结果显示结直肠癌CD133 +细胞亚群的miR-19表达水平与常规结直肠癌细胞相比显著升高(图1B),表明miR-19可能在结直肠癌CD133 +细胞亚群中发挥促肿瘤作用。
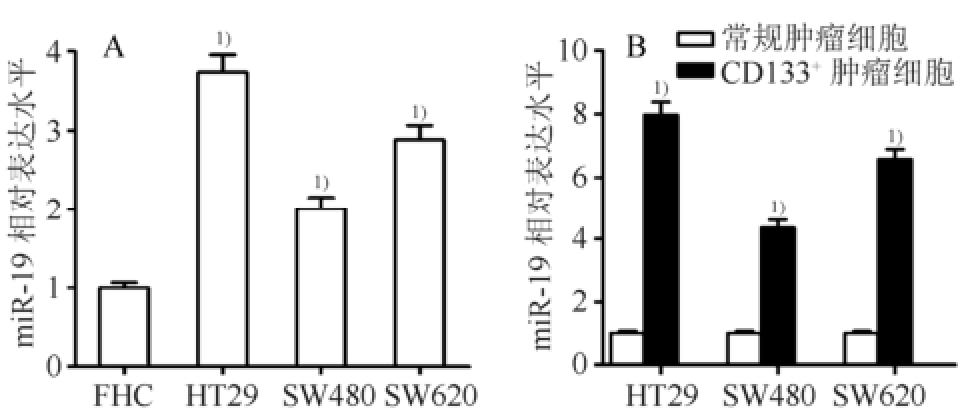
图1 结直肠癌CD133
+细胞亚群过表达miR-19(n=3,
 ±s)
±s)
A-miR-19的表达水平在结直肠癌细胞中显著下调;与FHC细胞相比,
1)P<0.05;B-结直肠癌CD133
+细胞亚群的miR-19表达水平显著高于常规结直肠癌细胞;与相应的常规结直肠癌细胞相比,
1)P<0.05。
Fig.1 miR-19 was overexpressed in the CD133
+colorectal cancer cells(n=3,
 ±s)
±s)
A-the expression of miR-19 was significantly up-regulated in the colorectal cancer cells; compared with the FHC cells,
1)P<0.05; B-the expression of miR-19 was significantly higher in the CD133
+colorectal cancer cells than that in the routine colorectal cancer cells; compared with the corresponding routine colorectal cancer cells,
1)P<0.05.
3.2 miR-19反义核酸提高CD133 +HT29细胞亚群对多柔比星的敏感性
MTT实验结果显示,CD133 +HT29细胞亚群对多柔比星的敏感性显著低于常规HT29细胞,表明CD133 +HT29细胞亚群对多柔比星存在抵抗性(图2A)。为了研究miR-19反义核酸是否能增强多柔比星对CD133 +HT29细胞亚群的杀伤活性,在CD133 +HT29细胞亚群中转染miR-19反义核酸,miR-19反义核酸的转染效率见图2B。流式细胞实验结果显示,多柔比星单独治疗能显著提高HT29细胞系中CD133 +细胞的比例,然而联用miR-19反义核酸后,CD133 +HT29细胞亚群的比例显著下降(图2C)。同时,MTT实验结果显示转染miR-19反义核酸能显著提高多柔比星对CD133 +HT29细胞亚群的杀伤活性(图2D)。这些实验结果表明miR-19反义核酸能显著提高CD133 +HT29细胞亚群对多柔比星的敏感性。

图2 miR-19反义核酸提高CD133
+HT29细胞亚群对多柔比星的敏感性(n=3,
 ±s)
±s)
A-CD133
+HT29细胞亚群对多柔比星的敏感性显著低于常规HT29肿瘤细胞;与相同浓度多柔比星处理的常规HT29肿瘤细胞相比,
1)P<0.05。B-转染miR-19反义核酸显著抑制HT29细胞中的miR-19表达水平;与NCO组相比,
1)P<0.05。C-miR-19反义核酸抑制多柔比星依赖的CD133
+HT29细胞亚群比例的上调;与NCO组相比,
1)P<0.05;与多柔比星组相比,
2)P<0.05。D-转染miR-19反义核酸显著提高CD133
+HT29细胞亚群对多柔比星的敏感性;与NCO组相比,
1)P<0.05;与多柔比星组相比,
2)P<0.05。
Fig.2 miR-19 antisense oligonucleotides increased the sensitivity of CD133
+HT29 cell subsets to doxorubicin(n=3,
 ±s)
±s)
A-the sensitivity to doxorubicin in the CD133
+HT29 cell subsets was significantly lower than that in the routine HT29 cells; compared with the routine HT29 cancer cells treated with equal concentrations of doxorubicin,
1)P<0.05. B-transfection with miR-19 antisense oligonucleotides significantly inhibited the expression of miR-19 in the HT29 cells; compared with the NCO group,
1)P<0.05. C-miR-19 inhibited the doxorubicin-dependent enrichment of CD133
+HT29 cell population; compared with the NCO group,
1)P<0.05; compared with the doxorubicin group,
2)P<0.05. D-miR-19 antisense oligonucleotides significantly enhanced the sensitivity of CD133
+HT29 cell subsets to doxorubicin; compared with the NCO group,
1)P<0.05; compared with the doxorubicin group,
2)P<0.05.
3.3 miR-19反义核酸上调CD133 +HT29细胞亚群中PTEN的表达
生物信息学(http://www.targetscan.org/)结果表明PTEN mRNA 3’UTR的第411~417位碱基序列(UUUGCAC),第1221~1228位碱基序列(UUUGCACA),第2252~2258位碱基序列(UUUGCAC)均能与miR-19互补结合,提示PTEN可能是miR-19的靶点。Western blot实验结果显示,3种结直肠癌CD133 +细胞的PTEN表达水平均显著低于相应常规结直肠癌细胞(图3A),结合图1B的结果,表明在结直肠癌CD133 +细胞中miR-19的表达水平与PTEN呈负相关。通过进一步的实验结果显示在CD133 +HT29细胞亚群中转染miR-19反义核酸后PTEN的表达水平显著上升,表明PTEN是miR-19的直接靶点且miR-19反义核酸能显著上调CD133 +HT29细胞亚群中PTEN的表达水平(图3B)。
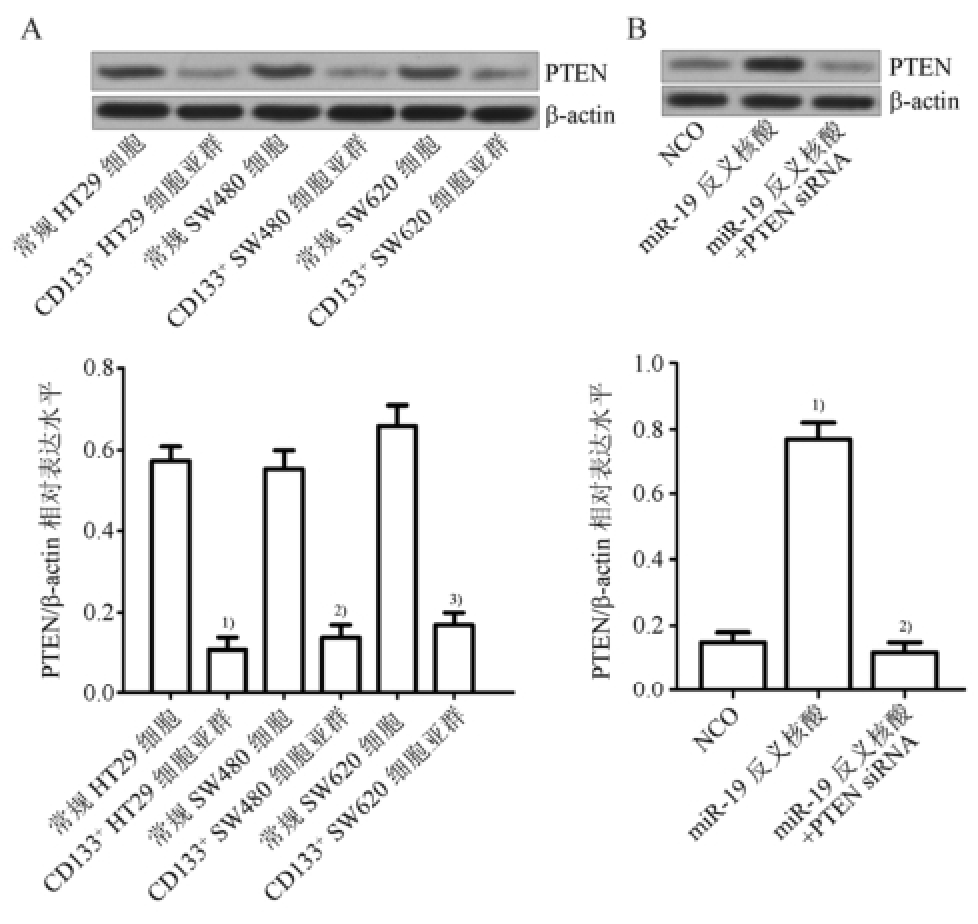
图3 miR-19反义核酸上调CD133
+HT29细胞亚群中PTEN的表达(n=3,
 ±s)
±s)
A-PTEN表达水平在结直肠癌CD133
+细胞中显著下调;与常规HT29细胞相比,
1)P<0.05;与常规SW480细胞相比,
2)P<0.05;与常规SW620细胞相比,
3)P<0.05。B-miR-19反义核酸上调CD133
+HT29细胞亚群中PTEN的表达水平;与NCO组相比,
1)P<0.05;与miR-19反义核酸组相比,
2)P<0.05。
Fig.3 miR-19 antisense oligonucleotides up-regulated the expression of PTEN in the CD133
+HT29 cell subsets(n=3,
 ±s)
±s)
A-the expression of PTEN was significantly down-regulated in the colorectal CD133
+stem cells; compared with the routine HT29 cancer cells,
1)P<0.05; compared with the routine SW480 cancer cells,
2)P<0.05; compared with the routine SW620 cancer cells,
3)P<0.05. B-the expression of PTEN was up-regulated by miR-19 antisense oligonucleotides in the CD133
+HT29 cell subsets; compared with the NCO group,
1)P<0.05; compared with the miR-19 antisense oligonucleotides group,
2)P<0.05.
3.4 MiR-19反义核酸通过PTEN/PI3K/AKT/Bad途径提高CD133 +
HT29细胞亚群对多柔比星的敏感性Western blot实验结果显示,转染miR-19反义核酸能显著抑制PI3K、AKT和Bad的磷酸化,而多柔比星单独处理对PI3K、AKT和Bad的磷酸化水平影响不大,同时转染PTEN siRNA能显著减弱miR-19反义核酸对PI3K、AKT和Bad磷酸化程度的抑制作用,表明miR-19反义核酸通过上调PTEN的表达抑制CD133 +HT29细胞亚群中PI3K/AKT/Bad通路的磷酸化(图4A)。图4B的结果显示miR-19反义核酸诱导的Bad去磷酸化显著增强了Bad蛋白与Bcl-2和Bcl-xl的相互作用,从而抑制了Bcl-2和Bcl-xl的活性。进一步实验结果显示,miR-19反义核酸能显著促进多柔比星依赖的caspase-9和caspase-3的活化(图5A),最后诱导CD133 +HT29细胞亚群发生凋亡(图5B)。另外,转染PTEN siRNA后多柔比星联合miR-19反义核酸诱导的Bcl-2和Bcl-xl的失活和凋亡的发生均受到显著抑制,表明miR-19反义核酸通过上调PTEN的表达促进多柔比星诱导的凋亡途径。
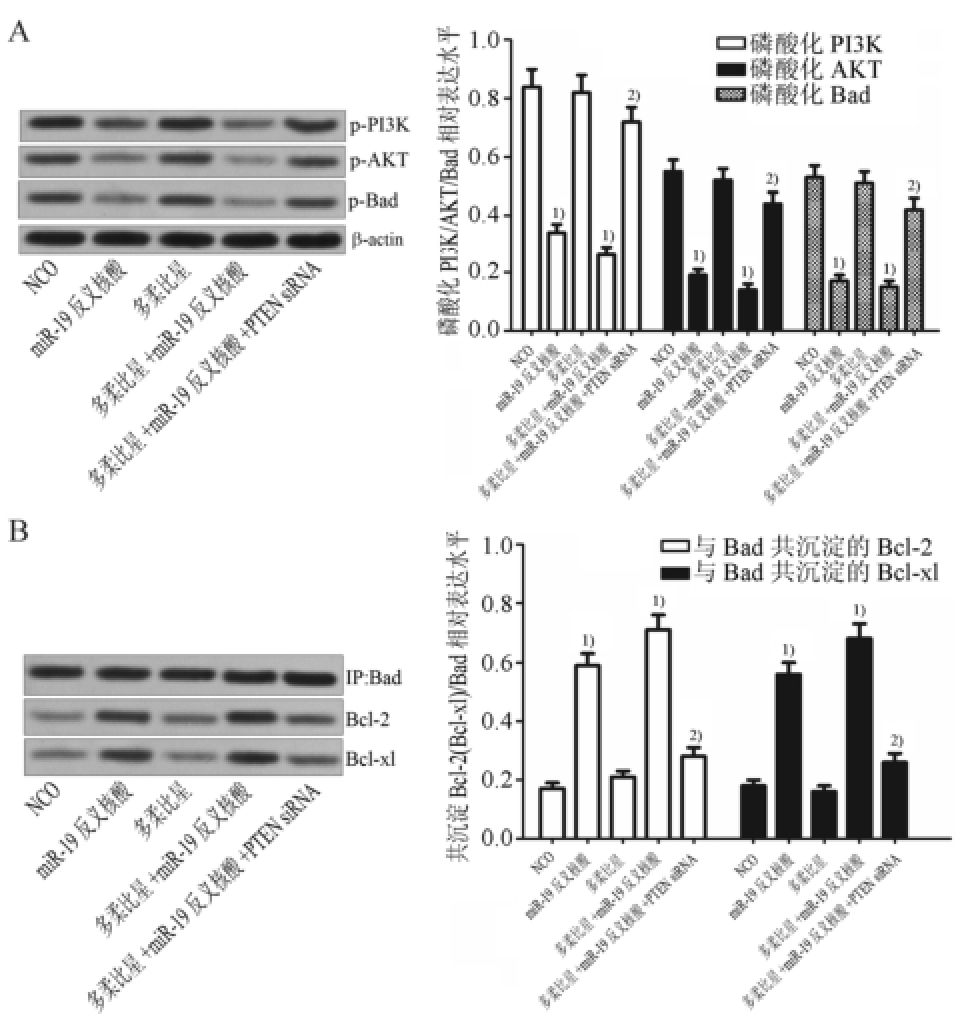
图4 MiR-19反义核酸通过PTEN/PI3K/AKT途径促进Bad与Bcl-2及Bcl-xl的相互作用(n=3,
 ±s)
±s)
A-miR-19反义核酸抑制CD133
+HT29细胞亚群中PI3K、AKT和Bad的磷酸化;与NCO组比较,
1)P<0.05;与多柔比星+miR-19反义核酸组相比,
2)P<0.05。B-miR-19增强反义核酸增强Bad与Bcl-2和Bcl-xl蛋白的相互作用;与NCO组比较,
1)P<0.05;与多柔比星+miR-19反义核酸组相比,
2)P<0.05。
Fig.4 MiR-19 antisense oligonucleotides promoted the interaction with Bad and Bcl-2/Bcl-xl through the PTEN/PI3K/AKT pathway(n=3,
 ±s)
±s)
A-miR-19 antisense oligonucleotides inhibited the phosphorylation of PI3K, AKT, and Bad; compared with the NCO group,
1)P<0.05; compared with the doxorubicin+ miR-19 antisense oligonucleotides group,
2)P<0.05. B-miR-19 antisense oligonucleotides enhanced the interaction with the Bad and the Bcl-2 as well as the Bcl-xl; compared with the NCO group,
1)P<0.05; compared with the doxorubicin+ miR-19 antisense oligonucleotides group,
2)P<0.05.

图5 MiR-19反义核酸提高多柔比星对CD133
+HT29细胞亚群的凋亡诱导活性(n=3,
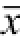 ±s)
±s)
A-miR-19反义核酸促进多柔比星依赖的caspase-9和caspase-3的活化;与NCO相比,
1)P<0.05;与多柔比星组相比,
2)P<0.05;与多柔比星+miR-19反义核酸组相比,
3)P<0.05。B-miR-19反义核酸促进多柔比星依赖的凋亡的发生;与NCO相比,
1)P<0.05;与多柔比星组相比,
2)P<0.05;与多柔比星+miR-19反义核酸组相比,
3)P<0.05。
Fig.5 MiR-19 antisense oligonucleotides increased the sensitivity of CD133
+HT29 cell subsets to doxorubicininduced apoptosis(n=3,
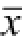 ±s)
±s)
A-miR-19 antisense oligonucleotides promoted the doxorubicindependent activation of caspase-9 and caspase-3; compared with the NCO group,
1)P<0.05; compared with the doxorubicin group,
2)P<0.05; compared with the doxorubicin + antisense oligonucleotides group,
3)P<0.05. B-miR-19 antisense oligonucleotides promoted the doxorubicin-dependent apoptosis in the CD133
+HT29 cell subsets; compared with the NCO group,
1)P<0.05; compared with the doxorubicin group,
2)P<0.05; compared with the doxorubicin + antisense oligonucleotides group,
3)P<0.05.
研究表明miR-19在多种肿瘤中是一个肿瘤促进因子,如Li等 [10]发现miR-19在肺癌细胞中过表达,且miR-19能通过促进肿瘤细胞的上皮间质转化(epithelial-mesenchymal transition)促进肺瘤的侵袭和转移。在结直肠癌中,也有报道表明miR-19通过下调谷氨酰胺转移酶-2的表达诱导肿瘤细胞发生转移 [11],然而miR-19在肿瘤干细胞中的作用,至今仍很少报道。在本研究中,实验结果显示3种结直肠癌细胞系的miR-19水平显著高于正常结肠上皮细胞系FHC,提示miR-19在结直肠癌中起肿瘤促进作用,这与文献报道一致。更为重要的是,实验结果显示miR-19在CD133 +HT29细胞亚群中异常高表达,而阻断miR-19后该群细胞对多柔比星的敏感性显著提高,表明miR-19反义核酸能以CD133 +细胞为靶点提高多柔比星对结直肠癌的治疗效果。
PTEN是一种已知的抑癌基因,能通过抑制PI3K/AKT信号通路阻断肿瘤的发生。研究表明PTEN在多种肿瘤中表达失调,PTEN基因的突变或缺失是肿瘤发生的一个独立危险因素 [12-13]。最近的文献报道PTEN的表达受miRNAs的调控,因此miRNAs/PTEN通路和肿瘤的生长、迁移、侵袭和化疗抵抗密切相关 [14-15]。在本研究中,作者发现PTEN基因在结直肠癌CD133 +细胞中受miR-19的调控,且miR-19/PTEN通路决定了CD133 +HT29细胞亚群对多柔比星的敏感性。
Bad是Bcl-2促凋亡蛋白家族成员,是AKT激酶的底物。非磷酸化的Bad能通过与抗凋亡蛋白Bcl-2和Bcl-xl结合,使之失活从而发挥促凋亡作用。然而,当Bad被PI3K/AKT途径磷酸化后,磷酸化的Bad会从其与Bcl-2或Bcl-xl形成的异二聚体中分离出来,并与14-3-3支架蛋白结合从而失去促凋亡活性 [16-17]。本研究的实验结果表明miR-19反义核酸能上调结直肠癌干细胞中的PTEN表达水平,从而抑制肿瘤细胞的PI3K/AKT通路,使Bad蛋白保持在非磷酸化活性状态中,从而抑制Bcl-2和Bcl-xl的抗凋亡活性提高了CD133 +HT29细胞亚群对多柔比星诱导的凋亡通路的敏感性。
综上所述,本研究证明了miR-19反义核酸能显著降低结直肠癌CD133 +细胞对多柔比星的抵抗性。通过机制研究发现,miR-19反义核酸通过上调PTEN的表达抑制PI3K/AKT/Bad信号通路,从而促进多柔比星对CD133 +细胞的凋亡诱导活性。这些研究为如何提高多柔比星对结直肠癌的疗效提供了新的思路。
REFERENCES
[1] SCHMOHL J U, VALLERA D A. CD133, selectively targeting the root of cancer [J]. Toxins (Basel), 2016, 8(6): E165.
[2] ZHANG G F, LI C X, CHEN H B, et al. Cancer stem cell targets-a review [J]. Eur Rev Med Pharmacol Sci, 2016, 20(10): 2045-2051.
[3] DU Z, YU Y, ZHANG W. Adverse events of bevacizumab in patients with metastatic colorectal cancer: a meta-analysis [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2012, 29(6): 542-547.
[4] KANNO S I, YOMOGIDA S, ISHIKAWA M, et al. Combined effect of papuamine and doxorubicin in human breast cancer MCF-7 cells [J]. Oncol Lett, 2014, 8(2): 547-550.
[5] ATASHPOUR S, FOULADDEL S, AZIZI E, et al. Quercetin induces cell cycle arrest and apoptosis in CD133(+) cancer stem cells of human colorectal HT29 cancer cell line and enhances anticancer effects of doxorubicin [J]. Iran J Basic Med Sci, 2015, 18(7): 635-643.
[6] GARGALIONIS A N, BASDRA E K. Insights in microRNAs biology [J]. Curr Top Med Chem, 2013, 13(13): 1493-1502.
[7] HE H, TIAN W, JIANG K, et al. MiR-944 functions as a novel oncogene and regulates the chemoresistance in breast cancer [J]. Tumour Biol, 2016, 37(2): 1599-1607.
[8] TAO Y J, LI Y J, XU L, et al. Antisense oligonucleotides against microRNA-21 reduced the proliferation and migration of human colon carcinoma cells [J]. Cancer Cell Int, 2015, 15(1): 1-10.
[9] DOU J, NI Y, ZHAO F, et al. Decreasing lncRNA HOTAIR expression inhibits human colorectal cancer stem cells [J]. Am J Transl Res, 2016, 8(1): 98-108.
[10] LI J, YANG S, XIAO D, et al. MicroRNA-19 triggers epithelial-mesenchymal transition of lung cancer cells accompanied by growth inhibition [J]. Lab Invest, 2015, 95(9): 1056-1070.
[11] CELLURA D, PICKARD K, PEAKE N J. miR-19-Mediated Inhibition of Transglutaminase-2 Leads to Enhanced Invasion and Metastasis in Colorectal Cancer [J]. Mol Cancer Res, 2015, 13(7): 1095-1105.
[12] TAY Y, KATS L, PANDOLFI P P. Codingindependent regulation of the tumor suppressor PTEN by competing endogenous mRNAs [J]. Cell, 2011, 147(2): 344-357.
[13] XU W, YANG Z, LU N, et al. Posttranslational regulation of phosphatase and tensin homolog (PTEN) and its functional impact on cancer behaviors [J]. Drug Des Devel Ther, 2014, 8(10): 1745-1751.
[14] WU W, YANG J, ZHOU Y, et al. MicroRNA-32 (miR-32) regulates phosphatase and tensin homologue (PTEN) expression and promotes growth, migration, and invasion in colorectal carcinoma cells [J]. Mol Cancer, 2013, 12(1): 186-195.
[15] MA F, ZHANG J, GUO B, et al. Upregulated microRNA-301a in breast cancer promotes tumor metastasis by targeting PTEN and activating Wnt/beta-catenin signaling [J]. Gene, 2014, 535(2): 191-197.
[16] FU Z, YANG J, LI J, et al. Effects of piceatannol and pterostilbene against β-amyloid-induced apoptosis on the PI3K/Akt/Bad signaling pathway in PC12 cells [J]. Food Funct, 2016, 7(2): 1014-1023.
[17] ZHANG H, XIONG Z, ZHANG Z, et al. Glucagon-like peptide-1 protects cardiomyocytes from advanced oxidation protein product-induced apoptosis via the PI3K/Akt/Bad signaling pathway [J]. Mol Med Rep, 2016, 13(2): 1593-601.
Study the Relationship Between MiR-19 Antisense Oligonucleotides and the Sensitivity of CD133 +HT29 Cell Subsets to Doxorubicin
PAN Haiqiang, SHEN Feng, CUI Junhui, CAI Ke, DU Zhijun(Department of Anus-intestines, Tongde Hospital of Zhejiang Province, Hangzhou 310012, China)
ABSTRACT:OBJECTIVE To investigate the relationship between the miR-19 and the sensitivity of colorectal cancer stem cells to doxorubicin. METHODS The expression of miR-19 was detected by RT-qPCR assay in the colorectal cancer stem cells. Flow cytometry analysis was performed to measure the percentage of CD133 +population in the HT29 cell line treated with miR-19 and doxorubicin. MTT assay was performed to evaluate the effect of miR-19 antisense oligonucleotides on the doxorubicin-induced cell death in the CD133 +HT29 cell subsets. Bioinformatics and Western blot assays were performed to determine whether the expression of PTEN is regulated by miR-19. Western blot, co-immunoprecipitation and flow cytometry assays were performed to study the pathway of apoptosis in the CD133 +HT29 cell subsets co-treated with miR-19 antisense oligonucleotides and doxorubicin. RESULTS The expression of miR-19 was significantly higher in the colorectal cancer cell lines than that in the normal colorectal epithelial cell line. In addition, the expression of miR-19 was up-regulated in the cancer stem cells compared with the routine colorectal cancer cells. Single treatment of doxorubicin increased the percentage of CD133 +HT29 cell population. However, the combination with miR-19 antisense oligonucleotides significantly inhibited the enrichment of CD133 +cell population induced by the doxorubicin. In addition, the results of MTT assay showed that the anti-tumor effect of doxorubicin could be significantly enhanced when the miR-19 antisense oligonucleotides were transfected into the CD133 +HT29 cell subsets. The results of western blot indicated that the PTEN gene was the target of miR-19. Furthermore, the miR-19 antisense oligonucleotides significantly inhibited the phosphorylation of PI3K, ATK and Bad and increased the interaction with the Bad and Bcl-2 as well as Bcl-xl. Subsequently, the sensitivity of CD133 +HT29 cell subsets to the doxorubicin-induced apoptosis was significantly enhanced, and the activation of caspase-9 and caspase-3 was promoted. CONCLUSION MiR-19 antisense oligonucleotides increased the sensitivity of CD133 +HT29 cell subsets to doxorubicin through PTEN/PI3K/AKT/Bad pathway.
KEY WORDS:miR-19; PTEN; doxorubicin; colorectal cancer stem cells; Bad
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2017)02-0215-06
DOI:10.13748/j.cnki.issn1007-7693.2017.02.014
收稿日期:2016-06-16
作者简介:潘海强,男,硕士,主治医师 Tel: (0571)89972372 E-mail: tongdepanhaiqiang@163.com