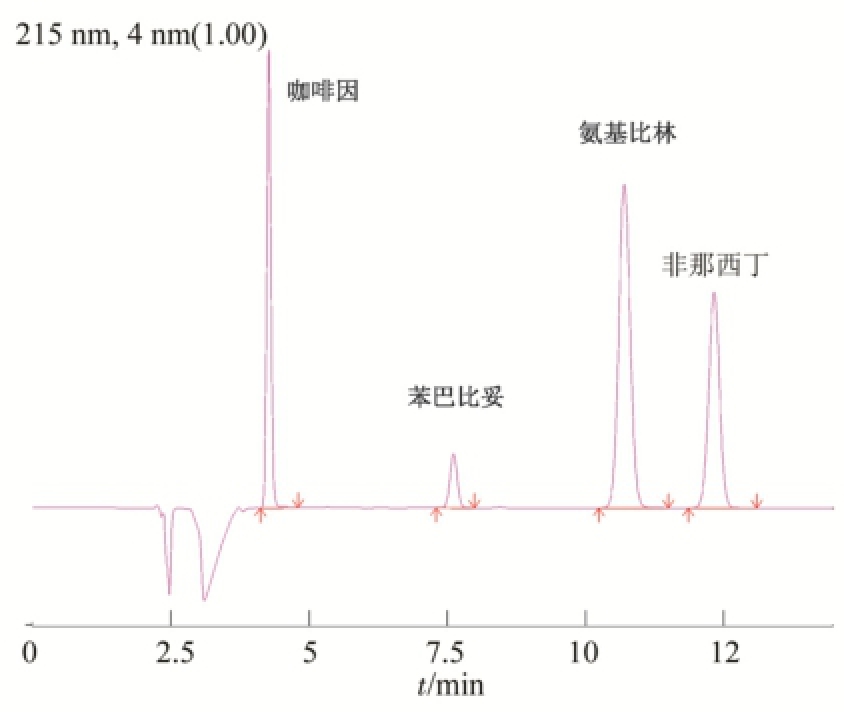
图1 去痛片溶出度测定供试液的色谱图(取样时间:30 min)
Fig.1 HPLC chromatogram of compound aminopyrine phenacetin tablets for dissolution test(sampling time: 30 min)
朱培曦 1,魏 炜 2,陆静娴 1,陶巧凤 3*(1.浙江省食品药品检验研究院,杭州 310000;2.浙江工业大学药学院,杭州 310014;3. 浙江省药品化妆品审评中心,杭州 310012)
摘要:目的 建立去痛片中氨基比林、非那西丁、咖啡因和苯巴比妥的溶出度测定方法。方法 采用浆法,以0.1 mol·L -1盐酸溶液900 mL为溶出介质,转速为50 r·min -1。应用高效液相色谱法,色谱柱为Kromasil C 18柱(250 mm×4.6 mm,5 μm),磷酸二氢钾溶液-甲醇(60∶40)为流动相,检测波长为215 nm,测定去痛片的溶出量。结果 不同厂家去痛片的溶出曲线存在明显差异。结论 所建方法可为提高去痛片的质量标准,建立合理的溶出度测定方法提供依据。
关键词:去痛片;溶出度测定;高效液相色谱法
去痛片,又名索密痛片,是由氨基比林(150 mg)、非那西丁(150 mg)、咖啡因(50 mg)和苯巴比妥(15 mg)组成的复方制剂,临床上主要用于解热、镇痛及抗风湿作用,适用于发热、头痛、神经痛、牙痛、月经痛、肌肉痛以及风湿痛、类风湿关节炎等疾病 [1]。查询国家食品药品监督管理总局网站数据库,目前共有614个去痛片批准文号。去痛片价格低廉,临床上仍在广泛使用。
去痛片质量标准收载在较早的卫生部药品标准化学药品与制剂分册,使用容量法对其中4种成分进行含量测定,专属性欠佳,且作为口服固体制剂未对溶出度测定方法进行研究制定 [2]。溶出方法的建立可以更好地控制药品的内在质量,有利于保持和控制批间的一致性 [3-6]。经查阅相关文献,类似解热镇痛复方制剂已经有报道对其体外溶出行为进行控制,因此有必要对去痛片进行相关研究 [7-12]。另去痛片所含氨基比林和非那西丁均有明显不良反应,有必要建立能反映内在质量的控制指标,在确保临床疗效同时降低其不良反应。本研究建立了去痛片溶出度测定方法,并参照国家局发布的去痛片补充检验含量测定方法(批件编号:2003011),采用液相色谱方法同时对4种成分进行分析,并考察了3个厂家供试品的体外溶出度,为提高去痛片的质量标准和科学评价提供实验依据 [13]。
LC-20AT液相色谱仪(日本岛津公司);AT7 Smart全自动溶出仪(瑞士Sotax公司);MS 205Du分析天平(瑞士梅特勒-托利多公司);氨基比林对照品(批号:100503-200301,含量:100.0%)、苯巴比妥对照品(批号:171222-200605,含量:99.7%)均由中国食品药品检定研究院提供;无水咖啡因对照品(批号:BW3508,含量:100.0%)由国家标准物质研究中心提供;非那西丁对照品(含量:100.0%)由企业提供精制品;去痛片由3个厂家提供(A厂:20130134,B厂:36131001、10501、120501,C厂:1312018、1312019、1312020);甲醇(色谱纯,德国Merck公司);其余均为分析纯。
2.1 溶液的制备
2.1.1 对照品溶液 精密称取氨基比林、非那西丁、咖啡因、苯巴比妥对照品适量,加溶出介质溶解并定量稀释制成每1 mL中各约含0.15,0.15,0.05,0.015 mg的溶液,作为对照品溶液。
2.1.2 供试品溶液 分别取7批供试品,照溶出度测定法,以0.1 mol·L -1盐酸溶液900 mL为溶出介质,转速50 r·min -1,在各选定时间点取溶液10 mL滤过,取续滤液作为供试品溶液。
2.2 色谱条件
Shimadzu LC-20AT型高效液相色谱仪,色谱柱为Kromasil C 18柱(250 mm×4.6 mm,5 μm),流动相为磷酸二氢钾溶液(取磷酸二氢钾约6.8 g,用水溶解并稀释至1000 mL,加三乙胺6 mL,用磷酸调节pH值至7.3±0.1)-甲醇(60∶40),流速为1.0 mL·min -1,柱温为30 ℃,进样方式为自动进样,进样量为10 μL,检测波长为215 nm。理论板数按氨基比林计算≥5 000。对照品溶液和供试品溶液的典型测定图谱见图1,按保留时间顺序先后依次为咖啡因、苯巴比妥、氨基比林和非那西丁。

图1 去痛片溶出度测定供试液的色谱图(取样时间:30 min)
Fig.1 HPLC chromatogram of compound aminopyrine phenacetin tablets for dissolution test(sampling time: 30 min)
2.3 溶出量测定方法的考察
参照国家局发布的去痛片补充检验方法(批件编号:2003011)中含量测定的液相色谱方法,对4个组分的溶出度进行检测。色谱条件相同,考察溶剂对测定方法的影响,用流动相与溶出介质(0.1 mol·L -1盐酸溶液)分别作为溶剂配制供试品进行含量测定,差异无统计学意义。
2.3.1 线性关系考察 取对照品适量,加0.1 mol·L -1盐酸溶液溶解并稀释制成系列浓度的溶液,分别进样。以浓度为x轴(μg·mL -1),以峰面积(A)为y轴,进行线性回归,咖啡因、苯巴比妥、氨基比林和非那西丁的回归方程如下:咖啡因A=35 765C+7 046,R 2=0.999 9;苯巴比妥A= 23 136C-2 180,R 2=1.000 0;氨基比林A=23 722C-147 90,R 2=1.000 0;非那西丁A=16 500C-148 2,R 2=1.000 0。上述结果表明,咖啡因、苯巴比妥、氨基比林和非那西丁浓度分别在5.777~69.32,1.479~17.74,14.30~ 171.6,14.97~179.6 μg·mL -1内线性关系良好。
2.3.2 稳定性试验 精密量取“2.1.2”项下方法新配制的供试品溶液,分别于0,2,4,8 h各进样1次进行测定,结果样品中对咖啡因、苯巴比妥、氨基比林和非那西丁的峰面积基本无变化,RSD分别为0.49%,0.29%,0.08%,0.15%,表明供试品中的各组分在8 h内稳定。
2.4 溶出度测定方法的建立
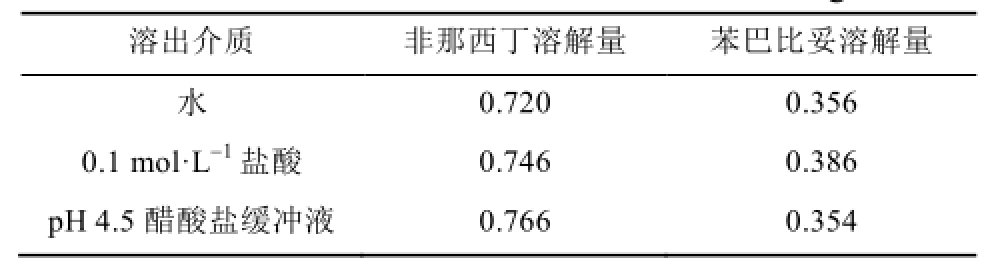
2.4.1 溶出介质的选择 去痛片含氨基比林、非那西丁、咖啡因和苯巴比妥4个有效成分,其中氨基比林在水中溶解,咖啡因在水中略溶,非那西丁和苯巴比妥在水中极微溶解。取非那西丁与苯巴比妥各适量,精密加入溶出介质(水、0.1 mol·L -1盐酸和pH 4.5醋酸盐缓冲液)250 mL进行溶解实验,振摇至饱和,结果见表1。非那西丁的溶解度为去痛片中其处方量4倍以上,苯巴比妥的溶解度为去痛片中其处方量20倍以上,均满足漏槽条件。依据溶解度考察结果,参照解热镇痛类似复方制剂的体外溶出度测定方法,采用溶出度第二法(桨法),并选择0.1 mol·L -1盐酸溶液900 mL为溶出介质。
表1 不同溶出介质中非那西丁和苯巴比妥的溶解度
Tab.1 Dissolution result of phenacetin and phenobarbital in different dissolution medium mg·mL
-1
2.4.2 转速的选择 取本品一批(批号:1312018),照溶出度测定法,以0.1 mol·L -1盐酸为溶出介质,分别在50,75,100 r·min -1转速下取样测定溶出度。可见咖啡因和氨基比林在上述转速下均溶解较好,在5 min时达到溶出平台(>80%);在50 r·min -1条件下,苯巴比妥和非那西丁分别在15 min时≥80%,因此选择转速为50 r·min -1。
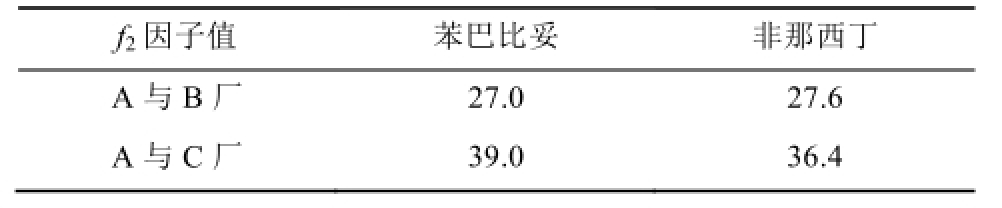
2.4.3 溶出曲线考察 分别取上述3批不同厂家供试品,以0.1 mol·L -1盐酸溶液900 mL为溶出介质,转速50 r·min -1,依法操作,经5,10,15,20,30,45,60 min时,分别取溶液10 mL,用0.45 μm滤膜滤过,同时补充相同体积、温度的溶出介质,按“2.2”项下方法测定溶液中咖啡因、苯巴比妥、氨基比林、非那西丁含量,计算每片溶出量。溶出曲线见图2,从图中可以看出,不同厂家的去痛片咖啡因与氨基比林在15 min均>85%,能够快速溶出;苯巴比妥与非那西丁约在30 min时达到85%的溶出量。同时,比较不同厂家的去痛片溶出曲线,各组分用f 2因子计算,结果见表2。各厂家产品中咖啡因及氨基比林在15 min时均溶出>85%,即溶出行为基本一致;A厂(批号:20130134)苯巴比妥和非那西丁相对B或C厂的f 2<50,即A厂溶出曲线与其他两厂家不相似。溶出度考察结果显示不同厂家的产品溶出行为有差异。
2.4.4 取样时间点的确立 目前解热镇痛类似复方制剂的体外溶出度测定方法 [4-8]都将取样时间定为30 min或45 min。由去痛片中咖啡因、苯巴比妥、氨基比林和非那西丁溶出曲线考察结果可知,20 min时咖啡因和氨基比林已达到溶出平台,而苯巴比妥和非那西丁还有上升趋势,30 min以后各组分的溶出曲线基本均是平台区,按口服固体制剂的一般要求暂定取样点为30 min。
2.4.5 溶出度测定方法的确立 取本品,按中国药典2015年版四部通则0931溶出度与释放度测定法第二法,以0.1 mol·L -1盐酸溶液900 mL为溶出介质,转速为50 r·min -1,依法操作,经30 min时,取溶液10 mL,滤过,取续滤液作为供试品溶液;另取氨基比林、非那西丁、咖啡因、苯巴比妥对照品适量,加溶出溶质溶解并定量稀释制成每1 mL中各约含0.15,0.15,0.05,0.015 mg的溶液,作为对照品溶液,测定各组分含量,计算每片中氨基比林、非那西丁、咖啡因和苯巴比妥的溶出量。
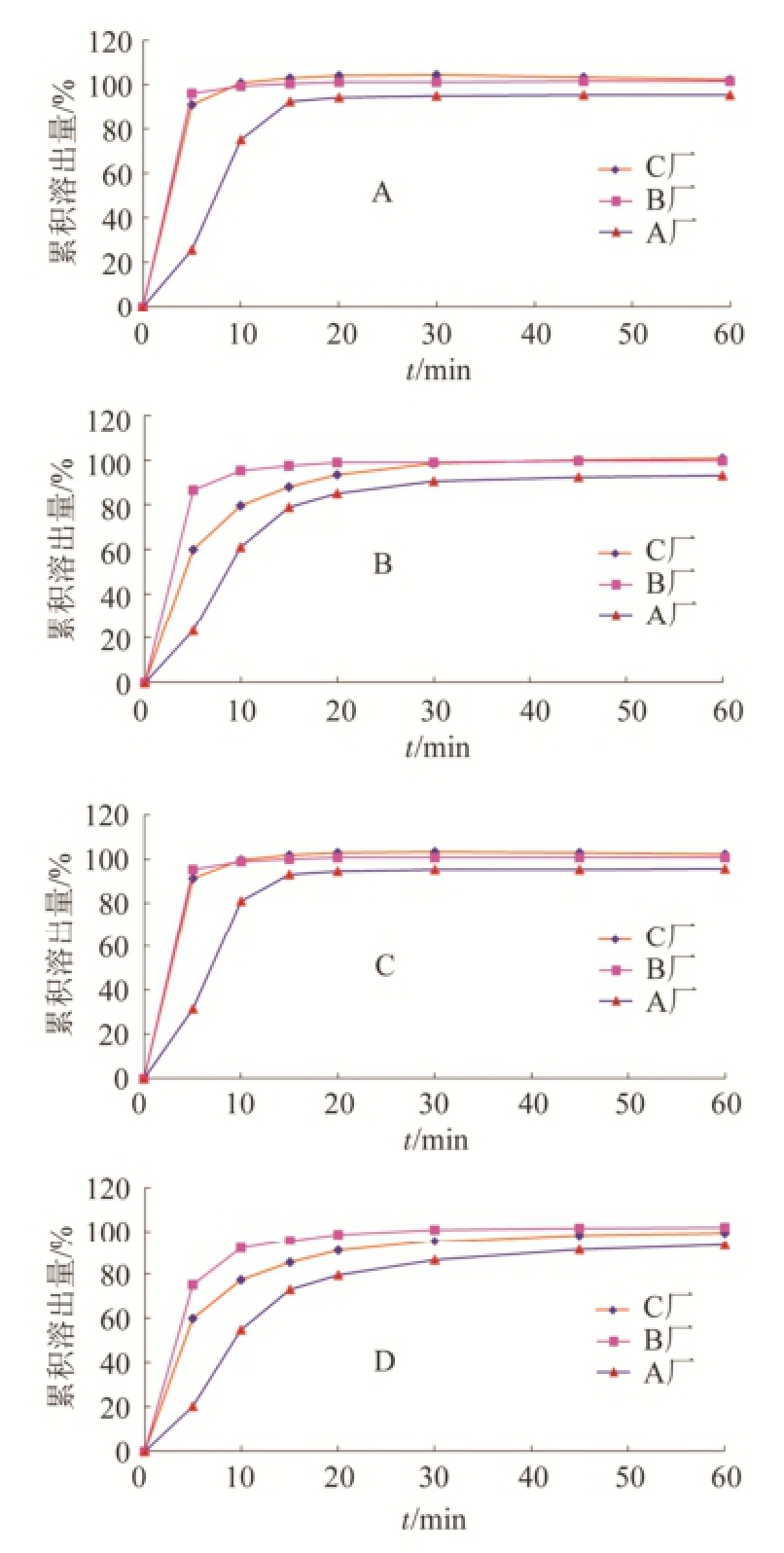
图2 3批供试品溶液咖啡因、苯巴比妥溶出曲线
A-咖啡因;B-苯巴比妥;C-咖啡因;D-咖啡因。
Fig.2 Dissolution curves of caffine, phenobarbital, pyramidon and phenacetin for three batches of test samples
A-caffine; B-phenobarbital; C-pyramidon; D-phenacetin.
表2 3个厂家比较的去痛片溶出度f
2相似因子
Tab.2 The dissolution similarity factor(f
2) of compound aminopyrine phenacetin tablets for three manufacturers
本研究考察了去痛片中各组分的溶出情况,氨基比林与咖啡因为快速溶出成分,非那西丁和苯巴比妥则溶解较缓,与其溶解度相符;从图5可见不同厂家的非那西丁溶出曲线有明显差异,去痛片质量特别是溶出度差异可能对药品临床不良反应发生有一定影响,建议后续完善标准确保产品质量。
本研究参照国家局发布的去痛片补充检验方法(批件编号:2003011)采用液相色谱方法同时测定4个组分的溶出量,较卫生部颁标准含量测定方法(容量法)操作简单,结果准确。为后续提高去痛片的质量标准提供实验依据。
去痛片中4个组分中苯巴比妥的水溶性最差,属于BCS四类;其次是非那西丁,去痛片溶出度的关键是苯巴比妥和非那西丁的溶出量。建立的溶出度测定方法不仅能有效控制产品的体外溶出情况,也能有效区分不同生产厂的制剂之间的差异。
REFERENCES
[1] WANG H Y, CAO J, JIA J, et al. Determination of the components of somedon in blood [J]. J Shanxi Med Univ(山西医科大学学报), 2007, 38(6): 518-522.
[2] 中华人民共和国卫生部药品标准·化学药品及制剂[S]. 第一册, 20.
[3] YE G J, QIN L H, HU Q H. Study on dissolution method for gefitinib tablets [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(6): 741-746.
[4] ZHU R, ZHANG H J, WANG J S, et al. Comparative study on dissolution profiles of betahistine hydrochloride tablets from different manufacturers [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(3): 306-309.
[5] ZHENG S F, GUO W B, WANG Y, et al. Improved dissolution method of loratadine tablets [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(2): 178-181.
[6] QIN B, TAN Z X, YIN G, et al. Dissolution determination of ketotifen fumarate tablets [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(1): 72-75.
[7] LEI K, XU C G, LI J, et al. Establishment of the dissolution method and assessment of Fen’ankamin tablets [J]. Northwest Pharm J(西北药学杂志), 2013, 28(1): 57-61.
[8] YU C M, ZHOU C L, XU J, et al. Study on the dissolution of compound paracetamol Ⅱ capsules and bioequivalence in healthy volunteers [J]. China Pharm(中国药房), 2013, 24(14) : 1274-1276.
[9] XU W K, WU Y. Determination of chlorzoxazome, ethenzamide and caffeine in dissolution test for compound Zong'anyin tablets by HPLC [J]. Drug Stand China(中国药品标准), 2008, 9(5): 372-374.
[10] YAO H, XU D Z, ZHANG X Z, et al. The dissolution determination of compound aminopyrine tablets by HPLC [J]. Northwest Pharm J(西北药学杂志), 2003, 18(3): 103-104.
[11] BAI X M, WEN L L, L W J. Determination of aminopyrine in dissolution test for compound amantadine hydrochloride tablets by HPLC [J]. Harbin Med J(哈尔滨医药), 2012, 32(4) : 253-254.
[12] FENG S M, ZHANG Z R, QIN B, et al. HPLC determination of dissolution of Fen’ankamin tablets [J]. Chin J Pharm Anal(药物分析杂志), 2009, 29(10): 1722-1725.
[13] WU G, ZHONG H B. Determination of four components in Qutong tablets by HPLC [J]. Drug Stand China(中国药品标准), 2005, 6(5): 31-33.
Study of Method for Dissolution Test of Compound Aminopyrine Phenacetin Tablets
ZHU Peixi 1, WEI Wei 2, LU Jingxian 1, TAO Qiaofeng 3*(1.Zhejiang Institute for Food and Drug Control, Hangzhou 310000, China; 2.College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China; 3.Zhejiang Center for Drug and Cosmetic Evaluation, Hangzhou 310012, China)
ABSTRACT:OBJECTIVE To establish the dissolution test method for the compound aminopyrine phenacetin tablets. METHODS The established dissolution was the paddle method. 900 mL 0.1 mol·L -1hydrochloride acid was used as the dissolution medium, the rotation speed was 50 r·min -1. HPLC was used for detection. A Kromasil C 18column (250 mm×4.6 mm, 5 μm) was used. Mobile phase consisted of a mixture of monopotassium phosphate solution-methanol (60∶40), and UV detection wavelength was 215 nm. RESULTS Obvious difference of dissolution curves between different companies was observed. CONCLUSION The developed method provided a scientific basis for improving the quality control standards, and establishing a reasonable dissolution test method for compound aminopyrine phenacetin tablets.
KEY WORDS:compound aminopyrine phenacetin tablets; dissolution test; HPLC
中图分类号:R944.4
文献标志码:B
文章编号:1007-7693(2017)02-0272-04
DOI:10.13748/j.cnki.issn1007-7693.2017.02.026
收稿日期:2016-06-12
作者简介:朱培曦,男,硕士,主管药师 Tel: (0571)86459422 E-mail:zhpx110@126.com *
通信作者:陶巧凤,女,博士,主任药师 Tel: (0571)81061206 E-mail: taoqiaofeng@126.com