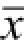 ±s表示,采用SPSS 11.5统计学软件进行统计分析,多组间比较采用单因素方差分析,2组间比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
±s表示,采用SPSS 11.5统计学软件进行统计分析,多组间比较采用单因素方差分析,2组间比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
刘勇锋 1a,李咪咪 1a*,刘 芳 1b,邹奇锋 2(1.福建医科大学附属第一医院,a.药学部,b.高压氧科,福州 350005;2.莆田市第一医院药剂科,福建 莆田 351100)
摘要:目的 观察甲氨蝶呤对脂多糖(lipopolysaccharide,LPS)诱导的大鼠脊髓神经胶质细胞pIκBα-NF-κBp65-炎性因子通路的影响。方法 脊髓组织块法培养神经胶质细胞。将分离的神经胶质细胞接种于多孔板培养48 h后,分为空白对照组、LPS组、LPS+pIκBα抑制剂组、LPS+甲氨喋呤组。随后应用免疫印迹法测定各组分的pIκBα与胞核及胞浆NF-κBp65水平变化,酶免疫法(ELISA)测定炎性因子TNF-α、IL-1β、IL-6含量。结果 神经胶质细胞经LPS诱导后,pIκBα、胞核NF-κBp65和细胞上清液炎性因子TNF-α、IL-1β、IL-6水平均显著增加(P<0.05或P<0.01)。甲氨喋呤可明显抑制经LPS诱导的神经胶质细胞pIκBα水平,显著降低胞核NF-κBp65水平和细胞上清液炎性因子TNF-α、IL-1β、IL-6的含量(P<0.05)。结论 甲氨喋呤对LPS诱导的脊髓神经胶质细胞pIκBα-NF-κBp65-炎性因子通路有显著的抑制作用。
关键词:甲氨蝶呤;脂多糖;神经胶质细胞;pIκBα;NF-κBp65;炎性因子
急性脊髓损伤是高致残率疾病,近年来的研究表明急性脊髓损伤促发的局部炎症反应是导致继发性损伤的重要机制 [1]。甲氨喋呤作为治疗类风湿性关节炎的一线处方药,广泛应用于其他炎性疾病的治疗,国内外学者研究表明,低剂量甲氨喋呤可以抑制急性脊髓损伤大鼠神经细胞凋亡,为临床急性脊髓损伤治疗提供新思路 [2-3]。本课题组前期研究发现,在急性脊髓损伤大鼠中应用甲氨喋呤,可以显著降低炎性因子含量,明显减轻急性脊髓损伤后大鼠损伤脊髓组织炎性反应,其神经保护作用与此密切相关。本实验通过体外细胞培养实验探讨甲氨喋呤调控急性炎症反应的靶点,进一步明确甲氨喋呤对急性脊髓损伤后炎性反应通路作用的分子机制,为甲氨喋呤用于临床急性脊髓损伤治疗提供理论基础。
1.1 动物
清洁级Sprague-Dawley大鼠,♂,体质量145 g,由福建医科大学实验动物中心提供。
1.2 药物及试剂
注射用甲氨喋呤(广东岭南制药有限公司,批号:271021-2,规格:每支5 mg);大鼠白介素IL-6、IL-1β、肿瘤坏死因子(TNF-α) ELISA检测试剂盒(美国R&D,批号:A6071377、A6071384、A6071379),兔抗鼠Vimentin单克隆抗体、兔抗鼠β-actin单克隆抗体(美国Santa Cruz);辣根过氧化物酶偶联的羊抗兔IgG(二抗,北京中杉公司);FITC标记的羊抗兔二抗(美国Santa Cruz);脂多糖(LPS,美国Sigma);Western-blotting蛋白印迹化学发光试剂(美国Santa Cruz);PVDF膜(millipore公司);抗pIκBα、NF-κBp65(英国Signal cell);pIκBα抑制剂R0106(美国Sigma);抗β-actin(美国Santa cruz);M199培养基、胎牛血清(FBS)、胰蛋白酶(美国Life);RIPA Buffer蛋白裂解液(美国Sigma);Bicinchoninic acid(BCA)蛋白定量试剂盒(天根生化科技有限公司,批号:PA115);SDS-PAGE蛋白上样缓冲液(碧云天生物技术研究所);其他常用试剂均为分析纯。
1.3 仪器
TGL-16B型号台式高速离心机(北京六一仪器厂);4 ℃低温冰箱(海尔公司);-70 ℃超低温冰箱(Thermo公司);PYX-YDH电热恒温鼓风干燥箱(北京六一仪器厂);DK-8D型电热恒温水槽(上海华连医疗器械公司);DYY-III-6B型稳压稳流电泳仪(北京六一仪器厂);Mini-PROTEAN Tetra MP4型蛋白垂直电泳槽(美国Bio-Rad公司);DYCP-40C型半干式碳板转印仪槽(北京六一仪器厂);680型全自动酶标仪(美国Bio-Rad)。
1.4 细胞培养
取SD大鼠(体质量145 g),脱臼处死,于75%酒精浸泡5 min,取腰段脊髓组织,将组织剪成约1 mm 2小块。用200目不锈钢筛网过滤,加入10%FCS M199培养基,于37 ℃、5% CO 2培养箱中培养2~3 d即可见到扁平星状的脊髓胶质细胞生长。更换新的培养基,待细胞铺满瓶底2/3时用0.25%胰酶消化传代,选择生长良好的3~6代细胞进行实验。
1.5 细胞鉴定
将培养细胞接种于24孔板,细胞生长至50%汇合时弃0.2% FSC培养基24 h,每孔加2 mL 10%福尔马林,室温30 min后弃福尔马林,加预冷PBS漂洗3次(每次5 min),0.1%Trion-100孵育10 min;PBS漂洗3次(每次5 min),加一抗(抗Vimentin抗体1∶50)4 ℃过夜PBS漂洗3次(每次5 min),加FITC标记的二抗(1∶500),25 ℃孵育1 h;PBS漂洗3次(每次5 min),荧光显微镜(波长480 nm)下观察阳性表达,阳性细胞表达>90%用于实验。
1.6 MTT法测定脊髓胶质细胞存活率
取对数生长期的脊髓胶质细胞以适宜的浓度接种于96孔板中,加入含10% FBS的DMEM培养液,置于37 ℃、5% CO 2培养箱培养细胞至生长密度为80%~90%时,弃去培养液,然后加入含甲氨喋呤浓度为10 -9,10 -8,10 -7,10 -6mol·L -1的细胞培养液,作用45 min后于10 -7mol·L -1管中加入浓度为100 ng·mL -1的LPS进行刺激,同时设立对照组。继续培养60 min后,每孔加入10 μL MTT溶液,培养4 h后,弃去上清液,每孔加入100 μL DMSO,振荡10 min,充分溶解结晶物,用酶标仪于492 nm波长下测定吸光值,计算相对细胞存活率。
1.7 分组及给药
将对数生长期的脊髓神经胶质细胞分别按每孔6×10 6个培养接种6孔板,并随机分为空白对照组、LPS组、LPS+pIκBα抑制剂组、LPS+甲氨喋呤组。按设定待细胞生长至60%~70%汇合时,更换0.2% FCS培养基培养24 h后,加入LPS (100 ng·mL -1)继续培养,分别在0,15,30,60,120 min行细胞蛋白攫取检测pIκBα与胞核及胞浆NF-κBp65水平变化;另待细胞生长至60%~70%汇合时,更换0.2% FCS培养基培养24 h后,加入甲氨喋呤(10 -7mol·L -1),pIκBα抑制剂R0106 (10 -6mol·L -1)45 min后,加入LPS(100 ng·mL -1)继续培养60 min,备用。
1.8 细胞总蛋白抽提
待抽提蛋白细胞弃培养基,加入4 ℃冰箱中取出的TBS 2 mL漂洗1次;弃TBS,将6孔培养板于干净滤纸上轻拍2~3次后置于冰板上;每孔迅速加入预冷解缓冲液200 µL,用细胞刷来回刮动;5~10 min后将裂解液移至1.5 mL的EP管,15 s超声破碎制备蛋白悬液,放置冰浴中继续裂解30 min;于4 ℃ 12 000×g离心10 min,取上清;用BCA蛋白浓度测定试剂盒进行样本的蛋白浓度测定;SDS上样缓冲液与蛋白按1∶4的比例混合,沸水煮10 min,冰上冷却,分装,置入-70 ℃冰箱保存。
1.9 细胞核蛋白与胞浆蛋白的提取
接种细胞于6 cm培养皿中,每个培养皿细胞数为3.0×10 5,待细胞生长至60%~70%汇合时更换0.2%FCS培养基3 mL孵育24 h;加入不同干预剂,干预完成后,弃培养基,每个培养皿加预冷PBS 3 mL,漂洗3次;加0.5 mL 0.25%胰酶2~3 min后,加入5 mL M199培养基,冲洗2~3次。将细胞悬浮液移至10 mL离心管中,4 ℃300 ×g离心5 min,弃上清液;加200 µL A液(低渗液)重悬细胞,4 ℃保存10 min;4 ℃下12 000 × g离心10 min,将上清移至另一EP管中;加50 µL 1×SDS裂解液(200 mmol·L -1DTT,10%甘油,2%SDS,1×PMSF,2 µg·mL -1Aprotion,1 µg·mL -1Leptin)重悬沉淀,超声仪震荡5 min,12 000×g离心5 min,取上清,即为细胞核蛋白;另一EP管中加入等体积2×SDS裂解液(400 mmol·L -1DTT,20%甘油,4%SDS,2×PMSF,4 µg·mL -1Aprotion,2 µg·mL -1Leptin),超声仪震荡5 min,12 000×g离心5 min,取上清,即为细胞胞浆蛋白。测定浓度后,与4×SDS样品缓冲液混匀,沸水煮5 min变性,冰上冷却,分装,置-70 ℃冰箱保存。
1.10 Western blot蛋白测定
免疫印迹法(Western blot)检测pIκBα、NF-κBp65水平。取出提取的胞核和胞浆样品,行10%SDS聚丙烯酰胺凝胶电泳,半干式转膜1 h,将PVDF膜置于含3%脱脂奶粉的TBST中,室温30 min,加pIκBα、NF-κBp65抗体(1∶500)、β-actin (1∶1 000) 4 ℃孵育过夜,用TBST漂洗3次,每次5 min;加辣根过氧化物酶标记的二抗(山羊抗兔IgG 1∶5 000)37 ℃摇1 h,用TBS洗涤3次,每次5 min;滴加ECL、暗室曝光、显影、定影、扫描,White/Ultraviolet Transilluminator凝胶成像分析系统分析。蛋白表达水平以目标蛋白与内参β-actin光密度比值表示。
1.11 ELISA法测定
ELISA测定肿瘤坏死因子(TNF-α)、IL-1β、IL-6含量。用PBS将细胞清洗,然后用裂解液裂解,使用蛋白定量试剂盒作蛋白定量,依照酶联免疫吸附测定法,按照抗原包被、加入样品、加入酶标抗体、加入底物显色、最后终止反应等步骤,在450 nm处测定OD值,建立标准曲线,计算出IL-6、IL-10、TNF-α的释放量。
1.12 数据处理及统计分析
所有数据均采用
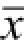 ±s表示,采用SPSS 11.5统计学软件进行统计分析,多组间比较采用单因素方差分析,2组间比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
±s表示,采用SPSS 11.5统计学软件进行统计分析,多组间比较采用单因素方差分析,2组间比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
2.1 MTT法检测甲氨喋呤单独作用及其与LPS联合作用对脊髓神经胶质细胞存活率的影响
与空白对照组相比,10 -9,10 -8,10 -7mol·L -1甲氨喋呤单独作用及其与LPS(100 ng·mL -1)联合作用时对脊髓神经胶质细胞存活率的影响无统计学差异,当甲氨喋呤剂量增大到10 -6mol·L -1时,甲氨喋呤明显影响脊髓神经胶质细胞的活性(P<0.01)。结果见图1。
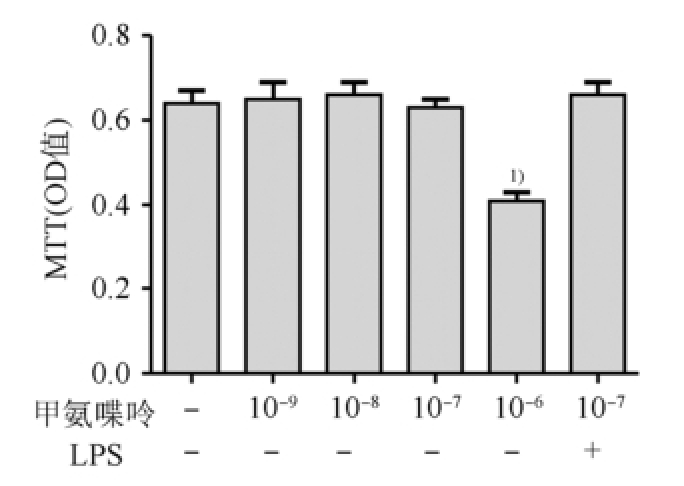
图1 甲氨喋呤对脊髓胶质细胞存活率的影响
与空白对照组相比,
1)P<0.01。
Fig.1 Effect of methotrexate on neurogliocyte viability
Compared with blank group,
1)P<0.01.
2.2 LPS对脊髓神经胶质细胞pIκBα、NF-κBp65水平的影响
LPS(100 ng·mL -1)能够呈时间依赖性诱导脊髓神经胶质细胞pIκBα及胞核NF-κBp65水平,与空白对照组相比,pIκBα在30 min时即能见到明显增加,在60 min时达到峰点(P<0.01);胞核NF-κBp65随时间推移水平显著增高,60 min时达到峰点(P<0.01);胞浆NF-κBp65水平显著降低(P<0.01)。结果见图2。
2.3 甲氨喋呤对LPS诱导脊髓神经胶质细胞pIκBα与胞核及胞浆NF-κBp65水平的影响
与空白对照组比较,LPS处理脊髓神经胶质细胞60 min后,细胞pIκBα、胞核NF-κBp65水平显著增加,胞浆NF-κBp65水平显著降低(P<0.01);与LPS组比较,LPS+甲氨喋呤组脊髓神经胶质细胞核NF-κBp65水平显著降低(P<0.05),而胞浆NF-κBp65水平显著升高(P<0.05),与pIκBα抑制剂组无统计学差异,结果见图3。
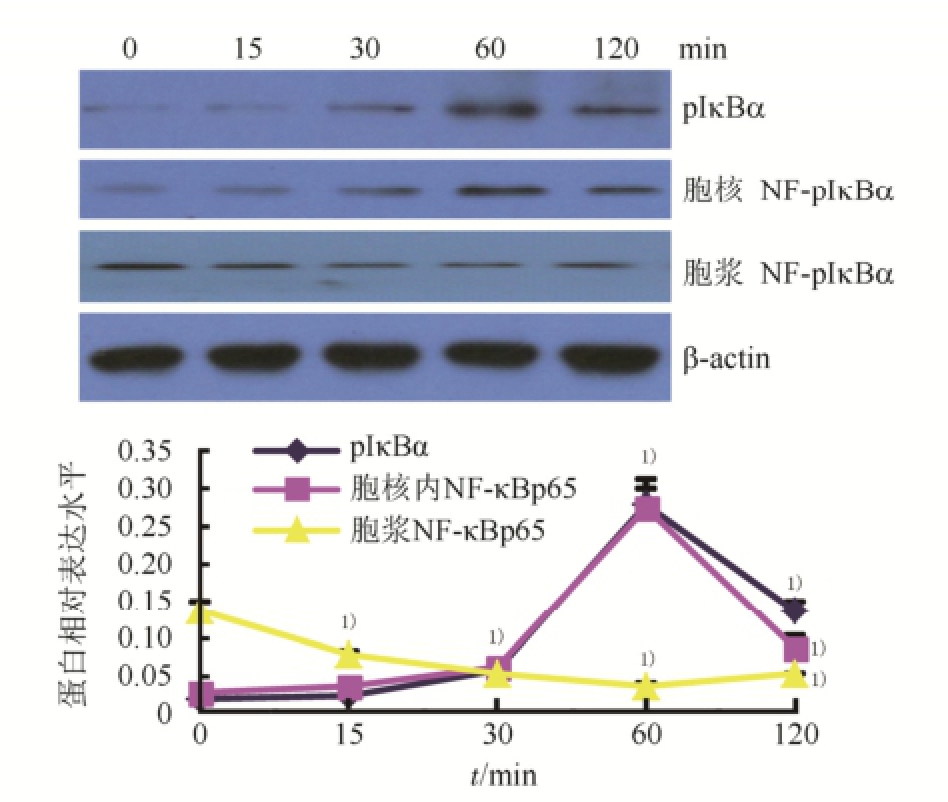
图2 LPS诱导脊髓神经胶质细胞pIκBα及NF-κBp65变化影响(n=6,
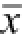 ±s)
±s)
与空白对照组相比,
1)P<0.01。
Fig.2 Effect of LPS on expressions of pIκBα、NF-κBp65 in neurogliocyte of spinal cord(n=6,
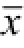 ±s)
±s)
Compared with normal control group,
1)P<0.01.
2.4 甲氨喋呤对LPS诱导脊髓神经胶质细胞TNFa、IL-1B及IL-6水平的影响
与空白对照组比较,LPS组脊髓神经胶质细胞上清液TNF-α、IL-1β、IL-6均显著增加(P<0.01);与LPS组比较,LPS+甲氨喋呤组脊髓神经胶质细胞上清液TNF-α、IL-1β、IL-6水平均显著降低(P<0.05);LPS+甲氨喋呤组与LPS+pIκBα抑制剂组比较差异具有统计学意义(P<0.05),结果见表1。
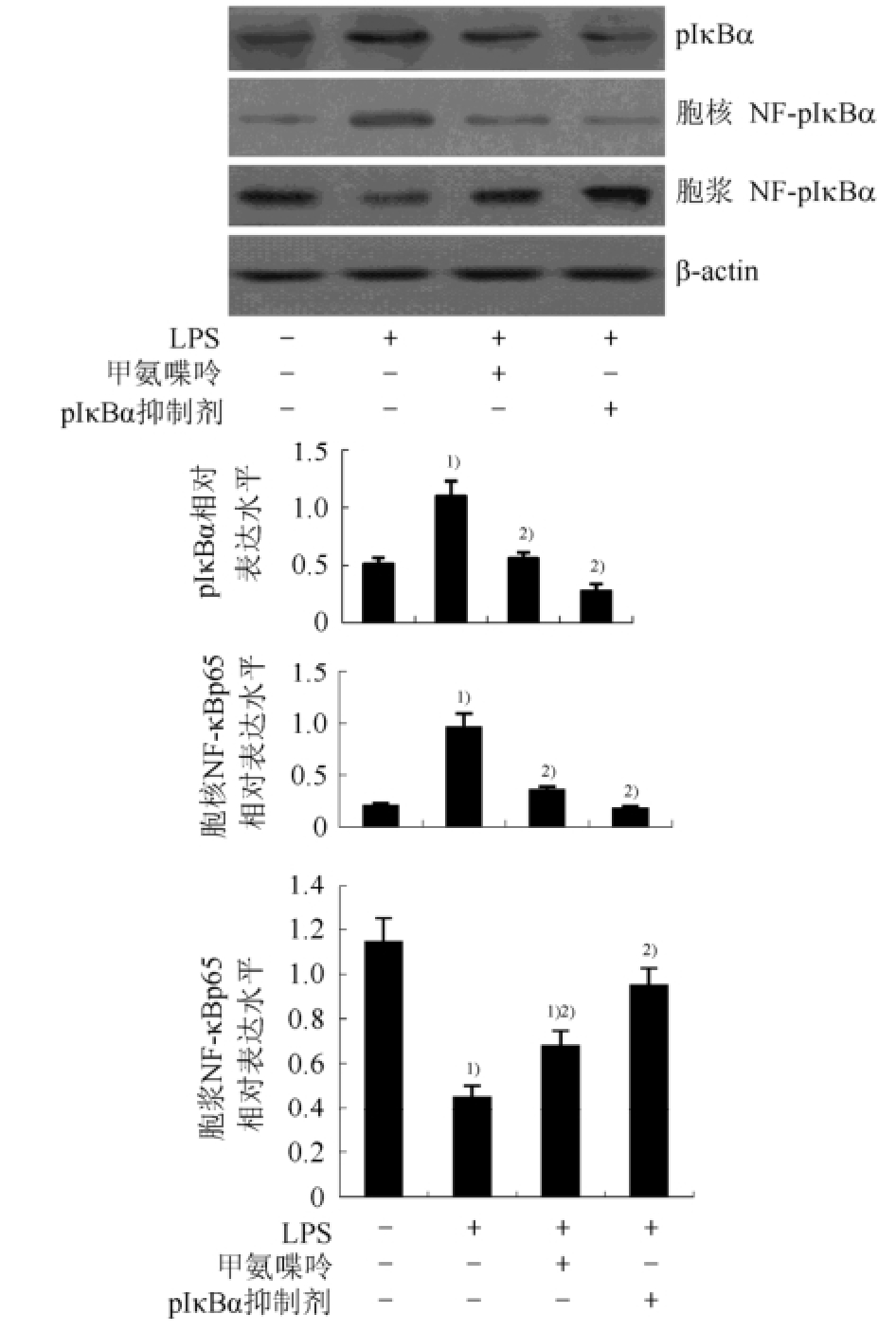
图3 甲氨喋呤对LPS诱导脊髓神经胶质细胞pIκBα与胞核及胞浆NF-κBp65水平的影响(n=6,
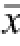 ±s)
±s)
与空白对照组比较,
1)P<0.01;与LPS组比较,
2)P<0.05。
Fig.3 Effect of low-dose methotrexate on expressions of pIκBα, NF-κBp65 in neurogliocyte of spinal cord(n=6,
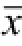 ±s)
±s)
Compared with normal control group,
1)P<0.01; compared with LPS group,
2)P<0.05.
表1 甲氨喋呤对LPS诱导大鼠脊髓神经胶质细胞TNFa, IL-1B及IL-6水平影响(n=6,
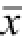 ±s)
±s)
Tab.1 Effect of low-dose methotrexate on levels of TNF-α, IL-1β, IL-6 in neurogliocyte of spinal cord(n=6,
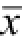 ±s)
±s)

注:与空白对照组比较,
1)P<0.01;与LPS组比较,
2)P<0.05;与LPS+甲氨喋呤组比较,
3)P<0.05。
Note: Compared with normal control group,
1)P<0.01; compared with LPS group,
2)P<0.05; compared with LPS+methotrexate group,
3)P<0.05.
脊髓神经胶质细胞是脊髓损伤后重要免疫细胞,邹云等学者在研究中发现 [4],大鼠脊髓损伤组织神经胶质细胞分泌大量炎性因子。有学者认为 [5-6],炎症细胞识别LPS并将炎症信号传入脊髓神经胶质细胞,引起NF-κB激活,进而释放多种炎症介质。NF-κBp65与抑制蛋白IκBα结合成无活性的复合物存在于胞质中,当受到外源性激活剂(如LPS)的刺激后,IκBα快速和大量的磷酸化为pIκBα,复合物被水解,核定位信号暴露,导致胞浆内NF-κBp65快速移至胞核内发挥基因表达的调控作用,增强TNF-α、IL-1β、IL-6等炎性因子的转录及其蛋白生成,pIκBα-NFκ-Bp65-炎性因子通路放大了炎症信号,导致继发瀑布式的级联损害 [7]。本研究利用LPS诱导体外培养的大鼠脊髓神经胶质细胞来构建动物脊髓损伤后炎性反应的模型,其结果提示pIκBα显著升高,NF-κBp65胞浆含量减少、入核增多,炎性因子含量增加。扈玉华 [8]学者也证实了在脊髓神经损伤中NF-κBp65的活化依赖pIκBα,表明pIκBα是调控炎症反应的重要靶点。
有研究表明,低剂量甲氨蝶呤可以调节循环中炎性细胞因子水平以及脂质过氧化表达产生影响 [9-10];近年来研究发现它的抗炎作用甚至可以与糖皮质激素类药物相媲美 [11]。本研究使用甲氨喋呤预处理经LPS诱导的大鼠脊髓神经胶质细胞,实验结果显示,甲氨喋呤可明显降低pIκBα、胞核NF-κBp65蛋白表达水平及炎性因子含量,这表明甲氨喋呤可直接抑制LPS诱导的细胞pIκBα,阻止胞浆NF-κBp65入核参与下游基因的调控,减少下游炎性因子的表达,提示甲氨喋呤通过pIκBα-NF-κBp65-炎性因子通路进行调控急性炎症反应。与使用pIκBα抑制剂预处理组相比较,两者具有统计学差异,表明甲氨喋呤对pIκBα-NF-κBp65-炎性因子通路的抑制还受到其他因子的调控。
综上所述,甲氨喋呤具有抑制炎性因子的过度表达,从而减轻损伤神经元的生化反应、基因表达等级联反应的发生,这种机制对LPS诱导的体外培养大鼠脊髓神经胶质细胞起到保护作用。本研究结果增加了甲氨喋呤对抗炎作用、减轻兴奋毒性作用的认识,拓宽了人们对甲氨喋呤用于脊髓神经损伤保护作用机制的理解。
REFERENCES
[1] 黄卫, 李新志, 卢国强, 等. 急性脊髓损伤的治疗现状和研究进展[J]. 中外医疗, 2015, 11(3): 197-198.
[2] BAKAR B, KÖSE E A, KUPANA AYVA S, et al. Effects of low-dose methotrexate in spinal cord injury in rats [J]. Ulus Travma Acil Cerrahi Derg, 2013, 19(4): 285-293.
[3] KERTMEN H, GÜRER B, YILMAZ E R. The protective effect of low-dose methotrexate on ischemia-reperfusion injury of the rabbit spinal cord [J]. Eur J Pharmacol, 2013, 714(1-3): 148-156.
[4] ZOU Y, YU Z J, LIN J T. The significance of proliferation of glial cells induced by experimental Hemi-sectioned spinal cord injury [J]. J Guiyang Med Coll(贵阳医学院学报), 2015, 40(9): 905-909.
[5] ROSSOL M, HEINE H, MEUSCH U, et al. LPS-induced cytokine production in human monocytes and macrophages [J]. Crit Rev Immunol, 2011, 31(5): 379-446.
[6] KALYANARAMAN M, HEIDEMANN S M, SARNAIK A P. Macrophage inflammatory protein-2 predicts acute lung injury in endotoxemia [J]. J Invegtig Med, 1998, 46(6): 275-278.
[7] CHEN Y Z, XU W H. Therapeutic significance of pre-inflammatory cyokines intervention in animal model with spinal cord injuries [J]. Med Recapit(医学综述), 2007, 13(17): 1301-1303.
[8] HU Y H, SHI X F, LU S K. Expression of NF-κB in spinal cord after acute spinal cord injury in rats [J]. J Hebei Med Univ(河北医科大学学报), 2003, 24(1): 1-3.
[9] 刘晓凯, 胡万英, 黄健雄. 小剂量甲氨蝶呤对急性冠脉综合症炎症反应影响的研究[J]. 淅江临床医学, 2008, 10(7): 954-955.
[10] ZHANG S, GU B, WANG S Y. Effects of methotrexate on acute phrase of spinal cord contusion-induced lipid peroxidation in rats [J]. Acta Neuropharmacol(神经药理学报), 2014, 4(1): 11-16
[11] KEITH M P, EDISON J D, GILLILAND W R. Progress toward personalized treatment of rheumatoid arthritis [J]. Clin Pharmacol Ther, 2012, 92(4): 440-442.
Effect of Methotrexate on the Pathway of LPS-induced pIκBα-NF-κBp65-Inflammatory Cytokine in the Rat Spinal Cord Glial Cells
LIU Yongfeng 1a, LI Mimi 1a*, LIU Fang 1b, ZOU Qifeng 2(1.The First Affiliated Hospital of Fujian Medical University, a. The Department of Pharmacy, b.The Department of Hyperbaric Oxygen, Fuzhou 350005, China; 2.The Department of Pharmacy, The First Hospital of Putian City, Putian 351100, China)
ABSTRACT:OBJECTIVE To study the effect of methotrexate on the pathway of lipolysaccharide(LPS)-induced pIκBα-NF-κBp65-inflammatory cytokine in glial cells of the rat spinal cord. METHODS The glial cells were obtained from the spinal cord tissue nubbles, then were inoculated into multi-well plate and cultured for 48 h. Cells were divided into 4 groups: control group, LPS group, LPS+pIκBα inhibitor group and LPS+methotrexate group. The expression of pIκBα, NF-κBp65 in each groups were detected by Western blot, and the concentrations of inflammatory factors(including TNF-α, IL-1β, IL-6) were measured by ELISA. RESULTS The LPS group showed significantly higher expressions of pIκBα, NF-κBp65 protein in the nucleus and the concentrations of inflammatory factors(including TNF-α, IL-1β, IL-6) compared to the normal control group (P<0.05 or P<0.01). Compared with LPS group, the expressions of pIκBα, NF-κBp65 protein and concentration of TNF-α, IL-1β, IL-6 were significantly decreased in LPS plus methotrexate group and pIκBα inhibitor group(P<0.05). CONCLUSION Methotrexate can markedly inhibit the pathway of LPS-induced pIκBα-NF-κBp65-inflammatory cytokines in glial cells.
KEY WORDS:methotrexate; lipopolysaccharide; glial cells; pIκBα; NF-κBp65; inflammatory cytokine
中图分类号:R322.81;R965.1
文献标志码:A
文章编号:1007-7693(2017)02-0186-05
DOI:10.13748/j.cnki.issn1007-7693.2017.02.008
收稿日期:2016-06-02
基金项目:福建省自然科学基金资助项目(2016J01526)
作者简介:刘勇锋,男,主管药师 Tel: 13763819990 E-mail: lyfxbl@163.com *
通信作者:李咪咪,女,主管药师 Tel: (0591)87981630 E-mail: limimi1979@139.com