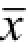 ±s表示,应用Microsoft Excel软件进行处理,组间比较采用t检验。
±s表示,应用Microsoft Excel软件进行处理,组间比较采用t检验。
诸葛定娟,陈爱瑛,程 敏,缪云萍,田雪君,郑高利,叶小弟 *(浙江省医学科学院,杭州 310013)
摘要:目的 研究冬虫夏草菌丝体多糖(虫草多糖)对正常小鼠T淋巴细胞及其亚群数量的影响及可能的机制。方法 ICR小鼠,随机分成空白对照组、阳性组(香菇多糖1 mg·kg -1)和虫草多糖高、中、低剂量(200,100,50 mg·kg -1)组,连续腹腔注射10 d后,流式细胞仪检测外周血T淋巴细胞(CD3 +细胞)及其亚群细胞CD4 +CD8 -和CD4 -CD8 +数量、CD3 +细胞凋亡率;MTT法测定小鼠脾淋巴细胞转化功能;实时荧光定量PCR检测脾脏组织Bcl-2 mRNA、Bax mRNA的转录水平,并测定胸腺和脾脏指数。结果 与空白对照组比较,虫草多糖能提高小鼠脾脏质量、促进未经ConA诱导的脾淋巴细胞增殖转化能力,并呈现剂量依赖性;虫草多糖高剂量组能明显增加外周血CD3 +细胞和CD4 +CD8 -细胞亚群的数量,降低CD4 -CD8 +细胞亚群数量,显著提高CD4 +CD8 -/CD4 -CD8 +的比值;高剂量虫草多糖能明显降低小鼠外周血CD3 +细胞凋亡率,显著升高脾组织Bcl-2 mRNA 转录水平和Bcl-2/Bax比值,而对Bax mRNA转录水平没有明显影响。结论 虫草多糖可刺激小鼠主要免疫器官(胸腺和脾脏)增生,提高T淋巴细胞及CD4 -CD8 +亚群的数量,其作用机制可能与上调抑制凋亡基因Bcl-2 mRNA的转录,提高Bcl-2/Bax比值,从而抑制淋巴细胞凋亡有关。
关键词:冬虫夏草菌丝体;虫草多糖;T淋巴细胞亚群;凋亡;Bcl-2;Bax
虫草发酵菌丝体是冬虫夏草[Cordyceps sinensis(BerK.) Sacc.]无性世代——中华束丝孢(Synnematum sinense Yin et Shen sp.now)经液体发酵而成,和天然虫草在化学成分和药理功能上非常相似 [1-3],已成为冬虫夏草的替代品。虫草及其菌丝体活性成分包括核苷类物质、麦角甾醇、多糖、氨基酸及微量元素等,其中多糖是其免疫调节和抗肿瘤作用的关键成分 [4-6]。实验研究表明,虫草菌丝体多糖能增强单核巨噬细胞功能,提高脾脏指数 [7-11],增加胸腺质量,缓解迟发型变态反应 [12]。对环磷酰胺造成的免疫功能低下小鼠,虫草菌丝体多糖可使其免疫力恢复到接近正常水平,具有良好的免疫调节作用 [13]。然而,虫草菌丝体多糖免疫调节作用机制尚不明了,本实验观察虫草菌丝体多糖(虫草多糖)对小鼠外周血T淋巴细胞(CD3 +细胞)及其亚群数量的影响,并从细胞凋亡途径研究其作用机制。
1.1 材料、试剂与仪器
冬虫夏草菌丝体粉(杭州中美华东制药有限公司);注射用香菇多糖(南京绿叶思科药业有限公司,规格:每瓶1 mg,批号:120101108)。
清洁级ICR小鼠,♂,体质量:18~22 g,购自浙江省实验动物中心,实验动物生产许可证号:SCXK(浙)2008-0033,实验动物使用许可证号:SYXK(浙)2011-0166。
RPMI1640完全培养液(南京凯基生物科技发展有限公司,批号:20120509);胎牛血清(杭州四季青生物工程材料有限公司,批号:120115);单克隆抗体Anti-Mouse CD3-PerCP(批号:2111680)、CD4-FITC(批号:2237793)、CD8-PE(批号:2195781)、APC Hamster Anti-mouse CD3e(批号:29414)、FITC Annexin V Apoptpsis Detection Kit I细胞凋亡试剂盒(批号:2195781)和Lysing Buffer(批号:07877)均购自BD Pharmingen公司;RNAprep Pure动物组织总RNA提取试剂盒(包含RNase-Free DNase I)(批号:L0615),FastQunat cDNA第一链合成试剂盒(批号:L0823),Super Real PreMix(SYBER Green)(批号:L0727),购自天根生化科技北京有限公司;GAPDH、Bcl-2和Bax基因引物由Invitrogen公司合成。
NUAIR-NU-5510E气套式CO 2培养箱(美国NUAIR公司);Biotek Synergy 2多功能酶标仪(美国佰腾仪器有限公司); FACS Calibar流式细胞仪(美国BD公司);7500 FAST实时定量PCR仪(Applied Biosystem公司)。
1.2 试验方法
1.2.1 虫草多糖的制备与总糖含量测定 冬虫夏草菌丝体粉经索氏提取器石油醚(80 ℃回流6 h)脱脂脱色素、95%乙醇去除小分子物质,25 ℃干燥后,残渣于沸水提取3次,每次4 h,合并上清液,减压浓缩后,在不断搅拌下,缓缓加入3倍体积的95%乙醇,4 ℃静置24 h,4 ℃、7 200 r·min -1离心20 min,沉淀物以丙酮洗涤5次,得多糖粗提物;经中性酶+Sevag方法除蛋白8次,再经截留分子量3 500 Da的透析袋透析,经冷冻干燥得到虫草多糖;采用苯酚-硫酸法测定总糖含量,虫草多糖水溶液于波长200~400 nm内进行紫外光谱扫描,以蒸馏水为对照。
1.2.2 动物分组及给药方法 ICR小鼠40只,♂,按体质量随机分成5组,分别为空白对照组、阳性组(香菇多糖组)、虫草多糖高、中和低剂量组。每天分别腹腔注射虫草多糖200,100,50 mg·kg -1和香菇多糖1 mg·kg -1,注射体积均为20 mL·kg -1;空白对照组腹腔注射等体积的生理盐水,连续给药10 d,于第11天眼眶采血,肝素抗凝,流式细胞仪检测外周血总T淋巴细胞(CD3 +)数量和CD4 +CD8 -、CD4 -CD8 +亚群淋巴细胞数量及其比例;Annexin V-FITC测定外周血的总T淋巴细胞(CD3 +)凋亡率。最后小鼠颈椎脱臼致死,无菌条件下取脾脏,称重后用于ConA诱导小鼠脾淋巴细胞转化实验和脾组织凋亡相关基因Bcl-2和Bax mRNA转录水平测定,然后取胸腺,计算胸腺指数和脾脏指数。
1.2.3 外周血T淋巴细胞(CD3 +细胞)及其亚群CD4 +CD8 -、CD4 -CD8 +细胞数量的测定 取100 µL全血置于流式管中,加CD3-PerCP-Cy、CD4-FITC、CD8-PE抗体复合物,置于4 ℃冰箱避光孵育30 min,各管加2 mL的10倍稀释的红细胞裂解液,置于4 ℃冰箱避光孵育10 min,4 ℃,1 500 r·min -1离心5 min,弃上清液,冷PBS洗涤2次,4 ℃,1 500 r·min -1离心5 min,弃上清液,用400 µL PBS重悬细胞,待测。
1.2.4 外周血T淋巴细胞(CD3 +细胞)凋亡测定取100 µL全血置于流式管中,加CD3-APC,置于4 ℃避光孵育20 min,各管加2 mL的10倍稀释的红细胞裂解液,置于4 ℃避光孵育10 min,4 ℃,1 500 r·min -1离心5 min,弃上清液,冷PBS洗涤2次,4 ℃,1 500 r·min -1离心5 min,弃上清液,用100 µL binding缓冲液混悬,再加5 µL Annexin V-FITC和5 µL碘化丙啶(PI),混匀,室温孵育15 min;每份样品加入l×binding缓冲液300 µL后流式细胞仪检测。
1.2.5 ConA诱导小鼠脾淋巴细胞转化试验(MTT法) 将脾脏置于盛有适量RPMI-1640的培养皿中,用一次性5 mL注射器的针芯研磨,制成单细胞悬液,200目筛网过滤,洗涤,计数,最后用RPMI-1640完全培养液调整细胞浓度为5×10 -6mL -1。将每个标本的细胞悬液分8孔加入96孔培养板中,每孔100 μL:4孔加100 μL ConA液(终浓度:3 μg·mL -1),另4孔作为对照,再加100 μL RPMI-1640完全培养液,总体积200 μL,置于37 ℃、5%CO 2培养箱中培养72 h。培养结束前4 h,每孔加入50 μL MTT(1 mg·mL -1),继续培养4 h。培养结束后,去除培养液,每孔加入150 μL酸性异丙醇,吹打混匀,使紫色结晶完全溶解。490 nm波长测定光密度值(OD值)。最后用加ConA孔的光密度值减去不加ConA孔的光密度值代表淋巴细胞的增殖能力。
1.2.6 Real-time PCR检测 小鼠脾脏按试剂盒提供的步骤提取RNA,按试剂盒说明逆转录得cDNA。Bcl-2、Bax基因及内参Gapdh基因PCR引物序列见表1,引物由Invitrogen公司合成。Real-time PCR循环参数设定:95 ℃ 15 min;95 ℃10 s,62 ℃ 45 s,经40个循环。应用荧光定量PCR技术检测Bcl-2、Bax mRNA表达。PCR扩增完毕后,进行溶解曲线分析检测产物的特异性。以Gapdh转录水平位内参,采用2 -ΔΔCT法对实时荧光定量PCR试验结果进行分析,基因转录水平相对量=2 -ΔΔCT。空白对照组Bcl-2、Bax及Gapdh mRNA的转录水平分别为1,虫草多糖各剂量组Bcl-2、Bax及Gapdh mRNA相对转录水平与相应的对照组比较进行计算。
1.3 统计学分析
实验数据以
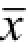 ±s表示,应用Microsoft Excel软件进行处理,组间比较采用t检验。
±s表示,应用Microsoft Excel软件进行处理,组间比较采用t检验。
表1 Bcl-2、Bax基因及内参基因PCR引物的序列信息
Tab.1 Primer sequences of Bcl-2, Bax and Gapdh for RT-PCR
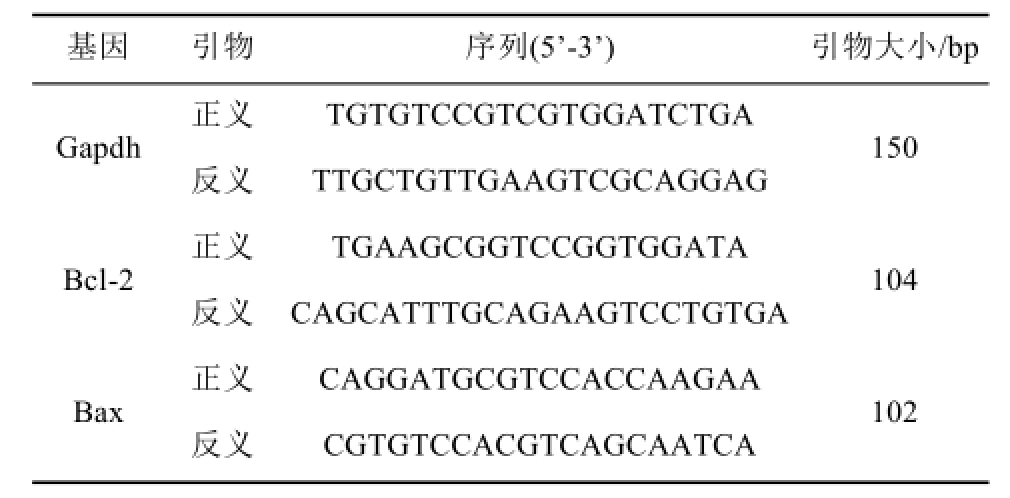
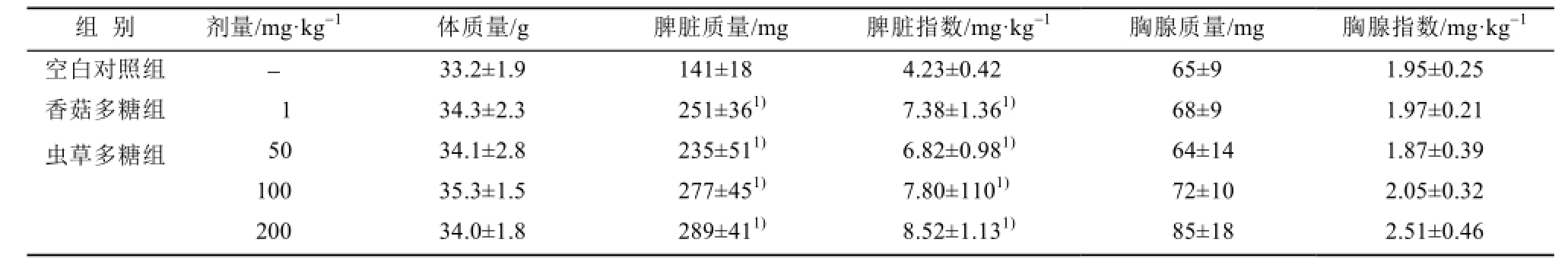
表2 虫草多糖对小鼠免疫器官质量的影响(n=7,
 ±s)
±s)
Tab.2 Effects of cordyceps polysaccharide on the immune organ weight of normal mice(n=7,
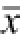 ±s)
±s)
注:与空白对照组比较,
1)P<0.01。
Note: Compared with blank control group,
1)P<0.01.
2.1 虫草多糖的制备及总糖含量测定
本法获得的虫草多糖水分为6.75%,苯酚-硫酸法测得总糖含量为71.21%(以干品计),200~400 nm紫外扫描图谱在200 nm显示为末端吸收,260,280 nm处无紫外吸收,表明多糖中无蛋白、多肽及核酸。
2.2 虫草多糖对小鼠的免疫器官质量及指数的影响
与空白对照组相比,虫草多糖各剂量组均能明显增加小鼠脾脏质量及其脏器指数,剂量关系明显;高剂量组小鼠胸腺质量及脏器指数也有增大趋势。结果见表2。
2.3 虫草多糖对小鼠外周血T淋巴细胞及其亚群的影响
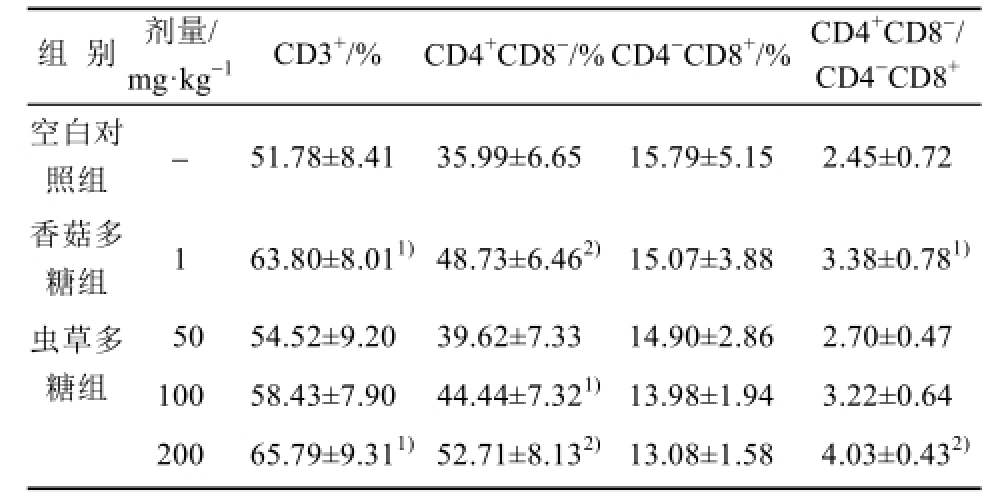
与空白对照组比较,虫草多糖高剂量组能明显增加外周血T淋巴细胞(CD3 +细胞)和CD4 +CD8 -细胞亚群的数量,降低CD4 -CD8 +细胞亚群数量,增加CD4 +CD8 -/CD4 -CD8 +的比值,中剂量组有相同的变化趋势,呈现一定的剂量关系。结果见表3。
2.4 虫草多糖对小鼠外周血T淋巴细胞(CD3 +细胞)凋亡的影响
与空白对照组比较,虫草多糖各组的小鼠外周血中CD3 +淋巴细胞凋亡率均有下降趋势,尤以高剂量组最为明显(P<0.05)。结果见图1~2。
表3 虫草多糖对小鼠外周血T淋巴细胞及其亚群数量的影响(n=7,
 ±s)
±s)
Tab.3 Effects of cordyceps polysaccharide on the number of T lymphocytes and its subsets in peripheral blood of normal mice(n=7,
 ±s)
±s)
注:与空白对照组比较,
1)P<0.05,
2)P<0.01。
Note: compared with blank control group,
1)P<0.05,
2)P<0.01.
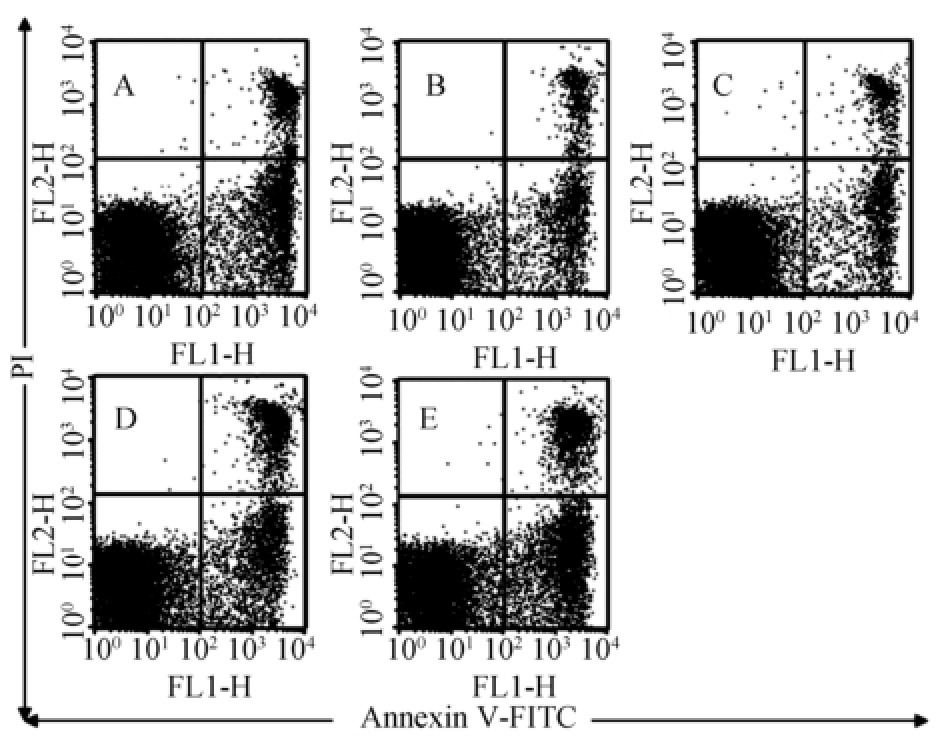
图1 虫草多糖对小鼠外周血CD3
+细胞凋亡的影响
A-空白对照组;B-香菇多糖组;C-虫草多糖200 mg·kg
-1组;D-虫草多糖100 mg·kg
-1组;E-虫草多糖50 mg·kg
-1组。
Fig.1 Effects of cordyceps polysaccharide on apoptosis rate of CD3
+lymphocytes in peripheral blood of normal mice
A-blank control group; B-lentinan group; C-cordyceps polysaccharide 200 mg·kg
-1group; D-cordyceps polysaccharide 100 mg·kg
-1group; E-cordyceps polysaccharide 50 mg·kg
-1group.
2.5 虫草多糖对小鼠脾淋巴细胞转化功能的影响
与空白对照组比较,虫草多糖各剂量组对未经ConA诱导的T淋巴细胞增殖转化能力具有明显促进作用,随剂量的增加而逐渐增高(P<0.01或P<0.05),表明虫草多糖能增强小鼠的细胞免疫功能;而对经ConA诱导的T淋巴细胞增殖转化能力却没有促进作用。结果见表4。
2.6 虫草多糖对小鼠脾脏组织凋亡相关基因表达的影响
与空白对照组比较,虫草多糖能不同程度的上调Bcl-2 mRNA相对转录水平,高剂量组具有统计学差异(P<0.05),而对Bax mRNA 转录水平没有明显变化,Bcl-2/Bax比值明显升高(P<0.05)。结果见图3~4。

图2 虫草多糖对小鼠外周血CD3
+细胞凋亡的影响(n=7,
 ±s)
±s)
与空白对照组比较,
1)P<0.05。
Fig.2 Effects of cordyceps polysaccharide on apoptosis rate of CD3
+lymphocytes in peripheral blood of normal mice (n=7,
 ±s)
±s)
Compared with blank control group,
1)P<0.05.
表4 虫草多糖对小鼠脾淋巴细胞增殖转化功能的影响(
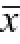 ±s,n=7)
±s,n=7)
Tab.4 Effects of cordyceps polysaccharide on the spleen lymphocyte transformation rate of normal mice (
 ±s, n=7)
±s, n=7)
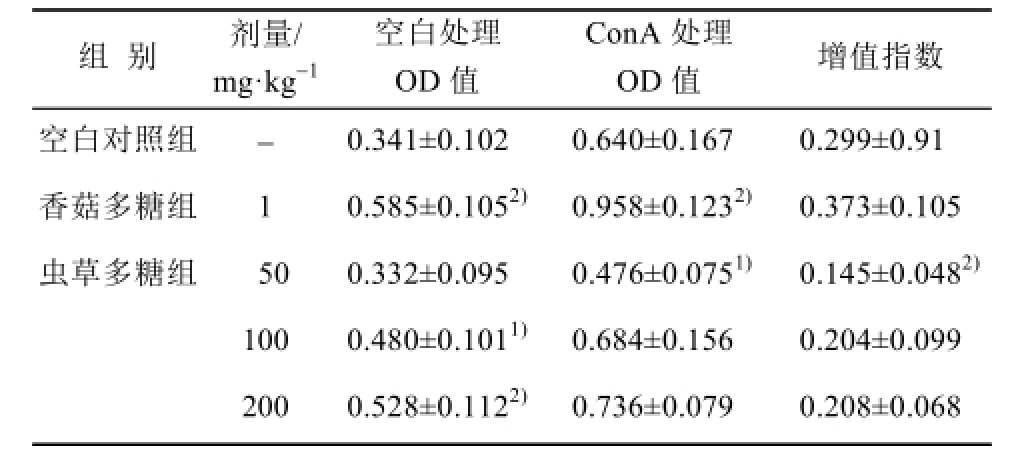
注:与空白对照组比较,
1)P<0.05,
2)P<0.01。
Note: Compared with blank control group,
1)P<0.05,
2)P<0.01.

图3 虫草多糖对小鼠脾脏组织Bcl-2和Bax mRNA相对转录水平的影响(n=7,
 ±s)
±s)
与空白对照组比较,
1)P<0.05,
2)P<0.01。
Fig.3 Effects of cordyceps polysaccharide on expression levels of Bcl-2 and Bax genes in spleens of normal mice (n=7,
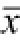 ±s)
±s)
Compared with blank control group,
1)P<0.05,
2)P<0.01.

图4 虫草多糖对小鼠脾脏组织Bcl-2/Bax 比值变化的影响(n=7,
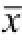 ±s)
±s)
与空白对照组比较,
1)P<0.05。
Fig.4 Effects of cordyceps polysaccharide on the spleen Bcl-2/Bax ratio changes of normal mice(n=7,
 ±s)
±s)
Compared with blank control group,
1)P<0.05.
胸腺和脾脏是机体的主要免疫器官。胸腺除了作为一个中枢免疫器官与T细胞成熟相关外,还具有外周淋巴器官的成分,即还能产生抗体。脾脏是后天淋巴细胞定居增生及发生免疫反应的场所,其质量的大小在一定程度上反映机体免疫系统的状态。这些免疫器官的发育状态及机能强弱,直接决定机体全身免疫水平。本试验显示,虫草多糖50,100和200 mg·kg -1剂量可剂量依赖性刺激小鼠脾脏质量及其指数显著增加,对胸腺质量及其指数也有一定程度的刺激作用,提示虫草多糖可促进小鼠的免疫功能。
T淋巴细胞在体外培养时,受到有丝分裂原ConA刺激后,可出现细胞体积增大,代谢旺盛,蛋白和核酸合成增加的现象,即向淋巴母细胞转化和增殖 [14]。T淋巴细胞调节机体的细胞应答,是适应性免疫系统的主要效应细胞 [15]。淋巴细胞转化率的高低可以反映机体的细胞免疫水平,因此可作为测定机体免疫功能的指标之一。本试验结果显示,与空白对照组比较,虫草多糖高、中剂量连续给药10 d后,对未经ConA刺激的脾T淋巴细胞增殖转化能力具有明显的促进作用(P<0.01或P<0.05),提示虫草多糖能提高正常小鼠的细胞免疫功能;但脾淋巴细胞在ConA刺激后,虫草多糖高、中剂量虽进一步促进T淋巴细胞增殖转化,但与正常组比较,差异不明显。
免疫细胞通过凋亡机制,使大量未成熟的细胞,包括自身反应性淋巴细胞得以清除,从而保证了免疫系统处于正常功能状态。本研究通过Annexin-V/PI双染法测定小鼠外周血中T淋巴细胞(CD3 +细胞)的凋亡率。本试验显示,虫草多糖明显提高外周血CD3 +细胞数量,降低CD3 +细胞凋亡率。
细胞凋亡的信号传导途径极其复杂,其中Bcl-2通过稳定线粒体膜,防止线粒体内促凋亡相关蛋白泄漏至胞质及阻断Ca 2+从内质网释放,使依赖Ca 2+的核酸内切酶活性降低等途径阻断细胞凋亡 [16-18]。Bax为Bcl-2相关蛋白,可与抗凋亡蛋白Bcl-2形成异源二聚体,抑制Bcl-2的作用,从而能促进细胞凋亡 [19-21]。Bcl-2/Bax比值决定细胞受诱导刺激后是凋亡还是存活,Bax过量时,形成Bax-Bax同二聚体,诱导细胞凋亡;Bcl-2过量时,形成Bcl-2-Bax异二聚体,抑制细胞凋亡 [22-23]。本研究显示,虫草多糖可诱导小鼠脾脏组织Bcl-2 mRNA转录水平显著升高(P<0.05),而Bax mRNA转录水平则没有明显变化,而Bcl-2/Bax比值明显升高(P<0.05),提示虫草多糖可能通过上调Bcl-2基因表达、抑制细胞凋亡,从而提高外周血CD3 +淋巴细胞数量。
本研究结果显示,冬虫夏草菌丝体多糖可刺激小鼠主要免疫器官增生,提高T淋巴细胞及CD4 -CD8 +亚群的数量,其作用机制可能与上调抑制凋亡基因Bcl-2 mRNA的转录,提高Bcl-2/Bax比值,从而抑制淋巴细胞凋亡有关。但本研究中样品的多糖含量仅71.21%,而且不是单一分子量多糖,虫草多糖中免疫刺激的活性分子及具体的信号通路需要进一步研究。
REFERENCES
[1] TAN Z L, YIN H S, HUANG H, et al. Chemical ingredients of submerged cultivation mycelium of Cordyceps sinensis [J]. Food Sci(食品科学), 2008, 29(3): 328-321.
[2] 高俊德, 马紫亮, 张喜财, 等. 冬虫夏草菌丝体分离培养及其与生药冬虫夏草化学成分的对比[J]. 中国中药杂志, 1988, 12(1): 3-5.
[3] XU F Y. Clinical application of Aweto and its fermentation mycelium [J]. Drug Eval (药品评价), 2005, 2(4): 255-265.
[4] HU X, HUANG X, WANG B, et al. Progress in studies on antitumor and immunomodulatory effect of Cordyceps sinensis [J]. Drug Eval Res(药物评价研究), 2015, 38(4): 448-452.
[5] JAYAKUMAR T, CHIU C C, WANG S H, et al. Anti-cancer effects of CME-1, a novel polysaccharide, purified from the mycelia of Cordyceps sinensis against B16-F10 melanoma cells [J]. J Cancer Res Ther, 2014, 10(1): 43-49.
[6] MEI Y X, YANG W, ZHU P X, et al. Isolation, characterization, and antitumor activity of a novel heteroglycanfrom cultured mycelia of Cordyceps sinensis [J]. Planta Med, 2014, 80(13): 1107-1112.
[7] REN J, ZHANG Q L, ZHENG L. Effects of polysaccharides from cultured Cordyceps sinensis on immune function of immunosuppressed mice [J]. J Fourth Mil Med Univ (第四军医大学学报), 2007, 28(21): 1967-1969.
[8] GONG X J, JI H, LU S G, et al. Effects of polysaccharides from Cordyceps sinensis on murine immunologic fuction [J]. J Chin Pharm Univ(中国药科大学学报), 2000, 31(1): 53-55.
[9] YUAN J G, CHENG X H, HOU Y Q, et al. Study on polysaccharide from Cordecps as functional factor [J]. China Food Add(中国食品添加剂), 1999, 10(2): 18-22.
[10] CHEN L, AN L G. Studies on the anti-tumour activity and immunomodulatory function of polysaccharide of carceps sinensis (csp) [J]. J Shandong Norm Univ (Nat Sci)(山东师范大学学报: 自然科学版), 2009, 24(4): 109-112.
[11] CHEN W, ZHANG W, SHEN W, et a1. Effects of the acid polysaccharride fraction isolated from a cultivated Cordyeeps sinensis on m acrophages in vitro [J]. Cell Immunol, 2010, 262(1): 69-74.
[12] ZHONG J C, ZHANG Y, DING Z T, et al. Effect of polysaccharide extract from artificial Cordyceps sinenisis on immune function of mouse [J]. J Sun Yat-sen Univ (Nat Sci)(中山大学学报 自然科学版), 2011, 50(6): 99-l02.
[13] YAN W J, LI T H, XIE Y Z. Immunoregulatory activity of hot aqueous extracts of Ophiocordyceps sinensis myceliun evaluated using a immune-deficient mouse model [J]. Acta Edulis Fungi(食用菌学报), 2013, 20(1): 75-79.
[14] HUANG H, JIANG J M, FU H Y. Effects of Hirsutella sinensis strain fermentation on the proliferation of T and B lymphocyte in mouse [J]. J Zhejiang Univ Tradit Chin Med (浙江中医药大学学报), 2010, 34(4): 604-605.
[15] CHEN W, MA X Q, FAN W X, et a1. Major efficacy component of rhodiola stimulate proliferation and transformation on mouse immune cells [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(1): 38-42.
[16] ORRENIUS S. Mitochondrial regulation of apoptotic cell death [J]. Toxicol Lett, 2004, 149(1-3): 19-23.
[17] HALESTRAP A P, DORAN E, GILLESPIE J P, et a1. Mitochondria and cell death [J]. Biochem Soc Trans, 2000, 28(2): 170-177.
[18] MIKHAILOV V, MIKHAILOVA M, PULKRABEK D J, et a1. Bcl-2 prevents Bax oligomerization in the mitochondrial outer membrane [J]. J Biol Chem, 2001, 276(21): 18361-18374.
[19] MERTENS H J, HEINEMAN M J, EVERS J L. The expression of apoptosis-related proteins Bcl-2 and Ki67 in endometrium of ovulatorymenstrual cycles [J]. Gynecol Obstet Invest, 2002, 53(4): 224-230.
[20] NESS J M, HAREY C A, STRASSER A, et a1. Selective involvement of BH3-only Bcl-2 family members Bim and Bad in neonatal hypoxia-ischemia [J]. Brain Res, 2006, 1099(1): 150-159.
[21] NIQUET J, WASTERLAIN C G. Bim, Bad and Bax: a deadly combination in epileptic seizures [J]. J Clin Invest, 2004, 113(7): 960-962.
[22] WANG W D, CHEN Z T. Bcl-2/Bax ratio and the “life or death fate” of cells [J]. Chin J Cancer Biother(中国肿瘤生物治疗学杂志), 2007, 14(4): 393-396.
[23] LE B M, ROUYL I, BRENNER C. The modulation of interorganelle cross-talk to control apoptosis [J]. Med Chem, 2006, 2(1): 1-12.
Mechanism in the Regulation of the Number of T Lymphocytes and Its Subsets of Normal Mice by Polysaccharides of Cordyceps Sinensis Mycelium
ZHUGE Dingjuan, CHEN Aiying, CHENG Min, MIAO Yunping, TIAN Xuejun, ZHENG Gaoli, YE Xiaodi *(Zhejiang Academy of Medical Sciences, Hangzhou 310013, China)
ABSTRACT:OBJECTIVE To study the effect of polysaccharides of Cordyceps sinensis mycelium (cordyceps polysaccharide) on the number of T lymphocytes and its subsets of normal mice and the possible mechanism. METHODS The ICR mice were randomly divided into the blank control group, positive group (lentinan 1 mg·kg -1), cordyceps polysaccharide groups in high, medium and low dose (200, 100, 50 mg·kg -1). After continuous celiac injection for 10 d, the number of T lymphocytes (CD3 +cells) and their subgroups (CD4 +CD8 -and CD4 -CD8 +cells), the apoptosis rate of CD3 +cells in peripheral blood were detected by flow cytometry; the transformation rates of spleen lymphocyte and the expression levels of apoptosis-related genes Bcl-2 and Bax mRNA in spleen tissue were detected by real-time PCR, and the thymus index and the spleen index were measured. RESULTS Compared with the blank control group, cordyceps polysaccharide groups significantly increased spleen weight and the transformation of spleen lymphocytes in a dose-dependent manner. High dose of cordyceps polysaccharide group could obviously increase the number of CD3 +cells and CD4 +CD8 -cell subsets, reduce the number of CD4 -CD8 +cell subsets, and significantly increase the ratio of CD4 +CD8 -/CD4 -CD8 +in peripheral blood. High dose of Cordyceps polysaccharide group significantly reduced apoptosis rate of CD3 +cells in peripheral blood, and the transcription levels of apoptosis-related genes Bcl-2 in spleen tissue, while no significant change in the transcription level of Bax, and the Bcl-2/Bax ratio was significantly increased accordingly. CONCLUSION Cordyceps polysaccharide stimulates proliferation of mice main immune organs (spleen and thymus) and increases the number of T lymphocytes and CD4 +CD8 -subgroup of mice. The protective mechanism suggests that cordyceps polysaccharide upregulates the transcription levels of inhibitory apoptosis gene Bcl-2 and the ratio of Bcl-2/Bax, and then inhibits the apoptosis rate of lymphocytes.
KEY WORDS:Cordyceps sinensis mycelium; cordyceps polysaccharide; T lymphocyte subgroup; apoptosis; Bcl-2; Bax
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2017)02-0171-06
DOI:10.13748/j.cnki.issn1007-7693.2017.02.005
收稿日期:2016-05-23
基金项目:浙江省自然科学基金(Y2090286)
作者简介:诸葛定娟,女,硕士生 Tel: (0571)88215620 E-mail: 770692046@qq.com *
通信作者:叶小弟,女,硕士,副研究员 Tel: (0571)88215620 E-mail: ye_xiaodi@hotmail.com