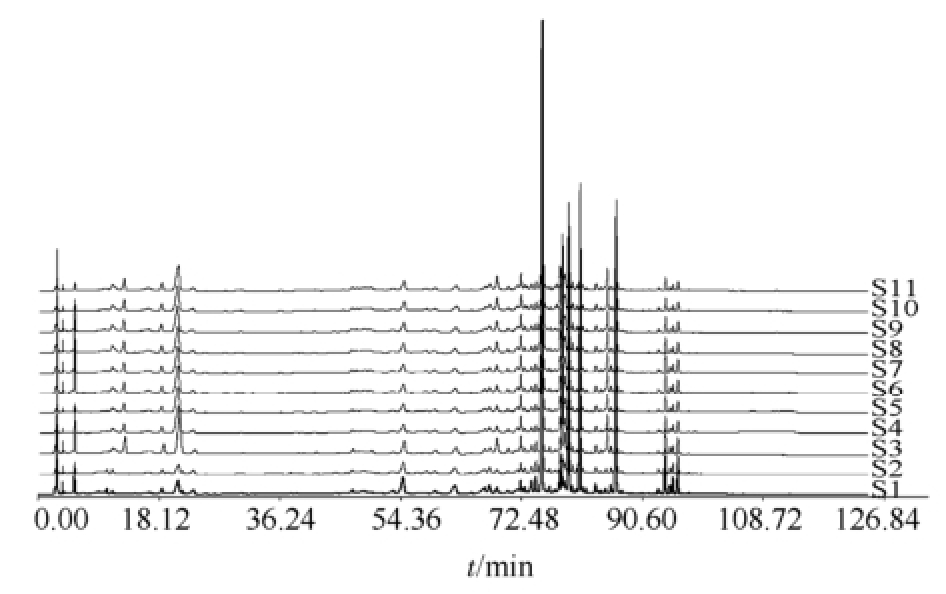
图1 11批消炎片HPLC指纹图谱
Fig.1 HPLC fingerprint of 11 batchs of Xiaoyan tablets
白 冰 1,2,徐 建 2,高丽娟 1,祁树贤 1,赫玉芳 2,3*,南敏伦 3,赵昱玮 3,孙佳明 2(1.修正药业集团股份有限公司,吉林 通化 134000;2.吉林修正药业新药开发有限公司,长春 130012;3.吉林省中医药科学院,长春 130012)
摘要:目的 采用HPLC建立消炎片的指纹图谱分析方法,并测定秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素的含量,为其质量控制提供依据。方法 采用ACE C 18色谱柱(4.6 mm × 250 mm,5 μm),以乙腈-0.1%甲酸溶液为流动相,梯度洗脱,检测波长为321 nm。运用“中药色谱指纹图谱相似度评价软件”(2004 A版)对11批消炎片进行相似度评价。结果 11批消炎片相似度均>0.90,确定25个共有峰,指定秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素为特征峰并测定其含量。结论 该方法建立的消炎片HPLC指纹图谱特征性强、多指标成分含量测定方法重复性好、方法简便、准确,可为产品综合评价和质量控制提供依据。
关键词:消炎片;指纹图谱;含量测定
消炎片收载于《中药部颁标准》,标准编号:WS3-B-0809,由蒲公英、紫花地丁、野菊花、黄芩4味中药组成,功能与主治为抗菌消炎 [1]。用于呼吸道感染,发热,肺炎,支气管炎,咳嗽有痰,疖肿等。黄芩中含有黄酮类、醇苷等成分,其中黄芩素、黄芩苷、汉黄芩素、汉黄芩苷等黄酮类成分是其主要药效成分 [2];紫花地丁的化学成分主要有黄酮及其苷类、香豆素及其苷类等,秦皮乙素为主要药效成分 [3];蒲公英中含有倍半萜、三萜、黄酮等类型化学成分 [4];野菊花主要含黄酮、萜类及挥发油等成分,其中蒙花苷是其主要药效成分 [5],4味中药均具有抗菌、抗炎等作用。
原部颁标准仅以显微鉴别和黄酮类化合物的定性鉴别控制该制剂质量。经检索发现多篇关于HPLC测定消炎片中绿原酸、黄芩苷等有效成分的报道 [6-8],但未见指纹图谱研究方面的报道,本研究采用HPLC建立了消炎片的指纹图谱分布方法,并测定秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素的含量。
Agilent 1220型高效液相色谱仪(美国安捷伦);KQ-100型超声波清洗器(昆山市超声仪器有限公司);RE-98型旋转蒸发仪(上海亚荣生化仪器厂);124S电子天平(北京赛多利斯天平有限公司)。
纯净水(娃哈哈),乙腈(色谱纯),其他试剂均为分析纯。秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素对照品(含量均>99%,批号分别为110741-200506、110715-201016、111528-200606、111595-200905、111514-200403,中国食品药品检定研究院)。消炎片(规格为:每片0.6 g;批号分别为:150301、150302、150303、150304、150305、150601、150801、150802、150803、150804、150805,修正药业集团股份有限公司)。
2.1 色谱条件
Agilent 1220型高效液相色谱仪,ACE C 18色谱柱(4.6 mm×250 mm,5 μm);进样量:10 μL;柱温:25 ℃;检测波长:321 nm;流动相:乙腈(A)-0.1%甲酸溶液(B),流速:1.0 mL·min -1,梯度洗脱:0~30 min,7%~10%A;30~45 min,10%~15%A;45~60 min,15%A;60~70 min,15%~25%A;70~80 min,25%~35%A;80~90 min,35%~45%A;90~100 min,45%~55%A;100~110 min,55%~65%A;110~115 min,65%~7%A;115~120 min,7%A。
2.2 溶液的制备
2.2.1 供试品溶液的制备 取消炎片(批号:150302)10片,精密称定,研细,取约0.3 g,精密称定,置索氏提取器中,加石油醚(60~90 ℃) 50 mL,加热回流1 h,弃去石油醚液,药渣挥去石油醚,置具塞锥形瓶中,精密加甲醇50 mL,密塞,称定质量,超声处理(功率160 W,频率50 kHz)30 min,放冷,再称定质量,用甲醇补足减失质量,摇匀,滤过,取续滤液,即得。
2.2.2 对照品溶液制备 分别精密称取秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素对照品适量,精密称定,置于同一10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,再精密吸取1 mL置于同一10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成质量浓度分别为0.053 1,0.533 0,0.044 3,0.044 8,0.021 5 mg·mL -1的混合对照品溶液。
2.3 指纹图谱方法学考察
2.3.1 稳定性试验 取同一供试品(批号:150302)溶液,分别于0,4,8,12,24 h按“2.1”项下色谱条件进行测定,各色谱峰的相对保留时间和相对峰面积的RSD均<2.0%,表明供试品溶液在24 h内稳定性良好。
2.3.2 精密度试验 取同一供试品(批号:150302)溶液,按“2.1”项下色谱条件下连续进样6次,各共有峰的相对保留时间的RSD均<1.5%,相对峰面积的RSD均<2.8%,表明仪器精密度良好。
2.3.3 重复性试验 取供试品(批号:150302)按“2.2.1”项下方法制备6份供试品溶液,按“2.1”项下色谱条件进行测定,各色谱峰的相对保留时间和相对峰面积的RSD分别<0.9%和2.6%,表明重复性良好。
2.4 指纹图谱的建立及相似度评价
按“2.2.1”项下方法分别制备11批消炎片供试品溶液,按“2.1”项下色谱条件进样检测,HPLC指纹图谱见图1,混合对照品图谱见图2。

图1 11批消炎片HPLC指纹图谱
Fig.1 HPLC fingerprint of 11 batchs of Xiaoyan tablets

图2 高效液相色谱图
A-混合对照品溶液;B-供试品溶液;1-秦皮乙素,2-黄芩苷,3-蒙花苷,4-黄芩素,5-汉黄芩素。
Fig.2 HPLC chromatograms
A-mixed standard solution; B-sample solution; 1-esculetin; 2-baicalin; 3-buddleoside; 4-baicalein; 5-wogonin.
采用国家药典委员会“中药色谱指纹图谱相似度评价系统”(2004 A版)对11批消炎片HPLC指纹图谱进行分析。设定S1为参照图谱,其他样品色谱峰与参照图谱自动匹配,共标定25个共有峰,相似度评价结果见表1。从相似度结果可以看出,11批消炎片相似度均>0.90,符合指纹图谱技术要求,表明各批样品的化学成分一致性较好。
2.5 多指标含量测定方法学考察
2.5.1 线性关系考察 分别吸取“2.2.2”混合对照品溶液2,4,8,12,16,20 μL,按“2.1”项下色谱条件进行测定,以各对照品的进样量为横坐标、峰面积为纵坐标,计算得线性方程,秦皮乙素:Y=2 384.14X-30.04,r=0.999 7,线性范围为0.106 2~1.062 μg;黄芩苷:Y=2 377.13X-322.63,r=0.999 7,线性范围为1.66~10.66 μg;蒙花苷:Y=3 196.91X+30.73,r=0.999 0,线性范围为0.088 6~0.886 μg;黄芩素:Y=4 293.05X-1.39,r=0.999 5,线性范围为0.089 6~0.896 μg;黄芩苷:Y=2 383.18X+2.54,r=0.999 9,线性范围为0.043~0.43 μg。表明各对照品在相应进样量范围内线性关系良好。
2.5.2 稳定性试验 取同一供试品(150302)溶液,分别于0,4,8,12,24,48 h按“2.1”项下色谱条件进行测定,结果秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素含量的RSD分别为1.8%,0.6%,1.8%,1.2%,1.5%。
2.5.3 精密度试验 取同一供试品(150302)溶液,按“2.1”项下色谱条件下连续进样6次,结果秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素含量的RSD分别为1.6%,0.8%,1.1%,1.3%,1.3%。
2.5.4 重复性试验 取同一供试品(150302)按“2.2.1”项下方法制备6份供试品溶液,按“2.1”项下色谱条件进行测定,结果秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素含量的RSD分别为1.3%,0.7%,1.7%,1.4%,1.2%。
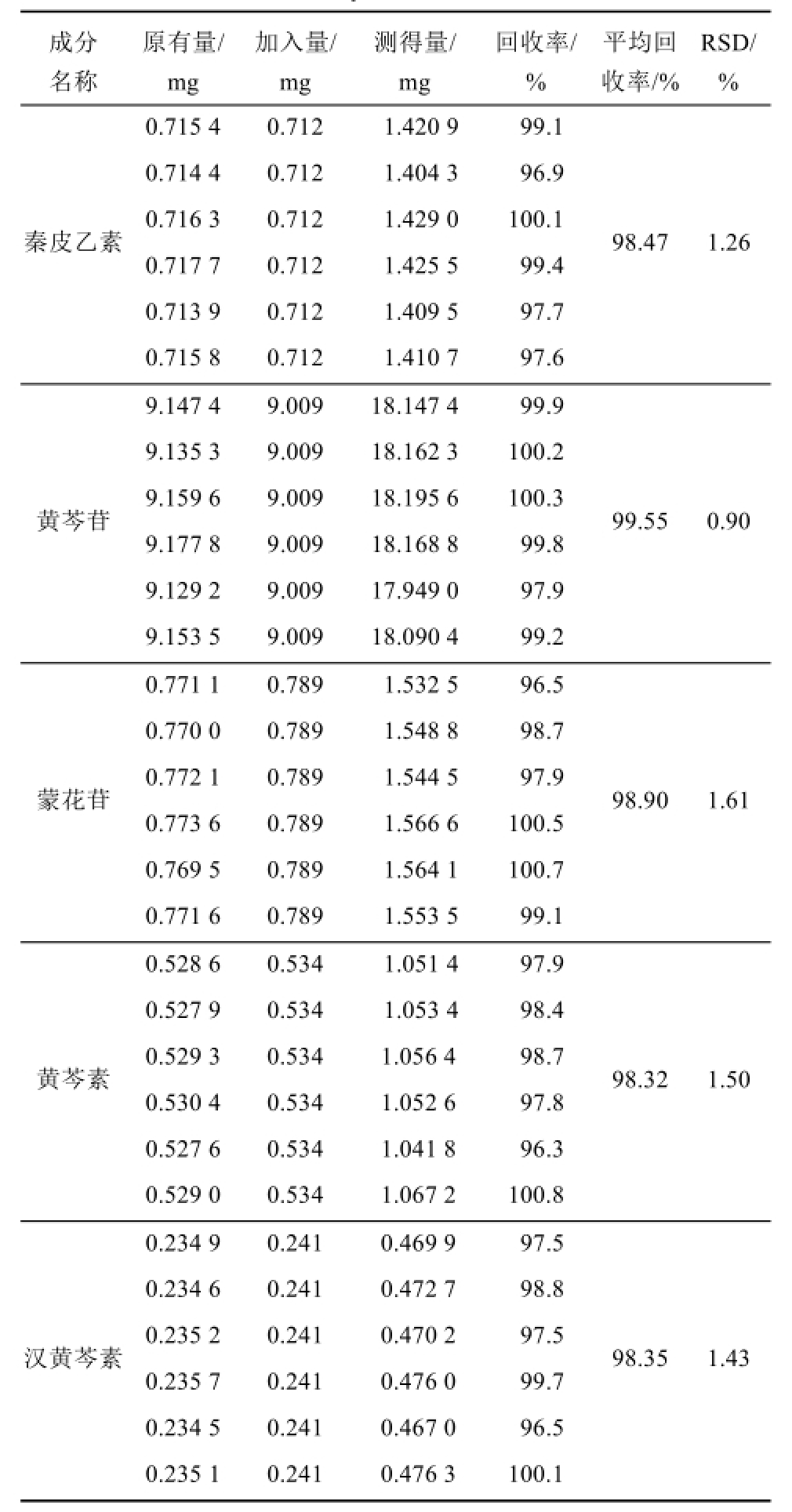
2.5.5 加样回收率试验 取已知含量的消炎片(批号:150302)6份各约0.15 g,精密称定,分别加入秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素,按“2.2.1”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,进行加样回收率考察秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素的平均回收率结果见表1。
表1 加样回收率试验结果(n=6)
Tab.1 Results of recovery test(n=6)
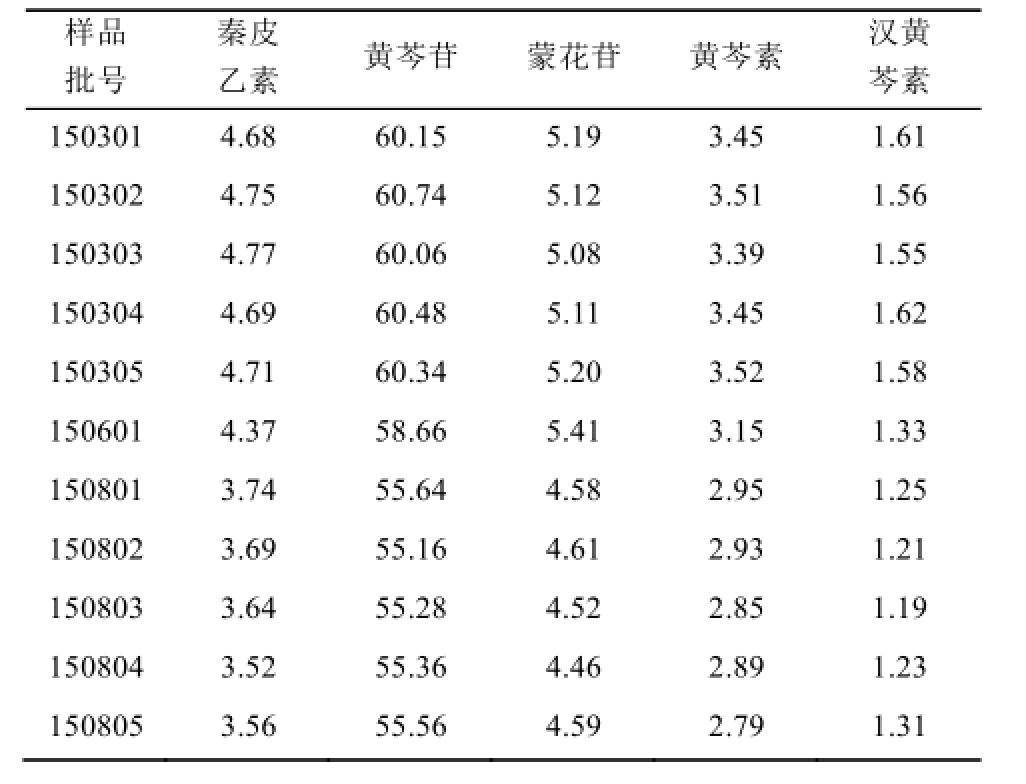
2.5.6 样品含量测定 精密称取11批样品,分别按“2.2.1”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,计算秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素的含量,结果见表2。
研究过程中分别对甲醇-水、甲醇-甲酸溶液、乙腈-水及乙腈-甲酸溶液等流动相 [5]进行了考察,进行了不同梯度洗脱的优选,最终确定乙腈-0.1%甲酸溶液为流动相的梯度洗脱系统。分别对Diamonsil C 18、ACE C 18、Agilent C 18(4.6 mm× 250 mm,5 μm)进行了考察,从中选定了ACE C 18(4.6 mm×250 mm,5 μm),该色谱柱对消炎片的分离效果较好。采用DAD检测器进行全波长检测,结果显示,在321 nm时,基线较平稳,检出峰各峰比例适中,故选择以321 nm作为检测波长。考察了柱温为25,30,35 ℃对色谱分离效果的影响,结果表明,柱温对分离效果影响较小,故柱温选择25 ℃。
试验过程中,首选对不同提取溶剂,50%甲醇、70%甲醇、甲醇、50%乙醇、70%乙醇、乙醇进行了优化研究,结果显示,甲醇提取效果较好;对供试品进行石油醚索氏提取预处理前后的对比研究,结果显示,采用石油醚索氏提取预处理效果更好;对超声提取20,30,40 min进行了对比研究,研究表明,超声处理30 min即可。
本研究利用HPLC建立了消炎片的指纹图谱测定方法,并同时测定消炎片中秦皮乙素、黄芩苷、蒙花苷、黄芩素、汉黄芩素的含量,方法简便、重复性好,稳定、可靠,为消炎片的质量控制提供了参考依据。
表2 11批消炎片中5种成分含量测定
Tab.2 Determination results of 5 components in 11 batches of Xiaoyan tablets mg·g
-1
REFERENCES
[1] 中华人民共和国卫生部药典委员会. WS3-B-0809-91. 中华人民共和国卫生部药品标准: 中药成方制剂[S]. 第4册. 1991: 152.
[2] WANG M H, QU W, LIANG J Y. Advances in studies of Scutellaria baicalensis Georgi [J]. Strait Pharm J(海峡药学), 2013, 25(9): 6-13.
[3] CAO J, QIN Y, YIN C L, et al. Chemical constituents of Viola yedoensis and their antioxidant activity [J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2013, 19(21): 77-81.
[4] LIU H Q, WANG T L. Study on water-soluble chemical constituents of Taraxacum mongolicum [J]. J Chin Med Mater(中药材), 2014, 37(6): 989-991.
[5] WANG J Y, CHEN D, LIANG L J, et al. Chemical constituents from flowers of Chrysanthemum indicum [J]. China J Chin Mater Med (中国中药杂志), 2010, 35(6): 718-721.
[6] SUN F, CHEN L Z. Simultaneous determination of chlorogenic acid and esculetin in Xiaoyan tablets by HPLC [J]. Chin Med Herald(中国医药导报), 2011, 8(11): 54-56.
[7] CHEN L Z, ZHAO H Q. Simultaneous determination of baicalin, baicalein and wogonin in Xiaoyan tablets by HPLC [J]. J Shenyang Pharm Univ(沈阳药科大学学报), 2011, 28(6): 448-452.
[8] PAN P F, CHEN L Z, SUN F. Simultaneous determination of chlorogenic acid, esculetin and caffeic acid in Xiaoyan tablets by HPLC [J]. China Pharm(中国药师), 2011, 14(12): 1757-1758.
Fingerprint and Multi-Component Quantification Analysis of Xiaoyan Tablets by HPLC
BAI Bing
1,2, XU Jian
2, GAO Lijuan
1, QI Shuxian
1, HE Yufang
2,3*, NAN Minlun
3, ZHAO Yuwei
3, SUN
Jiaming
2(1.Xiuzheng Pharmaceutical Group Co., Ltd., Tonghua 134000, China; 2.Jilin Xiuzheng Pharmaceutiacal New Drug Development Co., Ltd., Changchun 130012, China; 3.Academy of Chinese Medical Sciences of Jilin Province, Changchun 130012, China)
ABSTRACT:OBJECTIVE To establish HPLC fingerprint of Xiaoyan tablets and simultaneously determine 5 chemical compositions (aesculetin, baicalin, linarin, baicalein, wogonin), provide evidence for quality control. METHODS The analytical column was ACE C 18(4.6 mm × 250 mm, 5 µm). The mobile phase was acetonitrile-water(containing 0.1% formic acid) with gradient elution, and the detection wavelength was set at 321 nm. “Chromatographic fingerprint similarity evaluation software” (version 2004 A) was used to evaluate similarity for the 11 batches Xiaoyan tablets. RESULTS The similarity among the 11 batches was all >0.90, and 25 common peaks were defined in the HPLC fingerprint, and 5 characteristic peaks were earmarked 5 characteristic peaks (aesculetin, baicalin, linarin, baicalein, wogonin) were earmarked and determined. CONCLUSION The HPLC fingerprint method is high characteristics, and the determination of multi-index components is repeatability, accurate and simple, which can be used efficiently in the quality control composite evaluation of Xiaoyan tablets.
KEY WORDS:Xiaoyan tablets; fingerprint; determination
中图分类号:R282.5
文献标志码:B
文章编号:1007-7693(2017)02-0258-04
DOI:10.13748/j.cnki.issn1007-7693.2017.02.022
收稿日期:2016-05-04
基金项目:吉林省科技发展计划项目(20140311061YY)
作者简介:白冰,女,高级工程师 Tel: (0431)89255009 E-mail: 33063825@qq.com *
通信作者:赫玉芳,女,博士,研究员 Tel: (0431)86058683 E-mail: hyf_1992@163.com