
刁 晶 1,3,刘 琨 2,刘勇庆 3,张 莉 3(1.天津医科大学第二医院,天津 300211;2.中国人民武装警察部队辽宁总队医院大连分院,山东 大连 116000;3.中国人民武装警察部队后勤学院生药与药剂学教研室,天津 300309)
摘要:目的 比较胆固醇和β-谷甾醇作为囊材制备的盐酸小檗碱囊泡的特性和体外释药差异。方法 采用薄膜蒸发法用2种囊材分别制备盐酸小檗碱囊泡,光学显微镜观察比较囊泡形态,微粒分析仪评价囊泡粒径分布差异;采用HPLC测定盐酸小檗碱囊泡包封率和载药量,比较2种囊泡的体外释放情况,并考察温度对囊泡稳定性的影响。结果 镜下观察2种囊材制备的囊泡圆整度均较好,粒径分布范围比较相似;用胆固醇和β-谷甾醇制备的囊泡包封率分别为28.5%和25.21%,载药量分别为1.32%和1.26%;体外释放试验中,在人工肠液和人工胃液中的胆固醇囊泡12 h累积释放百分率在50%左右,而β-谷甾醇囊泡的累积释放百分率>70%;40 ℃以下放置8 h,温度对2种小檗碱囊泡的包封率影响较小,当温度高于40 ℃时,2种小檗碱囊泡的包封率均显著降低。结论 用薄膜分散法制备的2种小檗碱囊泡镜下形态相似,包封率近似;用β-谷甾醇制备的囊泡释药快,释药量多;40 ℃以下放置稳定性均较好。β-谷甾醇作为载体材料制备囊泡具有可行性。
关键词:盐酸小檗碱;β-谷甾醇;胆固醇;囊泡;包封率;体外释放;稳定性
某些非离子表面活性剂可作为一种药物载体,通过自身闭合排列形成双分子层微型或多室结构的囊泡 [1]。在制备囊泡的过程中,需要加入适量胆固醇来改变膜的流动性。但现代医学证实,胆固醇与各种疾病的发生密切相关 [2]。β-谷甾醇是动植物细胞膜的主要组成成分,与胆固醇结构极为相似,且β-谷甾醇同样也可以改变膜的流动性,并有较强的粒径稳定性和氧化稳定性 [3-6]。因此,本研究分别用胆固醇和β-谷甾醇作为囊材,以盐酸小檗碱为模型药物制备囊泡,并从外观、粒径、包封率及体外释放等方面进行比较,从制剂学角度探讨用β-谷甾醇制备囊泡的可行性。
高效液相色谱仪(日本SHIMADZU,LC-20AT液相色谱泵,SPD-20A系列检测器);UV-2401 PC紫外分光光度计;BUCHI R-124型旋转蒸发仪(瑞士BüCHI公司);MOTIC B系列生物显微镜(麦克奥迪实业集团有限公司);Motic Image Advance3.2成像系统(Motic China Group Co.,Ltd.);ZWF-6F注射液微粒分析仪(天津市天河医疗仪器研制中心);Biofugestratos高速冷冻离心机(美国科俊);S-3C型精密pH计(上海精密科学仪器有限公司雷磁仪器厂)。
盐酸小檗碱对照品(中国药品生物制品检定所,批号:110713-201403,供含量测定用);盐酸小檗碱(四川协力制药有限公司,批号:050518,纯度:99.9%);β-谷甾醇(进口分装,北京化学试剂公司,批号:060217);胆固醇(上海政翔化学试剂研究所);司盘20、司盘80(化学纯,天津市化学试剂三厂);7000透析袋(Solarbio,MD34,进口分装),乙腈、甲醇(色谱纯,天津市科锐思精细化工有限公司);其余试剂均为分析纯。
2.1 HPLC测定盐酸小檗碱含量
2.1.1 色谱条件 色谱柱:C 18(4.6 mm×150 mm,5 µm,天津市兰博实验仪器设备有限公司);流动相:乙腈-0.04 mol·L -1磷酸二氢钾(30∶70;磷酸调节pH至3.0);流速:1 mL·min -1;柱温:30 ℃;检测波长:346 nm。
2.1.2 峰特异性考察 分别量取β-谷甾醇和胆固醇制得的盐酸小檗碱囊泡液1 mL,减压蒸干溶剂,加入适量甲醇溶解,于70 ℃水浴上加热30 min,冷却后转移到50 mL量瓶中定容,过滤后得含药囊泡溶液。取空白囊泡液1 mL,同法操作得空白囊泡液。2种溶液分别进样10 µL,比较色谱图中盐酸小檗碱的峰位置。
2.1.3 标准曲线的制备 精密称取0.1 g盐酸小檗碱对照品置于100 mL量瓶中,以甲醇为溶剂,制得盐酸小檗碱储备液。分别将储备液稀释成浓度为0.5,1,2.5,5,10,12.5 µg·mL -1的系列标准溶液,分别进样10 µL,记录峰面积,采用最小二乘法回归得到标准曲线方程。用A表示峰面积,C表示盐酸小檗碱浓度,将数据进行线性回归,计算标准曲线方程。
2.2 囊泡的制备
2.2.1 溶液的配制 分别称取4.286 g司盘80,3.464 g司盘20,以氯仿-乙醇(4∶1)为溶剂,溶于100 mL量瓶中,制备成0.1 mol·L -1表面活性剂溶液。另再分别称取2.077 g β-谷甾醇和1.930 g胆固醇,以氯仿-乙醇(4∶1)为溶剂,溶于100 mL量瓶中,制备成0.05 mol·L -1的β-谷甾醇和胆固醇溶液。称取0.1 g盐酸小檗碱置于100 mL量瓶中,以pH值为6.86的磷酸盐缓冲溶液为溶剂,制备成1 mg·mL -1的盐酸小檗碱溶液。
2.2.2 空白囊泡的制备 [2]量取司盘20或者司盘80溶液2 mL置于50 mL圆底烧瓶中,分别加1 mL β-谷甾醇或胆固醇,混匀后于旋蒸仪上以80 r·min -1的速度减压蒸干溶剂(水浴温度45 ℃)。取下,加入已预热至65 ℃的pH值6.86的磷酸盐缓冲液30 mL,保温(65 ℃)孵化60 min,于磁力搅拌器上搅拌1.5 h,即得空白囊泡。
2.2.3 盐酸小檗碱囊泡的制备
量取司盘20溶液2 mL,参照“2.2.2”项下方法制备载药囊泡,水化介质用1 mg·mL -1的盐酸小檗碱溶液30 mL,其余同上。
2.3 囊泡的形态观察和粒度分布统计
将空白囊泡混悬液滴于载玻片上,于显微镜下观察不同表面活性剂与β-谷甾醇或胆固醇所制得囊泡的形态,并利用Motic Images Advanced 3.2成像系统统计囊泡粒径及粒径分布。精密量取囊泡混悬液60 µL,加入到80 mL生理盐水中,以注射液微粒分析仪分析每毫升液体中的微粒数。
2.4 囊泡包封率的测定
采用离心法测定 [6-7],分别精密量取β-谷甾醇和胆固醇囊泡液1 mL,于离心管中,以20 000 r·min -1的速度,在温度为20 ℃的条件下离心1 h,弃去上清液,再加入缓冲液冲洗2次后加入适量甲醇,使沉淀重新分散溶解,置于70 ℃水浴上加热30 min,冷却后转移至50 mL量瓶中定容,过滤,进样10 µL,进行HPLC分析,用下述公式计算盐酸小檗碱囊泡的包封率与载药量。

2.5 囊泡的体外释放特性比较
参照中国药典2015年版配制人工胃液和人工肠液。分别取2种盐酸小檗碱囊泡溶液3 mL,以20 000 r·min -1的速度,离心1 h,弃去上清液,将沉淀重新分散在人工胃液或人工肠液中,并放入透析袋内,置于50 mL释放液中,37 ℃恒温水浴震荡,于0.5,1,1.5,2,2.5,3,3.5,4,4.5,5.5,6.5,7.5,8.5,9.5,10.5,11.5,12 h时取样4 mL,并立即补充同温等量释放液。HPLC测定盐酸小檗碱浓度,并用下式计算累积释放量。
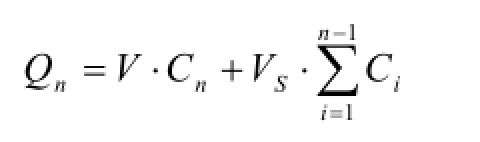
以累计释放百分比为纵坐标,以时间为横坐标,绘制释放曲线,比较β-谷甾醇和胆固醇制备的囊泡的体外释放情况。
2.6 温度对囊泡稳定性的影响
各取囊泡1 mL,分别置于4,20,30,40,50,60,70,80 ℃恒温水浴中,8 h后取出离心法测定包封率。
3.1 色谱行为
盐酸小檗碱囊泡与空白囊泡的液相图谱见图1。在此液相条件下,盐酸小檗碱出峰时间在8~9 min,分离度>2,理论板数>2 000。

图1 高效液相色谱图
A-空白囊泡(胆固醇为囊材);B-空白囊泡(β-谷甾醇为囊材);C-盐酸小檗碱囊泡(胆固醇为囊材);D-盐酸小檗碱囊泡(β-谷甾醇为囊材)。
Fig.1 The chromatograms of the niosomes
A-blank niosomes(cholesterol); B-blank niosomes(β-sitosterol); C-hydrochloride beberine niosomes(cholesterol); D-hydrochloride ebeerine niosomes(β-sitosterol).
3.2 标准曲线
计算得到盐酸小檗碱标准曲线方程为A= 37 026C+114 759(r=0.999 9,n=6),结果表明盐酸小檗碱浓度在1~12.5 µg·mL -1内与峰面积线性关系良好。
3.3 空白囊泡镜下观察结果
显微镜下可见,胆固醇囊泡粒径比β-谷甾醇囊泡大,而司盘20/β-谷甾醇为囊材制成的囊泡混悬液中比司盘20/胆固醇为囊材制成的囊泡混悬液中结晶要多。
司盘80/胆固醇为囊材制成的囊泡混悬液中有少量结晶,且显微镜下层叠现象比β-谷甾醇为囊材制成的囊泡多。
3.4 空白囊泡粒径分布情况
空白囊泡粒径分布统计结果显示,用司盘20制备的囊泡数目明显多于用司盘80制备的囊泡,用司盘20/胆固醇制备的囊泡与司盘20/β-谷甾醇制备的囊泡总数没有显著性差异,但是用司盘80/胆固醇制备的囊泡与司盘80/β-谷甾醇制备的囊泡总数有显著性差异,2种材料制备的囊泡粒径大小无显著性差异,结果见表1。
表1 空白囊泡粒径大小及分布(n=5)
Tab.1 Frequency size distribution of blank noisome(n=5)

3.5 囊泡的包封率与载药量
测得盐酸小檗碱囊泡包封率与载药量结果分别如下:胆固醇囊泡包封率为28.5%,载药量1.32%;β-谷甾醇囊泡包封率为25.21%,载药量1.26%。
3.6 囊泡的体外释放结果
2种盐酸小檗碱囊泡在人工肠液中的释药速度β-谷甾醇大于胆固醇,β-谷甾醇囊泡2 h时释放63.5%,12 h基本释放完全(101.1%),胆固醇囊泡2 h释放29.0%,12 h释放41.3%。在人工胃液中,β-谷甾醇囊泡释药速度同样大于胆固醇囊泡,β-谷甾醇囊泡2 h时能释放62.8%,12 h释放74.7%,胆固醇囊泡2 h释放40.7%,12 h释放53.5%。结果见图2。
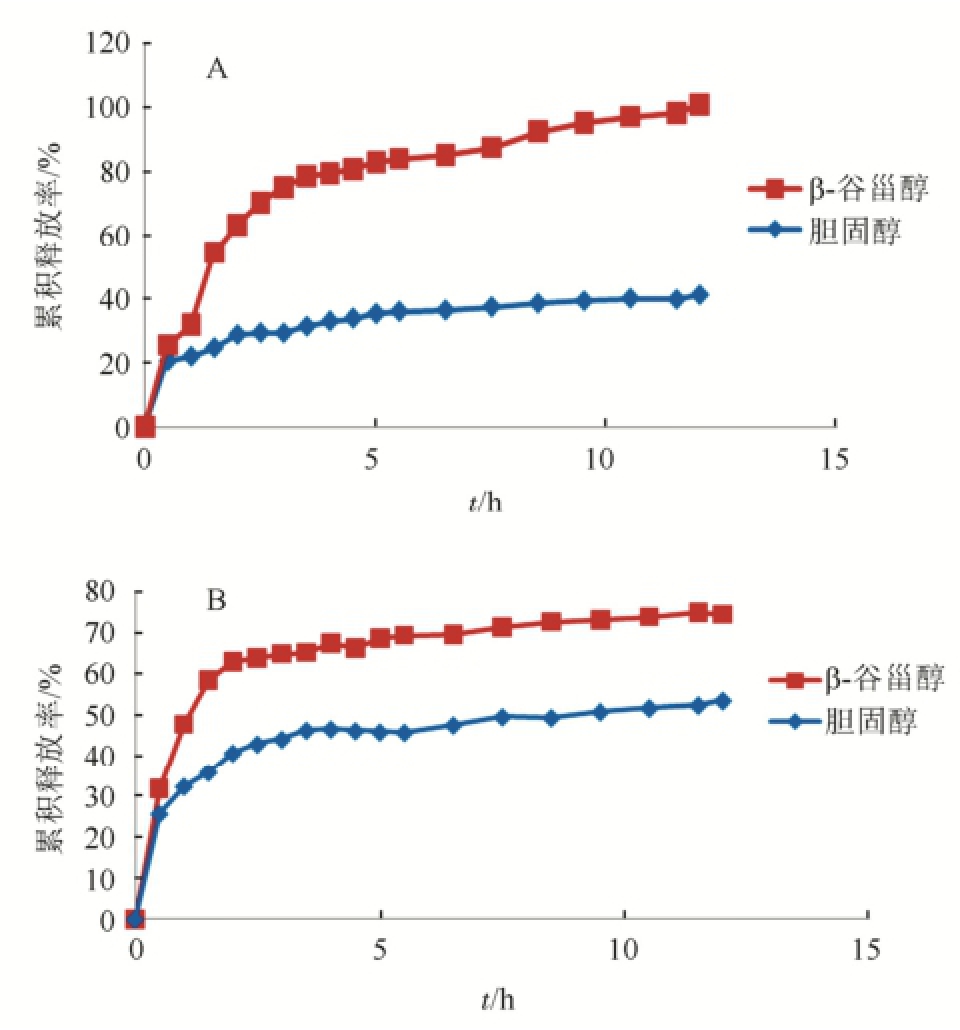
图2 盐酸小檗碱囊泡在人工肠液中的累积释放率
A-人工肠液;B-人工胃液。
Fig.2 The cumulative release percentage of two kinds of hydrochloride berberine niosomes in artificial intestinal juice and artificial gastric juice
A-artificial intestinal juice; B- artificial gastric juice.
3.7 温度对囊泡稳定性的影响
4~30 ℃之间,随温度升高,用胆固醇和β-谷甾醇制备的囊泡包封率基本没有变化;在温度进一步升高后,2种材料制备的囊泡的包封率均下降,但是两者之间包封率变化没有显著性差异。
表2 囊泡在不同温度放置8 h后的包封率(n=3)
Tab.2 The encapsulating rate of the niosomes after 8 h under varied temperature(n=3)

囊泡是以各种两亲分子(非离子表面活性剂)定向双分子层为基础的封闭双层结构,与脂质体相比,非离子表面活性剂囊泡的载体材料不含磷脂,避免了磷脂的氧化降解,生产和贮存皆不需特殊条件,可使工艺简单、成本降低。另外,非离子表面活性剂毒性较小,具有生物相容性和可降解性,不解离,不发生氧化水解,易大量生产 [8]。
植物甾醇结构与胆固醇类似,不仅可以影响脂质体膜上磷脂分子聚集,调节膜对小分子物质的透性,改变膜的表面性质,还可以减小胆固醇的肠道吸收 [9]。植物甾醇及其制品在拮抗胆固醇、预防心血管疾病等方面均表现出了良好的效果。因此,采用植物甾醇替代胆固醇制备盐酸小檗碱囊泡,一方面可以尝试将无法注射给药的药物制成,避免注射给药引起的药疹、过敏反应等症。另一方面,由于小檗碱在心血管疾病、糖脂代谢影响方面的广泛研究显示,小檗碱在降脂方面具有优异的治疗前景 [10]。因此,研究用植物甾醇替代胆固醇作为载体材料具有极大的使用价值。
本研究结果显示,β-谷甾醇为囊材制备盐酸小檗碱囊泡的粒径大小、包封率与载药量与胆固醇制备的载药囊泡无显著性差别。说明用植物甾醇代替胆固醇在制备工艺上可行。
囊泡属于流动性膜结构,在温度过高时,膜的流动性增加,甚至被破坏,从而导致包裹在囊泡内的药物释放出来。这一变化为不可逆变化,其结果表现为药物包封率下降 [11]。温度影响实验结果显示,2种盐酸小檗碱囊泡在<40 ℃放置8 h后,包封率基本没有变化。当温度>40 ℃后,包封率明显下降,在70~80 ℃时,包封率<10%。但温度影响稳定性研究结果显示,2种材料制备的盐酸小檗碱囊泡之间稳定性无显著性差别。
体外释放试验结果显示,在人工胃液和人工肠液中,2种材料制备的盐酸小檗碱囊泡体外释放均有显著性差异。文献报道,植物甾醇均可不同程度调节膜的流动性,植物甾醇增强囊泡膜流动性的效应大于胆固醇 [12-13],原因可能是亲水基团附近存在的水或者水溶性分子迁移入膜的非极性部位,随后渗透进入酰基构型异构体暂时形成的缝隙中,导致缝隙形成加快,膜的流动性大,药物释放快 [14]。因此,本研究中用β-谷甾醇制备的盐酸小檗碱囊泡释药速度和释药量快于胆固醇制备的囊泡。
本研究从制备工艺和体外释放方面均证实用β-谷甾醇替代胆固醇制备盐酸小檗碱囊泡具有可行性,其在生物体药物动力学特征的影响还有待于进一步研究。
REFERENCES
[1] LIN T, FANG Q, PENG D, et al. PEGylated non-ionic surfactant vesicles as drug delivery systems for Gambo-genic acid [J]. Drug Deliv, 2013, 20(7): 277-284.
[2] VLADIMIR P T, VOLKMAR W. Liposomes: A Practical Approach [M]. New York: Oxford University Press, 2003.
[3] KLINGBERG S, ANDERSSON H, MULLIGAN A, et al. Food sources of plant sterols in the EPIC Norfolk population [J]. Eur J Clin Nutr, 2007, 62(6): 695-703.
[4] YANG B B, CAO D, GENG Y N, et al. Differential membrane properties of liposomeb by plant sterols and cholesterol [J]. Sci Tech Food Ind (食品工业科技), 2013, 34(7): 7-82,85
[5] YU F, YANG J M. Feasibility of replacing cholesterol by β-sitosterol to prepare quercetin liposomes [J]. Chin Trad Herb Drugs(中草药), 2013, 44(23): 3303-3308.
[6] 王雪超. 盐酸小檗碱囊泡的制备及体内外研究[D]. 河北医科大学, 2009.
[7] ZHANG Y Y, ZHAO S Q, CHEN L, et al. Determination of entrapment efficiency of asiaticoside niosomes by equilibrium dialysis [J]. J Logis Univ PAP(Med Sci)(武警后勤学院学报医学版), 2015, 24(12): 951-954.
[8] JIANG S H, GEY R, WANG Z Y. Fundamental research of non-ionic surftant based vesicles [J]. Chin J Mod Drug App(中国现代药物应用), 2007, 1(11): 98-101.
[9] GU W T, ZHOU Y M, SHEN Y X, et al. Development of plant sterols and stanols on cholesterol metabolism [J]. Chin Feed(中国饲料), 2008, (1): 34-36.
[10] JIANG T, JIA Y H, LI Y S. Research progress on lipid-regulating mechanism of berberine [J]. Drugs Clinic(现代药物与临床), 2016, 31(5): 727-730.
[11] 陆彬. 脂质体、修饰脂质体与改良脂质体给药系统及其进展(上) [J]. 中国药师, 2005, 8(5): 374-377.
[12] VARSHOSAZ J, PARDAKHTY A, HAJHASHEMI V I, et al. Development and physical characterization of sorbitan monoester niosome for insulin oral delivery [J]. Drug Deliv, 2003, 10(4): 251-262.
[13] 扬贝贝. 甾醇对卵磷脂脂质体性质的影响[D]. 江南大学, 2013.
[14] ZHU H, CAO J S. Phytosterol as a liposom evehiele [J]. Chin J New Drugs(中国新药杂志), 2007, 16(9): 677-681.
Comparison of Two Kinds of Berberine Hydrochloride Niosomes Prepared by Different Matrix Materials
DIAO Jing 1,3, LIU Kun 2, LIU Yongqing 3, ZHANG Li 3(1.Second Affiliated Hospital, Tianjin Medical University, Tianjin 300211, China; 2.Dalian Branch of Liaoning Municipal Corps Hospital, Chinese People’s Armed Police Force, Dalian 116000, China; 3.Department of Pharmacognosy and Pharmaceutics, Logistics University of Chinese People’s Armed Police Force,Tianjin 300309, China)
ABSTRACT:OBJECTIVE To prepare the berberine hydrochloride-loaded niosomes with cholesterol or β-sitosterol separately, and compare their particle size, characteristics under the optical microscope, encapsulating rate, release profile in vitro and the stability of two kinds of niosomes. METHODS Thin-film evaporation method was applied to prepare the niosomes. Optical microscope was used to observe the morphology of the niosomes, and the particle diameter was observed and computed by Motic Images Advanced 3.2 system. HPLC was used to determine the encapsulating rate and loading capacity of the niosomes. The releasing profiles in vitro of the niosomes were observed and compared with each other, and the effect of temperature on the stability of the niosomes was invesgated. RESULTS The two kinds of niosomes both showed good sphericity, their particle diameter appenred to be similar. The encapsulating rate of cholesterol and β-sitosterol niosomes determined by HPLC was 28.5% and 25.21%, and the loading capacity of niosomes was 1.32% and 1.26%, respectively. The releasing study in vitro showed that the cholesterol niosomes reached an accumulative releasing rate about 50% at 12 h, while the accumulative releasing rate of β-sitosterol niosomes was higher than 70% in the artificial intestinal juice and in the artificial gastric juice. The encapsulating rate was not affected significantly by the temperature when the niosomes were storage under 8 h and the temperature was lower than 40 ℃. When the temperature was higher than 40 ℃, the encapsulating rate decreased significantly in both niosomes. CONCLUSION The two kinds of niosomes prepared by thin-film evaporation method have a similar appearance and a high encapsulating rate. The stability is good when the temperature is lower than 40 ℃. Compared with the cholesterol niosomes, the rate and the amount of drug release from β-sitosterol niosomes are better. The β-sitosterol can be used to prepare berberine hydrochloride niosomes.
KEY WORDS:berberine hydrochloride; β-sitosterol; cholesterol; niosomes; encapsulating rate; release profile in vitro; stability
中图分类号:R943
文献标志码:B
文章编号:1007-7693(2017)02-0253-05
DOI:10.13748/j.cnki.issn1007-7693.2017.02.021
收稿日期:2016-04-05
作者简介:刁晶,女,药师 Tel: (022)88329043 E-mail: 815449578@qq.com *
通信作者:张莉,女,硕士,教授 Tel: (022)84876772 E-mail: zhli62tianjin@163.com