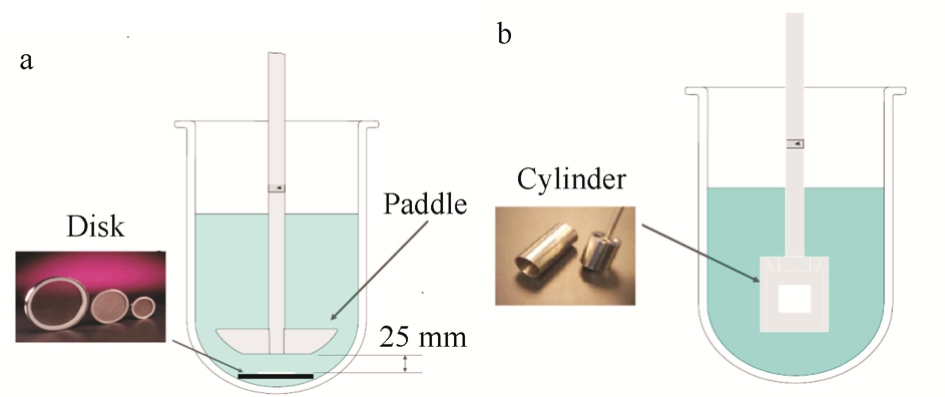
图1 妥洛特罗贴片的释放度测定装置
a-浆谍法装置;b-转筒法装置。
Fig. 1 Apparatus for the release rate test of tulobuterol transdermal patch
a-paddle over disk apparatus; b-rotating-cylinder apparatus.
熊玲,张亿,陈红*,梁恒兴,易伶璐,黄春燕
(成都市食品药品检验研究院,成都 610045)
摘要:目的 建立妥洛特罗透皮贴剂的释放度测定方法,并对不同装置测定的释放曲线进行比较。方法 采用中国药典2015年版收载的 2种透皮贴剂释放度测定新方法,即桨碟法和转筒法,规定时间点取样后采用 HPLC测定,色谱柱为Agilent C18(250 mm×4.6 mm,5 μm),流动相为乙腈-0.02 mol·L-1磷酸盐缓冲液(pH 3.0)(32∶68),流速为 1.0 mL·min-1,柱温为35 ℃,检测波长为215 nm。分别考察妥洛特罗透皮贴剂在500 mL水中24 h的释放曲线,并对2种方法的释放曲线进行拟合,比较二者的相似性。结果 妥洛特罗在 0.103~4.135 μg·mL-1内线性关系良好(r=0.999 9),回收率为99.8%(n=9),样品溶液在24 h内稳定。将2种方法测定的释放度结果经Weibull方程拟合后得到的参数进行方差分析,2组数据间无显著性差异。结论 中国药典2015年版透皮贴剂释放度测定桨碟法(方法2)和转筒法均可用于妥洛特罗透皮贴剂的释放度测定,两者的测定结果不存在差异。
关键词:妥洛特罗;透皮贴剂;桨碟法;转筒法;释放度;释放曲线
妥洛特罗为高选择性β2受体激动药,在临床上用于缓解支气管哮喘、急性支气管炎、慢性支气管炎、肺气肿等气道阻塞性疾病所致的呼吸道困难等症状。哮喘的发作存在昼夜节律性变化,哮喘的加重多发生于清晨 4点左右,这种现象称为“晨降”。妥洛特罗贴片为经皮吸收制剂,采用将结晶型和分子型的药物共同储备于贴片的黏胶层中,药物经晶体分解系统缓慢释放并透过皮肤进入全身血液循环,并可维持稳定的血药浓度达22 h以上。睡前贴用一剂妥洛特罗贴片,8~12 h后血药浓度达峰值,能够有效缓解因“晨降”引起的哮喘急性发作,且可用于吞咽比较困难的儿童[1]。
体外释放度检查是透皮贴剂质量控制的关键项目之一,在药物的研发阶段也具有非常高的使用价值,可用于考察处方、工艺、生产规模、生产场地等变更对药品质量的影响。中国药典 2000年版中首次收录了透皮贴剂的释放度检查方法,但仅有桨碟法一种检查装置,且该装置的碟片尺寸与美国药典、英国药典桨碟法收载的装置均有较大差异,导致在其使用时受到了一定的限制[2]。中国药典 2015年版借鉴并采用国际先进检测技术,完善了检测方法,其中释放度检查方法增加了桨碟法(小碟)及转筒法,且在装置构造上实现与美国药典等国际药典的统一[3-4]。
Agilent 1260高效液相色谱仪(美国Agilent);AEG-220天平(梅特勒);Agilent 708溶出仪配备850DS自动取样系统(美国Agilent)。
妥洛特罗贴剂(日本制造,批号:17C04,规格:1 mg);戊烷磺酸钠(山东禹王实业有限公司化工分公司,批号:2014091401);乙腈(Fisher Chemical,批号:L-25962);磷酸二氢钠二水合物(广东光华科技股份有限公司,批号:20160306);对羟基苯甲酸甲酯对照品(中国食品药品检验研究院,批号:100278-201103,纯度:100%);盐酸妥洛特罗对照品(中国食品药品检验研究院,批号:100472-200401,纯度:100%)。
2.1.1 桨碟法 采用中国药典2015年版四部0931溶出度与释放度测定法第四法(方法2装置)进行释放度试验。取本品,用硅黏合剂将本品的背衬层黏贴固定在网碟上,去除衬垫,释放面向上放置于仪器中,转速为50 r·min-1、溶出介质为500 mL水,温度(32±0.5)℃,分别在1,2,3,5,8,10,12,14,18,24 h取溶液5 mL,并及时补足同温度的水。精密量取释放液2 mL,精密加入内标溶液2 mL,摇匀,作为供试品溶液。测定装置见图1。
2.1.2 转筒法 采用中国药典2015年版四部0931溶出度与释放度测定法第五法进行释放度试验。取本品,去除衬垫,将有黏性的一面贴于一片Cuprophan膜[(11±0.5)μm,惰性多孔纤维素膜]上,剪裁使膜的边沿比贴剂宽约 1.5 cm。将硅黏合剂涂布于贴剂的背衬层及膜边沿,黏贴固定在转筒外部,使贴剂的长轴通过转筒的圆心,安装于仪器中,转速为50 r·min-1、溶出介质为500 mL水,温度(32±0.5)℃,分别在 1,2,3,5,8,10,12,14,18,24 h取溶液5 mL,并及时补充同温度的水。精密量取释放液 2 mL,精密加入内标溶液2 mL,摇匀,作为供试品溶液。测定装置见图1。

图1 妥洛特罗贴片的释放度测定装置
a-浆谍法装置;b-转筒法装置。
Fig. 1 Apparatus for the release rate test of tulobuterol transdermal patch
a-paddle over disk apparatus; b-rotating-cylinder apparatus.
色谱柱:Agilent C18(250 mm×4.6 mm,5μm);流动相:乙腈-0.02 mol·L-1磷酸盐缓冲液(pH 3.0)(32∶68);流速:1 mL·min-1;进样量:20 μL;柱温:35 ℃;检测波长:215 nm。
取对羟基苯甲酸甲酯适量,用流动相溶解并稀释制成每1 mL中含2 μg的溶液,摇匀,作为内标溶液。精密称取妥洛特罗对照品约 10 mg,置1 000 mL量瓶中,加水溶解并稀释至刻度,摇匀,精密量取5 mL,置10 mL量瓶中,加水稀释至刻度,摇匀,精密量取 2 mL,精密加入内标溶液2 mL,摇匀,作为对照品溶液。
精密称取妥洛特罗对照品约10 mg,置500mL量瓶中,加水溶解并稀释得到浓度分别为4.0,2.0,1.0,0.4,0.2,0.1 μg·mL-1的对照品溶液,按“2.2”项下色谱条件进行检测,考察其线性范围为 Y=1.935X-0.022,r=0.999 9。妥洛特罗的线性范围为0.103~4.135 μg·mL-1。
取“3.1”项下浓度为 0.4 μg·mL-1对照品溶液,连续测定6次,结果RSD为0.08%。
准确量取供试品溶液适量,分别加入相当于妥洛特罗已知量的50%,80%,100% 的对照品溶液依法进行测定,妥洛特罗的平均回收率为99.8%(n=9)。
取样品溶液,分别在0,4,8,12,18,24 h依法测定,结果样品溶液在24 h内稳定。
3.5.1 测定结果 分别采用“2.1”项下的2种装置对供试品进行释放度试验,测定不同时间点的释放度,计算累积释放率,测定结果见表1~2,根据平均值绘制释放曲线,见图2。
3.5.2 曲线拟合 采用DDsolver软件对2种装置测得的释放度数据分别进行拟合,选择零级模型,一级模型,指数模型,Weibull模型,Highchi方程,Korsmeyer-Peppas模型,Peppas-Sahlin模型,其中零级模型,一级模型,指数模型的拟合效果均不佳,后4种模型的拟合效果较好(R2>0.99),拟合曲线见图2。
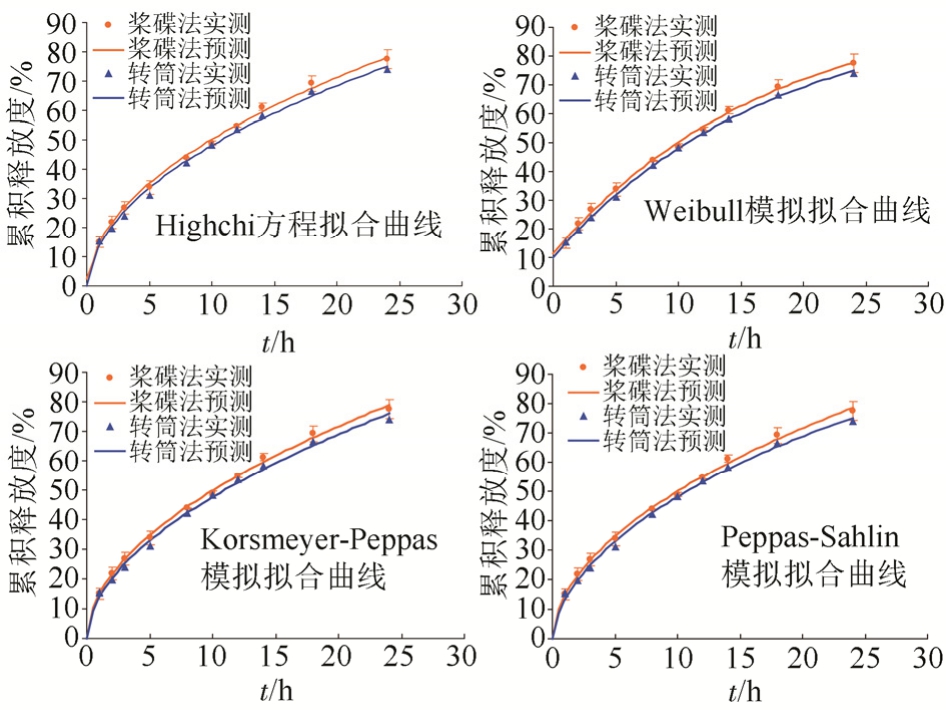
图2 两种装置测定的妥洛特罗贴片的释放曲线
Fig. 2 Comparison on release curve of two different apparatus
表1 采用桨碟法装置的释放度试验测定结果
Tab. 1 The result of release test using paddle over disk apparatus
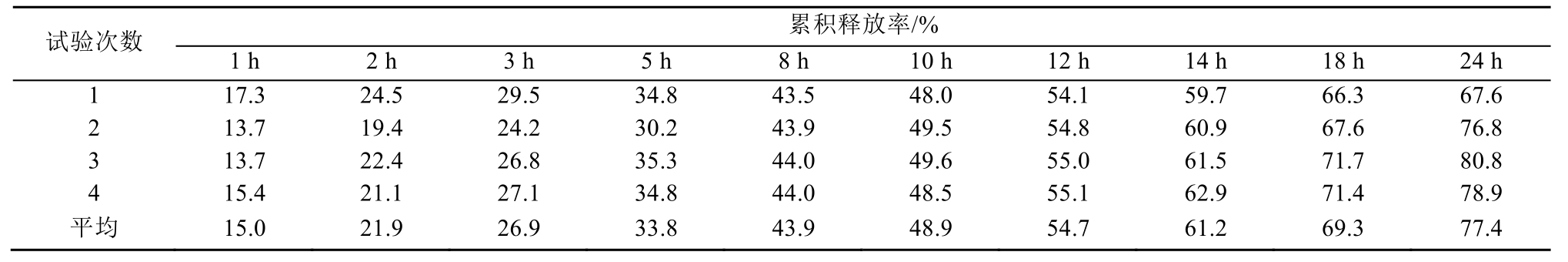
表2 采用转筒法装置的释放度试验测定结果
Tab. 2 The result of release test using rotating cylinder apparatus
3.5.3 溶出曲线的比较 最终选择“3.5.2”项下拟合优度最高的模型,即三参数 Weibull方程f(t)=1-e-(t-α)m/β进行释放曲线拟和,结果见表 3。其中α为位置参数,表示药物溶出延滞的时间;m为形状参数,决定曲线的形状;β为尺度参数,与制剂的释放机制有关;Td为药物累积溶出 63.2%的时间。根据桨碟法或转筒法分组后进行t检验,查t界值表,t(0.05,6)=2.447,2种装置的释放度试验测定结果之间无显著性差异。
对于一般的透皮给药系统,皮肤是药物透皮吸收的限速屏障,常通过 Franz扩散池[5-6],Valia.Chien水平扩散池[7]等方法评价其经皮透过性能。而在缓控释透皮给药系统中,药物的吸收是以其从制剂中的释放为限速步骤的,药物的释放速率会决定其起效和持续作用的时间,因此体外释放度是评价贴剂的重要指标。常用的透皮贴剂释放度测定方法有桨碟法,转筒法和往复支架法。3种方法的实验装置各有不同,释放液的温度与口服缓控释系统不同,为(32±0.5)℃。桨碟法直接使用桨法的装置,操作比较简单,但不同药典中网碟的尺寸和结构存在一定差异。中国药典2005年版,2010年版收载的浆碟法采用双层网碟,将贴片除去背衬夹于其中,碟片的直径为92 mm,尺寸比美国药典、欧洲药典(直径41.2 mm)大,迫使桨杆位置提高,桨叶远离溶出杯底,导致改变了溶出介质流体学性质。中国药典2015年版桨碟法新增了一种方法(方法2),采用直径为41.2 mm的网碟,与国际药典实现了统一,故本实验采用该法进行释放度研究。转筒法早在USP22版(1992年)中即被收载,陈华等[8]比较了丁丙诺啡透皮贴剂在释放度测定中桨碟法和转筒法的差异,结果发现桨碟法中溶剂的死体积较多,不能替代美国药典转筒法[9]。为与国际药典接轨,中国药典2015年版新增了该方法,其装置与转篮法相似,只是用不锈钢转筒代替转篮,转筒设计为可拆分的上下两截,根据贴剂的尺寸大小选择单用上截或合用两截。往复支架法作为USP 透皮贴剂释放度的方法之一,其优点是可以在规定的时间点自动转换到新的溶剂杯中,所有样品集中测定,节省时间,另外,使用往复支架法时待测样品和释放液接触充分,能够更科学地评价样品的释放特性[10]。
表3 释放度拟合参数汇总表
Tab. 3 Summary of the fitting parameter of release test

本实验采用的中国药典2015年版新增的2种透皮贴剂释放度测定方法,即桨碟法(方法2)和转筒法考察妥洛特罗贴片的体外释放度检查,其体外释放曲线无明显差异。考虑到转筒法在固定样品时需在贴剂上覆盖一层惰性多孔纤维素膜,并涂布专用胶水,操作较为复杂,且装置的普及性不高,故针对尺寸较小的贴剂的释放度检查,建议优先选用操作较为简单的网碟法。
DDsolver软件包含了40种拟合模型[11],本实验中选择了与缓控释制剂的释放度相关的模型,结果表明妥洛特罗贴片的释放符合Weibull模型、Higuchi方程和Peppas模型,原因可能与其释放机制有关,该贴剂为储库型的透皮给药系统,符合Fick’s 第一定律,即每单位面积的释药量与时间的平方根成正比[12]。
药物的溶出度和释放度是药品内在质量的灵魂,溶出度和释放度对制剂评价的重要意义不仅在于常规的质量控制,基于 BCS(biopharmaceutical classification system)理论的发展,而成为部分申请上市药物或者已上市药物变更申请提供生物等效豁免的依据[11]。未来溶出度测定仪的研制方面将更加注重自动化与生理模拟方面的结合,通过体外溶出度试验较好地模拟体内溶出过程,建立更加符合生理特征的体外溶出度与释放度模型,并建立起体内外相关性(IVIVC),充分发挥溶出度对药物有效性评价的作用[12-13]。
[1] DELGADO-CHARRO M B, GUY R H. Effective use of transdermal drug delivery in children [J]. Adv Drug Deliv Rev,2014(73): 63-82.
[2] QUE H Q, CHEN M L, QIAN L P, et al. Research advance on dissolution rate of emplastrum [J]. Drug Eval Res(药物评价研究), 2011, 34(5): 388-391.
[3] HONG X X, XU H Y, SHANG Y, et al. Brief introduction on Chinese Pharmacopoeia 2015 Volume Ⅳ [J]. Drug Standards China(中国药品标准), 2015, 16(5): 326-331.
[4] STIPPLER E. USP Compendial Dissolution/Drug Release testing-Overview and Updates [R] NIFDC-AAPS Joint Workshop on Dissolution Testing, Biowaver and Bioequivalence Tianjin China c2016 : 19-29
[5] YANG X L, YANG B, LI C L, et al. Preparation and in vitro transdermal diffusion characteristics of Paclitaxel Nano-liposomes gels [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(2): 156-161.
[6] CHEN D, NIE H Y, ZHANG W X, et al. Comparison of physicochemical property and transdermal absorption of ibuprofen cream and gel [J]. Chin J New Durgs(中国新药杂志), 2016, 25(4): 472-476.
[7] XU H Y, CHEN S Z, XU L J, et al. Preparation and in vitro permeation of Edaravone Gel [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(6): 752-755.
[8] CHEN H, MAO R, LI Y Q, et al. Difference between methods of cylinder and paddle over disk used in the release test of buprenorphine transdermal patches [J]. Chin J Pharm Anal(药物分析杂志), 2011, 31(4): 792-795.
[9] CHENG X, ZHAO Y Y, SHAO A L, et al. Study on experimental method and application of characterization and silver release assessment of silver containing dressings [J].Chin J Pharm Anal(药物分析杂志)2015, 35(3): 491-499.
[10] ZHANG Y, HUO M R, ZHOU J P, et al. DDSolver: An add-in program for modeling and comparison of drug dissolution profiles [J]. AAPS J, 2010, 12(3): 263-271.
[11] Waiver of in vivo bioavailability and bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutics classification system guidance for industry [EB/OL]. Science, May 2015, https: //www.fda.gov/downloads/Drugs/. . . /Guidances/ucm070246. Pdf.
[12] SANKI U K, MANDAL B K. In vitro-in vivo correlation evaluation of generic alfuzosin modified release tablets. [J].ISRN Toxicol, 2012: 813836. Doi: 10.5402/2012/813836.
[13] KRAMER J. Predictive dissolution testing for the development of new drugs [R]. NIFDC-AAPS Joint Workshop on Dissolution Testing, Biowaver and Bioequivalence Tianjin China, 2016: 49-55.
Determination of the Release Rate of Tulobuterol Transdermal Patch and Results Comparison of Different Methods
XIONG Ling, ZHANG Yi, CHEN Hong*, LIANG Hengxing, YI Linglu, HUANG Chunyan(Chengdu Institute for Food and Drug Control, Chengdu 610045, China)
ABSTRACT:OBJECTIVE To establish a method for determining the release rate of tulobuterol patch, evaluate the consistence of the release curve between different test methods. METHODS Two kinds of new transdermal release test methods in China Pharmacopoeia 2015 Edition (paddle over disk method and rotating-cylinder method) were used, the concentration of each sampling point was determined by HPLC. Agilent C18(250 mm×4.6 mm, 5 μm) column was used with the mobile phase of a mixture of acetonitrile and 0.02 mL·min-1phosphate buffer (pH3.0) (32∶68), the flow rate was 1 mL·min-1,the column temperature was 35 , ℃and the detection wavelength was 215 nm. Transdermal release behavior of tulobuterol patch in 500 mL water were investigated in 24 h, and similarity of the release curves was compared. RESULTS The linear correlation of tulobuterol was observed in the range of 0.103-4.135 μg·mL-1(r=0.999 9), with a recovery rate of 99.8%(n=9), and the sample solution was stable in 24 h. The results of the two methods were analyzed by Weibull equation, and there was no significant difference between the two methods. CONCLUSION Paddle over disk method (method 2) and rotating-cylinder method in China Pharmacopoeia 2015 Edition can both be used to determine the release of tulobuterol transdermal patch, and the results of these two methods are identical.
KEY WORDS:tulobuterol; transdermal patch; paddle over disk; rotating cylinde; release rate; release curve
REFERENCES
中图分类号:R941
文献标志码:B
文章编号:1007-7693(2017)12-1654-04
DOI:10.13748/j.cnki.issn1007-7693.2017.12.002
引用本文:熊玲,张亿,陈红,等. 妥洛特罗透皮贴剂的释放度测定及不同测定方法结果比较[J]. 中国现代应用药学, 2017,34(12): 1654-1657.
基金项目:“重大新药创制”国家科技重大专项(2017ZX09101001)
作者简介:熊玲,女,硕士,主管药师 Tel: (028)85362213 E-mail: gimy1983@yeah.net*
通信作者:陈红,女,硕士,主任药师Tel: (028)85362213 E-mail: 184217019@qq.com
收稿日期:2017-07-11
(本文责编:曹粤锋)