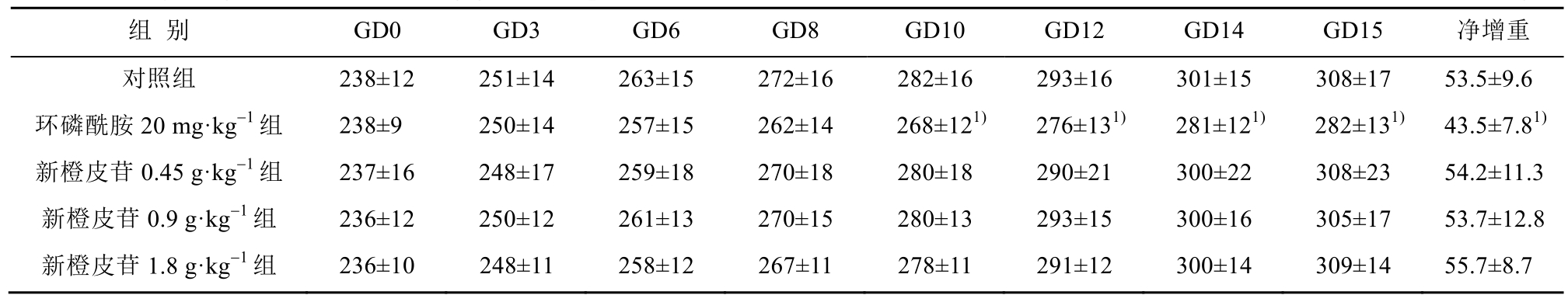
表1 雌鼠妊娠期体质量
Tab. 1 bodyweight of female during gestation period
注:与对照组比较,1)P<0.05。
Note: Compared with control group,1)P<0.05.
林春琴1,2,钱仁云1,2,沈晓飞1,2,袁晨星1,2,王丹丹1,2,丁玲1
(1.浙江大学药学院,杭州 310058;2浙江大学药物安全评价研究中心,杭州 310058)
摘要:目的 评价新橙皮苷对大鼠生育力及早期胚胎发育的毒性。方法 200只大鼠(♀♂各半)根据性别和体质量采用分层随机法分成对照(0.5%羧甲基纤维素钠)组、环磷酰胺(20 mg·kg-1)组、新橙皮苷低、中、高(0.45,0.9和1.8 mg·kg-1)组。雄鼠于交配前4周开始给药至交配期结束。雌鼠于交配前2周开始给药至妊娠第6天。实验期间每周测定动物体质量。交配结束后,雄性动物对附睾尾精子进行精子检查;妊娠第15天,对雌性动物子宫内容物包括黄体、着床腺、活胎、死胎及吸收胎、胎盘等进行检查。结果 给药期间,各组别动物一般观察均未见明显异常。与对照组相比,各给药组雄鼠交配前体质量、脏器重量、精子计数及精子活力数值未见显著性差异(P>0.05);对照组和新橙皮苷3个剂量组精子总畸形率均在2%以内。新橙皮苷各给药组雌鼠体质量、脏器重量、黄体数、着床腺、活胎数、吸收胎数、死胎数与对照组相比均无显著性差异(P>0.05)。病理组织学检查结果显示,雄鼠睾丸、附睾、前列腺和精囊腺未见给药相关改变,对照组和新橙皮苷组雌鼠子宫和阴道可见明显孕后变化。结论 新橙皮苷对大鼠生育力及早期胚胎发育未见明显毒性。
关键词:新橙皮苷;生殖毒性;生育力;早期胚胎发育
新橙皮苷是一种主要存在于芸香科以及茜草科植物中的天然黄酮类化合物。在各类研究中发现,新橙皮苷具有抑制骨质疏松[1]、降低血糖血脂及改善糖耐量[2-4]、抗氧化[5]、保护心血管[6-7]、促进胃消化、抗菌、抗过敏和抗肿瘤等药理活性,具有广泛的成药基础。确定新橙皮苷降糖降脂有效剂量后,在大鼠最大给药量试验、胚胎-胎仔发育毒性预试验以及大鼠 1个月毒性试验等系列毒性试验基础上进行本实验,目的是研究新橙皮苷对动物生殖的毒性或干扰,从而希望能够为新橙皮苷进一步的临床研究以及安全性评价提供实验依据和理论基础。
Pb1501-L/AL104/XS205型电子分析天平(瑞士METTLER TOLEDO);病理组织制片、阅片系列仪器(德国 Leica);Option S7纯水仪(英国ELGA);TOX IVOS精子分析仪(美国 MILTON THORNE)。
新橙皮苷(南京泽朗医药科技有限公司,含量98.47%,批号:ZL20130315YY);注射用环磷酰胺(江苏恒瑞制药有限公司,批号:13041125);羧甲基纤维素钠(CMC-Na,国药集团化学试剂有限公司,批号:F20110211);0.9%氯化钠注射液(四川科伦药业有限公司);水为超纯水。
SPF级SD大鼠,200只,9~10周龄,♀♂各半,由上海西普尔-必凯实验动物限公司[许可证号SCXK(沪)2008-0016]提供,动物合格证编号为2008001633462(♂)和 2008001634026(♀)。实验期间,饲养室温度为20~26 ℃,湿度为40%~70%,每小时最小换气15次,自动光照,12 h明暗交替(8: 00~20: 00)。饲料为经钴 60 辐照灭菌的 SPF 大小鼠生长繁殖饲料,由北京科澳协力饲料有限公司提供;原木垫料由北京科澳协力饲料有限公司提供,经高温高压消毒灭菌后使用;动物饮用水为城市居民饮用水,由杭州祥符水厂提供,经高温高压消毒灭菌后使用。
动物入室饲养7 d,根据性别和体质量采用分层随机法分为对照组、新橙皮苷 1.8,0.9,0.45 g·kg-1组和环磷酰胺 20 mg·kg-1组(阳性对照),每组每性别20只。对照组每天灌胃给予0.5%的羧甲基纤维素钠溶液,容量为10 mL·kg-1;新橙皮苷给药组每天灌胃给药,容量为10 mL·kg-1;环磷酰胺[8]每周皮下注射1次,容量为2 mL·kg-1,妊娠雌鼠于妊娠第3天与妊娠第6天给药。雄鼠于交配前 4周开始给药至交配期结束;雌鼠于交配前2周开始给药至妊娠第6天。
雄鼠与雌鼠1∶1合笼交配。交配期每天对雌鼠进行阴道涂片检查,发现精子或阴栓的当天记为妊娠第0天(gestation day 0,GD0)。
每天记录动物活动等行为状态和死亡情况。雄鼠每周称重2次至处死。雌鼠交配前每周称重2次,妊娠期于GD0、GD3、GD6、GD8、GD10、GD12、GD14、GD15称重。除交配期外,动物称重当天同步进行摄食量测定。
雄鼠于 2周交配期结束后处死,进行大体解剖观察,对睾丸、附睾、前列腺和精囊腺称重(成对器官分开称重)并固定用于组织病理学检查。分离一侧附睾尾,剔除附着的脂肪组织,用手术刀片沿附睾尾纵向做4~5个深切口,置于3 mL M199培养液中制得精子悬液,37 ℃恒温培养备用。取精子悬液采用TOX IVOS精子分析仪进行精子计数及活力分析。另取精子悬液 1~2滴涂片固定后进行HE染色,在高倍镜下观察精子形态,每只动物计数200个精子,计算畸形精子的百分率。
雌鼠于GD15处死,进行大体解剖观察,固定子宫和阴道以及未妊娠动物的卵巢用于组织学检查。妊娠动物计数卵巢中的黄体数。从左侧子宫角上方至子宫颈,右侧子宫角上方至子宫颈,按顺序剖开子宫,取出胎鼠,对子宫内着床腺、活胎、吸收胎、死胎进行计数。分离胎仔与胎盘进行称重,并对外观进行观察。
交配率、生育率、受孕率、妊娠率、着床前丢失率、着床后丢失率等百分率用 χ2检验,体质量等计量资料作方差齐性检验,若方差齐(P>0.05),则做单因素方差分析,后检验方法为Dunnet-t;若方差不齐(p<0.05),则进行非参数检验(Kruskal-Wsllis H检验),若有统计学差异(p<0.05),则各剂量组与对照组间做Mann-Whitney U检验。
试验期间,各组动物被毛光滑,反应机敏,呼吸平稳,一般行为正常,活动状态未见明显异常,无动物死亡。
实验期间,各组动物体质量保持增长。与对照组相比,各给药组雄鼠体质量与交配前雌鼠体质量均未见统计学差异。妊娠期新橙皮苷给药组雌鼠体质量与对照组相当,环磷酰胺 20 mg·kg-1组雌鼠妊娠期GD10、GD12、GD14和GD15的体质量以及孕期净增重均明显下降(p<0.05),见表1。
实验期间,与对照组相比,各组别动物摄食量未见明显改变(P>0.05)。
表1 雌鼠妊娠期体质量
Tab. 1 bodyweight of female during gestation period

注:与对照组比较,1)P<0.05。
Note: Compared with control group,1)P<0.05.
动物安乐处死后,对心、肝、脾、肺、肾、卵巢、子宫、睾丸和附睾等主要实质脏器进行大体解剖观察,各组别动物均未见明显病理改变。与对照组相比,各组动物的睾丸、附睾、前列腺和精囊腺的重量未见显著性差异(P>0.05)。
对照组、环磷酰胺组以及新橙皮苷1.8 g·kg-1组的雄鼠睾丸、附睾、前列腺和精囊腺进行组织病理学检查,除大鼠常见自发病变睾丸萎缩与前列腺炎细胞浸润外,各组动物未见药物相关改变。
对对照组、环磷酰胺组以及新橙皮苷1.8 g·kg-1组的雌鼠子宫和阴道进行组织病理学检查,结果显示,对照组和新橙皮苷1.8 g·kg-1组所有妊娠雌鼠子宫和阴道可见明显孕后变化;环磷酰胺 20 mg·kg-1组除未妊娠以外的所有孕鼠子宫内见坏死组织、炎性细胞和明显的滋养层,阴道黏液层、颗粒层和胚芽层结构正常,未见角化层。所有未妊娠雌鼠子宫、阴道及卵巢的病理组织学检查均未见明显病理改变,见图1。
雄鼠交配期结束,取附睾尾进行精子计数及活力分析,与对照组比,新橙皮苷各给药组和环磷酰胺 20 mg·kg-1组精子分析的各项指标并无显著性差异(P>0.05)。
雄鼠精子涂片的观察结果显示:对照组主要畸形有无钩、钩弯曲过度、无定形头、针尖形头、卷尾、弯曲尾、尾尖弯曲及钝钩;新橙皮苷各给药组畸形情况主要为无钩、无定形头、针尖形头、卷尾、弯曲尾及钝钩,其中新橙皮苷1.8 g·kg-1组还存在钩弯曲过度和尾尖弯曲,新橙皮苷0.9 g·kg-1组亦存在钩弯曲过度;环磷酰胺20 mg·kg-1组主要畸形有钩弯曲过度、无定形头、针尖形头、卷尾、弯曲尾、尾尖弯曲及钝钩。
与对照组比较,环磷酰胺20 mg·kg-1组头部畸形率、其他畸形率和总畸形率都显著性升高(p<0.05);新橙皮苷 1.8 g·kg-1组、新橙皮苷 0.9 g·kg-1组和新橙皮苷0.45 g·kg-1组的头部畸形率、尾部畸形率、其他畸形率和总畸形率,与对照组比较均无显著性差异(P>0.05)。环磷酰胺 20 mg·kg-1组的总畸形率为2.4%,大于精子正常畸形率上限2%。
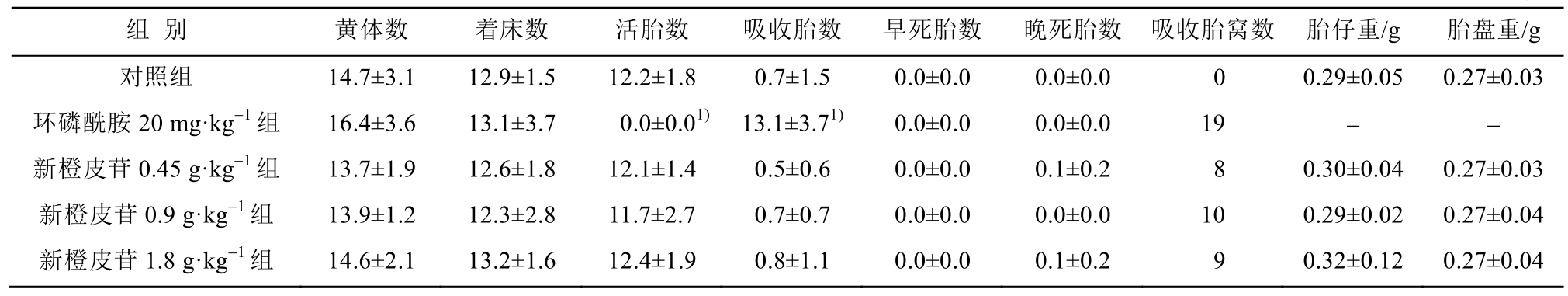
与对照组比较,新橙皮苷各给药组黄体数、着床数、活胎数、吸收胎数、早死胎数、晚死胎数、胎仔重、胎盘重等无显著性差异(P>0.05)。与对照组比较,环磷酰胺 20 mg·kg-1组所有孕鼠均为吸收胎,无活胎、吸收胎数显著性升高(p<0.05),黄体数、着床数、早期死胎数及晚期死胎数均无显著性差异(P>0.05)。结果见表2。
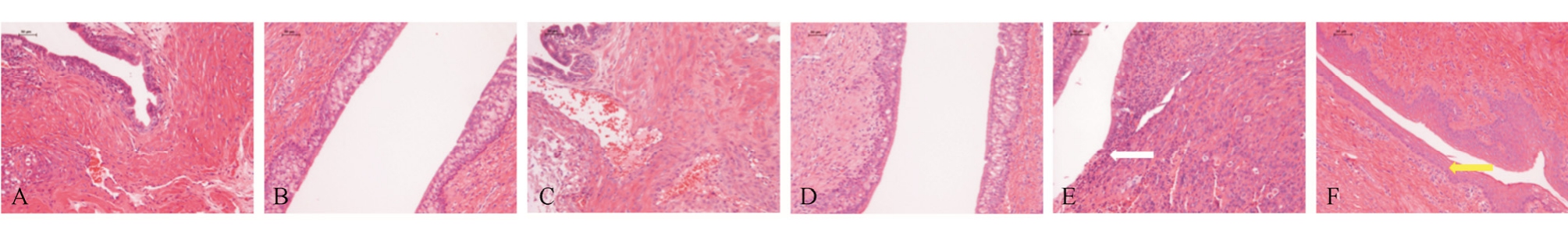
图1 子宫和阴道的组织病理学检查结果
A-对照组子宫,未见明显异常;B-对照组阴道,未见明显异常;C-新橙皮苷1.8 g·kg-1组子宫,未见明显异常;D-新橙皮苷1.8 g·kg-1组阴道,未见明显异常;E-环磷酰胺20 mg·kg-1组子宫,可见坏死组织、炎性细胞(箭头所示);F-环磷酰胺20 mg·kg-1组阴道,黏液层未见增厚(箭头所示)。
Fig. 1 Histopathology examination of uterus and vagina
A-uterus in control group, normal; B-vagina in control group, normal; C-uterus in neohesperidin 1.8 mg·kg-1group, normal; D-vagina in neohesperidin 1.8 mg·kg-1group, normal; E-uterus in cyclophosphamide 20 mg·kg-1group, necrotic tissue and inflammatory cells were noted (as arrow showed);F-Vagina in cyclophosphamide 20 mg·kg-1group, no corneum was noted (as arrow showed).
表2 子宫内容物检查
Tab. 2 Examination of uterine contents
注:与对照组比较,1)P<0.05。
Note: Compared with control group,1)P<0.05.
与对照组相比较,新橙皮苷各给药组雌鼠的交配率、受孕率等无统计学差异(P>0.05)。环磷酰胺 20 mg·kg-1组吸收胎窝数率和着床前丢失率与对照组相比均有显著性差异(p<0.05),而交配率无显著性差异(P>0.05)。各给药组雄鼠交配率及生育率与对照组比较均无显著性差异(P>0.05)。
环磷酰胺以 20 mg·kg-1剂量于雄鼠交配前四周给药直至交配期结束对雄鼠临床症状、体质量、摄食、精子活力及浓度无明显毒性,但对精子形态有一定的毒性影响。环磷酰胺 20 mg·kg-1组雌鼠试验期间,妊娠中期(GD10~GD15)各日体质量及净增重显著降低,该变化与环磷酰胺20 mg·kg-1组所有孕鼠均为吸收胎无活胎相关。而环磷酰胺组雌鼠的黄体数和着床数与对照组相比未见显著性差异,由此可见,环磷酰胺以 20 mg·kg-1剂量于雌鼠交配前2周给药直至GD15对雌鼠着床前阶段黄体生成、着床过程影响较小,但对于着床后胚胎发育过程有显著的不良反应,而该不良反应是否与精子形态畸形相关,有待进一步研究。作为阳性对照,环磷酰胺组观察到明显的生殖毒性,确保本试验系统的可靠性。
新橙皮苷以0.45,0.9,1.8 g·kg-13个剂量于雄鼠交配前 4周给药至交配期结束,雌鼠由交配前2周给药至GD6,对SD大鼠交配行为、生育力、胚胎着床及早期胚胎发育无明显毒性。新橙皮苷对高脂饮食诱导肥胖模型小鼠的降糖和降脂作用试验有效剂量为100 mg·kg-1,折算成大鼠剂量约为50 mg·kg-1,本试验设置的高、中、低剂量分别为 1.8,0.90,0.45 g·kg-1,约为有效剂量 36倍、18倍和9倍。而最大给药量试验和1个月大鼠重复给药毒性试验中,SD大鼠分别灌胃给予5 g·kg-1和 1.8 g·kg-1剂量新橙皮苷后,未见明显不良反应。结合现有研究结果,新橙皮苷药理活性多样,起效剂量低,安全窗广,具有广泛的成药基础,可进行进一步的成药研究。
大鼠精子发生整个过程约 9~10周[9-10],根据《药物生殖毒性研究技术指导原则》[11],本次交配前仅给药 4周,下次实验可进一步延长交配前雄鼠给药周期,以全面发现新橙皮苷对精子形成的干扰与毒性,明确新橙皮苷对生育力的作用性质。
[1] TAN Z. Effects of neohesperidin on RANKL-induced osteoclast differentiation and osteoporosis in ovariectomizied mice [D]. Guangxi Medical University, 2015.
[2] YAN Y Y. Effects and mechanisms of neohesperidin on glucose and lipid metabolismin vitroandin vivo[D]. Zhejiang University, 2014.
[3] 吴昊姝, 杨波, 何俏军. 新橙皮苷在制备防治糖尿病药物中的应用: 中国: 201210199606 [P]. 2012.
[4] ZENG L J, CHEN D, ZHENG L, et al. Studies on pharmacokinetics features of characteristic active ingredients of Daidai flavones extract in different physiological status [J].China J Chin Mater Med(中 国 中 药 杂 志), 2014, 39(2):309-315.
[5] LI Y, ZHOU Z Q, XI W P, et al. Composition and antioxidant activities of different polar fractions of enhanol extraction from the pell of citrus reticulate ‘Ponkan’ [J]. South China Fruits (中国南方果树), 2014, 43(6): 5-8.
[6] WANG C, ZHANG Y F, ZHAO X P. Study on screening cardioprotective components from Zhishi Xiabai Guizhi Tang[J]. China J Chin Mater Med(中国中药杂志), 2013, 38(10):1601-1605.
[7] LIAO Z B, ZHAO B X, LI G F, et al. A rapid determination for neohesperidin and neohesperidin dihydrochalcone in plasma via liquid chromatography-tandem mass spectrometry method [J]. Phram Today(今日药学), 2015, 25(6): 409-413.
[8] 孙昌华, 卜文, 李春令, 等. 环磷酰胺对 SD 大鼠围产期的毒性影响[J]. 山东畜牧兽医, 2013, 34(4): 1-4.
[9] SUN Z Y, ZHOU L, YAN H, et al. How to successfully carry out nonclinical reproductive toxictity study on new drugs [J].Chin J New Drugs(中国新药杂志), 2011, 20(22): 2195-2204.
[10] YUAN B J, LIAO M Y. LI B. Drug Toxicological Method and Technic [M]. Beijing: Chemical Industry Press, 2007.
[11] 《药物生殖毒性研究技术指导原则》课题研究组. 药物生殖毒性研究技术指导原则[S]. 2006.
Fertility and Early Embryonic Developmental Toxicity Study of Neohesperidin in Rats
LIN Chunqin1,2, QIAN Renyun1,2, SHEN Xiaofei1,2, YUAN Chenxing1,2, WANG Dandan1,2, DING Ling1
(1.College of Pharmaceutical Science, Zhejiang University, Hangzhou 310058, China;2.Center for Drug Safety Evaluation and Research of Zhejiang University, Hangzhou 310058, China)
ABSTRACT:OBJECTIVE To evaluate fertility and early embryonic developmental toxicity of neohesperidin in rats.METHODS According to sex and bodyweight, 200 rats(100 males and 100 females) were stratified randomly assigned to 5 groups, as control group (0.5% sodium carboxymethyl cellulose solution), cyclophosphamide group (20 mg·kg-1), neohesperidin low, middle and high dose group (0.45, 0.9 and 1.8 mg·kg-1). Male rats were administrated since 4 weeks before mating period to the end of mating period. Female rats were administrated since 2 weeks before mating period to 6th gestation period. At termination, sperm from the epididymides cauda was collected for examination. At 15th gestation period, uterine contents were examined as corpora luteum, implantation site, viable fetuses, deaths fetuses, absorptive fetus and placenta. RESULTS During administration, no abnormal behavior was observed for each group. No significant difference was found between control group and other groups for male rats on premating bodyweight, organ weight, enumeration of sperm reserves and sperm motility(P>0.05). Rate of total deformation was under 2% for control group and neohesperidin groups. No significant difference found between control group and neohesperidin groups for female rats on bodyweight, organ weight, corpora luteum, implantation site,viable fetuses, deaths fetuses, absorptive fetus (P>0.05). The result of histopathology examination showed that there was no pathological change related to dose noted for testis, epididymis, prostate and seminal vesicle; obvious pregnancy changes were found on uterus and vagina for control group and neohesperidin group. CONCLUSION There is no toxicity found for the fertility and early embryonic developmental toxicity of neohesperidin in rats.
KEY WORDS:neohesperidin; reproduction toxicity; fertility; early embryonic development
REFERENCES
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2017)12-1695-04
DOI:10.13748/j.cnki.issn1007-7693.2017.12.011
引用本文:林春琴, 钱仁云, 沈晓飞, 等. 新橙皮苷大鼠生育力与早期胚胎发育毒性研究[J]. 中国现代应用药学, 2017,34(12): 1695-1698.
作者简介:林春琴,女,助理实验员 Tel: (0571)88208076-103 E-mail: linchunqin@zju.edu.cn*
通信作者:丁玲,女,博士,副教授 Tel: (0571)88206915 E-mail: ld362@zju.edu.cn
收稿日期:2017-06-24
(本文责编:曹粤锋)