
图1 高效液相色谱图
A-对照品;B-供试品;1-艾司奥美拉唑
Fig. 1 HPLC chromatograms
A-sample; B-standard; 1-esomeprazole
支旭然,宋浩静,王觅,董占军*
(河北省人民医院药学部,石家庄 050051)
摘要:目的 考察注射用艾司奥美拉唑钠与0.9%氯化钠注射液在不同条件下的配伍稳定性。方法 将不同浓度注射用艾司奥美拉唑钠与0.9%氯化钠注射液配伍,然后将配置好的溶液放置于室温、遮光、光照(4 500 Lx)、40 ℃恒温环境下,定时考察注射用艾司奥美拉唑钠的性状、pH值、不溶性微粒数和艾司奥美拉唑的含量。结果 注射用艾司奥美拉唑钠在放置过程中出现不同程度的颜色变化,变化程度:40 ℃恒温>光照>室温>遮光。在4种条件下成品液pH值均相对稳定,pH值12 h内几乎无变化,24,48 h内略微下降,40 ℃恒温下降较多。高浓度溶液在40 ℃恒温条件下于48 h不溶性微粒数超出药典规定,其他所有溶液的不溶性微粒均符合药典要求。48 h内艾司奥美拉唑的含量也有所下降,40 ℃恒温条件下降较多。结论 注射用艾司奥美拉唑钠在40 ℃恒温条件下最不稳定,遮光条件下溶液最稳定。因此建议注射用艾司奥美拉唑成品溶液保存在室温条件下,尽量避光,同时避免高温影响,低浓度溶液(0.4 mg·mL-1)在配置后12 h内使用,高浓度溶液(1.6 mg·mL-1)8 h内滴完。
关键词:艾司奥美拉唑;配伍稳定性;pH值;不溶性微粒;高效液相色谱法
胃食管反流病(gastroesophageal reflux disease,GERD)的发病率逐年增长,已经成为严重影响人们生活质量的主要消化系统疾病之一[1-2]。艾司奥美拉唑是一种新型质子泵抑制药(proton pump inhibitors,PPI),是奥美拉唑的左旋光学异构体,主要在肝脏内代谢,其药用机制是通过不可逆地抑制胃内壁细胞 H+/K+-ATP酶而阻止胃酸的最终分泌[3-5],其治疗目标是缓解症状、治愈食管炎、提高生活质量、预防复发和并发症[6-7]。近年来,随着各个医院静配中心的建立,配制环境的提高,减少了配制过程中外源性的污染[8],但也导致配制后的成品液不能马上被使用,放置时间延长。随着放置时间的延长和放置环境的变化使得不溶性微粒、pH值、成分也会发生改变。因此,需要密切关注注射液集中配制后的稳定性,保障临床用药安全。
注射用艾司奥美拉唑钠说明书指出滴注液的制备浓度是0.2或0.4 mg·mL-1,应在12 h内使用;而有时临床用药剂量比较高。关于本药不同浓度的稳定性尚没有文献报道。本试验拟通过对不同浓度注射用艾司奥美拉唑钠配置后溶液的性状、pH值、不溶性微粒、有效成分的考察,为提高注射用艾司奥美拉唑钠的稳定性和临床合理用药提供科学依据。
Waters 2695高效液相色谱仪,配有2487双通道紫外可见检测器(美国Waters);AB204-S型十万分之一天平(瑞士 Metter Toledo);GWF-8JD微粒分析仪(天津天河分析仪器有限公司);FE20实验室pH计(梅特勒-托利多仪器有限公司);102CR电热鼓风干燥箱(山东潍坊精鹰医疗器械公司)。
甲醇、甲酸为色谱纯[赛默飞世尔(中国)有限公司];水为纯净水(杭州娃哈哈集团有限公司)。艾司奥美拉唑钠对照品(中国药品生物制品检定院,批号:420022-201501,纯度>99.8%);注射用艾司奥美拉唑钠(正大天晴药业集团股份有限公司,批号:161020122,规格:20 mg);0.9%氯化钠注射液(石家庄四药有限公司,批号:1702073803)。
按照注射用艾司奥美拉唑钠说明书和临床常用的用法用量,在静脉集中配制中心百级洁净台配制不同浓度(0.4,1.6 mg·mL-1)的成品溶液。配制后的成品溶液置于室温、遮光、光照(4500Lx)、40 ℃恒温的不同环境下,测定 0,1,2,4,8,12,24,48 h不同时间点的不溶性微粒、pH值、有效成分含量。
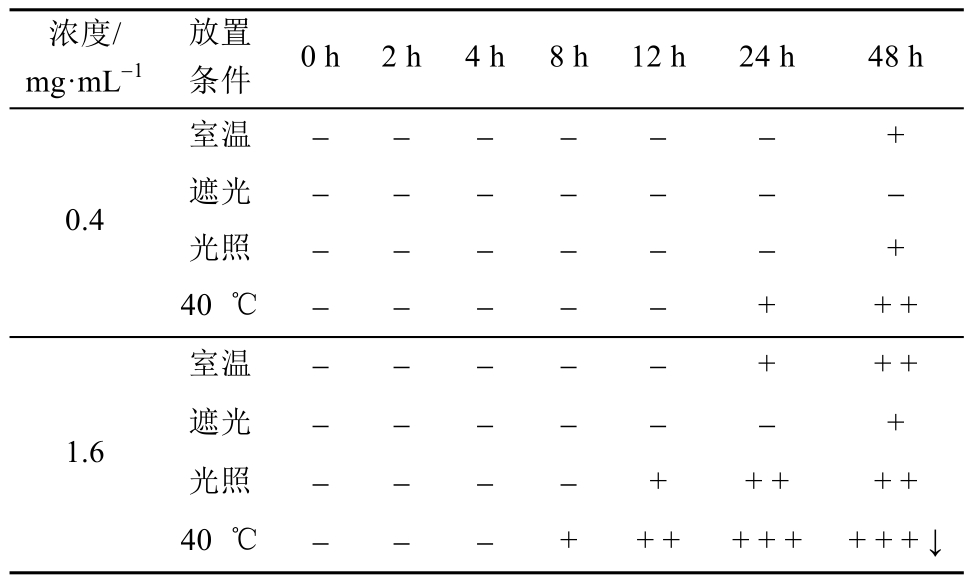
2.2.1 性状 观察室温、遮光、光照、40 ℃恒温条件下0,1,2,4,8,12,24,48 h不同时间点各成品输液的澄明度和颜色变化。无色澄清状态为-,微黄色为+,淡黄色为++,黄色为+++,出现浑浊为↓。
2.2.2 pH值 参照中国药典2015 年版四部通则0631[9],测定室温、遮光、光照、40 ℃恒温条件下0,1,2,4,8,12,24,48 h时各成品输液的pH值。
2.2.3 不溶性微粒 依照中国药典 2015 年版四部通则 0903[9],测定室温、遮光、光照、40 ℃恒温条件下0,1,2,4,8,12,24,48 h时各成品输液的不溶性微粒数,每个样品测 3次,求其平均值。
2.3.1 色谱条件 采用 Symmetry®C18色谱柱(4.6 mm×250 mm,5 μm)。流动相 A:乙腈(色谱纯),流动相 B:含 0.01 mol·L-1磷酸盐缓冲液(pH=7.6),梯度洗脱:0~10 min,12%→25%A;10~30 min,25%→65%A。流速:1.0 mL·min-1;检测波长:302 nm。进样量:10 μL。对照品和样品色谱图见图1。

图1 高效液相色谱图
A-对照品;B-供试品;1-艾司奥美拉唑
Fig. 1 HPLC chromatograms
A-sample; B-standard; 1-esomeprazole
2.3.2 溶液的制备 对照品溶液的制备:精密称定对照品适量,加适量甲醇制成对照品溶液,浓度为 10.0 mg·mL-1。供试品溶液的制备:取配制好的注射用艾司奥美拉唑钠成品液稀释10倍,再用 0.22 µm微孔滤膜过滤后取续滤液作为供试品溶液,进样测定。
2.3.3 线性范围考察 精密量取对照品溶液适量,用甲醇逐级稀释,制得 7个不同浓度梯度的对照品溶液,按“2.3.1”项下色谱条件分析测定,记录峰面积。以峰面积(Y)为纵坐标,浓度(X)为横坐标,制作标准曲线。得回归方程为Y=16 140X -2 830.6(r=0.999 9),表明在 3.125~200.0 μg·mL-1内有良好的线性关系。
2.3.4 仪器精密度试验 取同一浓度对照品溶液,按“2.3.1”项下色谱条件重复进样 6次,测定峰面积。峰面积 RSD为0.38%,结果符合要求,表明仪器精密度良好。
2.3.5 重复性试验 取同一批号样品,按“2.3.2”项下供试品溶液的制备方法平行制备 6份供试品溶液,分别进样测定分析,并计算RSD 为0.54%,结果均符合规定,表明该方法重复性良好。
2.3.6 回收率试验 精密量取样品(6份),分别精密加入对照溶液,摇匀。制备成供试品溶液后进样测定,记录结果,并计算回收率,结果测得平均回收率为97.12%,RDS为1.28%。结果表明,该方法的回收率良好。
2.4.1 性状 低浓度成品液在24 h时,40 ℃恒温溶液变为微黄;48 h时室温和光照条件下成品输液为微黄色,40 ℃恒温溶液为淡黄色,遮光条件下溶液无变化。高浓度24 h时,室温、光照、40 ℃恒温条件下溶液均变黄:40 ℃恒温>光照>室温,其中40 ℃恒温在8 h即出现微黄;48 h时各溶液黄色加深,其中40 ℃恒温出现浑浊;遮光条件下只在48 h出现微黄。结果见表1。
表1 性状考察结果
Tab 1 Results of properties
2.4.2 pH值 成品输液在室温、光照、遮光和40 ℃恒温条件放置过程中,40 ℃恒温时低浓度和高浓度在48 h内pH值变化较大,其他条件下pH值12 h内几乎无变化,24,48 h内略微下降。结果见表2。
表2 pH值考察结果(n=3)
Tab. 2 Results of pH(n=3)

2.4.3 不溶性微粒 中国药典2015年版规定,标示装量≥100 mL的静脉注射液,除另有规定外,每1 mL中粒径≥10 μm的微粒不得超过25个,粒径≥25 μm的微粒不得超过3个。从表3可以看出,高浓度溶液40 ℃恒温条件下,成品液在48 h微粒数超出药典规定;其他条件在48 h内微粒数均未超过药典规定。
2.4.4 艾司奥美拉唑含量 分别取室温、遮光、光照、40 ℃恒温条件下0,2,4,8,12,24,48 h时的艾司奥美拉唑钠注射液成品液适量,按照上述供试品处理方法和色谱条件进样分析测定,记录色谱峰面积,代入相应的标准曲线,计算含量。艾司奥美拉唑钠注射液配制后48 h内放置过程中含量均有下降,其中40 ℃恒温条件下下降较多。结果见表4。
表3 不溶性微粒考察结果(10 μm/25 μm,n=3)
Tab. 3 Results of the insoluble particles(10 μm/25 μm,n=3)个/毫升
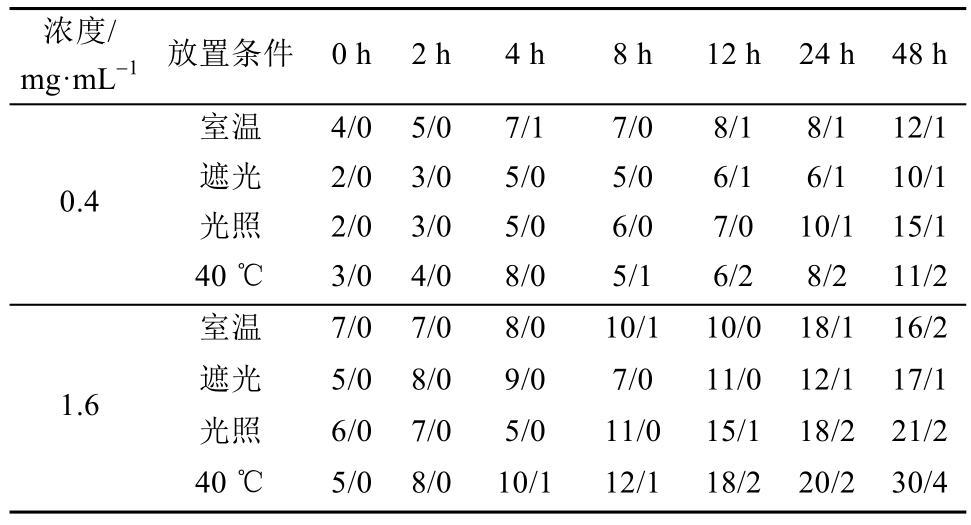
表4 艾司奥美拉唑含量变化结果(n=3)
Tab. 4 Results of content determination of esomeprazole(n=3) μg·mL-1

根据说明书规定,试验中溶液的配制采用的溶媒是0.9%氯化钠注射液。同时有文献考察[10-11]注射用艾司奥美拉唑与5%葡萄糖注射液、5%葡萄糖氯化钠注射液、10%葡萄糖注射液、0.9%氯化钠注射液、果糖注射液及木糖醇注射液配伍,发现艾司奥美拉唑宜与0.9%氯化钠注射液、木糖醇注射液配伍。因此,试验中只对0.9%氯化钠注射液配伍进行考察。
目前,各个医院都建立了静脉配制中心,配制后的成品液从静脉配制中心运送到科室时,可能经过高温的环境,比如夏天太阳的暴晒;冬天贴近暖气,这时运送车内的温度会升高,可能会影响到成品液的稳定性。因此,本试验考察了恒温40 ℃这个影响因素。
通过考察配伍后的注射用艾司奥美拉唑在室温、遮光、光照以及40 ℃恒温不同条件下性状、pH值、不溶性微粒、有效成分含量,发现成品溶液性状受温度和光照影响较大,但这个变色并不是伴随着药物含量的损失,这个结论跟文献相吻合[12]。通过试验,笔者建议注射用艾司奥美拉唑输液的配制应在静脉配制中心完成,成品溶液保存在室温条件下,尽量避光,同时避免高温影响,低浓度溶液(0.4 mg·mL-1)在配制后12 h内使用,高浓度溶液(1.6 mg·mL-1)8 h内滴完。
注射液的稳定性考察是其广泛应用于临床极为重要的一个环节,决定着患者的用药安全。本试验通过对艾司奥美拉唑钠注射液配制后成品液稳定性的研究,为艾司奥美拉唑钠注射液的临床用药安全提供了依据。而在实际工作中还应随时注意观察患者情况,减少不良反应的发生。
[1] LI Y H, ZHANG W L, WANG X, et al. Clinical observation on fire needle therapy for gastroesophageal reflux disease [J].World J Integr Tradit West Med(世界中西医结合杂志), 2015,10(11): 1600-1602.
[2] HU Y J, YANG Y F, YE Y C. Comparative efficacy of dexlansoprazole and esomeprazole in the treatment of gastro-esophageal reflux disease [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(6): 739-745.
[3] YANG W, ZHAO C Y, JIANG M Y. Impurities in esomeprazole sodium by LC-MS/MS [J]. Centr South Pharm(中南药学), 2017, 15(3): 352-355.
[4] ZHANG X N, ZHANG L M, GUO Y S, et al. Determination of esomeprazole in rat plasma by ultra performance liquid chromatography tandem mass spectrometry and study on its pharmacokinetics [J]. Chin Hosp Pharm J(中国医院药学杂志),2016, 36(24): 2161-2165.
[5] DING Y,WU X L, LIN M, et al. Meta-Analysis for efficacy of gastroesophageal reflux disease treated by lansoprazole [J].Phram Today(今日药学), 2015, 25(3): 198-201.
[6] 邓秋飒,刘丽青,谢静秋. 埃索美拉唑与奥美拉唑治疗反流性食管炎临床对比研究[J]. 当代医学, 2012, 18(32):127-128.
[7] SONG C, ZHENG L, LI J, et al. Esomeprazole vs first-generation pump inhibitors in the treatment of helicobacter pylori infection: a meta-analysis [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2013, 30(8): 914-919.
[8] ZHI X R, BAI W J, WANG Q M, et al. Compatibility stability of Shenkang injection [J]. Chin Pharm(中国药师), 2016,19(11): 2155-2157.
[9] 中国药典. 四部[S]. 2015: 附录77-78, 114-115.
[10] LIN D Y, LI Y T, YANG C Y, et al. Study on compatible stability of esomeprazole sodium for injection with six kinds of common solvents [J]. Her Med(医药导报), 2012, 31(9):1210-1213.
[11] ZHANG L N, ZHANG L M, GAO Y L, et al. Stability of esomeprazole sodium for injection in different solvents and different drug compatibility [J]. Shandong Med J(山东医药),2016, 56(7): 24-26.
[12] THOMAS C K, VASILEIOS A, MICHEL B, et al. Physical and chemical stability of esomeprazole sodium solutions [J].The annals of pharmacotherapy, 2008, 42(9): 1247-1251.
Compatibility Stability of Esomeprazole Sodium for Injection
ZHI Xuran, SONG Haojing, WANG Mi, DONG Zhanjun*
(Department of Pharmacy, Hebei General Hospital,Shijiazhuang 050051, China)
ABSTRACT:OBJECTIVE To investigate the compatible stability of esomeprazole sodium for injection with 0.9% sodium chloride injection under different conditions. METHODS Under the conditions of room temperature, shading, illumination(4 500 Lx), 40 ℃ in constant temperature environment, the appearance, pH value, insoluble particles and content of effective components(esomeprazole) in esomeprazole sodium for injection were determined regular after mixed with 0.9% sodium chloride injection. RESULTS Injection of esomeprazole sodium in the placement process had varying degrees of color changes,change degree: 40 ℃>illumination>room temperature>shading. Under the four conditions, the pH value of the finished product liquid was relatively stable; the pH value was almost unchanged within 12 h, and slightly decreased in the 24 and 48 h, and the constant temperature was decreased more at 40 ℃. The insoluble particle number of 48 h in the solution of high concentration under the 40 ℃ constant temperature exceeded the requirement of Chinese Pharmacopoeia, and the insoluble particles of all other solutions met the requirements of Chinese Pharmacopoeia. The content of esomeprazole in 48 h also decreased, and the 40 ℃ constant temperature condition decreased more.CONCLUSION The injection of esomeprazole sodium is the most unstable under the 40 ℃ constant temperature, and the solution is most stable under the condition of shading. Therefore, it is recommended that the injection of esomeprazole solution be preserved at room temperature, as far as possible to avoid light,while avoiding the impact of high temperature. The low concentration solution (0.4 mg·mL-1) is recommended that used after 12 h, and the high concentration solution (1.6 mg·mL-1) is recommended that dripped in 8 h.
KEY WORDS:esomeprazole; compatibility stability; pH; insoluble particles; HPLC
REFERENCES
中图分类号:R971.101
文献标志码:B
文章编号:1007-7693(2017)12-1727-04
DOI:10.13748/j.cnki.issn1007-7693.2017.12.018
引用本文:支旭然, 宋浩静, 王觅, 等. 注射用艾司奥美拉唑钠配伍稳定性考察[J]. 中国现代应用药学, 2017, 34(12): 1727-1730.
基金项目:医学科学研究基金资助项目(YWJKJJHKYJJ-A826)
作者简介:支旭然,女,硕士,药师 Tel: (0311)85988807 E-mail: zhixuran@163.com*
通信作者:董占军,男,博士,主任药师 Tel:(0311)85988604 E-mail: 510349303@qq.com
收稿日期:2017-06-15
(本文责编:曹粤锋)