 ,用SPSS 16.0统计软件进行数据分析,样本均数比较采用t检验,对统计数据进行分析,取p<0.05为显著性检验水准。
,用SPSS 16.0统计软件进行数据分析,样本均数比较采用t检验,对统计数据进行分析,取p<0.05为显著性检验水准。杨建苗1,李天傲2,3,许东航2*
(1.台州恩泽医疗中心(集团)浙江省台州医院,浙江 临海317000;2. 浙江大学医学院附属第二医院,杭州310009;3.中国药学会,北京100022)
摘要:目的 探讨多柔比星-五味子乙素共载脂质体克服肿瘤多药耐药机制。方法 制备多柔比星-五味子乙素共载脂质体,以人慢性髓系白血病耐药细胞株K562/DOX为模型细胞,分别探讨不同温度、内吞抑制剂存在下的细胞摄取药物的情况,并检测耐药细胞P-gp表达和细胞凋亡情况。结果 共载脂质体在4 ℃及氯喹、叠氮钠和甘露醇内吞抑制剂存在下进入耐药细胞的药物量明显减少;流式细胞仪检测多柔比星-五味子乙素共载脂质体可抑制 P-gp表达且诱导凋亡。结论多柔比星-五味子乙素共载脂质体进入 K562/DOX细胞主要通过耗能的内吞途径;而多柔比星-五味子乙素共载脂质体克服肿瘤多药耐药可能是通过抑制P-gp表达和促进凋亡双通道途径。
关键词:多柔比星;五味子乙素;共载脂质体;多药耐药;机制
肿瘤多药耐药(multidrug resistance,MDR)是化疗治疗失败的主要原因,如何有效克服MDR一直是医学各领域研究者思考的重要问题之一[1-2]。前期笔者采用脂质体联合五味子乙素制备多柔比星-五味子乙素共载脂质体(doxorubicinschizandrin B co-delivery liposomes,DSCL)促进了蒽环类药物多柔比星(doxorubicin,DOX)在耐药细胞K562/DOX中积聚[3],但其克服MDR机制有待进一步明确。
目前文献认为载体克服 MDR的机制主要是通过抑制P-gp功能与表达而发挥作用,笔者前期亦发现 DOX等纳米载体孵育可导致耐药细胞K562/DOX的 P-gp表达下调[4]。因此,药物载体技术克服肿瘤 MDR可能是通过特异性地与 P-gp结合,使其不能发挥药物转运泵的功能;或间接通过降低药物转运泵的数量而发挥作用。
但中药单体五味子乙素(schizandrin B,Sch B)作为肿瘤MDR小分子逆转剂,文献报道可通过抑制P-gp功能和促进凋亡途径而发挥作用[5-7],那将Sch B共载于脂质体后,是仅通过P-gp表达的改变还是通过 P-gp表达和凋亡共同发挥克服肿瘤MDR作用?为此,笔者拟通过实验研究DSCL克服肿瘤MDR的可能作用,分析其内在机制。
EPICS-XL型流式细胞仪(美国 Beckman Coulter);ELX-800型酶标联免疫仪(美国BIO-TEK INSTRNMENTS公司);Bio-Rad1350型高效液相色谱仪:Rheodyne 7125进样阀,AT-330柱温箱,System GOLD色谱工作站(美国Backman公司);FP-2020 Plus荧光检测器(美国 Jasco公司);BB16UV型二氧化碳培养箱(上海Heraeus公司);Hera Safe超净工作台(德国Heraeus公司);CKX-41型光学显微镜(日本 OLYMPUS公司);RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂);SHZ-DIII循环水式真空泵(西安博奥仪器有限公司);JY92-2D型超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
DOX(深圳万乐药业有限公司,含量:99.5%,批号:H44024359);Sch B(中国食品药品检定研究院,批号:110765-200710);柔红霉素(意大利Pharmacia & Upjohn公司);大豆磷酯和胆固醇(德国Lucas Meyer公司);聚乙二醇辛基苯基醚(Triton X-100,美国Sigma-Aldrich公司);RPMI-1640培养基(美国Hyclone公司);DMEM培养液与IMDM培养液(美国 Gibco公司);胎牛血清(美国 Gibco公司);四甲基偶氮唑蓝(MTT,美国Sigma-Aldrich公司,批号:303H0530);Annexin V-FITC/PI细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,批号:C1062);其他均为分析纯。DSCL、多柔比星脂质体(DOX-L)及其他DOX制剂均为自制。
人慢性髓系白血病细胞株 K562细胞和耐多柔比星人慢性髓系白血病细胞株 K562/DOX细胞由浙江大学肿瘤研究所提供。
参照文献[3-4],K562/DOX细胞培养于含10%灭活新生小牛血清(经56 ℃、30 min水浴灭活)的RPMI-1640 培养液中(含 DOX 1 μg·mL-1),于体积分数 5%、37 ℃ CO2培养箱培养,维持细胞处于对数生长期。试验前用不含DOX的培养基培养1周以上方可使用。
流动相:甲醇-水-冰醋酸(50∶50∶0.25);色谱柱为 Diamond C18柱(4.6 mm×250 mm,5 μm);流速为 1.0 mL⋅min-1;检测激发波长(Ex)为497 nm,发射波长(Em)为555 nm。以柔红霉素为内标,进样20 μL,测定峰面积,内标法计算样品中DOX的含量。
将1×106细胞接种于6孔培养板中,12 h后加入 DSCL(控制浓度为 5 µg·mL-1),于 4 ℃和37 ℃培养1,4 h后用冷pH 7.2 PBS洗细胞3次,终止细胞对药物的摄取,细胞悬液在冰浴下探头超声破碎细胞,HPLC测定耐药细胞 K562/DOX内DOX含量。
将1×106细胞接种于6孔培养板中,生长12 h后加入氯喹、叠氮钠和甘露醇等内吞抑制剂。30 min 后加入 DSCL(控制浓度为 5 μg·mL-1),细胞培养1 h和4 h后用冷PBS(pH 7.4)洗细胞3次,终止细胞对药物的摄取,细胞悬液在冰浴下探头超声破碎细胞,HPLC测定耐药细胞 K562/DOX内DOX含量。
取对数生长期各株细胞,收集细胞制成1×106·mL-1的悬液,加入一抗(1∶400),4 ℃避光反应45 min,用加1%小牛血清的PBS洗3次后,加入二抗(1∶1 000),4 ℃避光反应30 min,PBS洗细胞3次,用PBS垂悬后,流式细胞仪检测细胞荧光强度。
取对数生长期的 K562/DOX细胞以每孔 105个细胞的数量接种于6孔板上,在37 ℃,5% CO2条件下培养 12 h后,除去培养液,分别加入5 μg·mL-1的不同DOX制剂,与细胞共孵育72 h。根据 Annexin V-FITC/PI试剂盒的说明书处理细胞:将药物处理后的细胞,用PBS清洗3次,加入不含EDTA的胰酶将细胞消化,离心沉淀细胞,用PBS清洗2遍,加入500 μL Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL PI混匀,室温避光反应15 min,使用流式细胞仪进行检测。
实验数据均表示为 ,用SPSS 16.0统计软件进行数据分析,样本均数比较采用t检验,对统计数据进行分析,取p<0.05为显著性检验水准。
,用SPSS 16.0统计软件进行数据分析,样本均数比较采用t检验,对统计数据进行分析,取p<0.05为显著性检验水准。
前期研究已发现DSCL能提高DOX在耐药细胞 K562/DOX内的蓄积,提示 DSCL具有克服K562/DOX细胞MDR的效果,并通过细胞毒性试验中发现逆转倍数为DOX溶液的15.64倍[3]。进一步探讨DSCL克服MDR作用机制。
4 ℃是低能量培养条件,此条件下细胞处于“休眠”状态,采用不同温度(4 ℃和37 ℃)研究细胞摄取DSCL情况,探讨4 ℃进入细胞的摄取过程是否会受抑制结果见图1。4 ℃孵育时随时间从0.25 h到2 h,细胞内DOX积聚仅略增加,差异不具有统计学意义;但4 ℃细胞内DOX积聚显著低于 37 ℃(p<0.05)。说明耐药细胞摄取 DSCL时呈现明显的温度依赖性,提示细胞摄取脂质体需要消耗能量,推测 DSCL是通过内吞途径被细胞摄取。

图 1 不同时间、温度条件下给予 DSCL后 DOX在K562/DOX细胞内积聚情况与4 ℃比较,1)p<0.05。
Fig. 1 Accumulation situation of DOX in K562/DOX cells after incubation at different time and temperature with DSCL Compared with 4 ℃,1)p<0.05.
叠氮钠、甘露醇和氯喹 3个内吞抑制剂在0.25 h和2 h的细胞摄取结果显示,培养液中加入内吞抑制剂0.25 h和2 h后,耐药细胞内DOX的聚积量均比未加抑制剂的细胞显著降低(p<0.01)。表明内吞抑制剂可明显抑制 DSCL的内吞过程。结果见图2。

图2 内吞抑制剂对DSCL促进DOX在K562/DOX细胞内积聚的影响与DSCL比较,1)p<0.01。
Fig. 2 Effects of endocytic inhibitors on the accumulation of DOX in K562/DOX cells by DSCL Compared with DSCL,1)p<0.01.
采用流式细胞仪检测同样浓度的DOX-L、五味子乙素和多柔比星混合溶液(Sch B+F-DOX)和DSCL孵育K562/DOX细胞2 h后的P-gp表达是否出现变化(PBS作为对照)。结果显示,PBS组K562/DOX细胞P-gp表达非常高,而DOX-L组、Sch B+F-DOX组和DSCL组孵育后,对P-gp表达有明显的抑制作用,并且 DSCL组具有最优的抑制P-gp效果,结果见图3。
采用流式细胞仪检测相同浓度的 DOX-L、Sch B+F-DOX和DSCL孵育K562/DOX细胞2 h后的后的凋亡(PBS作为对照),结果见图4,Sch B+F-DOX诱导细胞产生较多的凋亡,明显高于DOX-L组。而 DSCL组诱导产生凋亡的细胞与Sch B+F-DOX组相接近,只是在凋亡时期有差别。说明DSCL不仅抑制了P-gp表达,而且还诱导细胞发生凋亡,所以其克服MDR效果优于Sch B+F-DOX组。
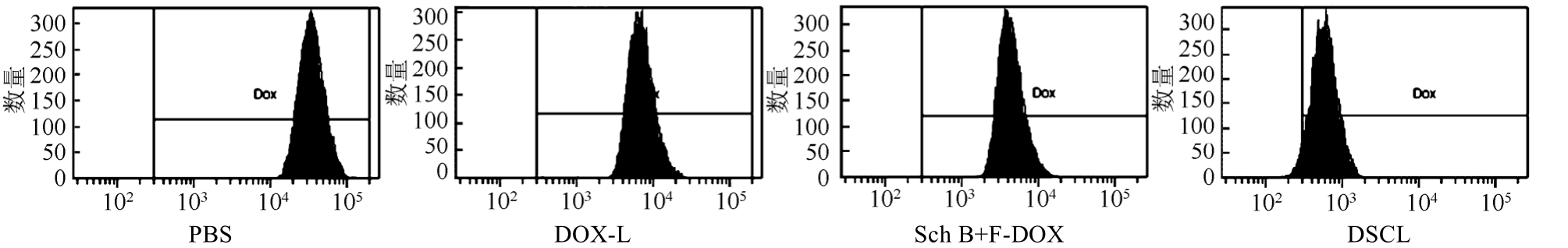
图3 PBS、DOX-L、Sch B+F-DOX和DSCL在K562/DOX细胞内对P-gp表达的影响(37 ℃,2 h)
Fig. 3 The effect of PBS, DOX-L, Sch B+F-DOX and DSCL on the expression of P-gp in K562/DOX cells(37 ℃, 2 h)
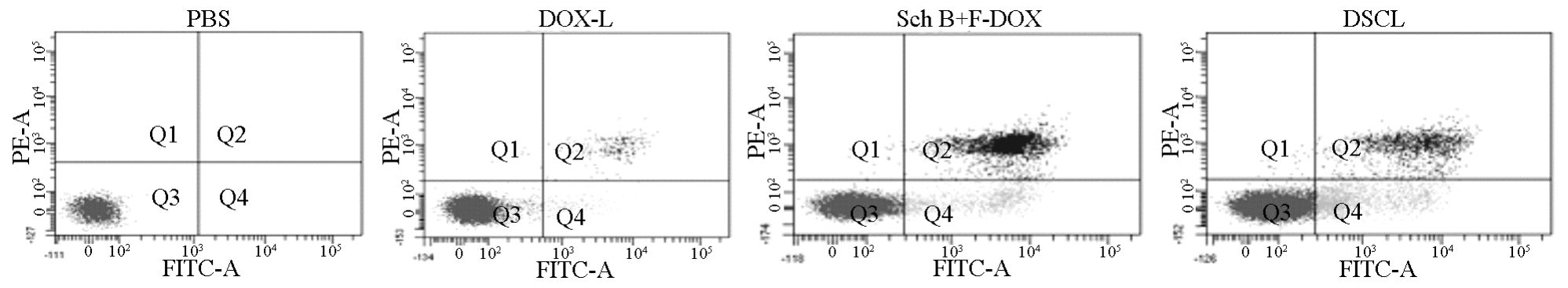
图4 PBS、DOX-L、Sch B+F-DOX和DSCL对K562/DOX细胞凋亡的影响(37 ℃,2 h)
Fig. 4 The effect of PBS, DOX-L, Sch B+F-DOX and DSCL on the apoptosis of K562/DOX cells(37 ℃, 2 h)
载体克服MDR机制一般认为[8-10]:①载体利用肿瘤血管渗透性增加而淋巴系统不全的特性增加药物在肿瘤组织内的浓度,利用载体使细胞膜流动性加快而增加药物在细胞内浓度,导致相同剂量化疗药物敏感度增加而克服MDR;②有效逃逸了P-gp的识别,使药物在细胞内滞留增加。而进入细胞后,药物快速释放和靶部位结合,从而促进药物的细胞摄取增加;③上调凋亡基因或下调凋亡抑制基因,促进细胞凋亡,使药物敏感度上升;④沉默药物转运蛋白如P-gp的表达,恢复细胞内药物阈值,使进入细胞药物增加[6]。但载体,特别是联合抗体、小分子逆转剂等的载体,其克服MDR可能是多个机制共同起作用,因此对特定载体而言,有必要进一步探讨其克服MDR机制。如Han等[11]探讨了PEG-PCL/P105复合胶束机制,结果发现复合胶束不改变耐药细胞表面的P-gp表达,但通过下调线粒体膜电位来限制P-gp的活性,同时避免P-gp的识别而发挥作用,因此后续可基于P105介导下调线粒体膜电位和PEG-PCL介导内化作用而组合设计克服MDR载体。
DSCL在 4 ℃时进入细胞的药物明显减少,而采用内吞抑制剂时摄取明显受抑制,说明纳米载体进入细胞一般通过非特异性吸附内吞,这是一个能量依赖性、可饱和的内化过程[9]。
经流式细胞仪的P-gp表达和细胞凋亡研究发现,DSCL克服MDR可能是通过抑制P-gp表达和促进凋亡双通道途径。DOX制剂的P-gp表达和凋亡的结果与耐药细胞的药物积聚结果及细胞毒性的结果相似[3]。
值得一提的是,从 K562/DOX细胞摄取看,DOX-L组和Sch B+F-DOX组的数据在2 h的摄取量比较接近[3],但其P-gp表达前者明显低于后者。笔者推测脂质体克服MDR作用除传统的通过与P-gp特异性结合或下调P-gp的表达外,可能还存在化疗药物通过脂质体的包裹,可避免DOX等药物被P-gp泵所识别,从而达到较多的药物在耐药细胞内积聚,这也是载体克服MDR的机制之一[4]。
载体克服MDR的研究需探讨其机制,DSCL克服MDR的机制为通过抑制P-gp表达和促进凋亡双通道途径而发挥作用。
[1] KUNJACHAN S, RYCHLIK B, STORM G, et al. Multidrug resistance: Physiological principles and nanomedical solutions[J]. Adv Drug Deliv Rev, 2013, 65(13-14): 1852-1865.
[2] HU C M, ZHANG L. Nanoparticle-based combination therapy toward overcoming drug resistance in cancer [J]. Biochem Pharmacol, 2012, 83(8): 1104-1111.
[3] LI T A, YANG J M, XU D H, et al. Co-delivery of Doxorubicin and Schisandrin B by liposome to overcome multidrug resistance [J]. Chin Pharm J(中国药学杂志), 2017,52(20): 1832-1836.
[4] XU D H. Overcoming multidrug resistance by doxorubicin nanocarriers [D]. Hangzhou: Zhejiang University, 2008.
[5] 胡汛, 王弢. 五味子乙素在制备治疗肿瘤药物中的应用[P].中国专利, 200410059607, 2006-10-25.
[6] WANG T. Schzandrin B in reversal of P-glycoprotein mediated cancer multidrug resistance [D]. Hangzhou: Zhejiang University, 2004.
[7] WANG G H, SHEN H P, JIN C S, et al. Antitumor activity of stearic acid grafted chitosan oligosaccharide polymeric micelles loading podophyllotoxin against human glioma cells[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016,33(10): 1248-1251.
[8] LI T A, XU D H, GAO J Q. Recent advances in inorganic materials-based nanoparticles to overcome multidrug resistance of cancer cells [J]. Chin Pharm J(中国药学杂志),2016, 51(16): 1360-1363.
[9] XU D H, GAO J Q, LIANG W Q, et al. Study progress of overcoming multidrug resistance by solid lipid nanoparticle [J].Chin Pharm J(中国药学杂志), 2010, 45(6): 401-403.
[10] CHEN Y, CHEN H, SHI J. Inorganic nanoparticle-based drug codelivery nanosystems to overcome the multidrug resistance of cancer cells [J]. Mol Pharm, 2014, 11(8): 2495-2510.
[11] HAN M, DIAO Y Y, JIANG H L, et al. Molecular mechanism study of chemosensitization of doxorubicin-resistant human myelogenous leukemia cells induced by a composite polymer micelle [J]. Int J Pharm, 2011, 420(2): 404-411.
Mechanism Study of Doxorubicin-schisandrin B Co-delivery Liposomes to Overcome Multidrug Resistance
YANG Jianmiao1, LI Tian’ao2,3, XU Donghang2*
(1.Taizhou Hospital of Zhejiang Province, Taizhou Enze Medical Center(Group), Linhai 317000, China; 2.Second Affiliated Hospital, School of Medicine, Zhejiang University, Hangzhou 310009,China; 3.Chinese Pharmaceutical Association, Beijing 100022, China)
ABSTRACT:OBJECTIVE To investigate the mechanism of doxorubicin-schisandrin B co-delivery liposomes(DSCL) to overcome multidrug resistance(MDR). METHODS DSCL were prepared. The K562/DOX cells were chosen as the model cells.The low temperature test, Endocytosis inhibitors (chloroquine, sodium azide, and mannitol) test were carried out on K562/DOX cells. And P-gp expression and apoptosis were detected by flow cytometry. RESULTS The uptake of DSCL was energy-dependent and was influenced by temperature, and endocytosis inhibitors, such as chloroquine, sodium azide and mannitol, could decrease significantly accumulation of DOX. The flow cytometry result revealed that the expression of P-gp of K562/DOX cells was significantly inhibited after treatment with DSCL, and it showed DSCL induced a regulated apoptotis in cells. CONCLUSION DSCL were uptaken through the endocytosis of energy-dependent. It is proposed the mechanism of DSCL to overcome multidrug resistance was a dual strategy by inhibiting the expression of P-gp and promoting apoptotis.
KEY WORDS:doxorubicin; schisandrin B; co-delivery liposomes; multidrug resistance; mechanism
REFERENCES
中图分类号:R965.2
文献标志码:A
文章编号:1007-7693(2017)12-1679-04
DOI:10.13748/j.cnki.issn1007-7693.2017.12.008
引用本文:杨建苗, 李天傲, 许东航. 多柔比星-五味子乙素共载脂质体克服多药耐药的机制研究[J]. 中国现代应用药学,2017, 34(12): 1679-1682.
基金项目:浙江省自然科学基金资助项目( LY15H300001,LY18H300004);恩泽医疗中心(集团)科学研究基金资助项目(16EZD23)
作者简介:杨建苗,女,硕士,主管药师 Tel: (0576)85199127 E-mail: yangjm@enzemed.com*
通信作者:许东航,男,博士,主任药师 Tel: (0571)87784540 E-mail: xudonghang@zju.edu.cn
收稿日期:2017-06-16
(本文责编:蔡珊珊)