表1 本处方工艺样品在不同介质中的溶出数据
Tab. 1 Craft sample dissolution data of the prescription in different medium

刘杨1,赖庆宽2
(1.成都铁路卫生学校,成都 611741;2.成都百裕制药股份有限公司,成都 610000)
摘要:目的 优化波生坦片的制剂处方,以解决波生坦溶出度不高,制剂不稳定的共性难题。方法 采用湿法制粒后压片的工艺,以片剂的性状、溶出度、有关物质、晶型稳定性等为评价指标,比较不同处方制得的波生坦片,并与原研药相比较。结果 优化后的处方制得的波生坦片,片面光洁美观,溶出效果好,晶型稳定,有关物质符合要求,且溶出行为和质量与原研药一致。结论 该新处方增加了波生坦的溶出度,提高了制剂晶型的稳定性,制剂质量与原研药一致,且制备方法简单、可行、易于实现产业化大生产,值得推广。
关键词:波生坦片;处方优化;晶型稳定性
肺动脉高压(pulmonary arterial hypertension,PAH)是由多种病因引起肺血管床受累而使肺循环阻力进行性增加,最终导致右心衰竭的一类病理生理综合征。国外报道严重 PAH患病率为(30~50)/10万[1]。根据国内文献资料判断,目前国内医院每年确诊的 PAH患者约 6.2~9.5万人,平均约8万人[2]。
波生坦是目前治疗 PAH的代表性药物,是FDA批准的首个内皮素受体拮抗剂,为Ⅲ期一线用药,短期及长期疗效显著[3]。但是波生坦在水中几乎不溶,因此,波生坦制剂的溶出对药效的发挥至关重要。另外,据文献报道波生坦存在16种晶型,晶型不同,药物溶解性、稳定性也会存在差异,因此,制剂中原料药需选择一种具有良好溶解性的晶型,并且保持该晶型的稳定性,防止其在制剂制备、贮存、使用过程中转晶型,从而影响药物溶解、溶出及疗效[4-5]。
本试验对波生坦片处方中的填充剂进行了筛选,波生坦和一水乳糖、微晶纤维素、十二烷基硫酸钠(SDS)等辅料形成组合物制得的波生坦片,其溶出度良好,晶型稳定,含量、有关物质等质量指标均良好。通过该处方制得的波生坦片能为广大PAH患者提供一种质优价廉的波生坦口服固体制剂。
G6实验型多功能湿法混合制粒机(深圳市信宜特科技);YSEI电热鼓风干燥箱(重庆永生试验仪器厂);JT4-60单冲压片机(上海天凡药机制造厂);YD-35片剂硬度仪(天津市天大天发科技有限公司);PL303电子天平(瑞士梅特勒);MD6万向混合机(深圳市信宜特科技);RC-8D溶出度测定仪(天津市天大天发科技有限公司);X-射线粉末衍射仪(BRUCKER D8 ADVANCE);752型紫外可见分光光度计(上海现科);1525型高效液相色谱仪(沃特世科技有限公司)。
波生坦(加拿大 Patheon Inc.,批号:IP036A01);一水乳糖(天津汉德威药业有限公司,批号:T2016038,纯度:99%);波生坦对照品(批号:101269,纯度:98.6%)、杂质A(批号:1076126,纯度:98.8%)、杂质 B(批号:1076137,纯度:98.5%)、杂质C(批号:1076148,纯度:98.3%)均购自上海子起生物科技有限公司;微晶纤维素KG802(旭化成株式会社);SDS(浙江海洲制药有限公司批号:20161012,纯度:98.9%);聚维酮 K30(上海昌为医药辅料技术公司);淀粉(安徽山河药用辅料股份有限公司);二氧化硅(上海卡乐康包衣技术有限公司);硬脂酸镁(安徽山河药用辅料股份有限公司);其他试剂均为分析纯。
根据波生坦原料存在多晶型且不同晶型的化合物在水中均几乎不溶解、稳定性和药理活性有显著差异的特点,综合考虑生产工艺稳定性和生产成本,拟选择先对原料进行粉碎,然后采用湿法制粒后压片的工艺,以中间体的休止角和可压性,片的外观、溶出度、有关物质和晶型为评价指标,筛选波生坦片的处方工艺。初步拟定的制备工艺如下:
①将处方量波生坦原料与填充剂、崩解剂、表面活性剂加入高效湿法制粒机中,搅拌速度30 Hz,切刀速度25 Hz,混合5 min,得混合物1,备用。
②将处方量聚维酮K30溶于纯化水中,充分搅拌溶解至均匀溶液,备用。
③将高效湿法制粒机搅拌速度降低至10 HZ,关闭切刀,低速搅拌下缓慢加入处方量的聚维酮K30水溶液;完成加浆后,调整搅拌速度至20 Hz,切刀速度35 Hz,混合90 s制软材;调整搅拌速度至10 Hz,关闭切刀出料制粒。
④将湿颗粒置于沸腾干燥机中,开启风机,调节物料温度为3~40 ℃,干燥10~15 min,控制颗粒干燥失重≤6%,出料得干颗粒。
⑤干颗粒用20目筛整粒后,与处方量的二氧化硅及硬脂酸镁一并加入万向混合机中混合5 min,得波生坦片中间体粉末。
⑥将波生坦片中间体粉末压片得波生坦片成品。
2.2.1 休止角测定方法 根据文献[6]采用固定漏斗法测定物料休止角:将漏斗垂直立于表面皿(直径为R)中心,底端距离表面皿2~3 cm,封住漏斗口,然后向漏斗中加满物料;打开漏斗口,待物料溢出表面皿后,测定表面皿檐口边距离堆尖高度 H,计算休止角(α)=Arctan(2 H/R)。
2.2.2 含量测定方法 照中国药典2015年版附录Ⅴ D 下HPLC条件进行测定。
色谱条件与系统适用性试验:用十八烷基硅烷键合硅胶为填充剂Zorbax Eolipse XDB Columns(250 mm× 4.6 mm,5 μm);以乙腈-枸橼酸钠溶液(取一水枸橼酸7.36 g,加水1 000 mL使溶解,用饱和氢氧化钠溶液调节pH至4.5)(60∶50)为流动相;检测波长为272 nm。理论板数按波生坦峰计算应≥2 000。
测定:取本品20片,精密称定,研细,精密称取适量(约相当于无水波生坦25 mg),置100 mL量瓶中,加乙腈10 mL,超声使波生坦溶解,用稀释剂稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。精密量取对照品溶液(取对照品25 mg,精密称定,置100 mL量瓶中,加乙腈10 mL超声使溶解,加稀释剂至刻度,摇匀,即得)和供试品溶液各20 μL,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算,即得。
2.2.3 溶出度测定方法 参照进口药品注册标准中波生坦片的溶出度测定法,取波生坦片适量,照溶出度测定法(中国药典2015年版附录CⅩ第二法),以900 mL纯化水、pH 1.2、pH 4.5、pH 6.8缓冲液为溶出介质,转速为每分钟50转,依法操作,经5,10,15,30,45 min时,取溶液适量,滤过,精密量取续滤液适量,加溶出介质稀释制成每1 mL中约含无水波生坦14 μg的溶液,照分光光度法(中国药典2015年版附录A)Ⅳ,在272 nm测定吸光度。另取波生坦对照品约15 mg,精密称定,置100 mL量瓶中,加乙腈10 mL使溶解,加溶出介质稀释至刻度,摇匀,精密量取5 mL,置50 mL量瓶中,加溶出介质稀释至刻度,摇匀,作为对照品溶液,同法测定吸光度,计算出每片的溶出度。结果波生坦片在上述溶剂中均较难溶出,加入 SDS后溶出均有较大幅度提高,在 pH 1.2+1%SDS中30 min溶出均达到81%,而在0.5%SDS、1%SDS、pH 4.5+1%SDS、pH 6.8+1%SDS中均几乎完全溶出,因此笔者采用1%SDS作为波生坦片的溶出介质,具体数据见表1。
表1 本处方工艺样品在不同介质中的溶出数据
Tab. 1 Craft sample dissolution data of the prescription in different medium

2.2.4 晶型测定方法 取本品细粉适量(约相当于波生坦1 g),加水适量,搅拌,过滤,再用适量水冲洗滤渣,将残渣置于60 ℃真空干燥2 h,取干燥后的残渣照 X-射线粉末衍射法(中国药典 2015年版二部附录F)Ⅸ测定。
2.2.5 有关物质测定方法 精密量取含量测定项下的对照品溶液1 mL,置于100 mL量瓶中,加稀释剂稀释至刻度,摇匀,作为对照溶液。分别精密称取波生坦、A、B、C对照品各适量,加乙腈溶解并稀释制成每1 mL中均约含100 μg的混合溶液;精密量取适量,加稀释剂稀释制成每1 mL中均约含10 μg的混合溶液,作为系统适用性试验溶液。照“2.2.2”项下的色谱条件,量取系统适用性试验溶液 20 μL注入液相色谱仪,记录色谱图;按出峰顺序依次为 A、波生坦、B、C,调节检测灵敏度,使C峰的峰高约为满量程的80%;A峰与波生坦峰的分离度应符合规定。再精密量取对照溶液和含量测定项下的供试品溶液各20 μL,分别注入液相色谱仪,记录色谱图至主峰保留时间的 5倍。供试品溶液的色谱图中如有杂质峰(溶剂峰除外),A的校正峰面积(A的峰面积乘以校正因子1.34)不得大于对照溶液主峰峰面积的0.2倍(0.2%),B的峰面积不得大于对照溶液主峰峰面积的0.2倍(0.2%),C的校正峰面积(C的峰面积乘以校正因子1.21)不得大于对照溶液主峰峰面积的0.2倍(0.2%),其他单个杂质的峰面积不得大于对照溶液主峰峰面积的0.2倍(0.2%),其他杂质峰面积的和不得大于对照溶液主峰峰面积的 0.4倍(0.4%)。供试品溶液色谱图中任何小于对照溶液主峰面积0.05倍的峰可忽略不计。
填充剂种类影响颗粒可压性、流动性及片子光洁度、硬度、脆碎度及片重差异。不同配比的处方组成见表2。研究表明淀粉作为填充剂,制得颗粒细粉较多,可压性及流动性均较差,片子外观不光洁,脆碎度及片重差异较大,不符合要求。微晶纤维素及乳糖均有效提高了颗粒可压性及流动性,二者1∶2为最佳配比,制得的颗粒及片子物理性质良好,满足要求,具体数据见表3。
表2 不同配比的处方组成
Tab. 2 Composition of prescriptions with different proportions
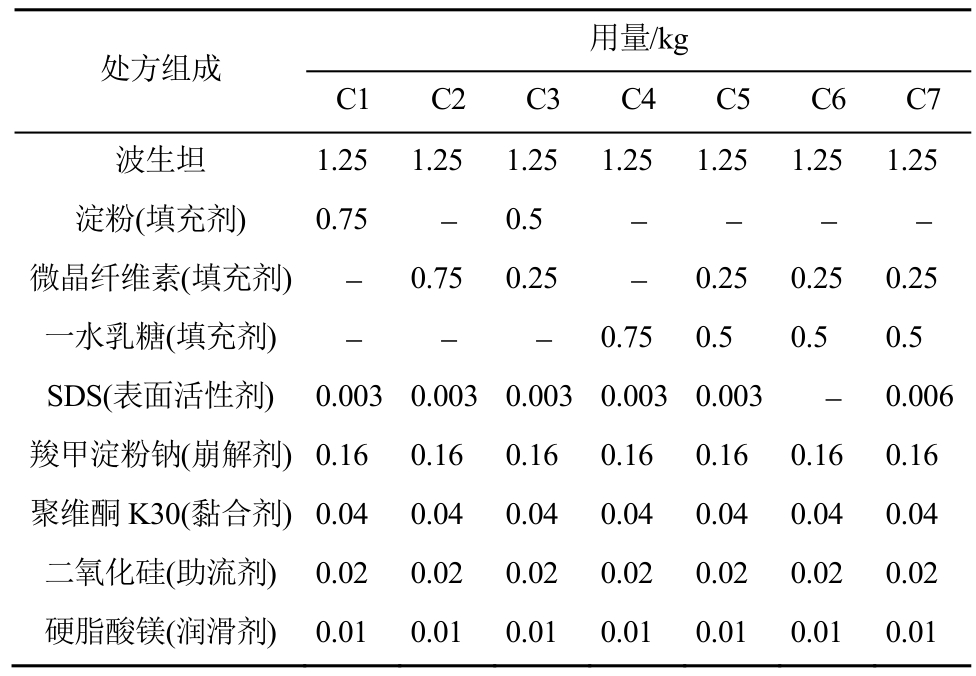
表3 不同处方对压片工艺的影响
Tab. 3 Effect of different prescriptions on tabletting process
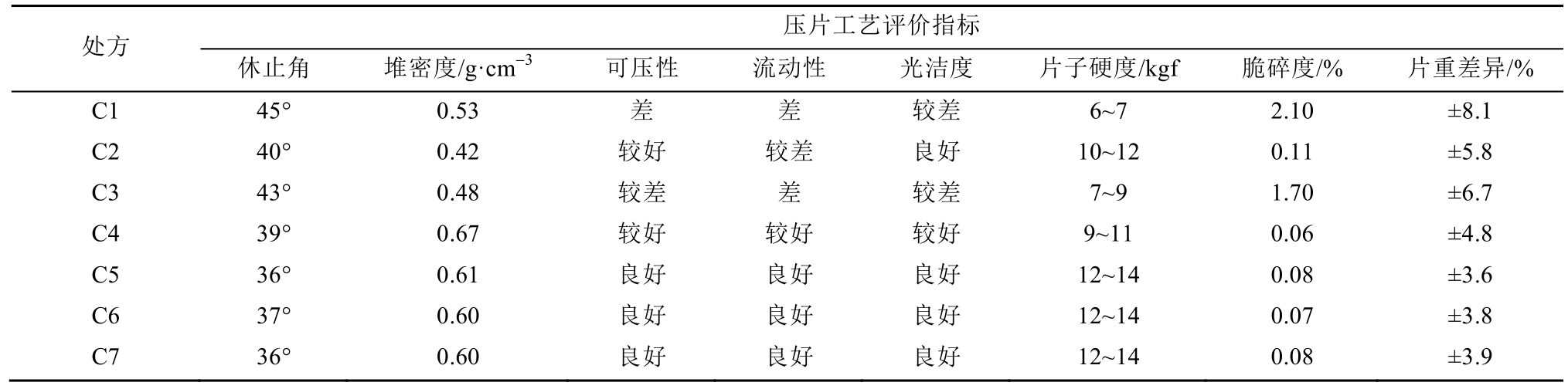
不同处方影响制剂含量、有关物质、晶型和溶出度,具体数据见表4。研究表明C5和C7处方的溶出度能快速溶出,且溶出完全,含量、有关物质、晶型也均符合要求。而其他配方样品,含量、有关物质、晶型虽符合要求,但溶出相对较差,难以溶出完全。原因为SDS作为表面活性剂能降低疏水性药物表面张力,通过增加润湿性的方法来提高波生坦的亲水能力,增加其溶出,试验证明SDS达到0.03%即能满足要求。此外,一水乳糖和微晶纤维素的合理搭配使用,也有利于提高波生坦口服固体制剂的溶出度,一水乳糖具有良好的亲水能力,能驱散疏水性药物粒子表面的电荷,改善了药物的润湿性,增加了药物的溶出;微晶纤维素可提高压片时片剂的硬度,具有磨损性和反应性低,崩解性良好等优点。
表4 不同处方0 d样品检测结果
Tab. 4 Sample results of different prescriptions for 0 d
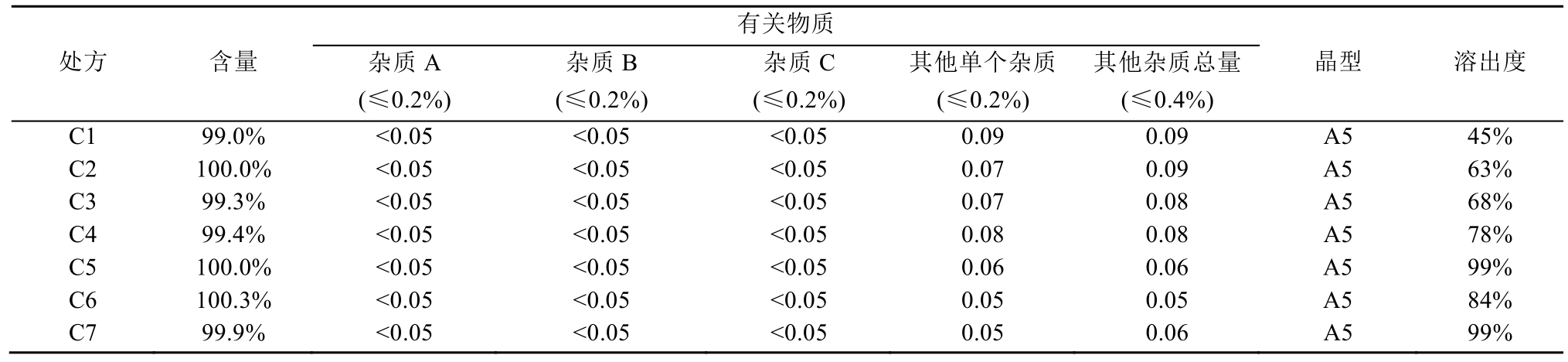
晶型往往影响制剂的成型制备、质量稳定性和治疗有效性。晶型不同,溶解度、生物利用度不同,所以需严格控制制剂中原料药的晶型,使其稳定,从而更好发挥疗效。试验表明本品一水乳糖有稳定波生坦晶型作用,其制剂加速 6月考察结果与0 d比较,晶型稳定性良好,都为A5晶型,与原料药的晶型相同,而其他不含乳糖的处方全部转晶为A4,具体数据见表5~6,X射线衍射图见图1。一水乳糖的晶型稳定作用,可能为其分子结构中具有8个羟基,可以与波生坦A5晶型形成氢键,而使其晶型稳定,不转晶。
表5 不同处方40 ℃加速6月稳定性结果
Tab. 5 Stability results of different prescriptions of 40 ℃ in six months
表6 A5与A4晶型X-射线粉末衍射特征峰
Tab. 6 Characteristic peaks of A5 and A4 crystalline X-ray powder diffraction

粒径通常对难溶性药物溶出度有影响,一般而言粒径越小,溶出越快,而本处方工艺,在波生坦粒径为15 µm和100 µm时溶出度基本无明显变化,其他质量指标也无明显变化,表明该处方工艺对原料粒径的适用范围较广,选择性更宽,具体数据见表7。
本处方工艺研制得到的片剂与进口波生坦片(全可利®)的质量进行比较。进口波生坦片(全可利®)批号:EP074A0501,生产厂家:Actelion Pharmaceuticals Ltd.,生产日期:2013.10,有效期:2017.09,贮藏条件:室温保存15~30 ℃。
表7 粒径对产品质量及稳定性的影响情况
Tab. 7 Influence of particle size on product quality and stability


图1 X射线衍射图
A-C3处方制得波生坦片—0 d;B-C3处方制得波生坦片—40 ℃,RH75%加速6月;C-本处方工艺制得波生坦片—0 d;D-本处方工艺制得波生坦片—40 ℃,RH75%加速6月;E-原料药。
Fig. 1 X-ray diffraction photograph
A-C3 prescription-0Day; B-C3prescription-40 ℃, RH75 % accelerated 6months; C-The prescription craft-0 d; D-The prescription craft-40 ℃, RH 75%accelerated 6 months; E-Active pharmaceutical ingredients.
参照进口药品注册标准中波生坦片的溶出度测定法,本处方工艺制得的片剂与进口波生坦片(全可利)进行了溶出度对比研究,结果本处方工艺与进口波生坦片在水、pH 1.2、pH 4.5、pH 6.8缓冲液中均较难溶出,加入SDS后溶出均有较大幅度提高,在pH 1.2+1%SDS中30 min溶出均达到80%左右,而在 0.5%SDS、1%SDS、pH4.5+1%SDS、pH 6.8+1%SDS中均几乎完全溶出。小试多批样品与进口波生坦片在1%SDS溶液条件下相似因子f2均>65,因此,本处方工艺与进口波生坦片在溶出行为上具有一致性,具体数据见表8。
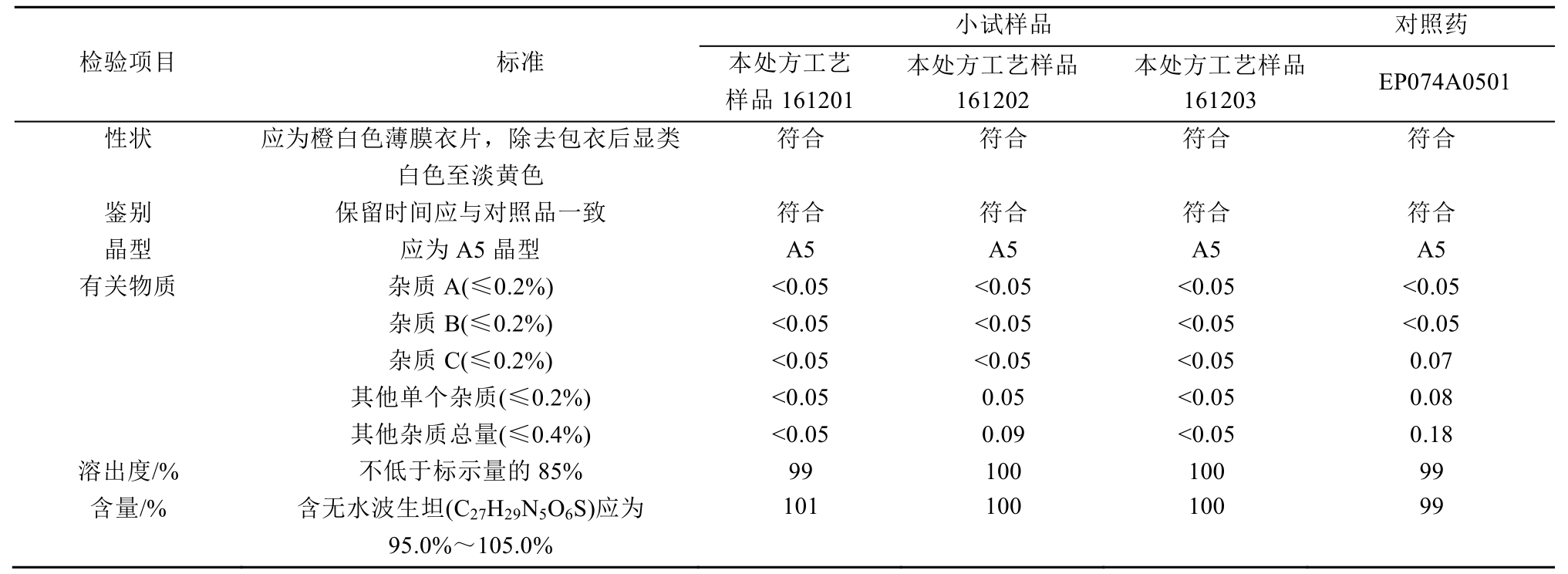
用本处方工艺制备了3批波生坦小试样品(批号:161201,161202,161203),参照进口药品注册标准,本处方工艺样品与进口波生坦片进行了全面质量对比,结果见表9。
本试验对波生坦片处方中的填充剂进行了筛选,利用表面活性剂、一水乳糖和微晶纤维素制得波生坦片,其溶出度良好,晶型稳定,含量、有关物质等质量指标均良好,有效解决了难溶性波生坦药物制成口服片剂溶出度低的难题,且该工艺对原料药粒径的要求不高,只需常规粒径即可,能有效避免因原料药粒径过大或过小引起的制剂弊端。该处方中的一水乳糖还加强了波生坦药物晶型的稳定性,避免了晶型互转,制得了晶型稳定的口服固体制剂,且溶出行为和其他质量指标与原研药一致,有效保证了波生坦的生物利用和治疗效果。该制剂工艺简单,普通湿法制粒工艺便可实现,相对于其他提高药物制剂溶出度的方法,节约了成本和能耗,经大生产验证表明本工艺合理、可行,并具有重现性。由该处方工艺生产制得的产品,打破了进口产品的垄断,获得了价格相对便宜的国内波生坦口服固体制剂,真正实现了质优价廉,为肺动脉高压患者大大减轻了经济负担。
表8 本处方工艺样品与进口波生坦片在不同介质中的溶出数据
Tab. 8 Samples of this prescription craft and import bosentan piece of dissolution data in different medium
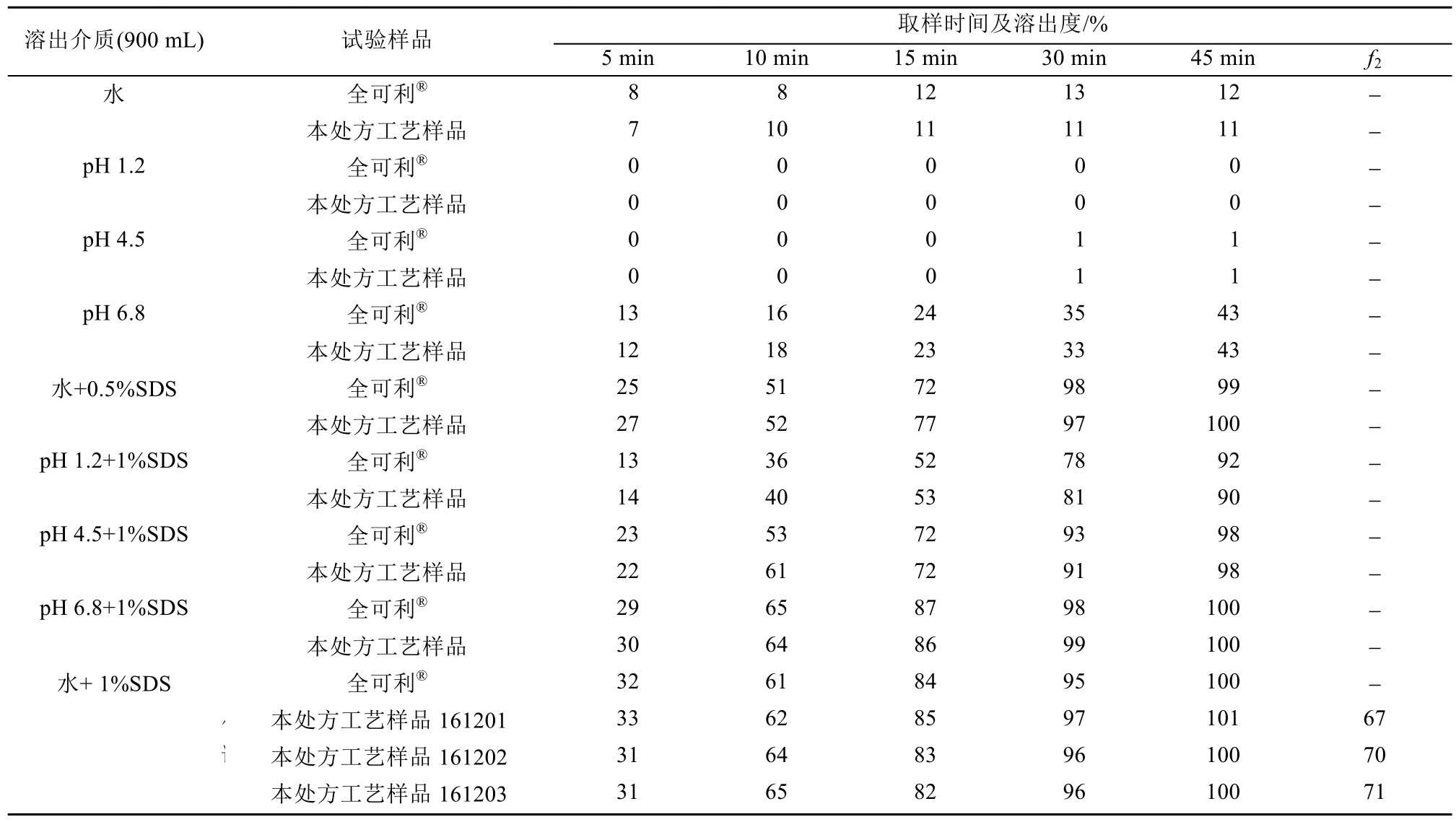
表9 本处方工艺样品与进口波生坦片全面质量对比(0 d)数据
Tab. 9 Samples of this prescription craft compared with imported bosentan temple total quality data(0 d)
[1] ZHANG Y T. The current situation and development trend in drug treatment of pulmonary hypertension [J]. Med Recapit(医学综述), 2012, 18(11) :1737-1739.
[2] XIAO Z C, LIU Y B. Treatment advance and tendency of pulmonary arterial hypertension [J]. Clin Med Eng(临床医学工程), 2016, 23(2) :257-260.
[3] XIONG M M, DU L L. Clinical study on bosentan in treatment of idiopathic pulmonary arterial hypertension [J].Guide China Med(中国医药指南), 2012, 10(34): 405-407.
[4] LI Y, ZHANG S, MEI M, et al. Quantitative analysis of crystal type Ⅰ content in atorvastatin calcium tablets by powder X-ray diffraction [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(10): 1293-1296.
[5] SHI Y F, WANG J, YANG W F, et al. Study of the polymorphs and dissolution of cilnidipine tablets [J]. Chin J Mod Appl Pharm(中 国 现 代 应 用 药 学 ), 2016, 33(12):1539-1543.
[6] DONG Y X, SONG Z P, CUI S J. Perspectives on the measurement of angle of repose [J]. J China Pharm Univ(中国药科大学学报), 2008, 39(4): 317-320.
Preparation of Bosentan Tablet
LIU Yang1, LAI Qingkuan2
(1.Chengdu Railway Health School, Chengdu 611741, China; 2.Chengdu Baiyu Pharmaceuticals Co., Ltd., Chengdu 610000, China)
ABSTRACT:OBJECTIVE To optimize the prescription of bosentan tablet, and in order to solve the common problem of dissolution and chemical stability. METHODS Tablets characters, dissolution, related substance and stability of crystal was used as the research index to compare the methods of preparating Bosentan tablet including original drugs, so as to get optimized method. RESULTS The tablets made by the best method (as tabletting after wet granulation after optimization) were one sided smooth and had beautiful appearance, high solubility, stable crystal and related substance according to requirement,especially the solubility activity and quality being compliant with original drug. CONCLUSION The new method can solve the problem of dissolution and chemical stability, can get tablets excellent quality of original drug, being simple and feasible to realize industrial production.
KEY WORDS:Bosentan tablet; prescription optimization; stability of crystal
REFERENCES
中图分类号:R941
文献标志码:B
文章编号:1007-7693(2017)12-1721-06
DOI:10.13748/j.cnki.issn1007-7693.2017.12.017
引用本文:刘杨, 赖庆宽. 波生坦片的制备[J]. 中国现代应用药学, 2017, 34(12): 1721-1726.
作者简介:刘杨,女,硕士,主管药师 Tel: 13880709380 E-mail: 16507102@qq.com
收稿日期:2017-05-11
(本文责编:曹粤锋)