 表示,组间差异比较采用单因素方差分析,方差齐性采用 LSD检验;方差不齐采用Dunnett T3检验,P<0.05有统计学意义。
表示,组间差异比较采用单因素方差分析,方差齐性采用 LSD检验;方差不齐采用Dunnett T3检验,P<0.05有统计学意义。阮丹,雷婧
(杭州市第三人民医院,杭州 310000)
摘要:目的 研究绞股蓝总皂苷对非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)大鼠肝脏保护作用及免疫调节作用机制。方法 48只SD大鼠随机分为正常对照组,模型对照组,多烯磷脂酰胆碱胶囊组(阳性对照组,150 mg·kg-1)及绞股蓝总皂苷高、中、低(240,120,60 mg·kg-1)剂量组,除正常对照组外,其余各组连续饲喂高脂饲料 10周,制备NAFLD模型;模型成功后,各组连续给药8周。实验期间,分别于给药0,4,8周眼眶取血检测血清AST、ALT;末次给药后,采用流式细胞技术检测外周血Th17和Treg细胞含量;酶联免疫法检测血清IL-17、IL-10及TNF-α含量。HE染色检查肝组织病理变化和免疫组化法检查肝组织IL-17和Foxp3表达。结果 给药4周,绞股蓝总皂苷高剂量显著降低大鼠血清ALT、AST(p<0.01);给药 8周,绞股蓝总皂苷各剂量均能显著降低血清ALT、AST(p<0.05,0.01)。绞股蓝总皂苷高、中剂量能改善肝组织病变,降低TNF-α水平;高剂量显著降低IL-17、升高IL-10水平(p<0.05,0.01),降低淋巴细胞IL-17含量,升高CD4+CD25+Treg含量(p<0.05),明显减少炎症因子IL-17的表达和增加Foxp3表达。结论 绞股蓝总皂苷能改善NAFLD大鼠肝脏病变,其作用机制可能与调节肝脏Treg/Th17细胞平衡,减少促炎症因子和增加抗炎因子产生相关。
关键词:绞股蓝总皂苷;非酒精性脂肪肝;Treg/Th17细胞;炎症因子
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是指除酒精和其他明确的损肝因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征,是脂肪肝主要类型。NAFLD在我国患病率高达15%[1];全球范围的患病率高达12.9~46%[2]。NAFLD的发生发展是一个多因素作用的复杂过程,除涉及脂质过氧化、线粒体功能障碍、炎性反应因子失平衡、天然免疫等外,NAFLD发病过程还存在免疫功能失衡,表现为调节性T细胞(Treg)和辅助性T细胞17(Th17)数目和功能的异常[3-4]。
绞股蓝总皂苷是绞股蓝(Gynostemma pentaphyllum)主要有效成分群,含有80余种达玛烷型四环三萜类人参皂苷类成分。绞股蓝总皂苷具有降脂保肝、降血糖、降血压、增强免疫力等药理作用[5-6]。研究发现,绞股蓝总皂苷能够调节机体T淋巴细胞亚群失调[7];抑制NAFLD肝病大鼠肝脏脂肪变[8]。然而绞股蓝总皂苷是否可通过免疫调节防治NAFLD及具体机制并不清楚。本实验采用高脂饲料诱导NAFLD大鼠模型,探讨绞股蓝总皂苷通过影响Treg/Th17细胞免疫功能,并从调节促/抗炎因子平衡途径研究其防治 NAFLD的作用机制。
48只清洁级SD大鼠,♂,体质量180~220 g,许可证号SCXK(浙)20080033,由浙江省医学科学院动物中心提供。高脂饲料含普通饲料 75%、猪油12%、胆固醇2%、胆盐1%、蛋黄粉10%,购于南通特洛菲饲料科技有限公司,批号为TP28708U。
绞股蓝总皂苷(南京泽朗医药科技有限公司,批号:ZL20160321RJ,含量:80%)。多烯磷脂酰胆碱胶囊(赛诺菲,批号:4JD036,规格:每粒228 mg)。
CD4-FITC(货号:11-0040-81)、CD25-PE(货号:12-0390-80)及 IL-17-PE(货号:12-7177-81)流式试剂均购于eBioscience公司。白细胞介素10(IL-10,批号:20161030)、白细胞介素 17(IL-17,批号:20161015)及 肿 瘤 坏 死 因 子 -α(TNF-α , 批 号 :20160928)酶联免疫试剂盒购于上海恒远生物科技有限公司。IL-17(抗兔,货号:ab91649)和 Foxp3(抗小鼠,货号:ab22510)购于abcam科技有限公司。丙氨酸氨基转移酶(ALT,批号:16092401)、天冬氨酸氨基转移酶(AST,批号:16092401)试剂盒均购于宁波美康生物科技股份有限公司。苏木素-伊红染液(H&E,南京建成科技有限公司,批号:20160806)。
Powerwave340酶标仪(美国Bio-TEK公司);自动脱水机(SAKURA Tissue-Tek VIP 5Jr);贝克曼流式细胞仪 FC500((美国 BeckmanCoulter公司);全自动血生化仪(日本东芝);ZEISS荧光倒置显微镜(德国Carl Zeiss公司)。
48只大鼠随机分为正常对照组、模型对照组、多烯磷脂酰胆碱胶囊组(阳性对照组,150 mg·kg-1),绞股蓝总皂苷高、中、低(240,120,60 mg·kg-1)剂量组,每组 8只。除正常对照组外,其余组给予高脂饲料连续喂养10周制备NAFLD大鼠模型。模型成功后,连续给药8周,此时边造模边给药;正常对照组及模型对照组给予相应体积的蒸馏水,灌胃容积10 mL·kg-1,每天1次。实验期间每周称量大鼠体质量,并观察大鼠一般体征。
给药期间,分别于给药第 0,4,8周进行眼眶取血,37 ℃水浴 2 h,3 500 r·min-1离心 10 min,分离血清,采用全自动血生化仪检测血清肝功能AST、ALT水平。末次给药后,禁食不禁水12 h,10%水合氯醛麻醉大鼠,腹主动脉取血,解剖大鼠取肝脏,生理盐水洗净,称量脏器湿重。计算肝脏系数:肝脏系数(%)=肝湿重/禁食后体质量×100%。取肝左叶相同部分适量放到4%中性福尔马林中固定,再经脱水、石蜡包埋、切片(4 μm)、展片、切片粘附、烤片等,采用HE染色,观察肝组织病理学改变。
肝脏病变评分:参考2010年版《非酒精脂肪肝病诊断指南》(修订版)中《美国国立卫生研究院非酒精性脂肪肝肝炎(NASH)临床研究网病理工作组指南》进行评分:①肝细胞气球样变(细胞肿大,胞浆残留少许),评分为 0~2分三个等级:无,0分;少见,1分;多见,2分。②肝细胞脂肪变(肝细胞胞浆内出现界限清晰的脂滴空泡),评分为0~3分 3个等级:<5%,0分;5%~33%,1分;34%~66%,2分;>66%,3分。③炎症病变(炎症细胞聚集),评分为0~3分四个等级:无,0分;l~2个病灶,1分;3~4个病灶,2分;>4个病灶或桥接(弥散性)或融合性坏死,3分。其中①~③三项病理改变的积分和为0~8分,≥5分时判定为肝炎。
肝脏称量后,取肝左叶0.5 g制备10%生理盐水肝组织匀浆。采用酶联免疫法测定肝匀浆TNF-α、IL-17及IL-10水平。
制备好的石蜡切片,用于免疫组化实验。切片经二甲苯脱蜡-乙醇复水-枸橼酸钠缓冲液煮沸抗原修复-3%双氧水抗原阻断-正常山羊血清封闭1 h,4 ℃对应一抗孵育过夜(Foxp3和IL-17一抗或PBS代替一抗做阴性对照)-次日复温30 min-二抗37 ℃孵育-DAB显色-苏木素染核-1%的盐酸酒精溶液分化-氨水返蓝-乙醇脱水-二甲苯透明-中性树胶封片。风干后在显微镜下观察 Foxp3、IL-17蛋白表达,黄色至棕褐色表示阳性表达。用Image Pro Plus 5.1软件计算平均光密度值。
1 mL抗凝腹主动脉全血进行外周淋巴细胞Treg/Th17含量检测,Th17细胞抗体标记为FITC-抗CD4和 PE-抗IL-17,CD4+IL-17+为Th17含量;Treg细胞抗体标记为FITC-抗CD4及PE-抗CD25,CD4+CD25+Treg细胞为Treg含量,按参考试剂说明书步骤处理完成后,上流式细胞仪进行检测。
计量资料数据结果均采用 表示,组间差异比较采用单因素方差分析,方差齐性采用 LSD检验;方差不齐采用Dunnett T3检验,P<0.05有统计学意义。
表示,组间差异比较采用单因素方差分析,方差齐性采用 LSD检验;方差不齐采用Dunnett T3检验,P<0.05有统计学意义。
给药8周(造模18周后),与模型对照组相比,绞股蓝总皂苷各剂量对大鼠体质量无明显影响;绞股蓝总皂苷高、中、低(240,120,60 mg·kg-1)剂量均能显著降低大鼠肝脏系数(P<0.01)。结果见表1。
高脂饲料造模 10周后(给药前),与正常对照组相比,所有造模大鼠血清AST及ALT显著升高(P<0.01)。给药4周,与正常对照组相比,模型大鼠血清ALT和AST显著升高(P<0.05);与模型对照组相比,绞股蓝总皂苷高剂量(240 mg·kg-1)显著降低大鼠血清 ALT、AST(P<0.01),中剂量(120 mg·kg-1)显著降低大鼠血清 AST(P<0.05);给药 8周,绞股蓝总皂苷高、中、低(240,120,60 mg·kg-1)剂量均能显著降低大鼠血清 ALT、AST(P<0.05或0.01)。结果见图1。
表 1 绞股蓝总皂苷对 NAFLD大鼠体质量和肝脏系数的影响(n=8,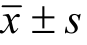 )
)
Tab. 1 Effect of stevenleaf on body weight and liver coefficient in NAFLD rats(n=8, )
)
注:与正常对照组比较,1)P<0.01;与模型对照组比较,2)P<0.01。
Note: Compared with normal control group,1)P<0.01; compared with model group,2)P<0.01.
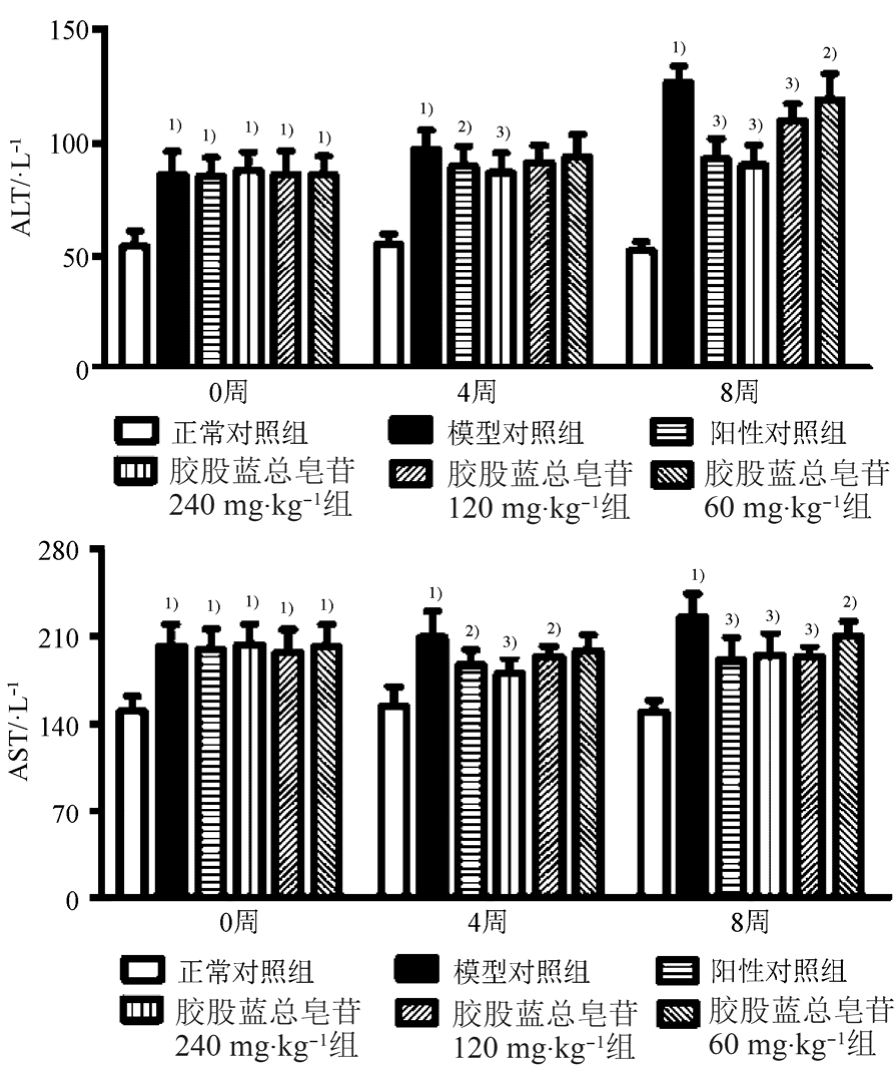
图1 绞股蓝总皂苷对NAFLD大鼠血清AST、ALT的影响(n=8, )与正常对照组比较,1)P<0.01;与模型对照组比较,2)P<0.05,3)P<0.01。
)与正常对照组比较,1)P<0.01;与模型对照组比较,2)P<0.05,3)P<0.01。
Fig. 1 Effect of stevenleaf on AST, ALT in serum of NAFLD rats(n=8, )Compared with normal control group,1)P<0.01; compared with model group,2)P<0.05,3)P<0.01.
)Compared with normal control group,1)P<0.01; compared with model group,2)P<0.05,3)P<0.01.
正常对照组肝细胞以中央静脉为中心向周围呈放射状排列,肝细胞核大而圆,位于细胞中央,肝细胞未见浊肿、脂肪变或坏死。与正常对照组相比,模型对照大鼠肝小叶消失,肝组织严重脂肪变,表现为大部分肝细胞空泡脂滴及小部分肝细胞的气球样变,并可见大量的炎性灶。与模型对照组相比,连续给药 8周,绞股蓝总皂苷高、中、低(240,120,60 mg·kg-1)剂量能减少肝细胞脂肪变及炎症细胞浸润,其肝脏病变程度明显减轻。结果见图2。
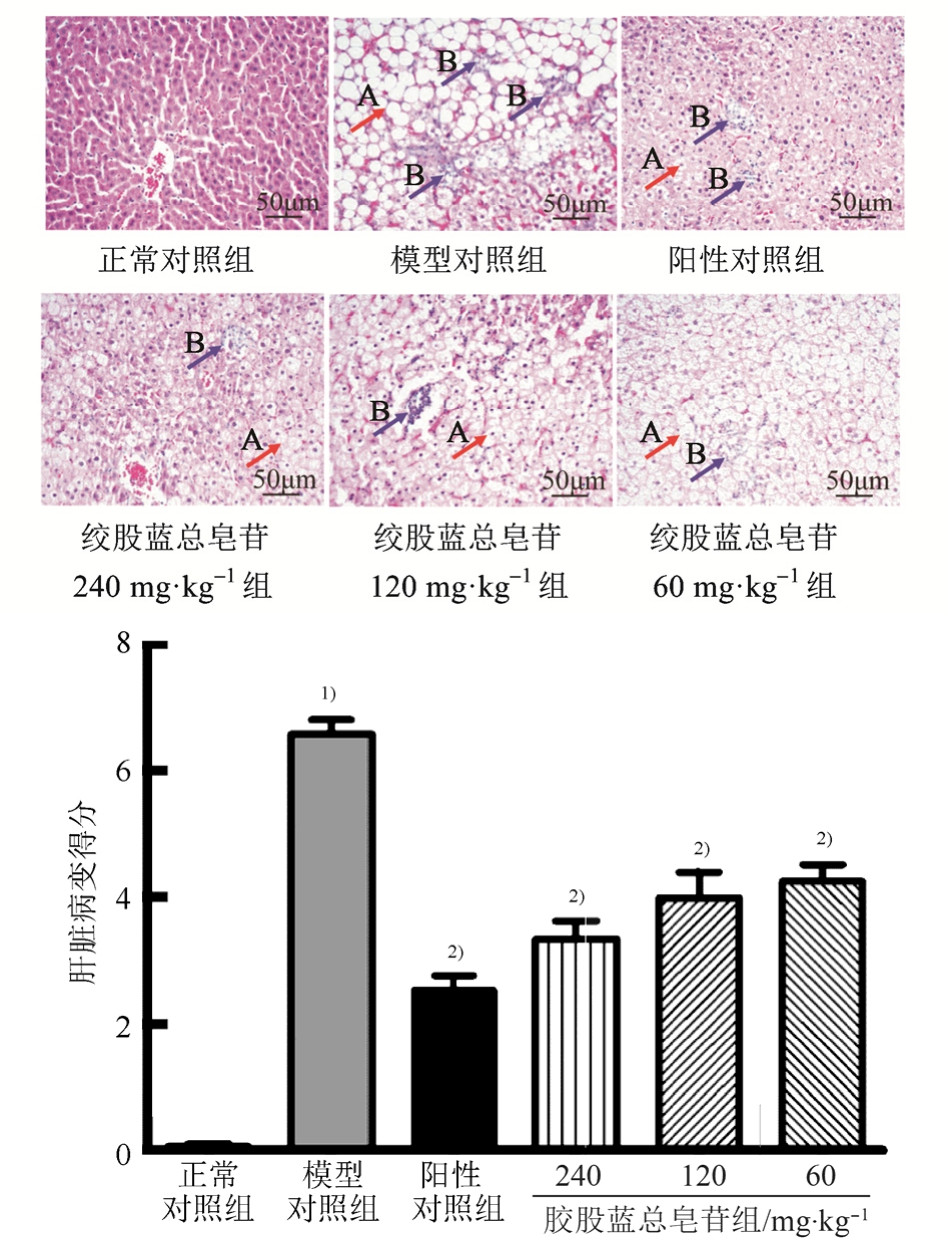
图 2 绞股蓝总皂苷对 NAFLD大鼠肝组织病变的影响(HE,200×)箭头 A表示代表性肝组织脂肪变或气球样变;箭头 B代表炎性灶;与正常对照组比较,1)P<0.01;与模型对照组比较,2)P<0.01。
Fig. 2 Effect of stevenleaf on pathological changes of hepatic tissues(HE, 200×)Arrow A meaned liver tissue damaged; arrow B meaned focal inflammation; compared with normal control group,1)P<0.01; compared with model group,2)P<0.01.
与正常对照组相比,模型对照组的肝组织炎症指标 IL-17、TNF-α、IL-10 水平显著升高(P<0.01);连续给药 8周,与模型对照组相比,绞股蓝总皂苷高剂量(240 mg·kg-1)显著降低肝组织中IL-17、TNF-α,升高IL-10水平(P<0.05或0.01);中剂量(120 mg·kg-1)降低肝组织中TNF-α水平;各剂量均能显著降低IL-17水平(P<0.05)。结果见表2。
表2 绞股蓝总皂苷对NAFLD大鼠Treg/Th17相关肝组织炎症指标的影响(n=8,x±s)
Tab. 2 Effect of stevenleaf on Treg/Th17-related inflammation markers in liver tissue of NAFLD rats(n=8,
x±s)

注:与正常对照组比较,1)P<0.01;与模型对照组比较,2)P<0.05,3)P<0.01。
Note: Compared with normal control group,1)P<0.01; compared with model group,2)P<0.05,3)P<0.01.
与正常对照组相比,模型组的大鼠肝组织细胞质IL-17阳性表达显著增多,Foxp3细胞核阳性表达显著减少;给药 8周,与模型对照组相比,绞股蓝总皂苷高剂量(240 mg·kg-1)能显著减少炎症因子IL-17的表达和增加核Foxp3表达。IL-17主要在细胞质表达;Foxp3主要在细胞核表达。结果见图3,箭头所指为代表性阳性表达。

图 3 免疫组化法观察绞股蓝总皂苷对 NAFLD大鼠肝组织Foxp3和IL-17 蛋白表达的影响(400×)与正常对照组比较,1)P<0.01;与模型对照组比较,2)P<0.05,3)P<0.01。
Fig. 3 Effect of stevenleaf on Foxp3 and IL-17 expression in liver tissue of NAFLD rats by immunohistochemistry Compared with normal control group,1)P<0.01; compared with model group,2)P<0.05,3)P<0.01.
与正常对照组相比,模型组外周血淋巴细胞IL-17含量显著升高(p<0.01),CD4+CD25+Treg含量显著降低(p<0.05);连续给药8周,与模型对照组相比,绞股蓝总皂苷高剂量(240 mg·kg-1)显著降低淋巴细胞IL-17含量,并升高CD4+CD25+Treg含量(p<0.05)。结果见图4。
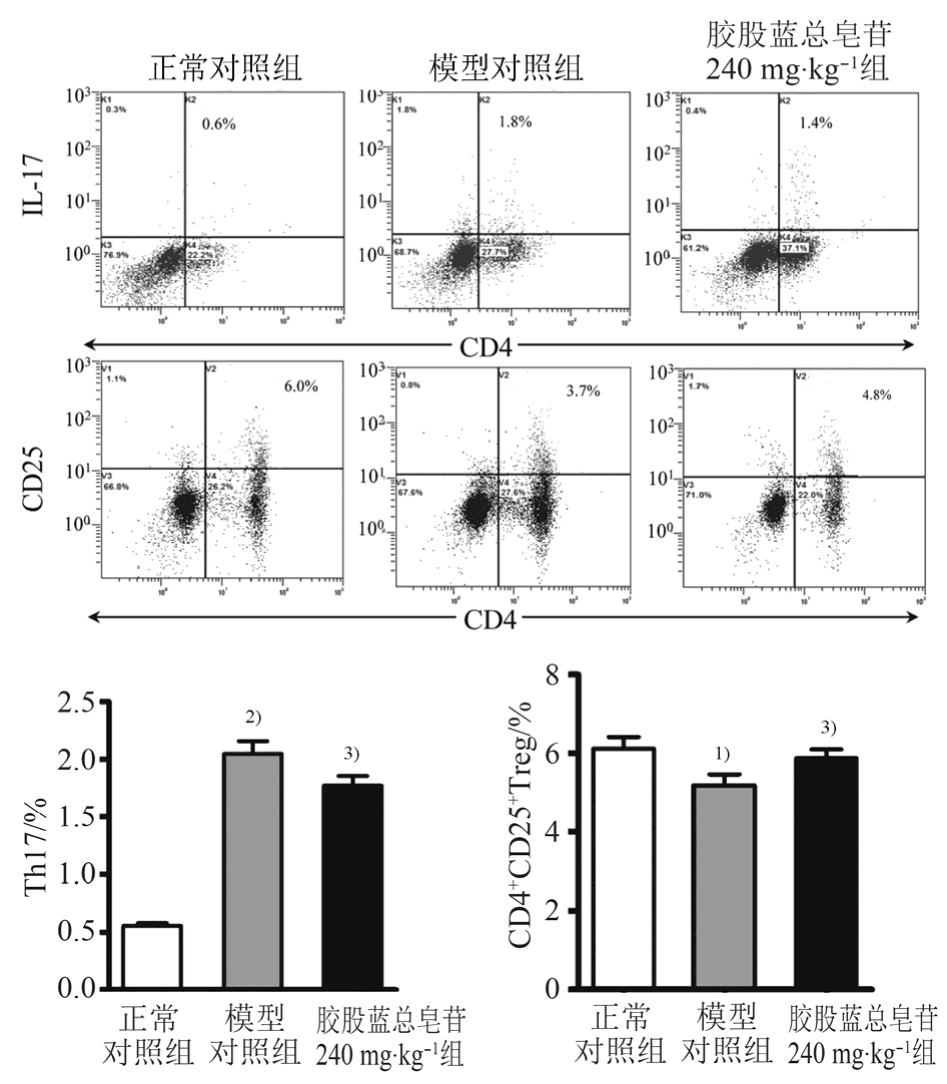
图 4 绞股蓝总皂苷对 NAFLD大鼠的外周血淋巴细胞Treg及Th17细胞的影响与正常对照组比较,1)p<0.05,2)p<0.01;与模型对照组比较,3)p<0.05。
Fig. 4 Effect of stevenleaf on Foxp3 and IL-17 in blood of NAFLD rats Compared with normal control group,1)p<0.05,2)p<0.01; compared with model group,3)p<0.05.
NAFLD主要是由于甘油三酯(脂肪变性)在肝脏过度堆积造成的肝脏疾病,已成为全球性重大公共健康问题。随着肝脏代谢紊乱、肝脏脂肪变性加剧,NAFLD可发展成肝纤维化、肝硬化、肝癌等。2010年《中国非酒精性脂肪肝诊治指南修订版》推荐治疗NAFLD的药物包括多烯磷脂酰胆碱、水飞蓟素、维生素E、甘草酸制剂、双环醇等。其中多烯磷脂酰胆碱胶囊可通过促进肝细胞膜的再生和稳定,减少肝脏脂质沉积,抑制脂质过氧化,抑制胶原合成等,对中毒性肝损伤和脂肪肝有较好的疗效,是临床保肝药的首选。研究表明多烯磷脂酰胆碱胶囊还可通过调节 NAFLD小鼠模型Treg/Th17细胞和相关的分泌因子平衡,抑制小鼠模型炎症反应,防止脂肪肝的发生发展[9]。因此本实验选择多烯磷脂酰胆碱胶囊为阳性药,研究绞股蓝总皂苷对NAFLD大鼠Treg/Th17免疫功能的影响。
NAFLD发病机制广泛认可的是肝脏“二次打击”学说,胰岛素抵抗先造成肝脏第一次打击,氧化应激、免疫系统激活以炎症细胞因子等产生第二次打击[10]。越来越多研究表明NAFLD存在免疫微环境的改变,并与免疫功能及炎症细胞因子失衡密切相关[9,11]。Treg细胞和 Th17细胞属于CD4+淋巴细胞亚群。Th17细胞主要分泌或诱导IL-17、IL-6与TNF-α等促炎因子[12],介导炎症反应,促进肝炎的发生发展。Treg细胞是一类具有较强免疫抑制效应的T细胞亚群,主要分泌IL-10、IL-4和TGF-β1等因子,可抑制肝脏的免疫炎症过度损伤;叉头状转录因子3 (Foxp3)是Treg细胞特异性转录活化因子[13]。研究表明脂肪肝小鼠TNF-α、IL-6及IL-17等表达显著升高,Foxp3表达降低,Th17/Treg免疫调节失衡[9]。
本实验通过连续喂食高脂饲料 10~18周,成功复制NAFLD,表现为肝损伤特异性标记物血清ALT和AST的显著升高和肝脏严重的脂肪及炎症变。采用流式细胞技术检测模型大鼠的外周血Treg/Th17细胞的酶联免疫法检测肝组织Treg/Th17相关炎症因子IL-17、IL-10和TNF-α,并结合免疫组化检测肝组织 IL-17和 Foxp3的表达。结果显示,Th17细胞、IL-17和TNF-α水平显著升高,Treg细胞和Foxp3水平显著减少,与已有报道一致。
已有研究表明,绞股蓝总皂苷能显著降低脂肪肝大鼠TNF-α和NF-κB含量,减轻肝脏炎症[14-15];表明绞股蓝总皂苷可能调节Th17免疫功能发挥抗肝炎作用。Treg细胞与Th17细胞在机体相互拮抗,维持机体免疫炎症平衡;目前,绞股蓝总皂苷对Treg、Th17细胞功能的影响研究鲜见报道。本实验结果显示,绞股蓝总皂苷能显著降低肝组织IL-17表达,增加Foxp3表达;减少Th17细胞相关炎症因子IL-17和TNF-α产生;增加Treg相关细胞因子IL-10含量;说明绞股蓝总皂苷能够调节Treg/Th17免疫功能失调,防止NAFLD大鼠肝脏病变的发生发展。
综上所述,绞股蓝总皂苷能有效防治NAFLD,其作用机制可能与调节肝脏Treg/Th17细胞平衡,减少促炎因子和增加抗炎因子产生,从而减少肝脏炎性反应,保护肝组织,值得进一步的研究开发。
[1] FAN J G. Epidemiology of alcoholic and nonalcoholic fatty liver disease in China [J]. J Gastroenterol Hepatol, 2013,28(Suppl 1): 11-17.
[2] TOSHIKUNI N, TSUTSUMI M, ARISAWA T. Clinical differences between alcoholic liver disease and nonalcoholic fatty liver disease [J]. World J Gastroenterol, 2014, 20(26):8393-8406.
[3] CAI X H, ZHU W H, LI W P. Effects of rapamycin on balance of regulatory T lymphocyte/T help cell 17 in nonalcoholic fatty liver of rats [J]. Chin J Clin Pharmacol(中国临床药理学杂志), 2017, 33(1): 36-39.
[4] RAU M, SCHILLING A K, MEERTENS J, et al. Progression from nonalcoholic fatty liver to nonalcoholic steatohepatitis is marked by a higher frequency of Th17 cells in the liver and an increased Th17/resting regulatory T cell ratio in peripheral blood and in the liver [J]. J Immunol, 2015, 196(1): 97-105.
[5] SHU B, LIU Z J, QIAN M Z. Effects of gypenosiedes on vascular smooth muscle cells phenotype in hyperlipidemic rats[J]. Nat Prod Res Dev(天然产物研究与开发), 2017 29(2):217-223.
[6] LI J Y, LI X F. Orthogonal test for optimization of extraction process of Gynostemma Pentaphylla soft gel [J]. Phram Today(今日药学), 2014, 24(2): 123-125.
[7] JIA D, ZHAO J T. Effects of gypenosides on immune function of heat-stressed broilers [J]. J Shanxi Agric Univ(山西农业大学学报), 2007, 27(5): 12-14.
[8] ZHANG X, LEI F F, LI F, et al. Effect of the degrees of fatty liver disease in rats with type 2 diabetes mellitus and nonalcoholic fatty liver disease was treated by gypenosides and ginkgo biloba extract mixture [J]. Chin J Liver Dis(中国肝脏病杂志), 2015, 7(1): 55-58.
[9] HE B H, WU L Y, XIE W, et al. The imbalance of Th17/Treg cells is involved in the progression of nonalcoholic fatty liver disease in mice [J]. BMC Immunol, 2017, 18(33): 1-9.
[10] LIU L B, ZHANG M G, FANG Q M, et al. Changes of GLP-1 and GIP in patients with non-alcoholic fatty liver disease after oral glucose [J]. Chin J Mod Appl Pharm(中国现代应用药学),2016, 33(3): 368-371.
[11] GUO W, GAO M S, LI W, et al. Effects of metformin combined with enteric bifid-triple viable capsule on nonalcoholic fatty liver disease [J]. Chin J New Durgs(中国新药杂志), 2016, 25(4): 439-442.
[12] XU J P, HE F, YANG M H, et al. Intervention effect of Shaoyao Gancao decoction on the imbalance of Treg/Th17 and their related cytokine in rats with asthma [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(1): 19-23.
[13] HOU X, SONG J, SU J, et al. CD4(+)Foxp3(+) Tregs protect against innate immune cell-mediated fulminant hepatitis in mice [J]. Mol Immunol, 2015, 63(2): 420-7.
[14] PAN Y X, WAN Y T, ZHANG H, et al. Protection of gypencsides and relationship with TNF-α in alcoholic fatty liver of rats [J]. J Public Health Prev Med(公共卫生与预防医学), 2013, 24(4): 25-29.
[15] CHENG D W. Protective effects of gynostemma total glucoside on alcoholic fatty liver in rat [J]. J Hubei Univ Nat(湖北民族学院学报), 2015, 32(1): 8-11.
Beneficial Effect of Stevenleaf on the Imbalance Between Th17 and Treg in Nonalcoholic Fatty Liver Disease Model Rats
RUAN Dan, LEI Jing
(The Third People’s Hospital of Hangzhou, Hangzhou 310000, China)
ABSTRACT:OBJECTIVE To study the effect of stevenleaf on improving non-alcoholic fatty liver disease in rat model and clarify mechanism from the point of immune-regulation. METHODS Forty-eight of rats were divided into six groups: normal group, model group, Essentiale (150 mg·kg-1), high-dose (240 mg·kg-1), moderate-dose (120 mg·kg-1) and low-dose of stevenleaf (60 mg·kg-1) groups. Rats were given high fat food for continuous 10 weeks, then given correspond drugs for 8 weeks.The levels of serum AST and ALT were measured at 0, 4 and 8 weeks experimental session. The rats were anesthetized after administration 8 weeks. The peripheral blood lymphocytes and serum were separated to measure the contents of Th17 and Treg cells in peripheral blood by flow cytometry and the levels of IL-17, IL-10 and TNF-α in serum by enzyme-linked immunosorbent assay (ELISA). HE staining was used to observe the pathological changes of liver tissue and immunohistochemistry to observe the positive expression of IL-17 and Foxp3 in liver tissue. RESULTS The 240 mg·kg-1of stevenleaf could reduce levels of serum ALT and AST after administration for 4 weeks (p<0.01). stevenleaf 240 mg·kg-1, 120 mg·kg-1and 60 mg·kg-1could reduce levels of serum ALT and AST after administration for 8 weeks (p<0.05, 0.01). Stevenleaf 240 mg·kg-1and 120 mg·kg-1could improve liver damage and reduce the level of TNF-α (p<0.05). Stevenleaf 240 mg·kg-1could reduce the content of IL-17 and increase IL-10 in serum (p<0.05, 0.01), reduce content of Th17 cell (CD4+IL-17+) and increase CD4+CD25+Treg in peripheral blood lymphocytes (p<0.05), also significantly reduced the expression of inflammatory factor IL-17 and increased Foxp3 expression. CONCLUSION Stevenleaf could protect liver tissue damages, its mechanism may be related to regulating Treg/Th17 cell balance, reducing pro-inflammatory factors and increasing anti-inflammatory factors.
KEY WORDS:stevenleaf; nonalcoholic fatty liver; Treg/Th17 cells; inflammatory factors
REFERENCES
中图分类号:R965.2
文献标志码:B
文章编号:1007-7693(2017)12-1683-06
DOI:10.13748/j.cnki.issn1007-7693.2017.12.009
引用本文:阮丹, 雷婧. 绞股蓝总皂苷对非酒精性脂肪肝大鼠 Treg/Th17免疫功能的影响[J]. 中国现代应用药学, 2017,34(12): 1683-1688.
基金项目:浙江省中西医结合学会科研项目(2014LYZD001)
作者简介:阮丹,女,硕士 Tel: 15088660981 E-mail: 328287055@qq.com
收稿日期:2017-05-10
(本文责编:蔡珊珊)