
图1 银杏外种皮中5种银杏酸化合物结构式
Fig. 1 Chemical structures of five major ginkgolic acids in external seed coat ofGinkgo biloba
李力,李贺,黄越,王国付,韩奇,刘炜*
(浙江医院药剂科,浙江省老年医学重点实验室,杭州 310013)
摘要:目的 建立LC-MS/MS同时测定大鼠血浆中5种银杏酸的浓度,并进行药动学研究。方法 大鼠血浆样品用乙酸乙酯萃取后,以水杨酸为内标,选用ZORBAX Eclipse XDB C18(2.1 mm×100 mm,3.5 μm)色谱柱,以乙腈-水(均含0.1%甲酸)为流动相梯度洗脱,梯度流速恒定为0.25 mL·min-1,柱温为30 ℃,进样量为10 μL,总分析时间为5.0 min,采用电喷雾离子化源,负离子方式,多反应监测(MRM)扫描方式进行监测。结果 血浆中 5种银杏酸浓度线性范围为 2.0~1 000 μg·L-1(r>0.99),定量下限为 2.0 μg·L-1;质控样品准确度为 92.8%~108.5%;日内、日间 RSD 均<15%;提取回收率为73.3%~86.2%。结论 该方法快速、灵敏、准确,专属性强,重复性好,适用于同时测定大鼠血浆中5种银杏酸浓度。
关键词:银杏酸;液相色谱串联质谱法;血药浓度;药动学
银杏酸是银杏中重要的生物活性化学成分之一,存在于银杏叶、果和外种皮中,以外种皮中的含量最高[1]。银杏酸是一类水杨酸衍生物,苯环 6位上的侧链碳原子数为 13~19个,侧链双键数为 0~3个,银杏酸各单体成分含量分别为 GA1(13∶0),3%;GA2(15∶1),47%;GA3(17∶2),3%;GA4(15∶0),3%;GA5(17∶1),43%[2-3],结构式见图1。研究表明银杏酸具有广泛的生物活性,如抗氧化、抗肿瘤、抑菌等[4-5]。已有HPLC、GC和液相色谱串联质谱法(LC-MS/MS)测定血浆中银杏酸的方法报道[6-8],但尚未有文献报道同时检测血浆中5种银杏酸浓度的方法,本实验建立了LC-MS/MS同时测定5种银杏酸浓度,并进行了大鼠灌胃银杏总酸提取物后的药动学研究,为银杏酸后续开发利用奠定了基础。

图1 银杏外种皮中5种银杏酸化合物结构式
Fig. 1 Chemical structures of five major ginkgolic acids in external seed coat ofGinkgo biloba
API4000+型三重四极杆质谱仪(美国 Applied Biosystems公司);Agilent 1260液相系统(美国安捷伦科技有限公司,包括G1312B型四元输液泵,G1329A型自动进样器,G1316A型柱温箱和G1379A型脱气机);Eppendorf centrifuge 5415R低温离心机(德国 Eppendorf);氮吹仪(美国 Jnc.公司);AL104型电子天平(瑞士梅特勒-托利多)。
甲醇、乙腈、甲酸(色谱纯,Merk公司);乙酸乙酯(分析纯,国药集团化学试剂有限公司);银杏酸(GA1,GA2,GA3,GA4,GA5,纯度均>98.0%)和银杏总酸提取物由浙江大学药学院提供;水杨酸(中国药品生物制品检定研究院,纯度>99.0%)。
Sprague-Dawley大鼠,♂,体质量为220~250 g,来自浙江省医学科学研究院实验动物中心,实验动物合格证号:SYXK(浙)2013-0184,购买后进行适应性饲养48 h。实验前禁食12 h,期间自由饮水。
色谱柱:ZORBAX Eclipse XDB C18(2.1 mm×100 mm,3.5 μm);流动相:乙腈-水(均含 0.1%甲酸)。梯度洗脱程序:0~1 min,40∶60,1~2 min,90∶10;2~4 min,95∶5;4~5 min,40∶60。流速:0.25 mL·min-1;柱温:30 ℃。
电喷雾电离源(ESI);正离子方式检测;雾化气482.7 kPa;气帘气206.9 kPa;碰撞气34.5 kPa;辅助气482.7 kPa;离子源电压为-5 500 V;温度为550 ℃;扫描方式为多反应监测(MRM),GA1、GA2、GA3、GA4、GA5和内标去簇电压(DP)分别为-42,-45,-48,-50,-50,-25 V(内标水杨酸);碰撞能量(CE)分别为-23,-20,-25,-20,-22,-15 V(内标水杨酸);用于定量分析的离子反应分别为m/z319.2→m/z275.1 (GA1)、m/z345.0→m/z 301.0(GA2)、m/z371.2→m/z 327.1(GA3)、m/z347.0→m/z 303.1(GA4)、m/z373.0→m/z 329.1(GA5)和m/z136.0→m/z92.0(内标水杨酸),扫描时间为200 ms。
取 GA1、GA2、GA3、GA4和 GA5约 10 mg,精密称定,分别置于10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,配成浓度为100 μg·mL-1的储备液。用甲醇依次稀释储备液,得到银杏酸浓度分别为 0.02,0.05,0.20,0.50,1.0,2.0,5.0,10.0 μg·mL-1的系列对照品溶液,于冰箱(4 ℃)内保存备用。
血浆样品在室温下解冻,吸取 100 μL至1.5 mL离心管中,加入0.8 μg·mL-1内标溶液5 μL,加乙酸乙酯 0.5 mL,涡流混合 2 min,往复振荡5 min,以8 000 r·min-1的转速离心10 min,分取上层有机相于另一试管中,于 40 ℃氮气流下吹干,残留物加入乙腈-水(90∶10,均含 0.1%甲酸)100 μL溶解,涡流混合,取 10 μL进行LC-MS/MS分析。
2.5.1 专属性试验 分别取 6份不同来源的空白血浆、标准血浆样品(加入内标溶液)按“2.4”项下方法处理,进样分析,结果显示,峰形良好,血浆中内源性物质不干扰银杏酸和内标的测定,结果见图2。
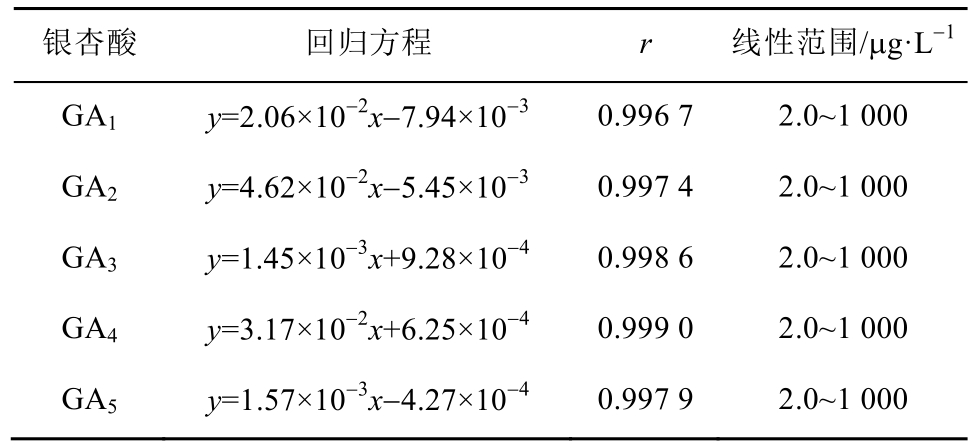
2.5.2 标准曲线和定量下限 分别加入银杏酸(GA1、GA2、GA3、GA4、GA5)系列对照品溶液各10 μL于1.5 mL EP管中,常温氮气挥干后,加入100 μL 血浆,制成相当于浓度为 2.0,5.0,20,50,100,200,500,1 000 μg·L-1模拟血浆样品,按“2.4”项下方法自加入内标溶液开始操作,每一浓度进行双样本分析,记录色谱图。以待测物浓度x(μg·L-1)为横坐标,待测物与内标物峰面积比值y为纵坐标,用加权(W=1/x2)最小二乘法进行回归运算。结果表明,5种银杏酸浓度在 2.0~1 000 μg·L-1内线性关系良好,定量下限均可达到2.0 μg·L-1,结果见表 1。
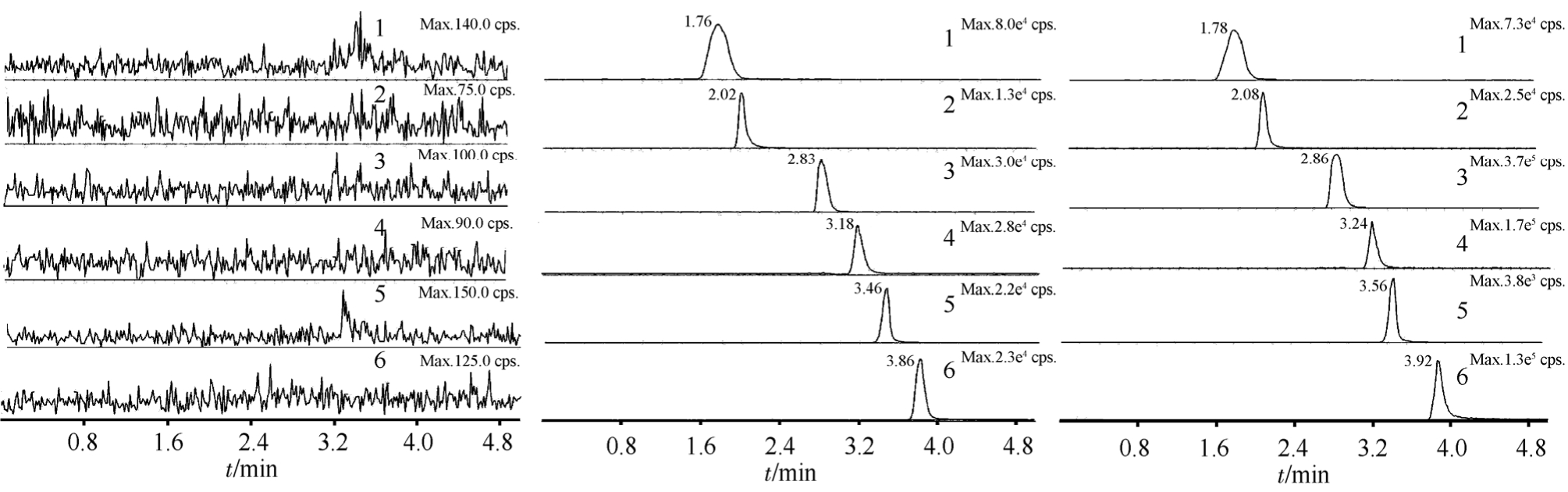
图2 血浆样品的典型LC-MS/MS色谱图
A-空白血浆;B-空白血浆+GA1、GA2、GA3、GA4、GA5(0.2 μg·mL-1) +IS(0.8 μg·mL-1);C-灌胃给予 20 mg·kg-1银杏总酸提取物 1 h 后;1-水杨酸(IS);2-GA1;3-GA2;4-GA3;5-GA4;6-GA5。
Fig. 2 Typical LC-MS/MS chromatograms in plasma
A-blank plasma; B-blank plasma spiked with GA1, GA2, GA3, GA4, GA5(0.2 μg·mL-1), and IS(0.8 μg·mL-1); C-plasma sample at 1 h after a single dose of 20 mg·kg-1; 1-Salicylic acid (IS); 2-GA1; 3-GA2; 4-GA3; 5-GA4; 6-GA5.
表1 5种银杏酸测定的标准曲线参数
Tab. 1 Calibration curves and linear ranges of five GAs in rat plasma
2.5.3 精密度和准确度 分别配制含 5种银杏酸的最低定量限、低、中、高(2.0,4.0,80,800 μg·L-1)4个浓度的质控(QC)血浆样本。按“2.4”项下方法处理样本,每一浓度进行 5样本分析,连续测定3 d。根据当日标准曲线计算质控血浆样本的测定浓度,根据QC样品结果计算本法的精密度和准确度。结果表明,日内、日间RSD均<15%,准确度为92.8%~108.5%,本试验所建立的LC-MS/MS测定 5种银杏酸的日内和日间精密度符合生物样品测定要求,结果见表2。
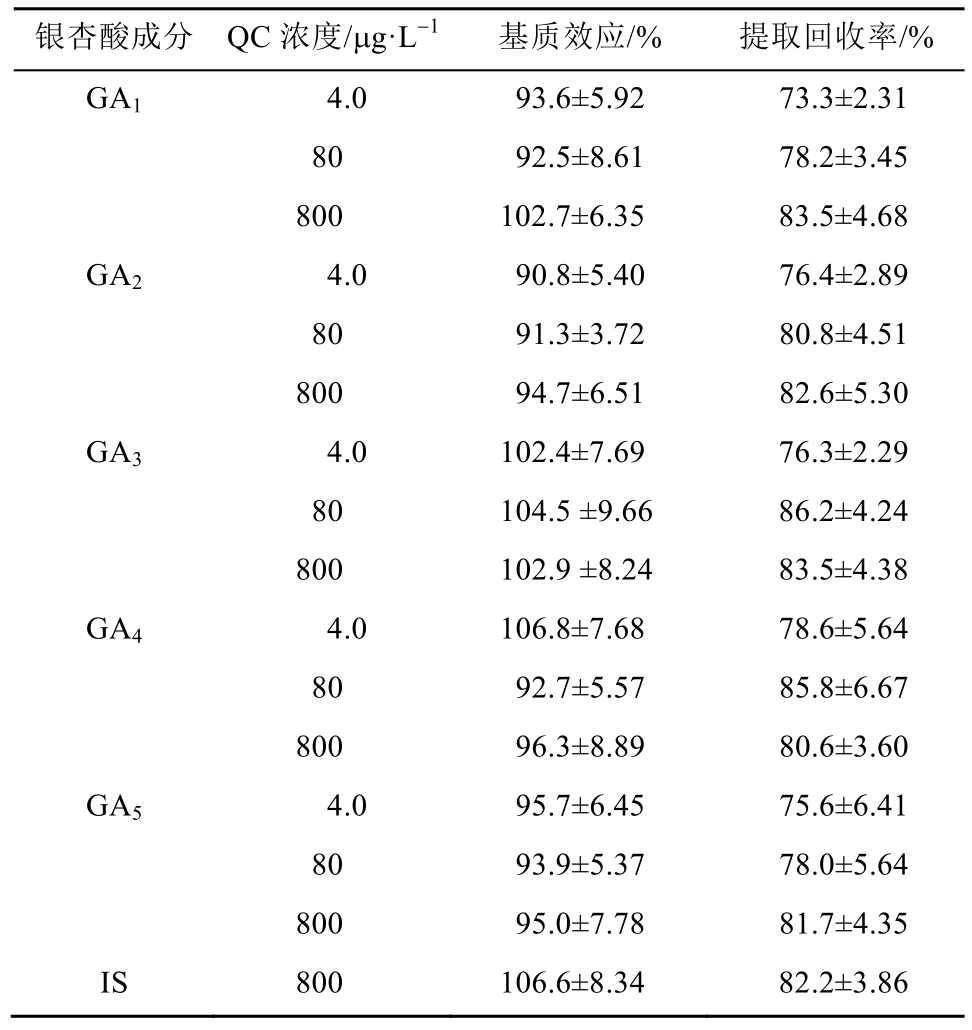
2.5.4 提取回收率和基质效应 分别配制含 5种银杏酸低、中、高(4.0,80,800 μg·L-1)3个浓度的质控血浆样本,按“2.4”项下方法操作,每个浓度平行5样本测定,得峰面积A;将大鼠空白血浆按“2.4”项下操作至氮气吹干后,加入银杏酸对照品溶液配制成浓度为4.0,80和800 μg·L-1的样品,进样得峰面积B,每个浓度平行5个样本测定;流动相中加入与低、中、高浓度相对应的对照品溶液,得到峰面积C,每个浓度平行5个样本测定。按上述3种方法得到内标峰面积分别为A1、B1和C1。计算公式:银杏酸的提取回收率=A/B×100%,基质效应=B/C×100%;内标提取回收率=A1/B1×100%,基质效应=B1/C1×100%。银杏酸的 QC样品和内标的提取回收率为 73.3%~86.2%,基质效应为 91.3%~106.8%,均符合生物样品测定要求,结果见表3。
表2 方法精密度和准确度测定结果
Tab. 2 Precision and accuracy for the determination of five GAs in rat plasma
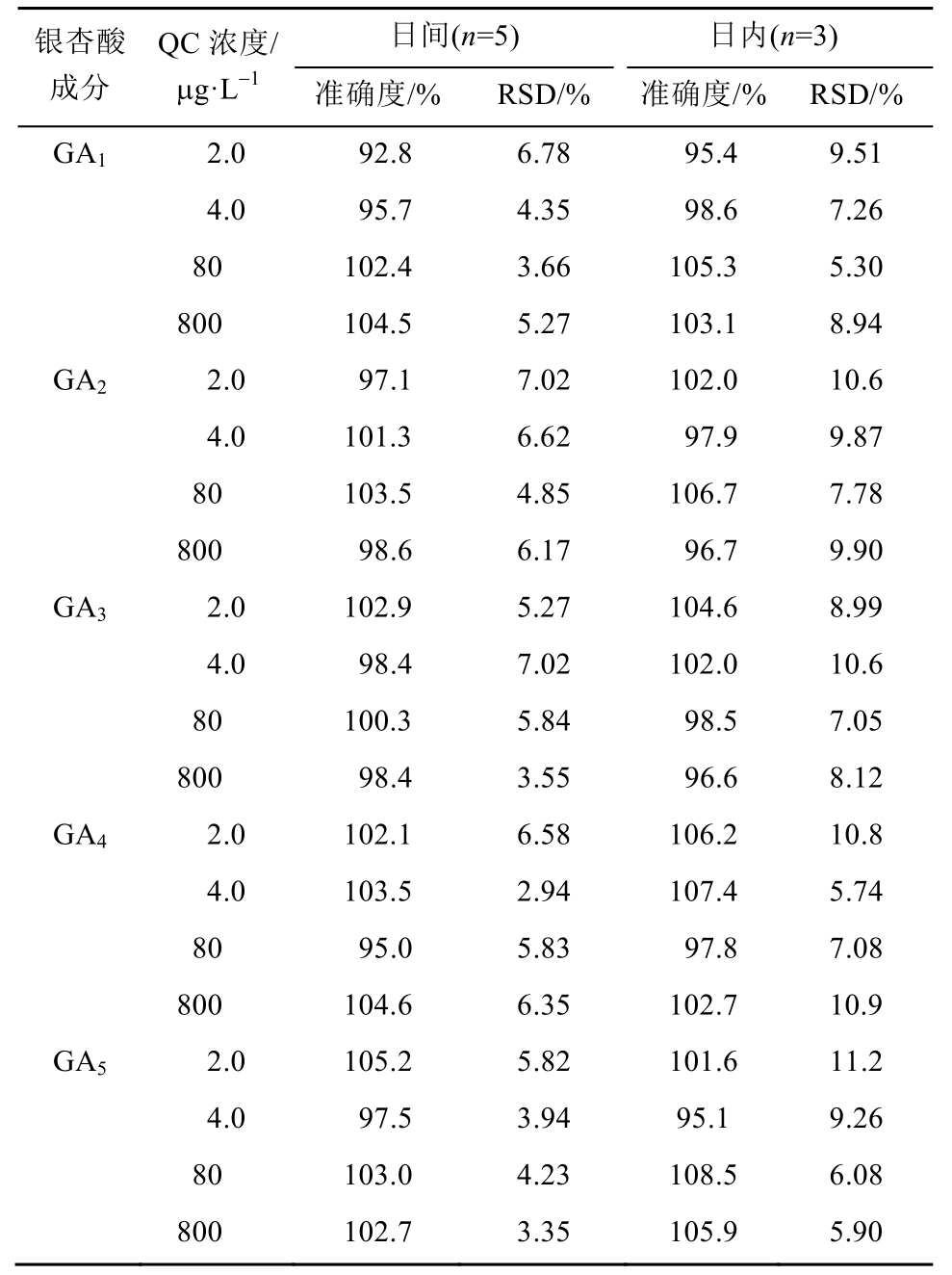
表3 基质效应和提取回收率测定结果(n=5,x±s)
Tab. 3 Matrix effect and extraction recovery for the assay of five GAs and IS in rat plasma(n=5,x±s)
2.5.5 稳定性考察 配制质量浓度为 4.0,80和800 μg·L-1的质控血浆样本,每个浓度平行配制5个样本,分别考察样品室温放置 12 h,处理后自动进样器(4 ℃)放置12 h,反复冻融3次,于-80 ℃环境中放置 30 d后的稳定性。在上述条件下,5种银杏酸的质控(QC)样品的准确度为 94.1%~106.5%,RSD为3.4%~10.1%,银杏酸在上述条件下稳定。
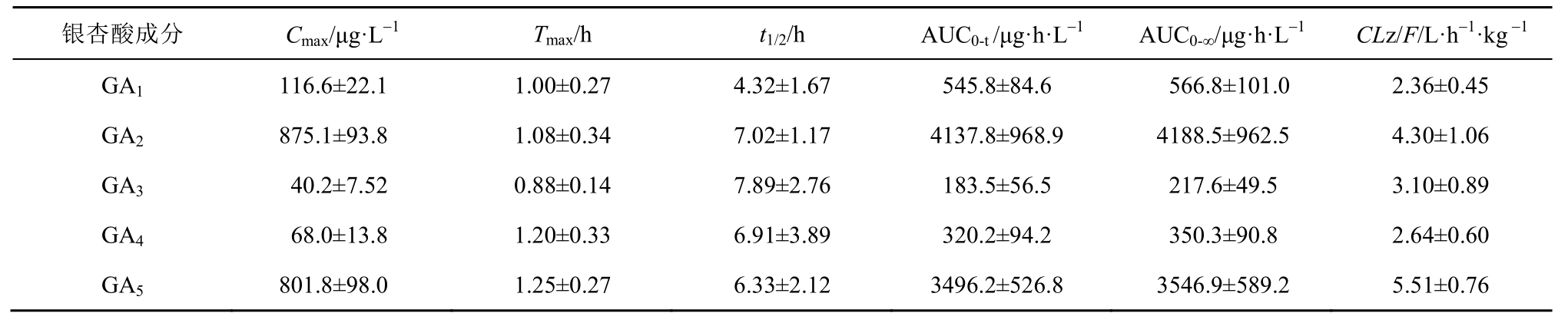
2.5.6 银杏酸大鼠体内药动学研究 取6只SD大鼠,给药前12 h禁食不禁水,按20 mg·kg-1剂量分别灌胃给予银杏总酸提取物,给药后0.25,0. 5,0.75,1,1.5,2,4,6,8,12,24 h 眼内眦取血至肝素化的EP管中。每次取血0.3 mL后,分离血浆于-80 ℃冰箱中保存待测。按“2.4”项下方法处理后进样,以随行标准曲线计算各时间点的血药浓度,绘制的药-时曲线见图3,用DAS 2. 0 程序进行曲线拟合,药动学参数见表4。
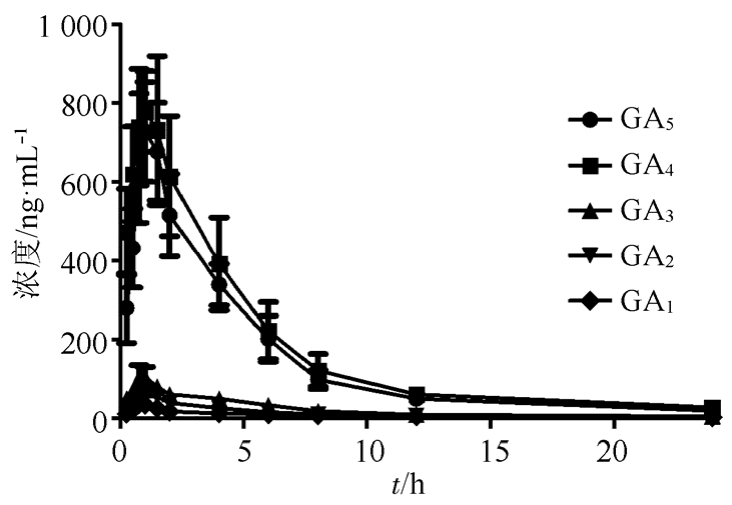
图3 大鼠灌胃银杏总酸提取物20 mg·kg-1后5种银杏酸平均血药浓度-时间曲线(n=6,x±s)
Fig. 3 The plasma concentration-time course five GAs in rats plasma after oral administration 20 mg·kg-1ginkgolic acid extract (n=6,x±s)
银杏酸是水杨酸类衍生物,选择水杨酸作为内标,其色谱保留行为、回收率以及质谱条件与待测物较为接近,且信号强、稳定性好。5种银杏酸结构中均存在羧基,发现准分子离子丢失一分子 CO2,可以生成响应稳定的碎片离子m/z[M-H-CO2]-,对流动相进行考察发现,加入0.1%的甲酸后,5种化合物和内标物质离子化完全,响应值提高。采用梯度洗脱的方法,化合物峰形较好,目标峰均出现在1 min以后,可以较好地避免血浆中内源性物质基质效应的干扰。
在考察提取条件时,发现简单的沉淀蛋白方法空白样品有一定的干扰。考虑采用液液萃取的方法分别对乙醚、二氯甲烷、乙酸乙酯及正己烷进行考察,结果表明乙酸乙酯提取效果最好。与文献报道相比[9-10],GA2和 GA5主要药动学参数Tmax和t1/2相似。本方法专属性强,灵敏度高,在5 min内可完成多个成分的定量分析,方法准确、灵敏,干扰少,能够满足分析要求,可用于银杏酸药动学研究。
表4 大鼠灌胃银杏总酸提取物20 mg·kg-1后5种银杏酸药动学参数(n=6,x±s)
Tab. 4 Pharmacokinetics parameters of five GAs in rats after administration 20 mg·kg-1ginkgolic acid extract(n=6,x±s)
[1] VAN BEEK T A. Chemical analysis of Ginkgo biloba leaves and extracts [J]. J Chromatogr A, 2002, 967(1): 21-55.
[2] HUANG Q W, ZHENG CY, ZHAO W L, et al. Revision of Ginkgo leaves extract and preparations in Chinese Pharmacopoeia (2015 Edition) [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(5): 615-618.
[3] JAGGY H, KOCH E. Chemistry and biology of alkylphenols from Ginkgo biloba L. [J]. Pharmazie, 1997, 52(10): 735-738.
[4] ZHOU C C, LI X Y, DU W, et al. Antitumor effects of ginkgolic acid in human cancer cell occur via cell cycle arrest and decrease the Bcl-2/Bax ratio to induce apoptosis [J].Chemotherapy, 2010, 56(5): 393-402.
[5] MANGO D, WEISZ F, NISTICÒ R. Ginkgolic acid protects against A β-Induced synaptic dysfunction in the hippocampus[J]. Frontiers in pharmacology, 2016(7): 401. Doi:10.3389/fphar.2016.00401.
[6] FUZZATI N, PACE R, VILLA F. A simple HPLC-UV method for the assay of ginkgolic acids in Ginkgo biloba extracts [J]. Fitoterapia, 2003, 74(3): 247-256.
[7] QIAN Y, ZHU Z, DUAN J, et al. Simultaneous quantification and semi-quantification of ginkgolic acids and their metabolites in rat plasma by UHPLC-LTQ-Orbitrap-MS and its application to pharmacokinetics study [J]. J Chromatogr B,2017(1041): 85-93.
[8] SCHÖTZ K. Quantification of allergenic urushiols in extracts of Ginkgo biloba leaves, in simple one-step extracts and refined manufactured material (EGb 761) [J]. Phytochem Anal,2004, 15(1): 1-8.
[9] LI L, GUO C, ZHOU H, et al. Pharmacokinetics, tissue distribution and excretion studies of ginkgolic acid (17∶1) in rats [J]. Lat Am J Pharm, 2014, 33(2): 278-287.
[10] XIA H, WANG X, LI L, et al. Development of high performance liquid chromatography/electrospray ionization mass spectrometry for assay of ginkgolic acid (15∶1) in rat plasma and its application to pharmacokinetics study [J]. J Chromatogr B, 2010, 878(28): 2701-2706.
Simultaneous Determination of Five Ginkgolic Acids in Rat Plasma by LC-MS/MS and the Application in Pharmacokinetics Study
LI Li, LI He, HUANG Yue, WANG Guofu, HAN Qi, LIU Wei*
(Department of Pharmacy, Zhejiang Hospital, Zhejiang Provincial Key Laboratory of Geriatrics, Hangzhou 310013, China)
ABSTRACT:OBJECTIVE To develop an LC-MS/MS method for simultaneous determination of five ginkgolic acids in rat plasma and applied to the pharmacokinetics study. METHODS The plasma samples were processed by ethyl acetate extraction,with salicylic acid as an internal standard. The separation was achieved on ZORBAX Eclipse XDB C18column (2.1 mm×100 mm,3.5 μm) and eluted with linear gradient using acetonitrile and water (both of containing 0.1% formic acid) at the flow rate of 0.25 mL·min-1, the injection volume was 10 μL and the column temperature was 30 ℃. The total time of the analysis was 5.0 min. Detection of the analytes were achieved using negative ion electrospray ionization (ESI) in the multiple reaction monitoring (MRM) mode. RESULTS The linear calibration curve of five ginkgolic acids obtained concentration range of 2.0-1 000 μg·L-1(r>0.99), with the lower limit of quantitation (LLOQ) of 2.0 μg·L-1. The accuracy of was between 92.8%-108.5%, Intra-day and inter-day relative standard deviations were both below 15%. The extraction recovery of low,middle and high concentrations was 73.3%-86.2%, respectively. CONCLUSION The established method is rapid, sensitive,accurate, specific and reliable, and suitable for simultaneous determination of five ginkgolic acids in rat plasma.
KEY WORDS:ginkgolic acids; LC-MS/MS; plasma drug concentration; pharmacokinetics
REFERENCES
中图分类号:R917.101
文献标志码:B
文章编号:1007-7693(2017)12-1658-05
DOI:10.13748/j.cnki.issn1007-7693.2017.12.003
引用本文:李力, 李贺, 黄越, 等. LC-MS/MS同时测定大鼠血浆中5种银杏酸浓度及其药动学研究[J]. 中国现代应用药学,2017, 34(12): 1658-1662.
基金项目:“重大新药创制”国家科技重大专项(2013ZX09303005);浙江省自然科学基金(LQ15H310003,LY15H050005)
作者简介:李力,男,博士,副主任药师 Tel: (0571)81595229 E-mail: ronaldoli2001@163.com*
通信作者:刘炜,女,主任药师 Tel:(0571)81595179 E-mail: zjyylw@163.com
收稿日期:2017-05-04
(本文责编:蔡珊珊)