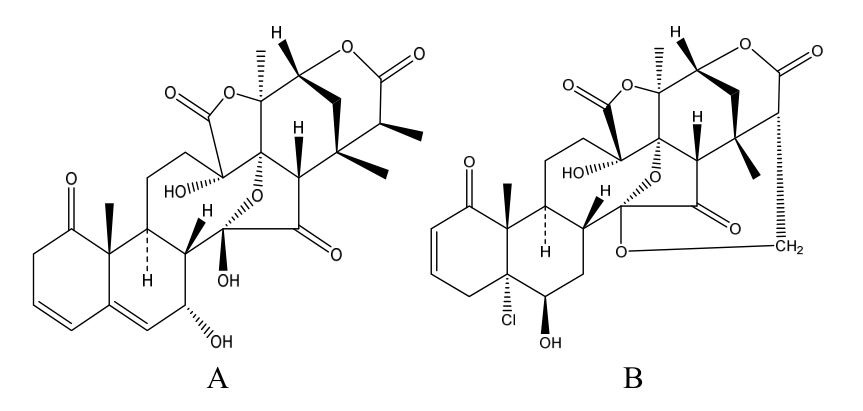
图1 酸浆苦素L(A)和酸浆苦素H(B)的化学结构图
Fig. 1 Chemical structure of physalin L (A) and physalin H(B)
沈旭1,郑运亮2*,申屠建中2
(1.浙江工业大学,杭州 310014;2.浙江大学医学院附属第一医院,杭州 310003)
摘要:目的 建立一种特异、灵敏、快速地检测酸浆苦素 L在大鼠体内的药动学特征的 LC-MS/MS方法。方法 采用Waters XBridgetm-C18色谱柱(4.6 mm×150 mm,3.5 μm),含有0.1%甲酸的水溶液-乙腈(45∶55)为流动相,等度洗脱,流速为0.6 mL·min-1。采用负离子模式、MRM模式进行检测。结果 酸浆苦素L浓度在0.492~493 ng·mL-1与峰面积呈良好线性关系,最低定量限为0.492 ng·mL-1;批间、批内RSD均<7.86%,平均回收率为99.23%~106.73%,方法重复性良好。药动学结果表示,每只SD雄性大鼠灌胃2.0 mg酸浆苦素L后,酸浆苦素L在大鼠体内平均达峰时间tmax为0.69 h,平均药峰浓度Cmax为 77.48 ng·mL-1,药时曲线下面积 AUC0→t为280.78 ng·h·mL-1,平均半衰期t1/2为 2.89 h。结论 本研究探明了酸浆苦素L在大鼠体内的药动学特征,为锦灯笼在动物体内的血药监测提供了一个新的指标,利于研究人员对锦灯笼(尤其是酸浆苦素类化合物)药理活性与药动学的深入研究。
关键词:酸浆苦素L;液质联用;定量分析;药动学
中药的药动学研究有利于让世界上其他国家肯定中药治疗疾病的药效,是中药现代化进程中必须面对的重要课题。酸浆苦素类化合物是中药锦灯笼(又名酸浆、灯笼草等)的主要化学成分之一,为高度含氧的甾体化合物,基本结构为13,14-裂环-16,24-环麦角甾烷[1]。
酸浆苦素 L是酸浆中主要的特异性酸浆苦素类化合物,化学结构见图1a。中国药典2010年版将酸浆苦素 L作为锦灯笼质量控制的定量指标(2015版药典无该指标),但是近年来,有关锦灯笼含量测定的研究多以黄酮类化合物为指标,对酸浆苦素类成分含量的研究较少[2-4],尤其缺少此类成分在生物体内的吸收、分布、代谢和排泄的信息,从而阻碍了此类成分的进一步开发和利用。
本实验采用与酸浆苦素 L结构相似的酸浆苦素 H(化学结构见图 1B)为内标,成功建立LC-MS/MS测定SD大鼠血浆中酸浆苦素L药物浓度的方法,在中药化学成分的定性、定量分析方面均有较强的应用价值,为锦灯笼在动物体内的血药监测提供了一个新的指标,有利于研究人员对酸浆苦素类化合物的药理活性与药动学的深入研究。

图1 酸浆苦素L(A)和酸浆苦素H(B)的化学结构图
Fig. 1 Chemical structure of physalin L (A) and physalin H(B)
LC20液相色谱仪(日本岛津);API 4000三重四级杆质谱、Analyst® software工作站V1.5(美国应用生物系统公司);Waters XBridgetm-C18色谱柱(4.6 mm×150 mm,3.5 μm);Eppendorf 移液器、Eppendorf 高速离心机(德国Abbott公司);超纯水系统(美国Millipore公司)。
乙腈和甲醇为色谱纯(德国Merk公司);乙酸乙酯为分析纯;Milli Q超纯水;NG1000氮气发生器(上海析维生物医药科技有限公司);酸浆苦素L(上海同田生物技术股份有限公司,批号:E-2607,纯度:98.0%);内标(酸浆苦素H)由本实验室制备,纯度均>96%(HPLC峰面积归一化法测得)。
SD大鼠6只,♂,体质量(108±25)g。实验大鼠购自浙江省实验动物中心[许可证号:SCXK(浙)2014-0001],体质量均衡,动物每笼 2只,动物实验符合动物伦理委员会相关标准。给药前动物适应性饲养24 h,禁食不禁水。
色谱柱:Water XBridgetm-C18(4.6 mm×150 mm,3.5 μm);流动相:0.1%的甲酸水溶液(A)-乙腈(B)(45∶55);流速:0.6 mL·min-1,等度洗脱;柱温箱温度40 ℃;进样室温度4 ℃,避光;进样量为 5 μL。
采用岛津LC20液相色谱仪和API 4000三重四级杆质谱联用。LC接口为大气压电喷雾离子源(ESI),负离子检测模式;干燥气温度为500 ℃;喷雾电压(Ion spray voltage,IS)为-4 500 V;气帘气(curtain gas,CUR):20 psi;碰撞气(collision gas,CAD):10 psi;离子源气体(GSP1、GSP2):55 psi。扫描方式为多重反应选择离子监测负离子模式(multi reaction monitoring,MRM),定量分析的离子(m/z)分别为 527.2→509.1(酸浆苦素 L,CE 为-17 V,DP为-105 V,CXP为-17 V)和 561.2→497.2(酸浆苦素H,CE为-25 V,DP为-95 V,CXP为-15 V)。
2.3.1 酸浆苦素 L储备液的制备 精密称取酸浆苦素L对照品9.85 mg,置于10 mL量瓶中,用甲醇溶解并定容,获得0.985 mg·mL-1的储备液,置4 ℃冰箱保存。临用时用甲醇逐步稀释得标曲(4 930,1 970,985,493,98.5,49.3,19.7,4.92 ng·mL-1)及质控(3 940,197,9.85 ng·mL-1)的工作液。
2.3.2 内标储备液的制备 精密称取酸浆苦素 H对照品5.360 mg,置于10 mL量瓶中,用甲醇溶解并定容,获得0.536 mg·mL-1的储备液,置4 ℃冰箱保存。临用时用甲醇稀释成10.72 μg·mL-1的内标工作液。
2.3.3 灌胃液的配制 精密称取酸浆苦素 L 15.01 mg,置于5 mL量瓶中,用羧甲基纤维素钠水溶液(0.5%)混悬并定容,得3.0 mg·mL-1的混悬液,置于4 ℃冰箱保存,备用。
取大鼠血浆50 μL,加入5 μL内标酸浆苦素H(10.72 μg·mL-1),加入 200 μL 乙酸乙酯,涡旋1 min,13 000 r·min-1离心5 min后取乙酸乙酯层,用氮气吹干,吹干后的EP管用50 μL的50%乙腈水溶液复溶,再13 000 r·min-1离心5 min后取上清 5 μL进样。
将6只♂SD大鼠以每只2.0 mg的给药量灌胃给药,分别于给药前及给药后0,5,10,20,40,60 min;1.5,2.5,4.0,6.0,9.0,12,24 h 各取尾静脉血0.3 mL,置于肝素抗凝的离心管中,采集后血样避光、冰浴暂存。血样采集完后,3 000 r·min-1,4 ℃,离心 10 min,分离出血浆立即置聚丙烯试管中置于-70 ℃冰箱保存待测。
分别取空白血浆、空白血浆加酸浆苦素L(0.492 ng·mL-1)、大鼠用药 1.5 h的血浆样品50 μL置于1.5 mL的离心管中,按照“2.4”项下方法处理,取上清5 μL进样;同时,用“空白血浆加内标工作液”替换“空白血浆加酸浆苦素L”,重复上述操作。观察、比较色谱图,色谱图见图2。结果表明,空白血浆的内源性物质不干扰酸浆苦素L(tR=4.41 min)和内标的测定(tR=5.09 min)。

图2 酸浆苦素L和内标的典型色谱图
A-空白血浆;B-空白血浆加酸浆苦素 L(0.492 ng·mL-1)和内标(1.072 μg·mL-1);C-给药后 1.5 h 大鼠血浆。
Fig. 2 Representative MRM chromatograms of physalins L and IS
A-blank sample; B-blank sample + physalin L (0.492 ng·mL-1) +internal standard(1.072 μg·mL-1); C-1.5 h after administration in rat plasma.
精密移取空白大鼠血浆50 μL,加入酸浆苦素L对照品工作液各 5 μL,得到分别含酸浆苦素 L 493,197,98.5,49.3,4.93,1.97,0.492 ng·mL-1的样品;同样方法配制得到含酸浆苦素 L 394,19.7,0.985 ng·mL-1的质控样品。再按“2.4”项下方法处理与测定。以酸浆苦素 L的浓度X(ng·mL-1)为横坐标,以酸浆苦素 L与内标峰面积之比Y为纵坐标,以加权(1/X)最小二乘法进行回归,得到回归方程为Y=0.137+0.072 3X(r=0.995 3),实验表明酸浆苦素 L在血浆中浓度 0.492~493 ng·mL-1内呈良好线性关系。最低定量限为0.492 ng·mL-1。
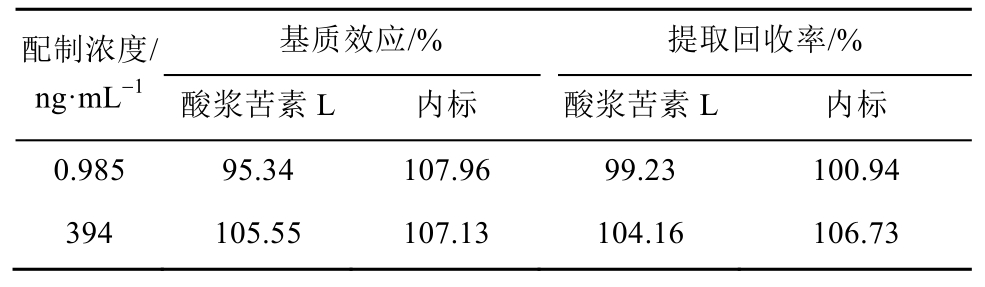
取SD大鼠空白血浆50 μL,加入200 μL乙酸乙酯,涡旋1 min,13 000 r·min-1离心5 min后取全部上清液,加酸浆苦素 L(3 940,197,9.85 ng·mL-1)、内标(10.72 μg·mL-1)各 5 μL,涡旋混匀后氮气吹干,吹干后的EP管用50 μL的50%乙腈水溶液复溶,再13 000 r·min-1离心5 min取上清5 μL进样,获得相应峰面积,记为B。同时,另取50 μL水代替空白血浆,按上述处理获得相应峰面积,记为 A。以每一浓度 2种处理方法的峰面积比值计算基质效应。
按“2.4”项下方法处理低(0.985 ng·mL-1)、高(394 ng·mL-1)2个浓度的质控血浆样品,每一浓度进行6个样品分析,峰面积为C。提取回收率(RE)=A/B×100%,基质效应(ME)=B/C×100%,计算结果见表1。
表1 基质效应与提取回收率结果
Tab. 1 Results of matrix and recovery
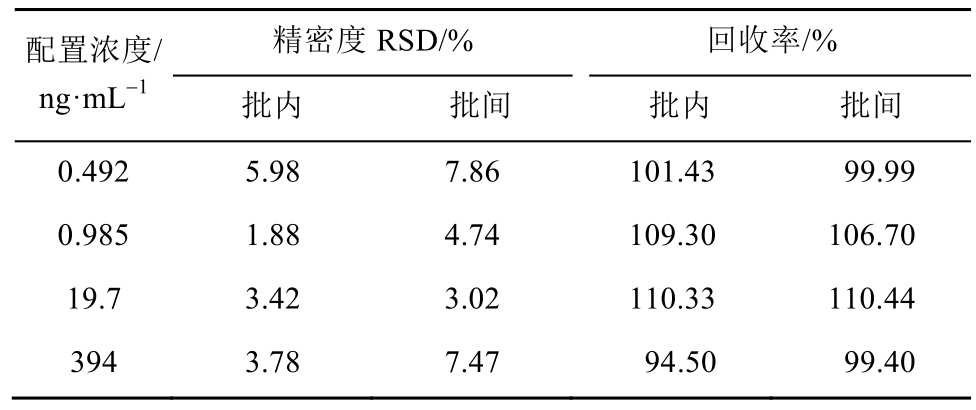
按“2.4”项下方法处理最低定量下限(0.492 ng·mL-1) 、 低 (0.985 ng·mL-1) 、 中(19.7 ng·mL-1)、高(394 ng·mL-1)4 个浓度的质控血浆样品,每一浓度进行 6个样品分析,考察精密度(RSD)(n=6);按此方法测定3个批次,计算批间RSD。批间、批内RSD均<7.86%,可见该方法重复性良好,结果见表2。
取低、中、高(0.985,19.7,394 ng·mL-1)3 种不同浓度的质控样品各3份,按“2.4”项下方法处理、测定,之后这些样品于室温下放置4 h,按同样方法进行测定,考察其短期稳定性;按“2.4”项下方法处理低、中、高 3个浓度的质控全血样品各 3份,考察样品上样液在自动进样器(室温)放置18 h的稳定性;低、中、高3个浓度的质控样品各3份在-70 ℃冰箱反复冻融3次后按“2.4”项下方法操作并立即进行LC-MS/MS分析,考察反复冻融3次的稳定性;低、中、高3个浓度的质控样品各3份在-70 ℃冰箱放置1个月,按“2.4”项下方法操作并立即进行LC-MS/MS分析,考察长期冻存稳定性。结果表明样品在各种条件下能保持稳定,结果见表3。
表2 精密度结果
Tab. 2 Results of precision
实验过程中,最高浓度校正标样后连续分析的 2个空白基质样品在分析物保留时间处干扰峰响应均低于定量下限中分析物响应的 20%,内标保留时间处的干扰峰的响应均低于零浓度样品中内标响应的5%。结果表明,残留可忽略,不影响定量分析。
采用WinNolin 6.3计算酸浆苦素L的药动学参数。6只SD大鼠以每只2.0 mg的给药量灌胃后药动学参数为:t1/2为(2.89±1.14)h、tmax为(0.69±0.26)h、Cmax为(77.48±28.30)ng·mL-1、AUC0→t为(280.78±86.48)ng·h·mL-1,AUC0→∞为(313.10±101.24)ng·h·mL-1、 (AUC0→∞-AUC0→t)/AUC0→∞× 100% 为 (9.49±5.78)% 、 MRT0→t为(3.13±0.63)h、MRT0→∞为(4.33±1.50)h、Vd 为(25 391.92±7 401.59)mL、CL 为(5 427.64±1 241.68)mL·h-1,平均血药浓度-时间曲线见图3。(AUC等参数可通过WinNolin 6.3计算得到,不需要建立隔室模型进行计算,故未建立隔室模型)。

图3 给药1.5 h后酸浆苦素L的平均药时曲线(n=6,x±s)
Fig. 3 Mean blood concentration-time curve of physalin L after given 1.5 h(n=6,x±s)
锦灯笼是一种常用中药,具有清热解毒、清肺治咳、利湿化痰等作用,现代医药学研究发现,锦灯笼还具有治疗食管癌症、治疗糖尿病等疾病的功效。锦灯笼中的酸浆苦素类成分是目前发现的我国仅有的番茄内酯药物资源,它使得锦灯笼具有抗菌、抗炎、镇痛、降血糖、降血脂等作用,在一定的剂量下,酸浆果实的水提液、带果实的宿萼水提液及醇提液,具有明显的降血糖作用;锦灯笼甲醇提取物对小鼠髓磷脂类白血病细胞生长有抑制作用[5-9]。
锦灯笼的现代化研究始于1969年,多集中于锦灯笼的药理活性或者少数几种已经分离出来的酸浆苦素类化合物(例如酸浆苦素A、B、D等)的提取分离方法与其药理活性研究,酸浆苦素 B可通过抑制PMN-H2O2的产生、释放,从而产生抗炎作用;酸浆苦素B抑制PSC小鼠淋巴白血病细胞的生长;酸浆苦素M拮抗Hela癌细胞;酸浆苦素X有堕胎的作用;酸浆苦素B、D、G、H等均具有较好的体外抗肿瘤活性[10-15],但是对酸浆苦素 L在动物体内的药理学研究较少,对其药理活性了解甚微。
表3 稳定性考察结果(n=3)
Tab. 3 Results of stability study(n=3)

注:L=0.985 ng·mL-1;M=19.7 ng·mL-1;H=394 ng·mL-1。
Note: L=0.985 ng·mL-1; M=19.7 ng·mL-1; H=394 ng·mL-1.
本研究报道了给每只SD雄性大鼠灌胃2.0 mg的酸浆苦素L后,其平均达峰时间tmax约0.69 h,平均药峰浓度 Cmax为 77.48 ng·mL-1,0~24 h 时间段药时曲线下面积 AUC0→t为 280.78 ng·h·mL-1,平均半衰期t1/2为2.89 h。
本研究以锦灯笼中酸浆苦素 L作为药动学研究的代表性指标,首先,建立了定量测定大鼠血浆中酸浆苦素L的LC-MS/MS的分析方法,并经过一系列的方法学验证证明本方法不但出峰速度快,而且具有较好的专属性、灵敏度,方法的精密度和准确度;随后将此方法成功地应用于灌胃给药后酸浆苦素 L药动学研究。该研究为锦灯笼在动物体内的血药监测提供了一个新的指标,有利于研究人员对锦灯笼(尤其是酸浆苦素类化合物)药理活性与药动学的深入研究。
[1] MA Z, ZHANG Y. The research of nuclear magnetic resonance spectral characteristics on physalin [J]. J Math Med(数理医药学杂志), 2014, 27(5): 583-585.
[2] SHI R, JIA L Y, SUN Q S, et al. RP-HPLC determination of there active components in Physalis alkekengi L. var.franchetii (Mast. ) Makino [J]. Chin J Pharm Anal(药物分析杂志), 2008, 28(2): 260-262.
[3] XU L, XU Q Y, WANG B, et al. Content determination of luteolin in Jindenglong by HPLC [J]. Lishizhen Med Mater Med Res(时珍国医国药), 2006, 17(4): 575-576.
[4] YANG W J, JING S Q, YANG J X. Study on determinination method of total flavonoid in Physalis alkekengi L. var.francheti (Mast.) Makino in Xinjiang [J]. J Xinjiang Univ (Nat Sci Ed)(新疆大学学报), 2007, 24(3): 339-341.
[5] GE Y, DUAN Y F, FANG G Z, et al. Polysaccharides from fruit calyx of Physalis alkekengi L. var. francheti: isolation,purification, structural features and antioxidant activities [J].Carbohydr Polym, 2009, 77(2): 188-193.
[6] LV C P, WANG H F, LI J. Study on anti-ammatory effects of the extract of Physalins alkekengi. var. francheti (Mast) [J].Mod Prev Med(现代预防医学), 2007, 34(12): 2213-2214.
[7] VIEIRA A T, PINHO V, LEPSCH L B, et al. Mechanisms of the anti-inflammatory effects of the natural secosteroids physalins in a model of intestinal ischaemia and reperfusion injury [J]. Br J Pharmacol, 2005, 146(2): 244-251.
[8] TONG H, WANG R F, LIU X M, et al. Structural characterization and in vitro inhibitory activities in P-selectin-mediated leukocyte adhesion of polysaccharide fractions isolated from the roots of Physalis alkekengi [J]. Int J Biol Macromol, 2011, 49(2): 210-217.
[9] HELVACI S, KÖKDİL G, KAWAI M, et al. Antimicrobial activity of the extracts and physalin D from Physalis alkekengi and evaluation of antioxidant potential of physalin D [J].Pharm Biol, 2010, 48(2): 142-150.
[10] MOHANA K, UMA R, PURUSHOTHAMAN K K.Abortifacent activity of Physalin--X.[J]. Indian J Exp Biol,1979, 17(7): 690-691.
[11] KAWAI M, YAMAMOTO T, MAKINO B, et al. The structure of physalin T from Physalis alkekengi var. franchetti[J]. J Asian Nat Prod Res, 2001, 3(3): 199-205.
[12] SUNAYAMA R, KUROYANAGI M, UMEHARA K, et al.Physalin and neophysalins from Physalis alkekengi var.francheti and their differentiation inducing activity [J].Phytochemistry, 1993, 34(2): 529-533.
[13] KANG H, KWON S R, CHOL H Y. Inhibitory effect of Physalis alkekengi L. var. franchetii extract and its chloroform fraction on LPS or LPS/IFN-γ-stimulated inflammatory response in peritoneal macrophages [J]. J Ethnopharmacol,2011, 135(1): 95-101.
[14] FANG C S, YANG Y J. Study on anti-tumor activities of physalins B in vitro [J]. J Guangzhou Univ Tradit Chin Med(广州中医药大学学报), 2015, 32(4): 652-655.
[15] CASTRO D P, MORAES C S, GONZALEZ M S, et al.Physalin B inhibits Trypanosoma cruzi infection in the gut of Rhodnius prolixus by affecting the immune system and microbiota [J]. J Insect Physiol, 2012, 58(12): 1620-1625.
Pharmacokinetic of Physalin L in Rat Plasma
SHEN Xu1, ZHENG Yunliang2*, SHENTU Jianzhong2(1.Zhejiang University of Technology, Hangzhou 310014, China;2.First Affiliated Hospital, College of Medicine, Zhejiang University, Hangzhou 310003, China)
ABSTRACT:OBJECTIVE To establish a specific, sensitive, efficient method for the quantitative determination of physalin L in rats plasma using LC-MS/MS system, and provide a detection means for its pharmacokinetic characteristic. METHODS The separation of physalin L was performed on a Waters XBridgetm-C18column (4.6 mm×150 mm, 3.5 μm) with a mobile phase consisted of 0.1% formic acid aqueous solution and acetonitrile (45∶50). The assay was based on a negative MRM scan.RESULTS The linear range of the calibration curve (0.492-493 ng·mL-1) was obtained with a good correlation coefficient.The lower limit of quantification was 0.492 ng·mL-1. The average recovery was 99.23%-106.73% and the RSD of intra- and inter-day precision were <7.86%. The repeatability of the method was good. After intragastric administration of 2.0 mg physalin L to each rat, the mean peak time (tmax) was 0.69 h and the mean maximum concentration (Cmax) was 77.48 ng·mL-1.The area under the curve (AUC0→t) was 280.78 ng·h·mL-1, its t1/2was 2.89 h. CONCLUSION This study provides the physalin L characteristics of pharmacokinetics in rats, whitch is good for researchers on Physalis Calyx Seu Fructus (especially physalin compounds) in-depth study of pharmacological activity and pharmacokinetics.
KEY WORDS:physalin L; LC-MS/MS; quantitative analysis; pharmacokinetic
REFERENCES
中图分类号:R969.1
文献标志码:B
文章编号:1007-7693(2017)12-1663-05
DOI:10.13748/j.cnki.issn1007-7693.2017.12.004
引用本文:沈旭, 郑运亮, 申屠建中. 酸浆苦素L在大鼠体内的药动学研究[J]. 中国现代应用药学, 2017, 34(12): 1663-1667.
基金项目:国家自然科学基金资助项目(81402807);高等学校博士学科点专项科研基金(新教师类)(20130101120136)
作者简介:沈旭,女,硕士生 Tel: (0571)87236560 E-mail: shenxu0630@163.com*
通信作者:郑运亮,男,博士 Tel:(0571)87236560 E-mail: ylzheng1984@zju.edu.cn
收稿日期:2017-04-07
(本文责编:李艳芳)