表1 UGT1A4和UGT2B7 SNPs与拉莫三嗪血药浓度的相关性
Tab. 1 Associations between UGT1A4, UGT2B7 SNPs and lamotrigine concentrations
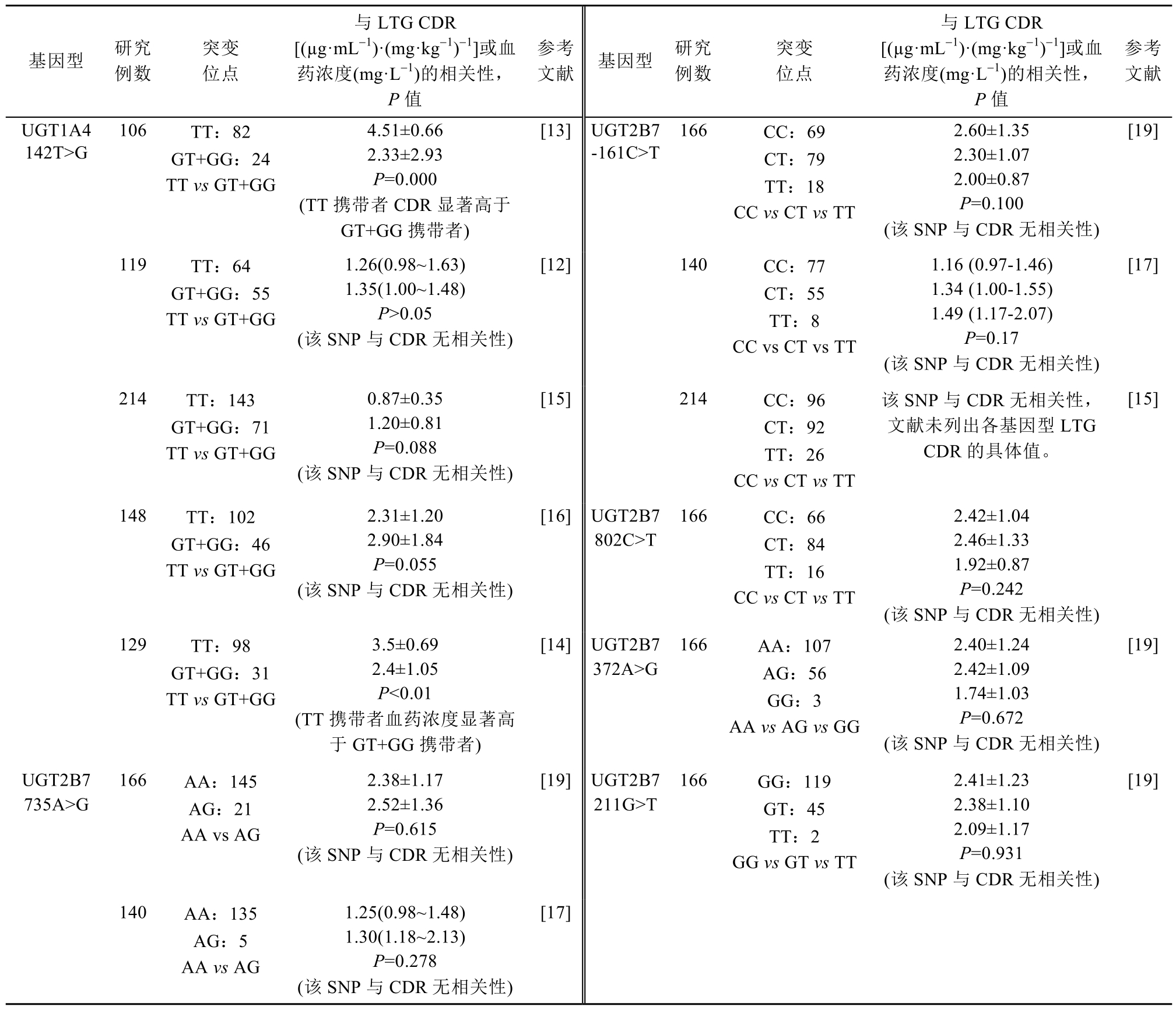
注:CDR-体质量和剂量校正浓度;SNP-单核苷酸基因多态性。
Note: CDR-concentration/dose/normalized by body weight; SNP-single nucleoside polymorphisms.
楼江a,林能明a,刘占利b,王刚a,王飞a,李晴宇a,陈玲a,严伟a*
(杭州市第一人民医院,a.药学部,b.儿科,杭州 310006)
摘要:拉莫三嗪是一线抗癫痫药物,临床疗效和不良反应个体差异大与血药浓度有关,近年来寻找拉莫三嗪血药浓度差异的原因是研究的热点。本综述探讨了代谢酶和转运体基因多态性对拉莫三嗪血药浓度的影响,以期为拉莫三嗪个体化治疗提供参考依据。
关键词:拉莫三嗪;代谢酶;转运体;基因多态性;血药浓度
癫痫是由多种原因引起的慢性脑部疾病,它不仅给患者造成了严重的躯体障碍,还给家庭带来严重的心理及经济负担。拉莫三嗪(lamotrigine,LTG)是新型抗癫痫药物,主要通过阻断突触前膜电压敏感性钠离子通道,抑制谷氨酸和天冬氨酸的释放,发挥抗癫痫作用。LTG的临床疗效和不良反应个体差异大,部分患者使用相同剂量也可能无效,部分患者可能发生不良反应,这与 LTG稳态血药谷浓度个体差异大有关,神经精神药理学与药物精神病协会(Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie,AGNP)的治疗药物监测(therqpeutic drug monitoring,TDM)专家组和中华医学会儿科学分会临床药理学组建议对服用LTG患者进行TDM,并建议治疗窗为 2.5~15 mg·L-1[1-3]。
目前,大部分临床医师采用剂量递增方案给予LTG,再经验性或根据TDM结果调整给药,可能需要较长时间,因此如何快速有效控制癫痫,使LTG快速达到血药浓度治疗窗,是临床亟需解决的问题。研究发现遗传因素如代谢酶和转运体的基因突变可能是LTG血药浓度个体差异大的重要原因之一,也是近年研究热点[4-5]。赵明明和黄钺等综述了代谢酶基因多态性对LTG药动学和血药浓度影响,但未探讨转运体基因多态性对 LTG血药浓度的影响[6-7]。随着药物基因组学的深入研究,转运体基因多态性对底物药物血药浓度影响日益受到重视。通过查阅国内外文献,本文就代谢酶和转运体基因多态性对LTG血药浓度影响的相关报道进行综述,以期为LTG的个体化治疗或进一步研究提供参考依据。
在体内,LTG主要经尿苷二磷酸葡醛酸转移酶(UDP-glycuronosyltransferase,UGT)代谢为无活性的葡萄糖醛酸结合产物,再由肾脏排出体外,UGT1A4是主要代谢酶,UGT2B7也参与了LTG的酸化反应[8]。LTG同时还是摄入转运体有机阳离子转运体(organic cation transporters,OCT)、外排转运体 P-糖蛋白(P-glycorption,P-gp)转运体和乳腺耐药转运蛋白(breast cancer resistance protein,Bcrp)的底物[9-10]。代谢酶和转运体的表达和活性会影响底物药物的吸收、分布、代谢和排泄,它们的表达和活性受单核苷基因多态性(single nucleoside polymorphisms,SNPs)影响,它们的SNPs可能也是影响LTG血药浓度的重要原因。
UGT1A4和UGT2B7是LTG的代谢酶[8]。目前发现UGT1A4存在2个潜在的功能等位基因突变:UGT1A4 70C>A和 142T>G,Zhou等[11]通过体外研究发现UGT1A4 70C>A和142T>G的突变会导致 UGT酶活性下降,使 LTG清除率下降。Zhou等[12]发现 UGT1A4 70C>A基因突变种族差异性较大,欧洲人群中该位点突变率在6%~9%,中国、韩国和日本等亚洲人群中突变率为0。Chang等[13]对 106例中国癫痫患者的 LTG血药浓度与UGT1A4 70C>A和142T>G基因型的相关性进行研究,发现UGT1A4 70C>A突变率为0,这与Zhou等[12]研究结果相同,而UGT1A4 142TT野生型携带者的 LTG标准化血药浓度/剂量/体质量(concentration/dose/normalized by body weight,CDR)为(4.51±0.66)(µg·mL-1)·(mg·kg-1)-1显著高于 TG+GG 携带者(2.33±2.93)(µg·mL-1)·(mg·kg-1)-1,P=0.000,这与土耳其人群的研究结果一致[13-14]。但Liu等和Wang等未发现UGT1A4 142T>G基因型会影响LTG的血药浓度,结果见表1[15-16]。
UGT2B7编码基因位于染色体4q13上,包括6个外显子和5个内含子,可编码259个氨基酸残基,其编码区和启动子区域存在高度的遗传多态性。Milosheka等对100例服用LTG患者进行群体药动学分析,发现UGT2B7-161C>T和372A>G基因型与LTG的清除率相关,其中-161TT携带者的LTG清除率显著低于-161CC携带者,372 GG携带者的清除率显著高于AA携带者[17]。但Zhou等和Liu等研究未发现UGT2B7-161C>T、211G>T、372A>G、735A>G和802C>T SNPs会影响LTG血药浓度或CDR,结果见表1[15,18-19]。
目前,UGT1A4和UGT2B7 SNPs对LTG血药浓度或CDR影响,各研究尚未达成共识,可能有以下原因:①多数研究为单中心、小样本研究;②UGT1A4和UGT2B7 SNPs突变较多,各研究人群不同,研究位点不一,而同位点在不同人群中突变率不同,结果可能有误差;③药物相互作用对LTG的影响。Chang等[13]研究入组LTG单用患者,发现UGT1A4 142T>G SNPs会影响LTG CDR。Liu等研究入组LTG单用或与丙戊酸(VPA)合用患者发现,LTG+VPA合用组UGT1A4 142T>G会影响LTG CDR,但LTG单用组未发现该结果;VPA是UGT的抑制剂,与LTG合用时,可降低LTG代谢,增加LTG血药浓度;除VPA外,口服避孕药、对乙酰氨基酚、卡马西平、苯妥英钠和奥卡西平等可诱导UGT代谢,减少LTG血药浓度,因此LTG血药浓度除受代谢酶SNPs影响外,可能还受药物相互作用的影响[13,15,20-21]。④部分研究患者的年龄跨度过大,年龄会影响人体的肝、肾功能,进而影响LTG的代谢和排泄[22-23];⑤雌激素水平会影响LTG代谢,妊娠和绝经女性体内雌激素水平下降,可使肝脏UGT酶催化的葡糖醛酸结合反应的能力减弱,导致 LTG的清除率下降,Tomson等研究发现51~55岁女性患者体内LTG的剂量/浓度为79.2(66.1~ 92.2) L/24 h显著低于同龄组男性的 105.0(81.1~ 129.0) L/24 h(p<0.05)[20,24]。
近年来,转运体对底物药物吸收、分布和排泄的影响日益受到关注,LTG是摄入转运体OCT1与外排转运体 P-gp和 Bcrp底物,它们分别受SLC22A1、ABCB1和ABCG2编码基因调控[9-10]。Shen等对112位服用LTG的中国癫痫患者进行研究,发现SLC22A1 1222 AA+AG携带者LTG CDR为 1.72(1.02~3.77) (µg·mL-1)·(mg·kg-1)-1,显著高于GG携带者1.28(0.90~1.93) (µg·mL-1)·(mg·kg-1)-1,P=0.01;ABCG2 421AA携带者LTG CDR为2.52(1.25~4.21) (µg·mL-1)·(mg·kg-1)-1,显著高于 CA+CC 携带者 1.48(0.90~2.23) (µg·mL-1)·(mg·kg-1)-1,P=0.015;但该研究未发现 ABCG2 1249G>A、ABCG2 34G>A 和 SLC22A1 1022 C>T 与 LTG CDR有相关性[25]。Lovrić MI等考察了222例克罗地亚患者的LTG血药浓度与ABCB1 SNPs的相关性,发现1236 CC基因携带者的LTG剂量校正浓度(dose-corrected concentration,C/D)为 0.068(0.026~0.204) (μmol·L-1·mg-1),显著高于 CT+TT 携带者0.053(0.016~0.187),P=0.017;但未发现 ABCB1 G2677T和C3435T基因多态性与LTG血药浓度具有显著相关性[26]。Zhou等研究也未发现 ABCB1 SNPs会影响LTG的血药浓度,结果见表2[17]。目前,有关SLC22A1、ABCB1和ABCG2 SNPs对LTG血药浓度影响的研究较少,还需更多的研究确定是否具有相关性。
综上所述,尚未发现LTG代谢酶和转运体基因多态性对LTG血药浓度影响的特异性突变位点,这可能与LTG的代谢和转运过程复杂,并不受单一代谢酶和转运体进行代谢和转运有关;同时LTG血药浓度又易受年龄、合并用药、雌激素水平等多种非遗传因素影响。因此要明确代谢酶和转运体 SNPs对LTG血药浓度影响,实现LTG“基因处方”的个体化治疗,笔者认为后续研究可从以下方面开展:①进行更多的多中心和大样本临床研究,为LTG的药物基因组学研究提供更有力的证据支持;②扩大样本量的基础上,应对研究人群进行更加细致的分组研究(将年龄和雌激素水平等因素干扰降到最低),再将TDM与基因多态性的相关研究进行整合;③将代谢酶和转运体基因多态性引入到LTG的群体药动学研究中,对导致药物差异的遗传和非遗传因素进行更全面分析,定量描述代谢酶和转运体基因多态性对LTG血药浓度的影响。
表1 UGT1A4和UGT2B7 SNPs与拉莫三嗪血药浓度的相关性
Tab. 1 Associations between UGT1A4, UGT2B7 SNPs and lamotrigine concentrations

注:CDR-体质量和剂量校正浓度;SNP-单核苷酸基因多态性。
Note: CDR-concentration/dose/normalized by body weight; SNP-single nucleoside polymorphisms.
表2 转运体 SNPs与LTG血药浓度的相关性
Tab. 2 Associations between transporters SNPs and lamotrigine concentrations

注:CDR-体质量和剂量校正浓度;C/D-剂量校正浓度。
Note: CDR-concentration/dose/normalized by body weight; C/D-dose-corrected concentration.
[1] HIRSCH L J, WEINTRAUB D, DU Y, et al. Correlating lamotrigine serum concentrations with tolerability in patients with epilepsy [J]. Neurology, 2004, 63(6): 1022-1026.
[2] HIEMKE C, BAUMANN P, BERGENMANN N, et al. AGNP consensus guidelines for therapeutic drug monitoring in psychiatry: update 2011 [J]. Pharmacopsychiatry, 2011, 44(6):195-235.
[3] 中华医学会儿科学分会临床药理学组. 儿童治疗性药物监测专家共识[J]. 中华儿科杂志, 2015, 53(9): 650-659.
[4] ZHANG Z B, JI S M, HAN Y, et al. Population pharmacokinetic models of lamotrigine in different age groups of Chinese children with epilepsy [J]. Eur J Clin Pharmacol,2017, 73(4):1-9.
[5] TAKEUCHI T, NATSUME J, KIDOKORO H, et al. The effects of co-medications on lamotrigine clearance in Japanese children with epilepsy [J]. Brain Dev, 2016, 38(8): 723-730.
[6] ZHAO M M, SUN Y X, CHEN Y H, et al. Progress on the pharmacokinetics of lamotrigine [J]. J Guangdong Pharm Univ(广东药学院学报), 2012, 28(5): 578-583.
[7] 黄钺,曹迪,李智平, 等. UGT1A4基因多态性对儿童拉莫三嗪药动学影响的研究进展[J]. 中国临床药学杂志, 2011,20(6): 383-386.
[8] REIMERS A, SJURSEN W, HELDE G, et al. Frequencies of UGT1A4*2 (P24T) and *3 (L48V) and their effects on serum concentrations of lamotrigine [J]. Eur J Drug Metab Pharmacokinet, 2016, 41(2): 149-155.
[9] DICKENS D, OWEN A, ALFIREVIC A, et al. Lamotrigine is a substrate for OCT1 in brain endothelial cells [J]. Biochem Pharmacol, 2012, 83(6): 805-814.
[10] NAKANISHI H, YONEZAWA A, MATSUBARA K, et al.Impact of P-glycoprotein and breast cancer resistance protein on the brain distribution of antiepileptic drugs in knockout mouse models [J]. Eur J Pharmacol, 2013, 710(1-3): 20-28.
[11] ZHOU J, ARGIKAR U A, REMMEL R P. Functional analysis of UGT1A4(P24T) and UGT1A4(L48V) variant enzymes [J].Pharmacogenomics, 2011, 12(12): 1671-1679.
[12] ZHOU Y F, WANG X D, ZHOU L M, et al. Interethnic differences in UGT1A4 genetic polymorphisms and its effect on lamotrigine trough concentration [J]. Clin J Clin Pharmacol(中国临床药理学杂志), 2015, 31(6): 439-442.
[13] CHANG Y, YANG L Y, ZHANG M C, et al. Correlation of the UGT1A4 gene polymorphism with serum concentration and therapeutic efficacy of lamotrigine in Han Chinese of Northern China [J]. Eur J Clin Pharmacol, 2014, 70(8):941-946.
[14] GULCEBI M I, OZKAYNAKCI A, GOREN M Z, et al. The relationship between UGT1A4 polymorphism and serum concentration of lamotrigine in patients with epilepsy [J].Epilepsy Res, 2011, 95(1/2): 1-8.
[15] LIU L, ZHAO L, WANG Q, et al. Influence of valproic acid concentration and polymorphism of UGT1A4*3, UGT2B7-161C>T and UGT2B7*2 on serum concentration of lamotrigine in Chinese epileptic children [J]. Eur J Clin Pharmacol, 2015, 71(11): 1341-1347.
[16] WANG Q, LIANG M, DONG Y, et al. Effects of UGT1A4 genetic polymorphisms on serum lamotrigine concentrations in Chinese children with epilepsy [J]. Drug Metab Pharmacokinet,2015, 30(3): 209-213.
[17] MILOSHESKA D, LORBER B, VOVK T, et al.Pharmacokinetics of lamotrigine and its metabolite N-2-glucuronide: Influence of polymorphism of UDP-glucuronosyl-transferases and drug transporters [J]. Br J Clin Pharmacol, 2016, 82(2): 399-411.
[18] ZHOU Y, WANG X, LI H, et al. Polymorphisms of ABCG2,ABCB1 and HNF4α are associated with Lamotrigine trough concentrations in epilepsy patients [J]. Drug Metab Pharmacokinet, 2015, 30(4): 282-287.
[19] WANG Q, ZHAO L, LIANG M, et al. Effects of UGT2B7 genetic polymorphisms on serum concentrations of valproic acid in Chinese children with epilepsy comedicated with lamotrigine [J]. Ther Drug Monit, 2016, 38(3): 343-349.
[20] WEGNER I, EDELBROEK P M, BULK S, et al.Lamotrigine kinetics within the menstrual cycle, after menopause, and with oral contraceptives [J]. Neurology, 2009,73(17): 1388-1393.
[21] GASTRUP S, STAGE T B, FRUEKILDE P B, et al.Paracetamol decreases steady-state exposure to lamotrigine by induction of glucuronidation in healthy subjects [J]. Br J Clin Pharmacol, 2016, 81(4): 735-741.
[22] ARIF H, SVORONOS A, RESOR SR J R, et al. The effect of age and comedication on lamotrigine clearance, tolerability,and efficacy [J]. Epilepsia, 2011, 52(10): 1905-1913.
[23] ITALIANO D, PERUCCA E. Clinical pharmacokinetics of new-generation antiepileptic drugs at the extremes of age: an update [J]. Clin Pharmacokinet, 2013, 52(8): 627-645.
[24] TOMSON T, LUKIC S, OHMAN I, et al. Are lamotrigine kinetics altered in menopause? Observations from a drug monitoring database [J]. Epilepsy Behav, 2010, 19(1): 86-88.
[25] SHEN C H, ZHANG Y X, LU R Y, et al. Specific OCT1 and ABCG2 Polymorphisms are associated with Lamotrigine concentrations in chinese patients with epilepsy [J]. Epilepsy Res, 2016(127): 186-190.
[26] LOVRIĆ M, BOŽINA N, HAJNŠEK S, et al. Association between lamotrigine concentrations and ABCB1 polymorphisms in patients with epilepsy [J]. Ther Drug Monit,2012, 34(5): 518-525.
Research Progress of the Effects of Polymorphic Metabolic Enzymes and Transporters on Lamotrigine Concentrations
LOU Jianga, LIN Nengminga, LIU Zhanlib, WANG Ganga, WANG Feia, LI Qingyua, CHEN Linga, YAN Weia*
(First People’s Hospital of Hangzhou, a.Department of Pharmacy, b.Department of Pediatrics, Hangzhou 310006, China)
ABSTRACT:Lamotrigine is used as a first-line therapeutic agent for the treatment of epilepsy. Large interindividual variability in clinical efficacy and adverse reactions of lamotrigine has been observed, it maybe associated with lamotrigine serum concentration. Recently, to search the variability has become a research focus in lamotrigine serum concentration. Through access to the domestic and foreign references in this paper, to investigate the effects of polymorphic metabolic enzymes and transporters on lamotrigine concentraions, and hope to provide reference for the individualized treatment of lamotrigine.
KEY WORDS:lamotrigine; metabolic enzyme; transporter; single nucleoside polymorphisms; plasma concentration
REFERENCES
中图分类号:R969.1
文献标志码:C
文章编号:1007-7693(2017)12-1774-05
DOI:10.13748/j.cnki.issn1007-7693.2017.12.029
引用本文:楼江, 林能明, 刘占利, 等. 拉莫三嗪代谢酶和转运体基因多态性对血药浓度的影响的研究进展[J]. 中国现代应用药学, 2017, 34(12): 1774-1778.
基金项目:浙江省药学会医院药学专项科研自助基金(2016ZYY14);浙江省医药卫生科技计划项目(2018RC061)
作者简介:楼江,男,硕士,临床药师 Tel: (0571)56007191 E-mail: jianglou5855@163.com*
通信作者:严伟,女,主任药师Tel: (0571)56007181 E-mail: yanwei_115@163.com
收稿日期:2016-12-30
(本文责编:蔡珊珊)