表1 番石榴叶药材来源
Tab. 1 Origin of Guava Leaf

傅予,张岩,陶遵威*
(天津市医药科学研究所,天津 300020)
摘要:目的建立同时测定不同产地番石榴叶药材中金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素含量的方法。方法采用色谱柱为Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm),流动相为甲醇-0.2%磷酸水(梯度洗脱),流速为1 mL·min-1,柱温为35 ℃,检测波长为360 nm,进样量10 µL。结果金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素检测进样量线性范围分别为0.155~3.100 μg (r=1.000 0),0.159~3.182 μg(r=0.999 8),0.180~3.601 μg(r=0.999 8),0.007~0.135 μg(r=1.000 0);精密度,稳定性,重复性试验的RSD<2.0%;加样回收率分别为100.32%(RSD=1.44%,n=6),97.79%(RSD=1.11%,n=6),100.73%(RSD=1.43 %,n=6),98.33%(RSD=1.48%,n=6),10批不同产地的番石榴叶药材中4种黄酮类成分含量差异较大。结论该方法简便、专属性强、准确度高、重复性好,可用于不同产地番石榴叶药材的质量控制。
关键词:番石榴叶;黄酮;高效液相色谱法
番石榴叶为桃金娘科番石榴属植物番石榴(Psidium guajavaL.)的干燥叶及带叶嫩茎[1],别名鸡矢茶,广泛种植于我国华南各地及四川西南部。番石榴叶入大肠经,无毒,具有生津止渴,甘平养胃,涩敛固阴功效。民间常用其治疗泻痢腹痛、疔疮肿毒等症。研究显示,番石榴叶中的活性成分具有降血糖、降血脂、抗菌消炎、抗氧化、抗病毒等药理作用[2-5]。目前已有以番石榴叶为主要成分的降血糖药物上市。本课题组前期研究表明,番石榴叶中的总黄酮有较好的调节糖尿病小鼠肝糖代谢[6]及促进胰岛再生功效。
目前,番石榴叶药材及上市药物的质量标准无含量测定项,仅依靠薄层鉴别,药材质量不易控制。文献报道多以UV测定番石榴叶中主要降血糖活性成分总黄酮的含量[7]。与HPLC相比较,UV操作复杂,且以芦丁为对照品测定吸光度,误差较大,专属性差。
不同产地药材因受环境、气候等因素的影响,有效成分含量会产生一定的差异,对药材的临床疗效产生影响。因此,选择适合的方法对不同产地药材的质量进行评定具有十分重要的意义[8-9]。本研究采用HPLC同时测定10个产地番石榴叶药材中4个的黄酮类成分的含量,并对结果进行聚类分析,为番石榴叶药材质量控制和资源开发利用提供理论支持和数据参考。
Agilent 1260 Infinity高效液相色谱仪(美国Agilent 公司);PDA二极管阵列检测器(美国Agilent 公司);AL204十万分之一电子分析天平(上海梅特勒-托利多公司)。
槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷对照品[4,10](自提,含量≥99%);金丝桃苷对照品(批号:111521-200303,含量以100%计)、槲皮素(批号:100081-201610,含量为99.1%)购自中国食品药品检定研究院;色谱甲醇(美国Sigma公司);乙醇,磷酸均为分析纯;实验用水为纯净水。
实验用番石榴叶购自安国市同羲中药饮片有限公司,具体见表1。经天津中医药大学中药学院马琳教授鉴定为桃金娘科番石榴属植物番石榴(Psidium guajavaL.)的干燥叶。粉碎,过40目筛。
表1 番石榴叶药材来源
Tab. 1 Origin of Guava Leaf

色谱柱:色谱柱为Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:甲醇(A)-0.2%磷酸水溶液(B);梯度洗脱,0~20.00 min,37%A;20.01~35.00 min,70%A;流速为1 mL·min-1;柱温为35 ℃;检测波长:360 nm;进样量10 µL,色谱图见图1。
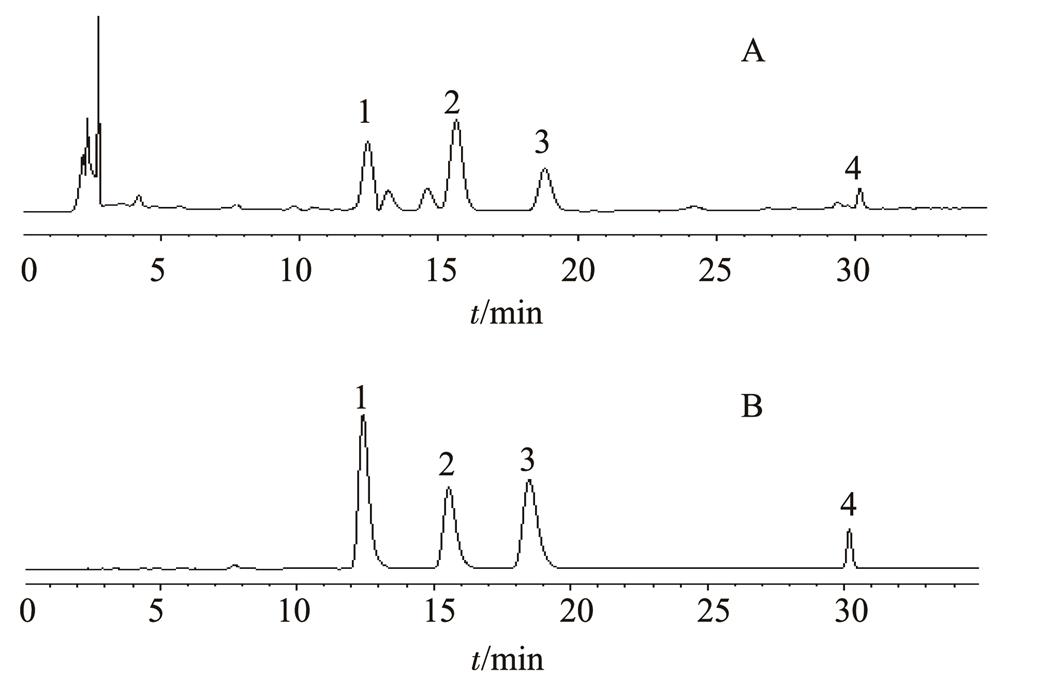
图1 供试品和对照品的HPLC图
A-供试品;B-对照品;1-金丝桃苷;2-槲皮素-3-O-β-D-吡喃阿拉伯糖苷;3-槲皮素-3-O-α-L-呋喃阿拉伯糖苷;4-槲皮素。
Fig. 1 HPLC of sample and reference substance
A-sample; B-reference substance; 1-hyperin; 2-quercetin-3-O-β-D- arabinopyranoside; 3-quercetin-3-O-α-L-furanarabino side ethyl acetate; 4-quercetin.
2.2.1 对照品溶液制备 精密称取金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素对照品适量,加50%甲醇配制成77.51,79.55,90.02,6.76 μg·mL-1的对照品溶液。
2.2.2 供试品溶液的制备 取过筛后的番石榴叶粉末1.0 g,精密称定,置于具塞锥形瓶中,精密加入60%乙醇25 mL,称定重量,回流提取30 min,放冷,复称重量,60%乙醇补足失重,摇匀,滤过,取续滤液过0.45 μm微孔滤膜,即得。
吸取金丝桃苷(310.04 μg·mL-1)、槲皮素-3-O-β-D-吡喃阿拉伯糖苷(318.20 μg·mL-1)、槲皮素-3-O-α-L-呋喃阿拉伯糖苷(360.08 μg·mL-1)、槲皮素(13.51 μg·mL-1)的混合对照品溶液0.5,1,2.5,5,7.5,10 mL,分别置10 mL量瓶中,加50%甲醇至刻度,摇匀,分别精密吸取10 μL注入液相色谱仪,按照“2.1”项下色谱条件测定峰面积,以峰面积积分值为纵坐标(y),对照品质量为横坐标(x)进行线性回归。金丝桃苷回归方程为y=331.420x+13.374,r=1.000 0,线性范围:0.155~3.100 μg;槲皮素-3-O-β-D-吡喃阿拉伯糖苷回归方程为y=318x+20.519,r=0.999 8,线性范围:0.159~3.182 μg;槲皮素-3-O-α-L-呋喃阿拉伯糖苷回归方程为y=349.820x+16.257,r=0.999 8,线性范围:0.180~3.601 μg;槲皮素回归方程为y=23.843x+0.663,r=1.000 0,线性范围:0.007~ 0.135 μg。
精密量取混合对照品溶液10 μL,按“2.1”项下色谱条件分析,连续进样6次,求得对照品金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素峰面积值的RSD分别为0.23%,0.36%,1.41%,1.70%,表明仪器精密度良好。
取6份番石榴叶粉末,每份1.0 g,精密称定,依照“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素峰面积,含量的RSD分别为1.04%,1.33%,1.80%,1.22%,结果表明方法重复性良好。
取供试品溶液,室温放置,按“2.1”项下色谱条件分别于0,2,4,6,8,10,12 h测定金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素峰面积,含量的RSD分别为0.22%,0.56%,0.27%,0.50%,表明供试品溶液在12 h内稳定。
取番石榴叶药材粉末6份,每份0.5 g,精密称定,分别精密加入金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素对照品溶液,按“2.2.2”项下方法提取,按“2.1”项下方法测定并计算加样回收率。结果表明本方法的加样回收率较好,符合方法学要求。结果见表2。
取10个产地样品各适量,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,并计算样品含量,结果见表3。
以1~10号样品中金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素的成分含量为依据,采用SPSS 16.0数据处理软件,以Euclidean distance为测度,对不同产地番石榴叶药材进行聚类分析,结果见图2。
表2 加样回收试验结果(n=6)
Tab 2 Results of recovery test(n=6)
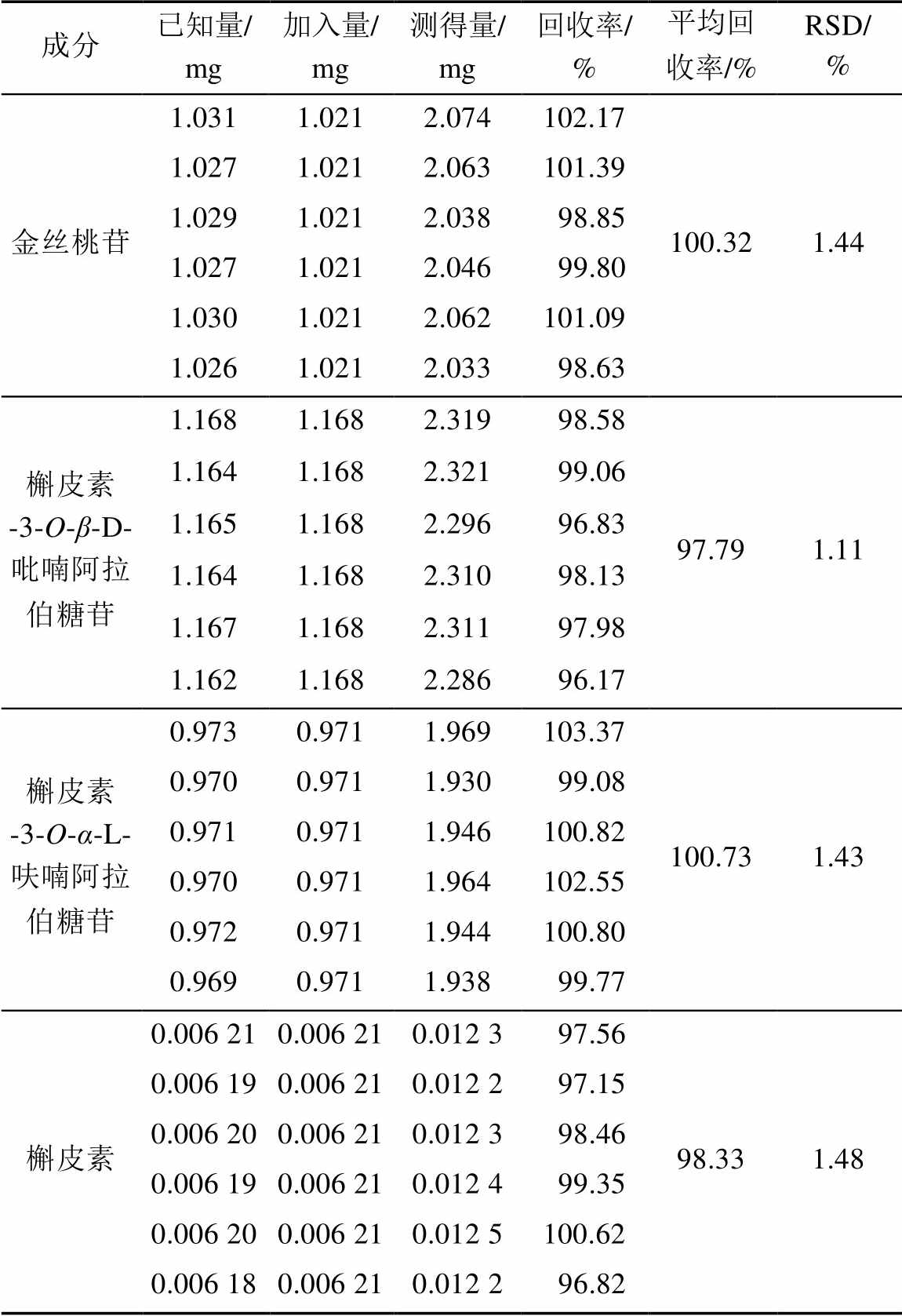
表3 不同产地番石榴叶药材中待测物质含量(n=4)
Tab. 3 Contents of investigated compositions in samples (n=4) mg·g-1

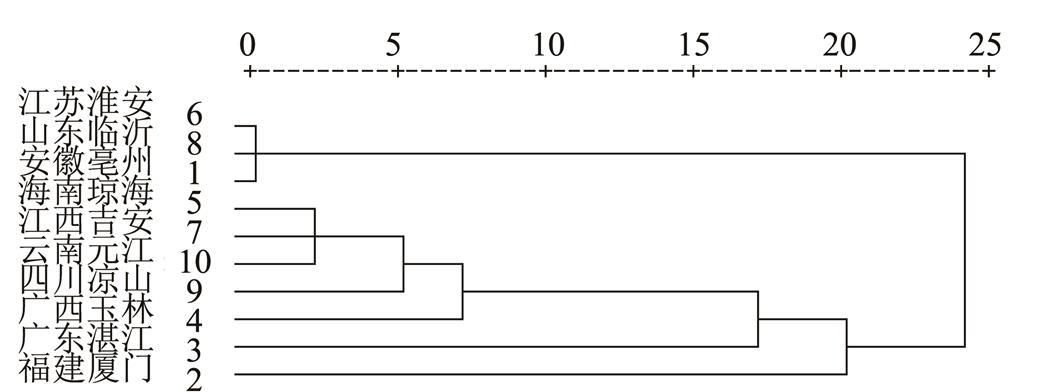
图2 10个产地番石榴叶聚类分析
Fig. 2 Dendrogram of cluster analysis from10 regions
分别考察了回流与超声2种提取方法,甲醇与乙醇2种提取溶剂对番石榴叶药材中主要黄酮类成分含量的影响。结果显示,采用一定体积分数的乙醇加热回流的方法更有利于黄酮类成分的提取。同时对溶剂浓度(40%,50%,60%,70%,80%),溶剂用量(15,25,50 mL)和回流时间(15,30,45,60 min)进行了考察,最终根据金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素的成分含量、色谱峰峰形、节约溶剂及时间成本等方面综合考虑,确定60%乙醇25 mL回流30 min。
考察了甲醇、乙腈分别与0.2%磷酸水、0.4%磷酸水作为流动相时的分离效果和出峰时间。最终选择甲醇-0.2%磷酸水为流动相,梯度洗脱,得到的色谱图中各色谱峰出峰时间适中,分离效果较好。根据文献报道[11-12],黄酮类化合物的最佳吸收波长集中在230~280 nm和330~370 nm 2个区段,故本试验采用PDA检测器在200~400 nm进行扫描,结果显示金丝桃苷、槲皮素-3-O-β-D-吡喃阿拉伯糖苷、槲皮素-3-O-α-L-呋喃阿拉伯糖苷、槲皮素在360 nm波长有较大吸收,且色谱峰峰形较好。
由样品测定结果可知,10个不同产地番石榴叶药材中4种黄酮类成分含量存在较大的差异,金丝桃苷含量为0.557~2.567 mg·g-1,槲皮素-3-O-β-D-吡喃阿拉伯糖苷含量为1.696~ 2.876 mg·g-1,槲皮素-3-O-α-L-呋喃阿拉伯糖苷含量为0.536~2.998 mg·g-1,槲皮素含量为0.016~ 0.333 mg·g-1。
10个不同产地番石榴叶药材按主成分含量进行聚类分析,结果可分为2大类,安徽亳州、江苏淮安、山东临沂分为一类。福建厦门、广东湛江、广西玉林、海南琼海、江西吉安、四川凉山、云南元江分为一类。其中安徽亳州、江苏江阴、山东临沂地理位置偏北,种植番石榴多采用温室大棚,药材生长环境相似,对番石榴叶药材影响近似。另外7个产地均为我国华南西南各省,亦有着相似的生态环境。聚类分析结果可以看出,生长的环境与番石榴叶中黄酮类成分的形成和积累密切相关。但不同土壤、采摘季节等差异也是影响中药材质量的重要因素,还有待进一步研究。
REFERENCES
[1] XIANG T, HE X e, PAN W s. Experimental study on hypoglycemic effect ofPsidium guajavaL. andPyrus betulaefoliaBge. [J]. Pharmacy Today(今日药学), 2016, 26(3): 145-148, 152.
[2] ZHANG Y Y, CHEN Y F, YANG C Y, et al. Study on effects ofPsidium guajavaleaves on blood sugar and blood lipid in mice [J]. Chin J Ethnomed Ethnopharm(中国民族民间医药), 2014, 23(1): 14-16.
[3] QIN M M, HE R J, GUO Y, et al. Study on guava leaf flavonoids extraction technology and antibacterial activity [J]. Chin Arch Tradit Chin Med(中华中医药学刊), 2015, 33(9): 2136-2139.
[4] WU H X, LI X F, LI R, et al. Study on anti-oxidative components from leaves ofPsidium guajava[J]. Chin Tradit Herb Drugs(中草药), 2010, 41(10): 1593-1597.
[5] ZHANG W J, CHEN B T, ZHU Q H, et al.In vitroantirotaviral effects of quercetin and 2α-hydroxyursolic acid extracted fromPsidium guajavaleaves [J]. Chin Tradit Herb Drugs(中草药), 2005, 36(1): 76-79.
[6] GUO S N, LIU H B, LI D H, et al. Effects of flavonoids fromPsidium guajavaleaves on hepatic glucose metabolism and insulin signaling pathway in diabetic mice [J]. Chin J Exp Traditi Med Form(中国实验方剂学杂志), 2015, 21(4): 166-170.
[7] ZHONG F L, ZHU B, WANG H Z. Study on the extraction process of total flavonoids inFolium Psidii Guajavae[J]. Chin Hosp Pharm J(中国医院药学杂志), 2011, 31(7): 567-570.
[8] WU P Y, REN Y S, WU D L, et al. HPLC-ELSD for determining contents of three triterpenoidal saponins in fruits ofBuddleja lindleyanafrom different habitats [J]. China J Chin Mater Med(中国中药杂志), 2016, 41(7): 1218-1221.
[9] SUN J, GU Y F, LI M M, et al. HPLC determination of two phenylpropanoid amides in Solani Melongenae Radix from different cultivation regions [J]. China J Chin Mater Med(中国中药杂志), 2014, 39(12): 2300-2304.
[10] ZHENG X H, MENG D L, LI X. Identification of chemical constituents from leaves ofPsidium guajava[J]. J Shengyang Pharm Univ(沈阳药科大学学报), 2014, 31(7): 513-520.
[11] ZERAIK M L, YARIWAKE J H. Quantification of isoorientin and total flavonoids inPassiflora edulisfruit pulp by HPLC-UV/DAD [J]. Microchem J, 2010, 96(1): 86-91.
[12] WANG B L, WANG X D, SHI X F, et al. Simultaneous determination of quercetin, luteolin and isorhamnetin in pollen ofPaeonia rockiiby RP-HPLC [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(2): 262-265
(本文责编:李艳芳)
Simultaneous Determination of 4 Flavonoids inPsidium GuajavaLeaves from Different Habitats by HPLC
FU Yu, ZHANG Yan, TAO Zunwei*
(Tianjin Institute of Medical Science, Tianjin 300020, China)
ABSTRACT:OBJECTIVETo establish a method for the simultaneous determination of 4 flavonoids inPsidium guajavaleaves.METHODSHPLC was performed on the column of Eclipse XDB-C18with mobile phase of methanol-0.2% phosphate(gradient elution) at a flow rate of 1.0 mL·min-1, the detection wavelength was 360 nm, column temperature was 35 ℃ and injection volume was 10 μL.RESULTSThe linear range was 0.155-3.100 μg for hyperin(r=1.000 0), 0.159-3.182 μg for quercetin-3-O-β-D-arabinopyranoside (r=0.999 8), 0.180-3.601 μg for quercetin-3-O-α-L-furanarabino side ethyl acetate (r=0.999 8),0.007-0.135 μg for quercetin (r=1.000 0); RSDs of precision, stability and reproducibility were lower than 2.0%; recoveries were 100.32%(RSD=1.44%,n=6), 97.79%(RSD=1.11%,n=6), 100.73%(RSD=1.43%,n=6), 98.33%(RSD=1.48%,n=6), respectively. There were quite large differences in the contents of 4 flavonoids inPsidium guajavaleaves from different habitats.CONCLUSIONThe method is simple with good specific, precision and repeatability,can be used for the quality control ofPsidium guajavaleavesfrom different habitats.
KEY WORDS:Psidium guajavaleaves; flavonoids; HPLC
中图分类号:R284.1
文献标志码:B
文章编号:1007-7693(2017)11-1585-04
DOI:10.13748/j.cnki.issn1007-7693.2017.11.019
引用本文:傅予, 张岩, 陶遵威. HPLC同时测定不同产地番石榴叶药材中4种黄酮类成分含量[J]. 中国现代应用药学, 2017, 34(11): 1585-1588.
基金项目:天津市卫生和计划生育委员会中医中西医结合项目(2015042)
作者简介:傅予,女,硕士,助理研究员 Tel: (022)27236182 E-mail: fyyyyy_82@126.com
*通信作者:陶遵威,男,研究员 Tel: (022)27236182 E-mail: taozunweitj@163.com
收稿日期:2017-05-10